不同宿根性甘蔗品种根际土壤微生物学特性分析


摘要:分析不同宿根性甘蔗品种根际土壤微生物的群落组成及多样性,了解根际土壤微生态与宿根性的关系,为评价甘蔗宿根潜力及促进我国甘蔗产业的可持续发展提供参考依据。采用盆栽种植甘蔗品种桂热2号(GR2,设为处理1)、柳城05136(LC05136,设为处理2)和新台糖22号(ROC22,设为处理3),于分蘖期采集其根际土壤及未种植甘蔗的盆土(CK),利用传统培养法结合高通量测序等技术,分析其微生物区系及土壤酶活性。结果表明,4个处理间可培养微生物群落结构存在一定差异,在数量方面均表现为细菌>放线菌>真菌,细菌与真菌比表现为处理1>处理3>处理2>CK;UE、SC、ACP活性在4个处理间存在极显著差异,CAT活性在不同甘蔗品种的根际土壤间存在极显著差异;高通量测序结果表明,4个处理的细菌优势菌门相似,主要包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、黏球菌门(Myxococcota)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),各处理间优势菌门的丰度存在差异,其中占比最高的变形菌门表现为处理1(43.17%)gt;处理3(40.66%)gt;处理2(37.28%)gt;CK(35.44%);4个处理的真菌优势菌门主要为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),此外,丰度排名前10位的其余菌门在不同处理间占比也存在一定差异,如处理1根际土壤的被孢霉门(Mortierellomycota)占比高于其他品种,而蛙粪霉门(Basidiobolomycota)占比低于其他品种。冗余分析结果表明,土壤酶活性与土壤微生物群落有着较强的相关性。综上表明,种植甘蔗改变了原土壤的生态环境,不同宿根性甘蔗品种根际土壤微生物群落结构和酶活性存在一定差异,初步推测宿根性强的甘蔗品种在分蘖期其根际化学反应相对较强,且其根际微生物群落结构较理想。本研究结果可为“甘蔗―根际微生物”的互作在甘蔗宿根性上的研究提供理论依据。
关键词:甘蔗;宿根性;根际土壤;微生物
中图分类号:S566.106.1 文献标志码:A
文章编号:1002-1302(2024)12-0253-08
宿根栽培作为甘蔗生产的重要手段,具有早熟、增产、省工、省种等优势,因此,甘蔗的宿根性已成为评价甘蔗品种好坏的一个重要标准。广西壮族自治区甘蔗种植面积占全国60%以上,但种植年限多为2~3年,且宿根蔗产量不理想,而国际上主要蔗糖生产国的甘蔗生长周期一般为5~8年[1],因此,延长甘蔗宿根年限对激发蔗区生产潜力、保障我国蔗糖产业健康发展及提高我国甘蔗产业在国际上的竞争力显得尤为重要。根系微域作为连接土壤与植株的重要区域,承载着植物的第2套基因组[2],在植物生长过程中发挥着重要作用。因此,分析不同宿根性甘蔗品种的根际土壤微生物学和酶学特性,揭示其在甘蔗品种宿根性表现上的作用机制,对评价甘蔗宿根潜力及实现我国甘蔗产业的可持续发展具有重要意义。植物与土壤微生物在根际微生境中共存并发生协同作用,植物通过控制根系分泌物的种类和数量募集微生物,微生物在根际逐步被筛选,从而使不同植物形成不同的根际微生物群落结构[3-4],而不同微生物根据其固氮、解磷、解钾、硝化和反硝化等功能的不同,对植物生长发挥着至关重要的作用。已有研究证实,植物根际富集的细菌类群主要有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),根际排斥的微生物类群为酸杆菌门(Acidobacteria)[5-9]。Chaparro等研究发现,拟南芥在生长过程中保持着核心的根际微生物组,这种核心微生物组可能在植物发育的不同阶段表达不同功能,且土壤微生物群落中酸杆菌门、放线菌门、拟杆菌门和蓝细菌(Cyanobacteria)的量与根系分泌物中的酚酸组分密切相关[10]。此外,同种作物不同品种其根际土壤微生物也可能存在差异[11-12],同一作物在不同生育时期[13-14]和不同营养状态[15-16]下根际微生物也会呈现一定的动态变化。根际作为地球上最复杂的生态系统之一[17],也是连作障碍防治技术及原理研究的热区。常亚锋等研究表明,随着种植年限的增加,三七根际酚酸物质降解能力不足可能是导致其积累并驱动根际微生态失衡和形成连作障碍的重要原因[18]。张敏等发现,根际土壤微生物群落结构的改变可能是导致甘草发生连作障碍的重要原因之一[19]。高子勤等也从根际微生态角度阐述了连作障碍的机制及缓解措施,随着研究手段的不断更新,植物根圈这个“黑匣子”也逐渐被大家深入了解[20-21]。近年来,大量科研人员从不同甘蔗品种[11]、不同种植模式[22-24]、根际微生物多样性[25-26]、病害与根际微生物关系[27-29]及相关功能微生物的挖掘与利用[30-32]等方面深入探究了甘蔗根际微域环境,为实现甘蔗作物与环境生物的高效适应打下坚实基础。迄今,有关甘蔗宿根性的评价主要集中在宿根发株情况、蔗茎产量和蔗兜形态[33-35]等方面,但对甘蔗宿根性的差异机制仍知之甚少,甘蔗宿根性与根际土壤微生态环境相关性的研究也鲜见系统报道。本研究通过分析宿根性不同的甘蔗品种其根际土壤微生物及酶学特性的差异,探究不同宿根性甘蔗品种与微生物相互作用与合作的潜力,以期为甘蔗宿根性研究提供参考依据。
1 材料与方法
1.1 试验材料
试验于2022年4—6月在广西壮族自治区亚热带作物研究所甘蔗种植资源圃进行。供试甘蔗品种为广西亚热带作物研究所自主选育的品种桂热2号(GR2,宿根性强)、当前主产区种植面积较大的品种柳城05136(LC05136,宿根性好)及在过去的十几年里作为广西当家品种的新台糖22号(ROC22,品种退化使其宿根性弱),以其盆栽分蘖期采集的根际土壤为研究对象。
1.2 试验方法
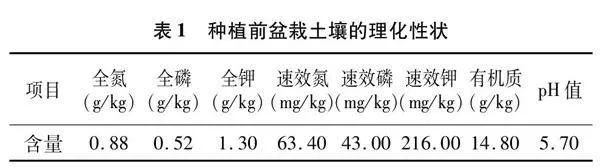
1.2.1 试验设计 选择在沙床培育生长情况一致的各品种甘蔗苗,于2022年4月13日分别移栽至室外花盆,品种GR2、LC05136、ROC22分别设为处理1、处理2、处理3,每个品种种植10盆,每盆种植1株,并以5盆不种植任何作物的土壤作为空白对照(CK)。盆栽土壤为甘蔗地典型红壤土,敲碎过筛后装盆;甘蔗生长后期均在相同条件下进行常规栽培管理。种植前土壤的理化性状见表1。
1.2.2 土壤采集
土壤样品于2022年6月27日(甘蔗分蘖期)采集,去除盆栽表土后将整株植株取出,抖落部分土壤,将黏在甘蔗根上的土壤收集于无菌封口袋中,放入冰盒,运回实验室进行过筛处理,处理后分成3份,一份存于-80 ℃冰箱,用于高通量测序,一份存于4 ℃冰箱,用于可培养微生物分析,一份风干后用于酶活性测定。
1.2.3 测定项目及方法
土壤可培养微生物测定:采用稀释平板法培养根际土壤中可培养的细菌、真菌和放线菌。细菌培养采用牛肉膏蛋白胨(NA)培养基,真菌培养采用马铃薯(PDA)培养基,放线菌培养采用高氏一号培养基,3种培养基均参考林先贵的方法[36]进行配制。培养结束后记录微生物菌落形成单位,计算公式如下:
土壤样品菌落形成单位(CFU/g)=同一稀释度3次重复的菌落平均数×稀释倍数×10。
土壤酶活性测定:新鲜土样自然风干后,过50目筛,采用微量法分别检测土壤过氧化氢酶(CAT)、脲酶(UE)、酸性磷酸酶(ACP)和蔗糖酶(SC)活性。
土壤细菌和真菌高通量测序:收集的新鲜根际土壤保存于-80 ℃冰箱,提取土壤微生物DNA,经检测合格后用于构建文库,以各土壤样品微生物总DNA为模板,选用编码16S rRNA的V3~V4区(341F/ 806R)引物作为根际土壤细菌的扩增引物,以及编码位于真核生物核糖体rDNA序列18S和5.8S间的引物(ITS1)作为真菌的扩增引物(引物序列见表2),通过扩增、纯化、定量等制备高质量测序样品,采用Illumina NovaSeq测序平台对PCR产物进行双端测序分析,委托武汉迈特维尔生物科技有限公司完成测序。
1.3 统计分析
使用Excel2007对试验数据进行统计和制图,以DPS 7.05进行差异性分析,高通量测序结果在迈维—云平台 (https://cloud.metware.cn )上进行相关分析。
2 结果与分析
2.1 不同宿根性甘蔗品种根际土壤可培养微生物数量的差异
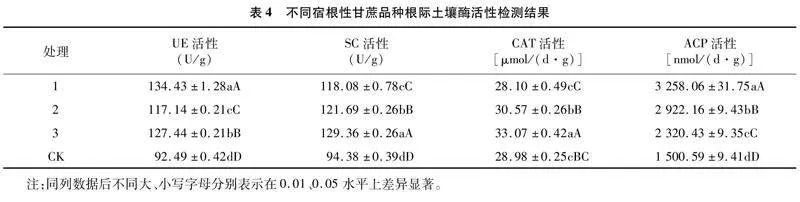
由表3可知,3个不同宿根性甘蔗品种的根际土壤及CK土壤的可培养微生物在数量方面表现为细菌gt;放线菌gt;真菌,其中,处理1的可培养细菌数显著高于其他3个处理,而真菌数量显著低于处理2与CK;各处理间土壤的可培养放线菌数量差异不显著;各处理间土壤的细菌与真菌比表现为处理1>处理3>处理2>CK。细菌与真菌比值显示,宿根性强的GR2属于“细菌型”品种,宿根性好的LC05136和宿根性弱的ROC22倾向于“真菌型”品种。说明宿根性强的甘蔗品种其根系在一定程度上更倾向于募集生长速度更快的细菌来协助植株生长。
2.2 不同宿根性甘蔗品种根际土壤酶活性的差异
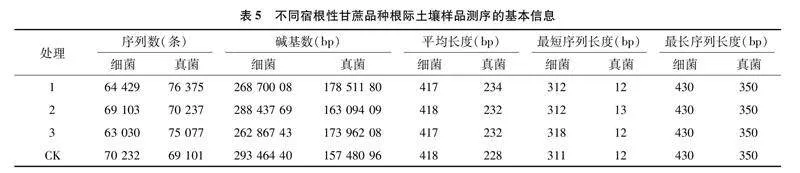
由表4可知,各处理间的UE、SC和ACP活性存在极显著差异,不同甘蔗品种根际土壤的CAT活性存在极显著差异;处理1的UE和ACP活性最高,处理3的SC和CAT活性最高。可见,不同品种间根际土壤化学反应环境不同,其中,强宿根性品种GR2根际土壤的UE和ACP活性最高,而宿根性弱的品种ROC22根际土壤的SC活性及CAT活性最高,表明GR2根际土壤氮循环及有机磷矿化等反应更强烈,而ROC22根际土壤有机碳积累与分解转化较活跃。
2.3 基于Illumina MiSeq高通量测序的甘蔗根际土壤微生物多样性
2.3.1 样品测序结果分析
对不同宿根性甘蔗品种根际土壤样品及空白土壤在97%相似水平下进行Illumina高通量测序,共得到细菌优化数据量 266 794 条有效序列,真菌优化数据量290 790条有效序列(表5)。其中,CK土壤样品的细菌序列数最高,为70 232条,但其真菌序列数最低,为69 101条;细菌16S rRNA V3~V4区的长度在311~430 bp 之间,真菌ITS1长度在12~350 bp之间,从序列长度的分布来看,本研究测得的序列与16S rRNA V3~V4区序列及真菌ITS1序列长度基本吻合。
2.3.2 土壤微生物群落的α多样性分析
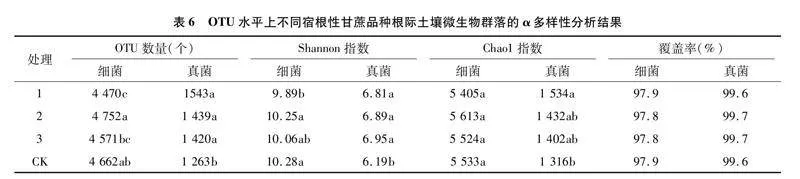
由表6可知,测序结果的覆盖率均达到97.0%以上,说明测序结果能真实反映样品中的微生物群落;处理1细菌群落的OTU数量和多样性指数(Shannon指数)均显著低于处理2与CK,与处理3差异不显著;4个处理间细菌群落的丰富度指数(Chao1指数)差异不显著;真菌群落结构表现为品种间差异不显著,但其OTU数量和多样性指数均显著高于CK;处理1的丰富度指数显著高于CK。说明种植甘蔗在一定程度上改变了土壤中微生物的群落结构,而不同甘蔗品种间细菌群落结构的差异比真菌群落结构的差异相对明显。
2.3.3 土壤微生物群落的β多样性分析
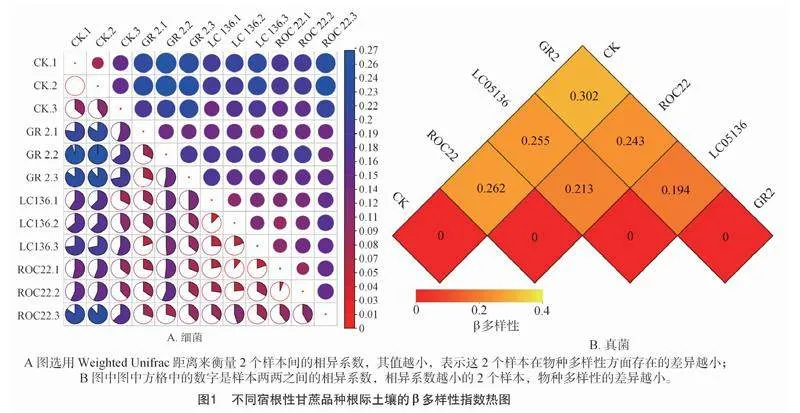
β多样性分析是对不同样本的微生物群落构成进行比较分析,本研究选用Weighted Unifrac距离来衡量2个样本间的相异系数。图1-A可知,GR2的根际土壤细菌群落与CK土壤差异最明显,相异系数达0.217;LC05136和ROC22根际土壤真菌群落与CK土壤真菌群落的相异系数分别为0.172和0.170;3个甘蔗品种土壤细菌群落的相异系数差异相对较小,均为0.10左右。由图1-B可知,GR2的根际土壤真菌群落与CK土壤差异最明显,相异系数达0.302,LC05136和ROC22根际土壤真菌群落与CK土壤真菌群落的相异系数分别为0.255和0.262;3个甘蔗品种土壤真菌群落之间的相异系数在 0.194~0.243之间。说明甘蔗根系改变了土壤微生物群落结构,且不同品种其根际微生物多样性存在一定差异,此外,与空白土壤的微生物群落物种多样性相比,3个不同宿根性甘蔗品种中GR2的根际土壤微生物群落物种多样性差异较大。
2.3.4 土壤微生物群落结构组成分析
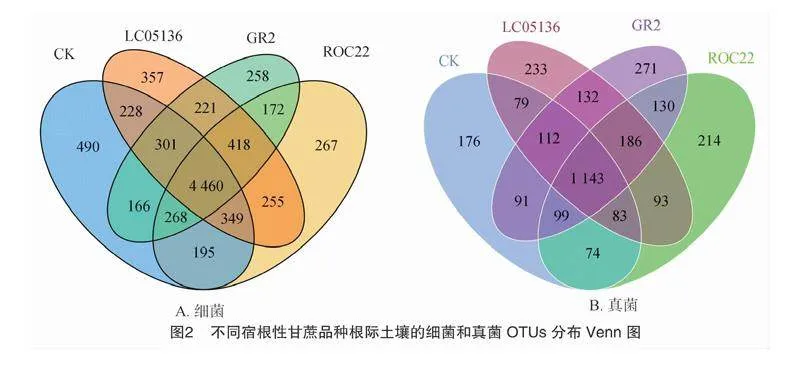
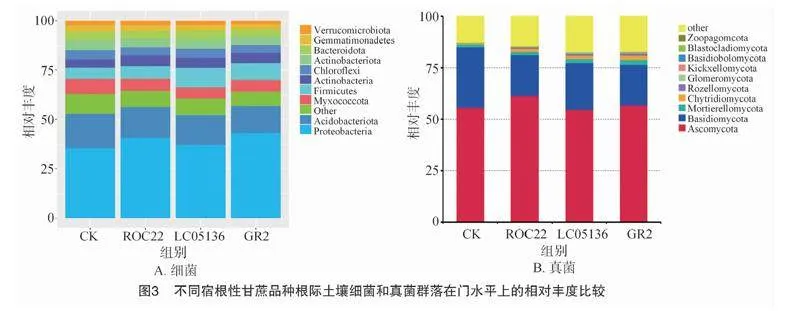
根据聚类得到OTU结果,分析不同处理之间共有、特有的OTU,绘制成韦恩图。由图2-A可知,4个土壤样品共检测出4 460个共有细菌OTU;处理1、处理2、处理3、CK的特有OTU数量分别为258、357、267、490个,而各处理样品总OTU数量分别为6 264、6 589、6 384和6 457,各组特有OTU数占其总OTU数量比例分别为4.12%、5.42%、4.18%和7.59%。根据物种注释结果,选取每个处理在门水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图(图3),以便直观查看各处理在门水平上相对丰度较高的物种及其比例。由图3-A可知,各处理土壤的优势细菌群落结构相似,主要包括变形菌门(35.44%~43.17%)、酸杆菌门(13.60%~17.33%)、黏球菌门(Myxococcota,5.81%~7.67%)、厚壁菌门(Firmicutes,5.67%~9.79%)、放线菌门(9.24%~9.90%)、绿弯菌门(Chloroflexi,4.11%~4.64%)、拟杆菌门(Bacteroidetes,3.90%~4.59%)、芽单胞菌门(Gemmatimonadetes,2.39%~3.18%)和疣微菌门(Verrrucomicrobiota,1.89%~2.44%),但优势菌门的丰度在各处理间存在一定差异,其中,占比最高的变形菌门的丰度表现为处理1(GR2,43.17%)gt;处理3(ROC22,40.66%)gt;处理2(LC05136,37.28%)gt;CK(35.44%),厚壁菌门在GR2和LC05136的根际土壤中占比较高,黏球菌门的占比在CK土壤和ROC22根际土壤中较高。
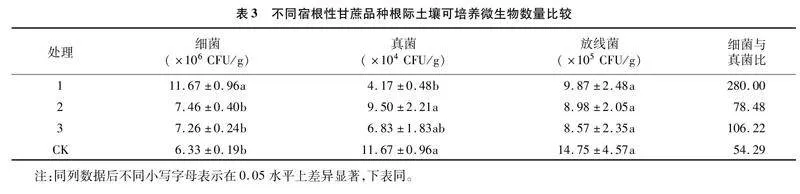
由图2-B可知,4个土壤样品共检测出1 143个共有真菌OTU;处理1、处理2、处理3、 CK的特有OTU数量分别为271、233、214、176个,而各处理样品总OTU数量分别为2 164、2 061、2 022和1 857个,各组特有OTU数占其总OTU数量比例分别为12.52%、11.31%、10.58%和9.48%。由图3-B可知,各处理土壤的优势真菌门主要为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),子囊菌门占比表现为处理3(61.46%)gt;处理1(56.87%)gt;CK(55.77%)gt;处理2(54.66%);担子菌门占比表现为CK(29.39%)gt;处理2(22.56%)gt;处理1(19.63%)=处理3(19.63%)。此外,处理1中被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、罗兹菌门(Rozellomycota)、梳霉门(Kickxellomycota)的占比均高于其他样品;蛙粪霉门(Basidiobolomycota)占比在处理2中最高,其次为处理3,再次为处理2,CK最低。
综上所述,不同处理间细菌与真菌优势菌门类似,但其丰度存在一定差异,说明种植甘蔗以及种植不同甘蔗品种可能不会导致土壤微生物群落组成发生根本性改变,但群落结构存在差异,推测是由于不同品种其根系分泌物不一样使其在根际微域中产生对某类微生物进行募集或者拮抗的反作用,从而形成其特有的微生物群落结构。
2.4 不同宿根性甘蔗品种根际土壤酶活性与土壤微生物群落的冗余分析(RDA)
为明确土壤酶活性对甘蔗根际土壤细菌群落的影响,分别在细菌门分类水平、真菌门分类水平上对土壤微生物群落进行冗余分析,结果(图4)表明,LC06135与GR2的根际土壤细菌和真菌均分布在同一象限,ROC22的根际土壤细菌和真菌分布在第2象限,CK的根际土壤细菌和真菌分布在第3象限,说明4个处理的土壤微生物群落结构存在较大差异。由图4-A可知,细菌RDA分析的第1轴(RDA1)和第2轴(RDA2)分别解释了土壤酶活性与细菌群落89.38%和7.86%的相关性,累积解释量达97.24%,说明RDA1与RDA2能较好地反映土壤酶活性与土壤微生物的关系,且主要以RDA1解释为主;土壤ACP活性与厚壁菌门、拟杆菌门、放线菌门和变形菌门占比呈正相关,与酸杆菌门和疣微菌门占比呈负相关;土壤CAT、SC和UE活性与疣微菌门、放线菌门和变形菌门的占比呈正相关,与拟杆菌门的占比呈负相关。由图4-B可知,真菌RDA分析的第1轴(RDA1)和第2轴(RDA2)分别解释了土壤酶活性与真菌群落89.94%和7.92%的相关性,累积解释量达97.86%,主要以RDA1解释为主;土壤ACP活性与梳霉门、被孢霉门、罗兹菌门、壶菌门、球囊菌门和蛙粪霉门的占比呈正相关,与担子菌门的占比呈负相关;土壤CAT、SC和UE活性与芽枝霉门(Blastocladiomycota)、捕虫霉亚门(Zoopegomcota)、子囊菌门的占比呈正相关,与担子菌门的占比呈负相关。以上结果均说明土壤酶活性与土壤微生物群落有着较强的相关性。
3 讨论
宿根栽培作为甘蔗生产的一种重要栽培方式,具有省工、省种、成本低等优点,延长甘蔗宿根年限对提高我国甘蔗产业竞争力具有重要意义。已有研究表明,根际微生态的变化如根际微生物群落结构失衡[18-19]、根际土壤理化性质恶化[37]是作物发生连作障碍的主要原因之一。农泽梅等研究表明,不同品种宿根甘蔗根际细菌的多样性存在显著差异[11];杨尚东等研究表明,甘蔗根际微环境的细菌群落结构发生改变可能是导致甘蔗宿根矮化病发生的原因之一[27];刘钺从根际微生态角度研究了甘蔗根腐病、甘蔗黑穗病的发病原因及其生物防治途径[28-29]。本研究分析不同宿根性甘蔗品种的土壤微生物学特性差异,探究不同品种其特定的根系微生物群落结构,对选育出理想根型的甘蔗品种从而实现理想株型与理想根型的深度融合具有重要意义。
不同植物或同一植物不同品种在根际微域中,随着自身的生长不断从根外土、根际土及根内筛选微生物,从而逐步形成其特有的微生物群落结构[4]。本研究结果表明,不同处理土壤细菌及真菌群落结构均存在一定差异,细菌主要以变形菌门、酸杆菌门、黏球菌门、厚壁菌门和放线菌门为优势菌门,真菌主要以子囊菌门、担子菌门为优势菌门;3个不同宿根性甘蔗品种的根际土壤优势菌门占比与CK土壤呈现一定的差异,其中占比最高的变形菌门在4个处理间表现为处理1gt;处理3gt;处理2gt;CK,厚壁菌门的丰度也表现出3个甘蔗品种根际土壤高于CK土壤,而酸杆菌门的丰度在4个处理间表现为处理1﹤处理3﹤处理2﹤CK。已有研究表明,非根际土壤中寡营养型细菌门如酸杆菌门在数量上占绝对优势,植物根际土壤中的微生物群落以生长速度更快的富营养型细菌为主,如变形菌门和厚壁菌门[38-39],本研究结果与其一致。此外,曾有研究证实,被孢霉门对病原菌具有拮抗作用,蛙粪霉菌在病害组的土壤中含量较高[40-41]。本研究中,高通量测序结果显示GR2根际土壤的被孢霉门占比高于其他品种,而蛙粪霉门占比低于其他品种,因此推测,品种GR2在抵抗病害上具有一定的优势。
土壤酶是土壤中物质转化的驱动因子,其种类及活性可作为判断土壤生物化学过程强度及评价土壤肥力的指标之一[42]。其中,CAT是土壤微生物代谢的重要酶类,在H2O2清除系统中具有重要作用;UE能水解尿素,产生氨和碳酸,直接参与土壤中有机氮的转化;ACP是一类催化土壤有机磷矿化的酶,其活性的高低直接影响土壤中有机磷的分解转化及其生物有效性,是评价土壤磷素生物转化方向与强度的指标;SC能水解蔗糖变成相应的单糖而被机体吸收,其酶促作用产物与土壤中的有机质、氮、磷含量,以及微生物数量和土壤呼吸强度密切相关,是评价土壤肥力的重要指标[43]。本研究发现,不同处理间的UE、SC和ACP活性差异极显著,CAT活性在不同品种根际土壤中差异极显著。此外,强宿根性品种GR2根际土壤的UE和ACP活性最高,表明其氮循环及有机磷矿化等反应更强烈,有利于促进甘蔗植株地上部生长,也能在一定程度上增强植株的抗逆能力,而宿根性弱品种ROC22根际土壤的SC活性最高,表明其根际土壤有机碳积累与分解转化较活跃,其CAT活性也最高,推测其土壤过氧化氢含量较高,可促使土壤中能分解过氧化氢的微生物繁殖,从而有利于解除过氧化氢的毒害作用。已有研究表明,土壤微生物与UE、SC、ACP和CAT活性呈显著相关关系[44-45]。本研究中冗余分析结果表明,土壤ACP与细菌群落中的厚壁菌门、拟杆菌门、放线菌门、变形菌门及真菌群落中的梳霉门、被孢霉门、罗兹菌门、壶菌门、球囊菌门、蛙粪霉门均呈正相关,土壤样品中CAT、SC、UE活性与细菌群落中的疣微菌门、放线菌门、变形菌门及真菌群落中的芽枝霉门、捕虫霉亚门、子囊菌门呈正相关。这表明土壤酶活性与其微生物群之间有着较强的相互作用,土壤微生物群落结构的变化可能将极大地改变土壤的功能。
分蘖期作为甘蔗生长的一个最重要时期,不同品种的分蘖能力与甘蔗宿根性表现息息相关,分蘖力强的品种一般宿根性也较好,选育宿根性好的品种时,品种分蘖力是宿根性研究的重要方向之一[46]。本研究选取分蘖期来分析相关信息,虽然由于甘蔗生长期较长,未能完全反映不同宿根性甘蔗品种间根际土壤微生态特性的真实差异,但研究结果对探讨甘蔗宿根性具有一定的代表性和参考意义。在今后的研究工作中,将继续跟踪不同品种宿根甘蔗根际土壤微域在不同生长时期的变化,为更好地探究“甘蔗―根际微生物”的互作及其协同进化关系提供理论依据。
4 结论
3个不同宿根性甘蔗品种GR2、LC05136、ROC22新植蔗在分蘖期的根际土壤微生物群落结构及其土壤酶活性均存在一定差异。其中,高通量测序结果显示,品种GR2的根系有益微生物如变形菌门、被孢霉门等的占比相对其他品种高;根际土壤酶活性结果显示,品种GR2的UE和ACP活性最高,表明其氮循环及有机磷矿化等反应更强烈,有利于促进甘蔗植株地上部生长,在一定程度上增强植株的抗逆能力。综上,可初步推测宿根性强的甘蔗品种在分蘖期其根际化学反应相对较强,且其根际微生物群落结构较理想。
参考文献:
[1]李杨瑞. 广西甘蔗生产中的主要问题及几点建议[J]. 广西糖业,2020,40(4):3-7.
[2]艾 超. 长期施肥下根际碳氮转化与微生物多样性研究[D]. 北京:中国农业科学院,2015:1-2.
[3]Caracciolo A B,Terenzi V. Rhizosphere microbial communities and heavy metals[J]. Microorganisms,2021,9(7):1462.
[4]Wang X L,Wang M X,Xie X G,et al. An amplification-selection model for quantified rhizosphere microbiota assembly[J]. Science Bulletin,2020,65(12):983-986.
[5]Bulgarelli D,Rott M,Schlaeppi K,et al. Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota[J]. Nature,2012,488(7049):91-95.
[6]Lundberg D S,Lebeis S L,Paredes S H,et al. Defining the core Arabidopsis thaliana root microbiome[J]. Nature,2012,488(7049):86-90.
[7]Edwards J,Johnson C,Santos-Medellín C,et al. Structure,variation,and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(8):E911-E920.
[8]Lebeis S L,Paredes S H,Lundberg D S,et al. PLANT MICROBIOME. Salicylic acid modulates colonization of the root microbiome by specific bacterial taxa[J]. Science,2015,349(6250):860-864.
[9]Kwak M J,Kong H G,Choi K,et al. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Biotechnology,2018,36:1100-1109.
[10]Chaparro J M,Badri D V,Vivanco J M. Rhizosphere microbiome assemblage is affected by plant development[J]. The ISME Journal,2014,8(4):790-803.
[11]农泽梅,史国英,曾 泉,等. 不同甘蔗品种根际土壤酶活性及微生物群落多样性分析[J]. 热带作物学报,2020,41(4):819-828.
[12]崔纪超,武小霞,林 怡,等. 甘薯根际土壤微生物群落结构及多样性分析[J]. 西南农业学报,202 5(9):2086-2095.
[13]张 亮. 百合不同生育期根际土壤微生物和酶活性的变化[D]. 杨凌:西北农林科技大学,2008:15-35.
[14]孙建波,畅文军,李文彬,等. 香蕉不同生育期根际微生物生物量及土壤酶活的变化研究[J]. 生态环境学报,202 1(6):1169-1174.
[15]钟文辉,蔡祖聪. 土壤管理措施及环境因素对土壤微生物多样性影响研究进展[J]. 生物多样性,2004,12(4):456-465.
[16]刘 芳,汪航飞,蒲春燕,等. 不同施肥对葡萄苗根际微生物量、土壤酶活性和生理的影响[J]. 四川农业大学学报,2023,41(2):318-324.
[17]Raaijmakers J M,Paulitz T C,Steinberg C,et al. The rhizosphere:a playground and battlefield for soilborne pathogens and beneficial microorganisms[J]. Plant and Soil,2009,321(1/2):341-361.
[18]常亚锋,于文豪,陈厚朴,等. 种植年限对健康三七根际土壤微生物活性和功能的影响[J]. 土壤,2023,55(1):132-139.
[19]张 敏,马 淼. 甘草根际土壤微生物群落对长期连作的响应[J]. 生态学报,2022,42(22):9017-9025.
[20]高子勤,张淑香. 连作障碍与根际微生态研究Ⅰ.根系分泌物及其生态效应[J]. 应用生态学报,1998,9(5):549-554.
[21]瞿瑜婷,张前前,俞叶飞,等. 根际微生态视角下药用植物连作障碍机制和缓解措施研究进展[J]. 浙江大学学报(农业与生命科学版),2022,48(4):403-414.
[22]张爱加,周明明,林文雄. 不同种植模式对甘蔗根际土壤生物学特性的影响[J]. 植物营养与肥料学报,2013,19(6):1525-1532.
[23]彭东海,杨建波,李 健,等. 间作大豆对甘蔗根际土壤细菌及固氮菌多样性的影响[J]. 植物生态学报,2014,38(9):959-969.
[24]郑亚强,杜广祖,李亦菲,等. 间作甘蔗对玉米根际微生物功能多样性的影响[J]. 生态学杂志,2018,37(7):2013-2019.
[25]农泽梅,史国英,曾 泉,等. 赤红壤条件下宿根甘蔗根际可培养细菌的多样性研究[J]. 西南农业学报,2019,32(5):1079-1086.
[26]廖 楠. 广西甘蔗根际土壤丛枝菌根(AM)真菌多样性研究[D]. 桂林:广西师范大学,2016:1-39.
[27]杨尚东,郭 霜,任奎喻,等. 甘蔗宿根矮化病感病与非感病株根际土壤生物学性状及细菌群落结构特征[J]. 植物营养与肥料学报,2019,25(6):910-916.
[28]刘 钺. 甘蔗根腐病对根际微生态的影响及其病原菌的拮抗细菌筛选鉴定[D]. 南宁:广西大学,2022:10-21.[HJ2mm]
[29]张 靖,尤垂淮,曹 月,等. 甘蔗根际微生态及其与黑穗病防治之间的关系[J]. 生物技术通报,202 8(11):21-31.
[30]史国英,魏源文,林 丽,等. 1株甘蔗根际促生细菌的鉴定及其生物学功能研究初报[J]. 西南农业学报,2016,29(5):1110-1114.
[31]陈 炫,林希昊. 甘蔗根际土壤解磷细菌的筛选及培养条件优化[J]. 热带农业科学,2017,37(12):61-69.
[32]陆 珍. 耐铝甘蔗根际促生长细菌的筛选及其对铝胁迫下植株生长的影响[D]. 南宁:广西大学,2021:1-48.
[33]韦开军,邓 思,阳康春,等. 6个甘蔗优良新品种(系)宿根性状结果分析[J]. 中国种业,2018(11):68-70.
[34]黄玉新,段维兴,张保青,等. 138份国外引进甘蔗品种(系)宿根性评价[J]. 云南农业大学学报(自然科学),2019,34(4):564-570.
[35]林兆里,罗方喻,林承宥,等. 应用甘蔗蔗蔸形态特征评价甘蔗宿根性研究[J]. 南方农业学报,2022,53(5):1325-1336.
[36]林先贵. 土壤微生物研究原理与方法[M]. 北京:高等教育出版社,2010:362-364.
[37]吴静妮. 土壤理化性质与甘蔗连作障碍的相关性研究[D]. 南宁:广西大学,2016:1-47.
[38]刘京伟,李香真,姚敏杰. 植物根际微生物群落构建的研究进展[J]. 微生物学报,2021,61(2):231-248.
[39]Tian P,Razavi B,Zhang X C,et al. Microbial growth and enzyme kinetics in rhizosphere hotspots are modulated by soil organics and nutrient availability[J]. Soil Biology and Biochemistry,2019,141:107662.
[40]陶 禹,李东波,李兴杰,等. 菌核病不同发病率的菜田土壤中真菌多样性分析[J]. 上海农业学报,202 8(2):63-69.
[41]于帮红,徐 慧,张传博. 一株冬虫夏草来源真菌的鉴定及抑菌活性检测[J]. 中国实验方剂学杂志,2016,22(8):36-40.
[42]李艳春,陈志鹏,林伟伟,等. 茶树连作障碍形成机制及调控措施研究进展[J]. 生态科学,2019,38(5):225-232.
[43]曹 慧,孙 辉,杨 浩,等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报,2003,9(1):105-109.
[44]孙秀山,封海胜,万书波,等. 连作花生田主要微生物类群与土壤酶活性变化及其交互作用[J]. 作物学报,2001,27(5):617-621.
[45]柴 强,黄 鹏,黄高宝. 间作对根际土壤微生物和酶活性的影响研究[J]. 草业学报,2005,14(5):105-110.
[46]丁雪儿,林萍萍,余 凡,等. 甘蔗宿根性研究进展[J]. 中国糖料,2020,42(2):12-18,2.
收稿日期:2023-08-01
基金项目:广西科技重大专项(编号:桂科AA22117002-6、桂科AA22117002-7);广西自然科学基金(编号:2023GXNSFAA026327);广西农业科学院科技发展基金(编号:桂农科2022JM93);广西农业科学院基本科研业务专项(编号:桂农科2021YT151、桂农科2023YM10)。
作者简介:农泽梅(1991—),女,广西藤县人,硕士,助理研究员,主要从事甘蔗育种与栽培研究。E-mail:1102466436@qq.com。
通信作者:吕 平,硕士,高级农艺师,主要从事甘蔗育种与栽培研究。E-mail:602337911@qq.com。

