旱柳NAC基因家族的全基因组鉴定及其在淹水和盐胁迫下的表达分析








摘要:【目的】对旱柳(Salix matsudana)NAC基因家族成员进行鉴定,并分析其在淹水胁迫和盐胁迫下的表达差异,为研究SmNAC家族成员参与逆境胁迫调控机制及培育高耐非生物胁迫旱柳品种提供理论基础。【方法】以敏淹旱柳品种Yanliu No.1、耐淹旱柳品种Suliu 795和敏盐旱柳种质Yanjiang和耐盐旱柳品种9901等4份旱柳种质为试验材料,通过基因组数据挖掘鉴定出旱柳全基因组范围内的NAC基因家族成员,并对其蛋白理化性质、保守基序、系统发育关系、基因结构及其染色体位置、共线性关系进行预测分析。对SmNAC基因家族成员进行淹水胁迫和盐胁迫下的表达谱分析;选取对淹水胁迫和盐胁迫均具有明显响应的基因构建拟南芥过表达载体并获取转基因拟南芥,通过实时荧光定量PCR检测该基因在野生型和转基因拟南芥中的相对表达量,并分析转基因拟南芥和野生型拟南芥在淹水胁迫下的表型差异,测定其生理指标。【结果】鉴定出290个SmNAC基因家族成员,命名为SmNAC001~SmNAC290;SmNAC家族基因编码的氨基酸数量范围为105~710个,分子量为12.7~77.8 kD,理论等电点(pI)为4.33~9.65,大多数蛋白成员定位于细胞核。根据SmNAC家族蛋白与拟南芥NAC蛋白的系统发育进化关系及其保守基序分析结果,将SmNAC家族蛋白分为16个亚家族。大部分SmNAC家族基因中含有3个外显子,同一亚家族内的SmNAC成员基序组成和排列模式相似,如NAP和OsNAC7亚家族。大部分SmNAC家族基因成员启动子含有茉莉酸甲酯以及缺氧胁迫等响应元件。SmNAC基因家族中有244个基因随机分布在38条染色体上,其中存在13对串联复制事件。转录组数据结果显示,淹水胁迫和盐胁迫后,ATAF亚家族(SmNAC007、SmNAC008、SmNAC009、SmNAC010、SmNAC011和SmNAC012基因)表达量在不同抗性旱柳种质中均明显上调。实时荧光定量PCR结果显示,转基因拟南芥中SmNAC007基因的相对表达量明显高于野生型,为10~15倍;与野生型拟南芥相比,转基因拟南芥中总蛋白含量显著降低(Plt;0.05)。【结论】鉴定出290个SmNAC基因家族成员,其中分别有102个和151个家族成员在淹水胁迫和盐胁迫中差异表达;初步证实SmNAC007基因在淹水胁迫响应中发挥正向调控功能。
关键词:旱柳;NAC基因家族;盐胁迫;淹水胁迫;SmNAC007基因
中图分类号:S687.101文献标志码:A文章编号:2095-1191(2024)10-3056-15
Whole genomic identification of NAC gene family and expres⁃sion analysis under flooding stress and salt stress inSalixmatsudana
QIAN Chao-nan,XU Sun-ran,LI Meng-ru,DENG Ming-chao,SUN Shuo,LIU Guo-yuan,LIAN Bo-lin,ZHANG Jian*,CHEN Yan-hong*
(School of Life Sciences,Nantong University/Nantong Key Laboratory of Ornamental Plant Genetics and Breeding,Nantong,Jiangsu 226019,China)
Abstract:【Objective】The purpose of the study was to identify members of the NAC gene family in Salix matsudanaand analyze their expression differences under flooding stress and salt stress,so as to provide theoretical basis for stu-dying the mechanism of SmNAC family members involved in stress regulation and cultivating S.matsudana varieties with high tolerance to abiotic stress.【Method】Using the 4 S.matsudanagermplasms(flooding-sensitive S.matsudana variety Yanliu No.1,the flooding-tolerant S.matsudana variety Suliu 795,the salt-sensitive S.matsudanagermplasmYanjiang,and the salt-tolerant S.matsudana variety 9901)as experimental materials,the NAC gene family members within the whole genome of S.matsudana were identified through genomic data mining,and their protein physicochemical proper-ties,conserved motifs,phylogenetic relationships,gene structures,chromosome localization and collinearity relationships were predicted and analyzed.Expression profiles of SmNAC gene family members under flooding stress and salt stress was conducted;genes that showed obvious response to both flooding stress and salt stress were selected to construct Ara-bidopsis thaliana overexpression vectors and obtain transgenic A.thaliana.The relative expression levels of these genes in wild-type and transgenic A.thaliana were detected by real-time fluorescence quantitative PCR,and the phenotypic diffe-rences between transgenic A.thaliana and wild-typeA.thaliana underwater flooding stress were analyzed,and the physio-logical indicators were measured.【Result】A total of 290 SmNAC gene family members were identified,named SmNAC001 to SmNAC290;the number of amino acids encoded by SmNAC family genes ranged from 105 to 710,with molecular weights ranging from 12.7 to 77.8 kD and theoretical isoelectric points(pI)ranging from 4.33 to 9.65.Most of the protein members were localized in the nucleus.Based on the phylogenetic evolutionary relationship between SmNAC family proteins and A.thaliana NAC proteins and the results of conserved motifs,the SmNAC family proteins were di-vided into 16 subfamilies.MostSmNAC family genes contained 3 exons,and SmNAC members within the same subfami-ly had similar motif composition and arrangement patterns,such as the NAP and OsNAC7 subfamilies.MostSmNAC family gene members promoters contained elements responsive to methyl jasmonate and hypoxia stress.In the SmNAC gene family,244 genes were randomly distributed on 38 chromosomes,among which there were 13 pairs of tandem du-plication events.Transcriptome data showed that after flooding stress and salt stress,the expression levels of the ATAF subfamily(SmNAC007,SmNAC008,SmNAC009,SmNAC010,SmNAC011,and SmNAC012 genes)was up-regulated in the S.matsudanagenplasms with different resistance.Real-time fluorescence quantitative PCR results showed that the relative expression level of the SmNAC007 gene in transgenic A.thaliana was greatly higher than that in the wild-type by 10 to 15 times;compared to wild-type A.thaliana,the total protein content in transgenic A.thaliana was significantly re-duced(Plt;0.05).【Conclusion】A total of 290 SmNAC gene family members are identified,among which 102 and 151 family members are differentially expressed under flooding stress and salt stress respectively;the SmNAC007 gene is pre-liminarily confirmed to play a positive regulatory role in the response to flooding stress.
Key words:Salixmatsudana;NAC gene family;salt stress;flooding stress;SmNAC007 gene
Foundation items:National Natural Science Foundation of China(31971681);Jiangsu Key Research and Develop-ment plan Project(BE2022420);Nantong Social Welfare Project(MS12022028);Jiangsu College Student Innovation and Entrepreneurship Training Plan Project(202410304108Y)
0引言
【研究意义】旱柳(Salix matsudana)是隶属于杨柳科(Salicaceae)柳属(Salix)柳组(Sect.Salix)的乔木,树姿美观,具有耐水湿、耐盐碱与耐污染等优点,是我国重要的用材树种,也是固沙保土和绿化的优良树种。在植物生长发育及对逆境胁迫的响应过程中,转录因子(Transcriptional factors,TFs)发挥关键作用。NAC转录因子家族是植物特有的一种TF类型,从苔藓植物到双子叶植物均有分布,是最大的植物特异性转录家族之一(Olsen et al.,2005)。据此推测旱柳NAC(SmNAC)基因家族成员在胁迫调控中发挥重要作用,因此,了解SmNAC基因家族的成员组成、分类、结构特征、表达模式和功能对于揭示其参与逆境胁迫调控的机制及培育高耐非生物胁迫旱柳品种具有重要意义。【前人研究进展】TFs通过与下游基因的顺式调控元件结合激活或抑制靶基因的表达调控不同的信号通路,从而影响植物的生理和生化过程。NAC的命名来源于其结构域中3个基因的名称,即无顶端分生组织(No apical meristem,NAM)基因、拟南芥转录激活因子1/2(Arabidopsistranscription activator factor 1/2,ATAF1/2)基因和杯状子叶2(Cup shaped cotyledon2,CUC2)基因(Souer et al.,1996)。NAC转录因子家族最显著的结构性特点是存在1个高度保守的NAM域,由150~160个氨基酸组成,可以结合DNA和其他蛋白质,其C端是1个可变的转录激活区域,可以激活或抑制基因转录(Nakashima et al.,2007)。NAC转录因子在植物生长发育包括侧根构建、细胞分裂、叶片衰老、果实成熟和种子萌发等方面起着关键作用(Puranik et al.,2012;王晓菲等,2024),其家族成员在低温(An et al.,2018)、干旱(Thirumalaikumar et al.,2018;Yang et al.,2022;纪艺红等,2024)、盐碱(Li et al.,2021a,2021b)、高温(Xi et al.,2022)特别是淹水(Bui etal.,2020)等非生物胁迫响应及调控过程中扮演重要角色。如苹果中的MdNAC029在CBF依赖的方式下作为负调控因子调节植物的耐寒性(Anet al.,2018);NAC因子JUNGBRUNNEN1(JUB1)是番茄耐旱性的调节因子(Thirumalaikumar et al.,2018);拟南芥幼体和成体耐淹性的差异与AtNAC017转录因子有关(Bui etal.,2020);大豆中的GmNAC06(Li et al.,2021a)和猕猴桃中的AvNAC030(Li et al.,2021b)在耐盐性调控机制中发挥积极作用;玉米中的ZmNAC074在耐热性中发挥关键作用(Xi et al.,2022)。GmNAC12基因作为关键基因可正向调控大豆对干旱胁迫的耐受性(Yang et al.,2022)。此外,诸多报道也表明一些NAC家族成员可参与多重胁迫的调控;如一种新的NAC转录因子VvNAC17在干旱、高温、冷冻、水杨酸和脱落酸处理后的葡萄多种组织中均有表达,可增加葡萄对脱落酸的敏感性,提高其耐盐性、抗冻性和抗旱性(Ju etal.,2020);乙烯诱导的PtNACs在油松中对盐、冷、旱、热冲击和渗透等多重非生物胁迫均有应答作用(Han et al.,2023)。【本研究切入点】尽管在拟南芥和其他模式植物中对NAC基因家族的研究已取得显著进展,但有关SmNAC基因家族成员及其转录因子家族功能研究尚未见报道。【拟解决的关键问题】以敏淹旱柳品种Yanliu No.1、耐淹旱柳品种Suliu 795和敏盐旱柳种质Yanjiang、耐盐旱柳品种9901等4份旱柳种质为试验材料,通过基因组数据挖掘鉴定出旱柳全基因组范围内的NAC基因家族成员,并对其理化性质、保守基序、系统发育关系、基因结构、染色体位置、共线性关系进行预测分析。对SmNAC基因家族成员进行淹水胁迫和盐胁迫下的表达谱分析,构建拟南芥过表达载体并获取转基因拟南芥。通过实时荧光定量PCR检测该基因在野生型和过表达拟南芥中的相对表达量,为研究SmNAC家族成员参与逆境胁迫调控的机制及培育高耐非生物胁迫旱柳品种提供理论基础。
1材料与方法
1.1试验材料
以种植于南通大学植物园的敏淹旱柳品种Yan-liu No.1和耐淹旱柳品种Suliu 795作为淹水胁迫试验的研究对象;敏盐旱柳种质Yanjiang和耐盐旱柳品种9901作为盐胁迫试验的研究对象。将4份种质的茎剪成长8~10 cm、粗2~3 mm的插条。淹水胁迫试验种质插条经水培长出新根备用;盐胁迫试验种质插条在基质(无菌泥炭∶珍珠岩=2∶1)中培养18d长出新根,培养条件为25℃、16 h光照/8 h黑暗。
1.2 SmNAC基因家族成员鉴定及理化性质分析
旱柳基因组来自本试验测序数据。从Phytozome网站(https://phytozome-next.jgi.doe.gov/)分别下载毛果杨(Populus trichocarpa)、拟南芥(Arabidopsisthaliana)和红皮柳(Salix purpurea)的全基因组和注释文件。从Pfam数据库(https://pfam.xfam.org/)下载NAM蛋白保守结构域的HMM文件(PF02365),将其作为搜索模型。代入TBtools的HMM search功能筛选模块,筛选出目标物种中相似结构域的蛋白序列。将获得的旱柳、毛果杨、拟南芥及红皮柳NAC转录因子家族候选基因,采用SMART(https://smart.embl.de/#)和CDD(https://www.ncbi.nlm.nih.gov/cdd/)网站进一步确定候选蛋白中存在NAM结构域。将SmNAC基因家族的蛋白序列提交至ExPASy的ProtParam(https://www.expasy.org/),对SmNAC转录因子家族成员理化性质预测分析;使用WolfSport(https://wolfpsort.hgc.jp/)在线分析工具预测SmNAC家族蛋白的亚细胞定位。
1.3系统发育进化树构建
利用MAGA 7.0中ClustaW对SmNAC家族蛋白进行氨基酸序列多重序列比对,采用邻接法(Neighbor-Joining,NJ)构建系统发育进化树,利用Chiplot网站对系统发育进化树进行美化(https://www.chiplot.online/),Bootstrap设为1000次。利用MEME(https://meme-suite.org/meme/doc/meme.html)对SmNAC蛋白中的保守基序进行鉴定,并使用TBtools对基于柳树SmNAC家族基因结构及蛋白保守基序和结构域进行可视化。
1.4 SmNAC家族基因的染色体定位及基因复制事件分析
使用TBtools中AmazingGeneLocationfromGFF3/GTF File工具,将SmNAC家族基因定位到旱柳38条染色体。由于一部分支架(Scaffolds)尚未组装到染色体上,因此并非所有的SmNAC家族基因均能定位到染色体。
基因组中有2种基因复制:串联复制事件(TDs)和片段复制事件(SDs)。在TBtools中,基因复制对通过Blast compare 2 Seq[sets]lt;Big Filegt;和Quick McscanX Wrapper工具鉴定。候选复制基因应具有至少80%的覆盖度和至少65%的相似性。SmNACs基因的TDs通过TBtools中的Amazing Gene Loca-tion from GFF3/GTF File工具展示在染色体上。而SmNAC家族基因的SDs则通过TBtools的Amazing Super Circos工具进行可视化。
1.5 SmNAC基因家族共线性分析
通过下载毛果杨、红皮柳和拟南芥的基因组序列和注释信息,使用TBtools进行基因组比对和共线性区块识别,并通过TBtools中Amazing Super Circos工具进行可视化。
1.6 4份旱柳种质的非生物胁迫处理
1.6.1淹水胁迫将Yanliu No.1和Suliu 795这2个旱柳品种的茎插条完全浸入水中,并在淹水胁迫0、4、12、24和48h后采集根作为样品。共有10组样品,每组样品3个生物学重复。将Yanliu No.1淹水胁迫处理0、4、12、24和48 h的样品分别标记为WSYL-CK、WSYL-4h、WSYL-12h、WSYL-24h和WSYL-48h;Suliu 795淹水胁迫处理0、4、12、24和48 h的样品分别标记为WR-CK、WR-4h、WR-12h、WR-24h和WR-48h。提取样品RNA并进行转录组测序,转录组数据上传在中国国家基因库数据库(CNGBdb,登录号CNP0002062),根据淹水胁迫下SmNAC家族基因的表达量绘制表达热图。
1.6.2盐胁迫将敏盐旱柳品种Yanjiang和耐盐旱柳品种9901已长出新根的茎插条分别在浓度为200 mmol/L的NaCl溶液中处理0、4、8和12 h。采集根作为样品,每样品3个生物学重复,共有8组样品,Yanjiang盐胁迫处理0、4、8和12 h样品分别标记为S-CK、S-N4h、S-N8h和S-N12h。9901盐处理0、4、8和12 h的样品分别标记为T-CK、T-N4h、T-N8h和T-N12h,提取样品RNA并进行转录组测序,转录组数据上传在中国国家基因库数据库(CNGBdb,登录号CNP0003817),根据盐胁迫下SmNAC家族基因的表达量绘制表达热图。
1.7拟南芥的过表达载体构建
在淹水胁迫和盐胁迫处理中,选取对于淹水胁迫和盐胁迫均具有明显响应的基因构建拟南芥的过表达载体,对其进一步进行相关功能分析。根据SmNAC基因序列设计引物(表1),以旱柳RNA反转录合成的cDNA为模板进行PCR检测,将PCR产物切胶回收,回收产物采用pMDTM 18-TVector Cloning Kit试剂盒[宝生物工程(大连)有限公司]进行测序。测序成功后,使用Xho I对pWM101环状质粒进行单酶切。设计基因接头引物(表1),以pMDTM 18-T融合质粒为模板进行PCR扩增,然后使用非连接酶依赖型单片段快速克隆试剂盒ClonExpress II One Step Cloning Kit(南京诺唯赞生物科技股份有限公司)将酶切后的pWM101载体和PCR产物进行连接,连接产物转化到大肠杆菌DH5“感受态细胞(南京诺唯赞生物科技股份有限公司)中,获得含pWM101-SmNAC重组菌株;挑选阳性重组菌株,扩大培养提取pWM101-SmNAC重组质粒,转化至农杆菌GV3101感受态细胞[宝生物工程(大连)有限公司]。
花序侵染法转化拟南芥:取阳性农杆菌参照菌液活化方法,培养至OD600 nm为1.2~1.6,随后在4800 r/min下离心10min,沉淀菌体。将菌体重悬于渗透缓冲液(1/2 MS液体培养基和5%蔗糖溶解充分后,121℃灭菌20 min,每100 mL缓冲液加入20~25μL表面活性剂SilwettL-77),使OD600 nm为0.6~0.8。在转化前1 d将拟南芥浇足水,用剪刀去除已经结荚的角果。转化时将每株拟南芥花序蘸入转化介质中约50 s,转化完后将拟南芥平放于托盘中,洒水保湿,暗培养24h,第2 d拿出后放到培养室正常培养。一周后再进行1次转化以获得更多转基因种子。收获成熟种子后,标记为T0代种子,并进行筛选点种培养,筛选到T3代植株进行试验。
1.8基因表达模式分析
对生长相同周期的野生型拟南芥和NAC转基因拟南芥为模板进行实时荧光定量PCR检测。采用RNA试剂盒[天根生化科技(北京)有限公司)]提取总RNA,使用RNA反转录试剂盒(TaKaRa)将RNA反转录合成cDNA。通过Oligo 7避开序列保守区域设计NAC引物(表1),引物委托苏州金唯智生物科技有限公司合成。反应体系20.0μL:cDNA模板1.0μL,SYBR Mix 10.0μL,10µmol/L上、下游引物各0.5μL,无菌水补足至20.0μL。扩增程序:95℃预变性1 min;95℃10 s,60℃5 s,72℃12 s,进行40个循环。每个样品设3个生物学重复,采用2-ΔΔCt法计算目的基因的相对表达量。
1.9拟南芥野生型和转基因植株缺氧胁迫指标测定
在生长5 d后,拟南芥野生型和转基因植株模拟淹水胁迫设置缺氧胁迫试验,参照Mathew等(2023)的方法进行并稍作修改,在体积为2.5 L的矩形盒子底部放置1个AnaeroGenTM 2.5 L GasPakTM厌氧包(Thermo Fisher Scientific,OXAN0025A)。在厌氧包上方放置8个装有拟南芥的培养皿,厌氧包和培养皿间使用多层纸巾隔开,以防止厌氧包产生的热量影响植物生长。在盒子的密封区域涂抹凡士林确保其密封性。盒子关闭紧密并用铝箔包裹后放置在黑暗处进行缺氧胁迫处理,野生型拟南芥(标记为WT)和3个拟南芥转基因株系(标记为NAC-D-4、NAC-D-6和NAC-D-8)各设3个生物学重复。处理12 h后,将培养皿取出进行正常培养。5 d后,测定WT、NAC-D-4、NAC-D-6和NAC-D-8株系的根长和鲜重;测定WT、NAC-D-4和NAC-D-6株系叶片中总蛋白含量和过氧化物酶(POD)活性,参照总蛋白和POD试剂盒(南京建成生物工程研究所)说明进行测定。
1.10统计分析
使用GraphPad Prism 9.5.0作图,并采用t检验进行差异显著性分析。
2结果与分析
2.1 SmNAC家族基因成员鉴定及蛋白理化性质分析结果
利用HMM文件对旱柳全基因组中可编码NAM结构域的基因进行搜索,筛选后共获得290个NAC家族基因,并根据其在染色体上的位置命名为SmNAC001~SmNAC290。
由图1可知,SmNAC家族基因编码的氨基酸残基数量为105~710个;蛋白分子量为12.7~77.8 kD;理论等电点(pI)为4.33(SmNAC138)~9.65(SmNAC074),其中有69个SmNAC家族蛋白成员为碱性蛋白(pIgt;7.00),其他成员为酸性蛋白(pIlt;7.00)。此外,大部分成员氨基酸数量为300~399个,pI为5.00~5.99,分子量为30~39 kD。亚细胞定位结果显示,大多数SmNAC家族蛋白成员定位于细胞核。
2.2 SmNAC家族蛋白系统发育分析结果
通过MEGA 7.0中的NJ和氨基酸序列多重比对构建旱柳和拟南芥的系统发育进化树,结果由图2可知,SmNAC家族蛋白与拟南芥NAC蛋白一样具有多样性,且在各亚家族中分布不均匀。277个SmNAC蛋白和112个拟南芥NAC蛋白分为15个亚家族,包括12个ANAC001蛋白、21个ANAC063蛋白、32个NAM蛋白、9个NAC1蛋白、32个OsNAC7蛋白、8个SENU5蛋白、17个NAP蛋白、5个AtNAC3蛋白、6个ATAF蛋白、34个ONAC003蛋白、38个ONAC022蛋白、12个ANAC011蛋白、9个NAC2蛋白、10个OsNAC8蛋白和10个TIP蛋白。其中ANAC019、ANAC055和ANAC072与SmNAC202、SmNAC203、SmNAC204和SmNAC205聚类,且同属于AtNAC3亚家族。此外,SmNAC蛋白还存在1个不典型的亚家族,该亚家族与拟南芥NAC蛋白无相似性,仅包括来自旱柳的13个NAC蛋白成员。2.3 SmNAC家族成员基因结构、蛋白保守基序及结构域分析结果
所有SmNAC蛋白均有1个NAC基因家族特有保守结构域NAM,证明基因鉴定结果可靠。为了解基因的结构特征,将SmNAC家族基因的编码区(CDS)、非编码区(UTR)进行可视化处理,由结果(图3)可知,除ANAC063亚家族的部分基因(SmNAC282、SmNAC283、SmNAC281、SmNAC280、SmNAC088、SmNAC087、SmNAC260、SmNAC261和SmNAC278)无内含子外,其他基因均包含1个以上的内含子,但大多数基因的外显子数量为3个,仅有5个基因(SmNAC083、SmNAC186、SmNAC037、SmNAC035和SmNAC060)外显子数量大于8个。同一亚群基因大多具有相似的外显子和内含子结构,如所有的SENU5亚家族中均含有3个外显子,ATAF和AtNAC3亚家族中仅有1个基因不含3个外显子。
为揭示SmNAC家族蛋白结构多样性,利用MEME共鉴定得到10个基序,且基序长度不同(图3)。在290个SmNAC蛋白中,至少有1~8个保守基序,其中Motif 7和Motif 10仅出现在ONAC003中。Motif 3、Motif 5、Motif 1、Motif 2、Motif 4和Motif 9组成保守结构域NAM,并非所有蛋白均含有这些基序,有些蛋白包含不完整的NAM结构域,仅含有1~2个基序,如SmNAC087和SmNAC277仅有1个基序。SmNAC086、SmNAC044、SmNAC192和SmNAC191含有基序种类最多,包含8个保守基序。同一亚家族内的SmNAC成员基序组成和排列模式相似,如NAP和OsNAC7亚家族。
2.4 SmNAC家族基因启动子顺式作用元件分析结果
为分析SmNAC家族基因潜在的生物学功能,对290个SmNAC家族基因成员启动子序列进行顺式作用元件预测,并筛选植物激素响应和非生物胁迫响应元件,结果(图4)表明,大部分SmNAC家族基因成员启动子含有茉莉酸甲酯(MeJA)以及缺氧胁迫等响应元件。290个家族成员中,在激素反应方面,主要包括生长素(Auxin)、赤霉素(ABA)、MeJA和水杨酸(SA)响应元件,其中MeJA响应元件最多(778个)。而非生物胁迫中,主要有厌氧诱导响应元件(545个)、缺氧诱导响应元件(172个)、参与干旱诱导反应的MYB结合位点(177个)和参与低温响应的顺式作用元件(145个)。推测SmNAC家族基因在参与植物激素和非生物胁迫响应中发挥重要作用。
2.5 SmNAC家族基因染色体定位及共线性分析结果
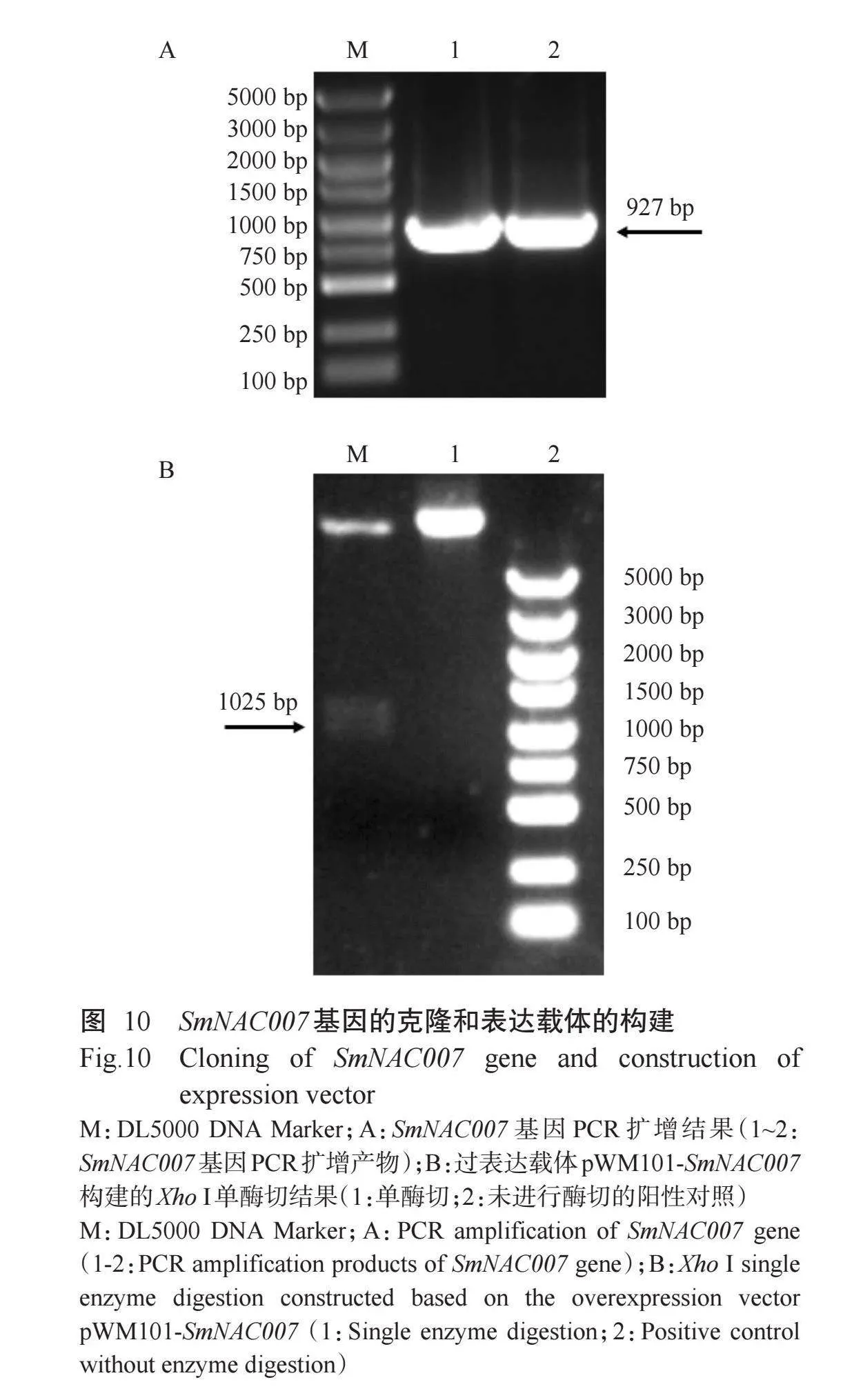
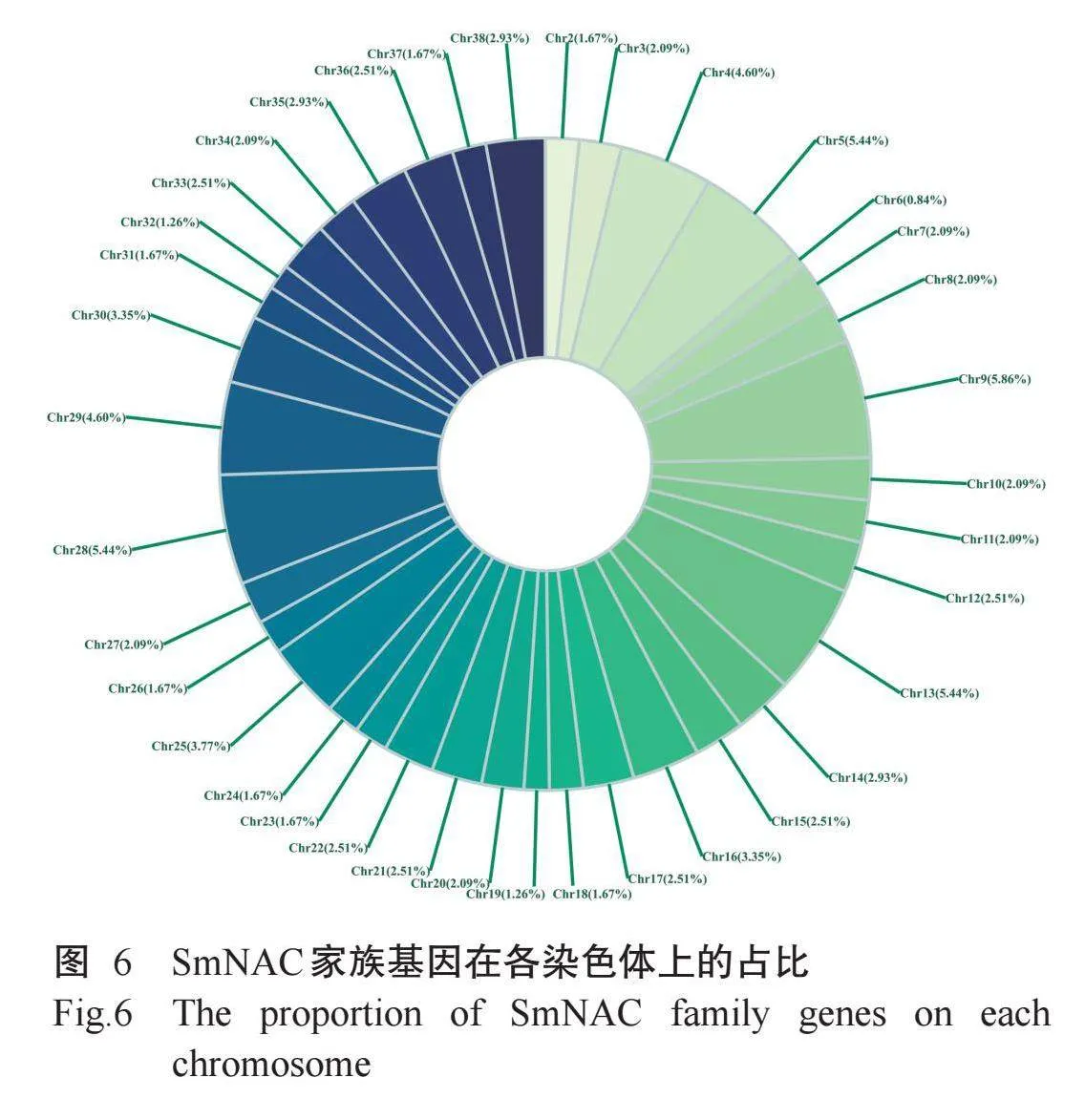
利用TBtools对旱柳基因组注释信息对290个SmNAC家族基因进行染色体定位,结果(图5)显示,244个SmNAC家族基因随机分布在38条染色体上。由图5和图6可知,9号染色体(Chr9)最多,为14个,占比5.86%,其次是5号、13号和28号染色体,均为13个基因,占比5.44%。6号染色体基因数量最少,仅有2个基因,占比0.84%。
基因复制事件是植物家族基因形成过程中常见且广泛发生的事件,对理解物种适应性进化具有重要意义。对所有SmNAC家族基因进行共线性分析及复制事件研究,结果如图5和图7所示,在SmNAC家族基因中发现13对串联复制事件,且在不同染色体之间存在多个片段重复,推测原因是旱柳为四倍体植物,随着物种进化和植物基因组的复杂性,会发生NACs基因的复制,从而增加了物种中NAC家族成员的数量。
为进一步探讨旱柳与模式植物拟南芥和杨柳科物种之间NAC家族基因的进化关系,分析了SmNAC基因家族与拟南芥、毛果杨和红皮柳的共线性关系,结果(图8)表明,旱柳与3种植物的亲缘关系各不相同,与红皮柳的共线性基因对最多,其次是毛果杨,与拟南芥的共线性基因对最少,表明旱柳与红皮柳的亲缘关系最近。基因组间和基因组内共线性分析表明,直系同源基因对的片段重复或全基因组重复在NAC基因家族的进化过程中比例较大。
2.6 SmNAC家族基因在非生物胁迫下表达模式分析结果
2.6.1淹水胁迫为研究SmNAC家族基因在非生物胁迫中的作用,根据转录组数据,对SmNAC家族基因在淹水胁迫下的转录表达量进行分析。结果(图9-A)表明,淹水胁迫处理后,共102个SmNAC家族基因的表达量有差异。其中,NAP亚家族基因(SmNAC159、SmNAC160、SmNAC161和SmNAC162)的表达量在敏淹旱柳品种Yanliu No.1和耐淹旱柳品种Suliu 795中均有较大幅度升高。淹水胁迫处理后,ATAF亚家族基因(SmNAC007、SmNAC008、SmNAC009、SmNAC010、SmNAC011和SmNAC012)表达量在2个旱柳品种中均明显上调,其中在敏淹旱柳品种Yanliu No.1中上调幅度较大,2个品种均在淹水胁迫处理4 h时,ATAF亚家族基因的表达量达最大值;TIP亚家族基因(SmNAC184、SmNAC185和SmNAC186)表达量在敏淹旱柳品种Yanliu No.1中明显上调,在耐淹旱柳品种Suliu 795中变化不明显;OsNAC7亚家族基因表达量变化不明显且均维持较低水平;ONAC003亚家族基因表达量明显下降,且耐淹旱柳品种Suliu 795较敏淹旱柳品种Yanliu No.1下降更明显。淹水胁迫4~48 h,2个柳树品种的SmNAC237、SmNAC238、SmNAC239和SmNAC240基因表达量相对稳定并维持较高水平。
2.6.2盐胁迫对SmNAC家族基因在盐胁迫处理下的转录表达量进行分析,结果(图9-B)显示,有151个基因表达量存在差异,其中ATAF亚家族基因(SmNAC007、SmNAC008、SmNAC009、SmNAC010、SmNAC011和SmNAC012)和AtNAC3亚家族基因(SmNAC202、SmNAC203、SmNAC204和SmNAC205)的表达量在敏盐旱柳种质Yanjiang和耐盐旱柳品种9901中均明显上调;而二者的NAC1亚家族基因表达量均有所下调;OsNAC7亚家族基因的表达量在敏盐旱柳种质Yanjiang和耐盐旱柳品种9901中变化不明显且表达量较低。
2.7 SmNAC007基因的克隆及表达载体构建
在淹水胁迫和盐胁迫处理中,SmNAC007基因表达量对于2种胁迫处理均有明显响应,因此选取该基因构建拟南芥的过表达载体,对其进行进一步相关功能分析。
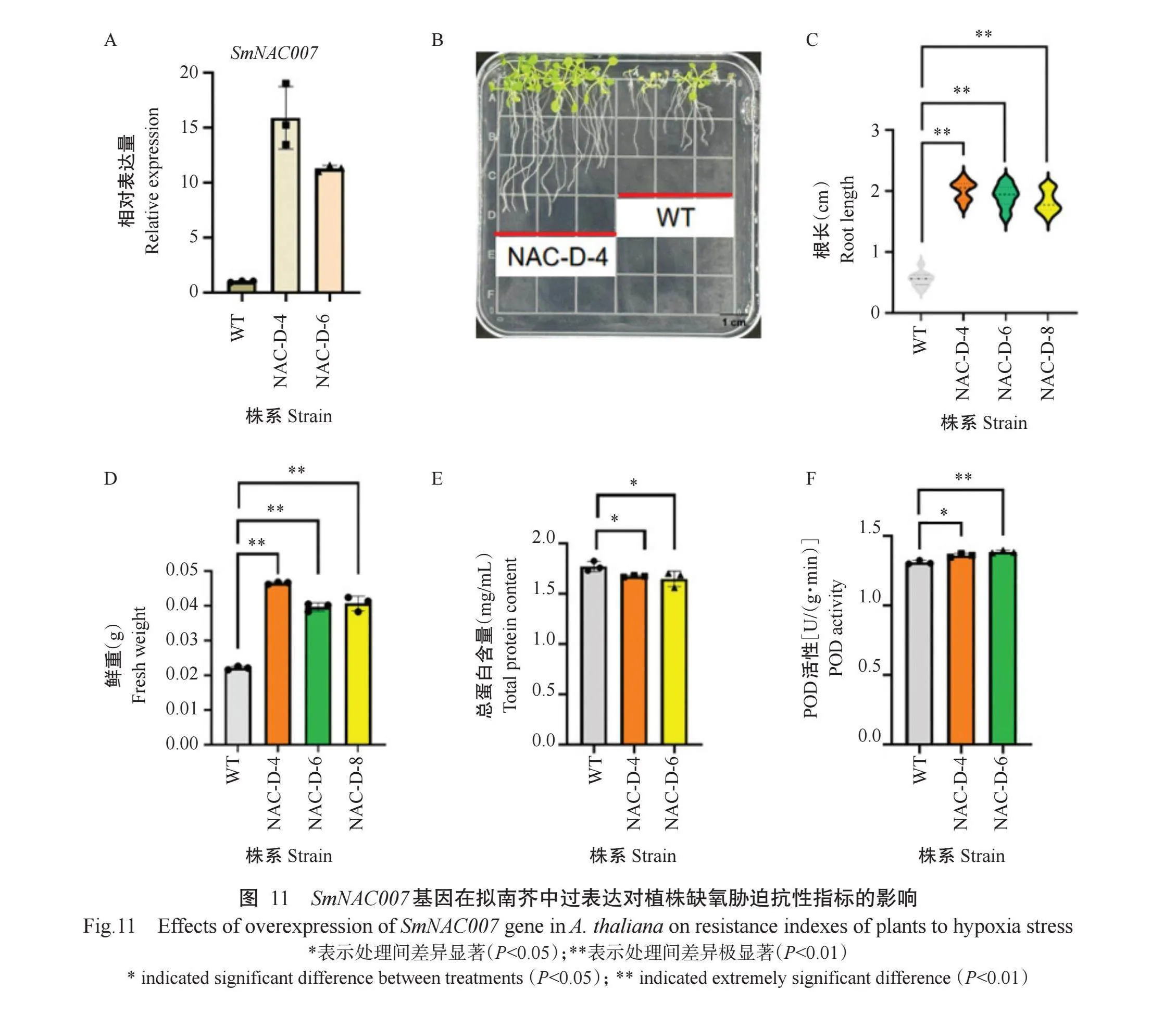
以旱柳cDNA为模板经PCR扩增获得长度约为927 bp的片段(图10-A),将PCR产物经切胶回收后测序。测序成功后对pWM101环状质粒进行单酶切(图10-B)。将PCR扩增得到的片段和与酶切后的pWM101载体连接,获取pWM101-SmNAC007重组质粒并转到农杆菌GV3101感受态细胞,随后使用花序侵染法成功获得转基因拟南芥株系。
2.8 SmNAC007基因表达模式及缺氧胁迫指标测定分析结果
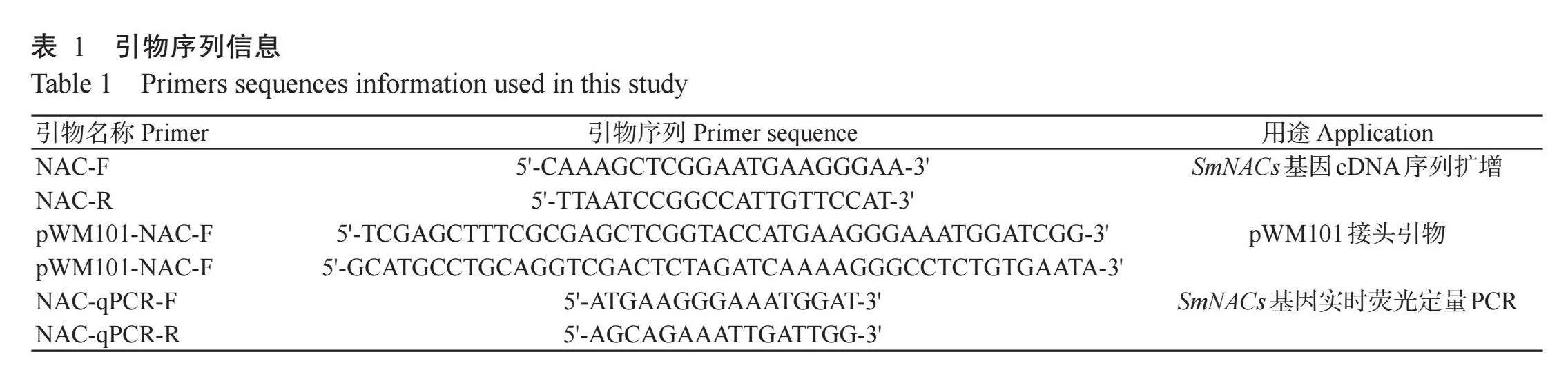
以生长相同周期的野生型拟南芥和SmNAC007转基因拟南芥为模板,进行实时荧光定量PCR检测,结果(图11-A)表明转基因拟南芥NAC-D-4和NAC-D-6株系中SmNAC007基因的相对表达量明显高于野生型拟南芥,为10~15倍。
对野生型拟南芥和转基因拟南芥株系进行缺氧胁迫处理,结果(图11-B)显示,缺氧胁迫的环境下,转基因拟南芥株系生长势较野生型拟南芥株系好,表现为3个转基因拟南芥株系NAC-D-4、NAC-D-6、NAC-D-8的根长和鲜重均极显著高于WT(Plt;0.01,下同)(图11-C和图11-D),说明过表达SmNAC007基因可以促进拟南芥适应缺氧胁迫的环境。由图11-E和图11-F可知,与WT相比,NAC-D-4和NAC-D-8株系中总蛋白含量显著降低(Plt;0.05,下同),POD活性分别显著和极显著升高。推测SmNAC007基因在缺氧胁迫响应中起着正调控功能,能通过促进POD基因的表达,使细胞免受氧化氢损害。
3讨论
诸多研究已证明NAC基因家族广泛参与调控植物对非生物胁迫的响应过程,是提高作物抗逆性的重要基因家族之一。截至目前,NAC基因家族成员的全基因组鉴定已经在许多植物中完成(Ooka et al.,2003;Wang et al.,2013;Peng et al.,2015;Ahmad et al.,2018;Diao et al.,2018)。例如,在拟南芥中已鉴定出105个NAC基因家族成员,在水稻中鉴定出151个,在玉米中鉴定出148个(Ooka et al.,2003;Peng et al.,2015)。而对旱枊NAC基因家族在全基因组水平上的系统分析和深入研究鲜见报道。本研究在旱柳参考基因组中共鉴定到290个NAC基因家族成员,旱柳属四倍体植物,其SmNAC基因家族成员数量与三倍体拟南芥NAC基因家族成员数目接近。本研究通过对SmNAC基因家族成员的全基因组鉴定和系统发育进化分析,推测SmNAC基因家族的扩展与基因组复制有关,基因复制可能是响应环境压力,如淹水胁迫所驱动的进化机制。SmNAC家族成员中存在1个不典型的亚家族,该亚家族仅包含13个SmNAC蛋白成员,与拟南芥NAC蛋白无相似性,其原因可能与旱柳和拟南芥在基因组、生理特征和生态环境等方面的差异有关,也可能与该亚家族中SmNAC蛋白独有的功能特性或调控机制有关。此外,本研究对SmNAC进行基因结构和基序分析,发现同一亚家族内的SmNAC成员基序组成和排列模式相似,如NAP和OsNAC7亚家族,推测同一亚家族SmNAC成员的功能相似。
基于不同物种直系同源物的结构特征,使用系统发育进化树预测分析基因功能。在拟南芥中,NAC转录因子家族成员如ANAC019、ANAC055和ANAC072等3个基因的过表达可显著提高植物抗旱性,3个基因通过与参与干旱胁迫反应的ERD1基因启动子CATGTG核心区结合调控ERD1蛋白及其下游基因的表达(Tran et al.,2004)。本研究的系统发育进化树结果显示,ANAC019、ANAC055和ANAC072与SmNAC202、SmNAC203、SmNAC204和SmNAC205聚类,且同属于AtNAC3亚家族,结合盐胁迫下差异表达热图推测SmNAC202、SmNAC203、SmNAC204、SmNAC205基因的过表达可提高旱柳耐盐性,以增强其在盐胁迫环境下的适应能力。不同的是,SmNAC家族蛋白成员存在应对不同胁迫的功能分化,原因可能与基因的染色体定位和保守基序差异有关,也可能与NAC家族成员在不同物种进化的过程中发生功能分化有关,因此,有关不同SmNAC家族蛋白成员的功能特异性还需进一步探究。
SmNAC家族基因可能在响应旱柳淹水胁迫和盐胁迫中发挥调控作用。在本研究中,发现经过淹水胁迫处理后,大多数SmNAC的表达水平产生了变化。其中,在淹水处理4~48 h后,SmNAC159、SmNAC160、SmNAC161、SmNAC162、SmNAC007、SmNAC008、SmNAC009、SmNAC010、SmNAC011和SmNAC012基因的表达量在2个旱柳品种中均上调,表明这些基因可能是旱柳响应淹水胁迫的重要候选基因。同时盐胁迫处理下,发现SmNAC007、SmNAC008、SmNAC009、SmNAC010、SmNAC011、SmNAC012、SmNAC202、SmNAC203、SmNAC204和SmNAC205基因表达量在敏盐和耐盐植株中均明显上调,表明这些基因可能是响应旱柳盐胁迫的重要候选基因。研究表明,某些NAC转录因子可参与植物对两种或多种非生物胁迫的响应,例如SNAC1基因过表达可通过改善根系发育增强田间试验中水稻的耐旱性和耐盐性(Liu et al.,2014),StNAC053基因的过表达可提高马铃薯耐盐性和耐旱性(Wang et al.,2021),本研究中也发现SmNAC007基因对于淹水和盐处理的表达均具有明显响应。
正常条件下,植物体内的活性氧产生与清除系统处于平衡状态。环境胁迫会使植物细胞中积累大量活性氧,从而严重损伤细胞蛋白质、膜脂、DNA及其他细胞组分,植物可通过产生超氧化物歧化酶、过氧化氢酶等酶促脱毒系统清除体内活性氧缓解细胞受损(杜秀敏等,2001)。如明网纹甜瓜可通过提高自身抗氧化酶活性适应低氧胁迫缓解膜脂过氧化程度(刘义玲等,2010);玉米ZmWRKY101基因通过调控抗氧化系统参与对盐胁迫的信号转导(郭玉敏等,2020)。本研究对SmNAC007基因功能进行分析,结果表明该基因在淹水胁迫下的发挥正调控作用,因此推测SmNAC007基因通过调控下游基因表达,特别是涉及酶促脱毒系统和细胞保护机制的基因,增加体内抗氧蛋白减缓细胞在胁迫条件下的损伤。
旱柳作为一种常见的树种,其强大的生命力使其在绿化和生态修复中发挥着重要作用。旱柳不仅具有出色的适应性和生长速度,还能在各种环境条件下展现出强大的抗逆性。旱柳在生长发育过程中经常受到各种非生物胁迫,如土壤污染(汪庆兵等,2014)、寒冷、干旱和盐胁迫(李子英等,2017),特别是金属镉胁迫(曹继敏等,2020)等,造成产量和质量损失。因此,挖掘旱柳抗逆性基因并制定分子育种策略对旱柳遗传改良具有重要意义。NAC基因家族作为植物中重要的基因家族之一,在植物生长和对不同非生物胁迫的反应中发挥重要作用。本研究对SmNAC基因家族相关研究结果,可为下一步研究证实SmNAC基因家族成员对各种胁迫的响应机制和调控功能提供参考依据。
4结论
鉴定出290个SmNAC基因家族成员,其中分别有102个和151个在淹水胁迫和盐胁迫中差异表达,差异表达大部分成员属于ATAF亚家族。通过对ATAF亚家族成员SmNAC007基因进行基因克隆、表达载体构建和转基因拟南芥,证实SmNAC007基因在淹水胁迫响应中起正向调控功能。
参考文献(References):
曹继敏,李双财,何德.2020.镉胁迫后旱柳转录组变化分析[J].生物技术通报,36(7):32-39.[Cao J M,Li S C,He D.2020.Transcriptome analysis of Salizmatsudana under cadmium stress[J].Biotechnology Bulletin,36(7):32-39.]doi:10.13560/j.cnki.biotech.bull.1985.2019-1018.
杜秀敏,殷文璇,赵彦修,张慧.2001.植物中活性氧的产生及清除机制[J].生物工程学报,(2):121-125.[Du X M,Yin W X,Zhao Y X,Zhang H.2001.The production and scavenging of reactive oxygen species in plants[J].Chinese Journal of Biotechnology,(2):121-125.]doi:10.13345/j.cjb.2001.02.003.
郭玉敏,张云华,井涛,臧小平.2020.过表达玉米转录因子ZmWRKY101基因提高拟南芥植株的耐盐力[J].植物生理学报,56(9):1921-1932.[Guo Y M,Zhang Y H,Jing T,Zang X P.2020.Overexpression of a maize transcrip-tion factor ZmWRKY101 improving salt tolerance of Arabi-dopsis plants[J].Plant Physiology Journal,56(9):1921-1932.]doi:10.13592/j.cnki.ppj.2020.0064.
纪艺红,索梅芹,邵子莹,张宁,王磊.2024.马铃薯StNAC6基因克隆及干旱胁迫表达分析[J].江苏农业科学,52(11):51-60.[Ji Y H,Suo M Q,Shao Z Y,Zhang N,Wang L.2024.Cloning and expression analysis of StNAC6 gene in potato under drought stress[J].Jiangsu Agricultural Scien-ces,52(11):51-60.]doi:10.15889/j.issn.1002-1302.2024.11.007.
李子英,丛日春,杨庆山,周健.2017.盐碱胁迫对柳树幼苗生长和渗透调节物质含量的影响[J].生态学报,37(24):8511-8517.[Li Z Y,Cong R C,Yang Q S,Zhou J.2017.Effects of saline-alkali stress on growth and osmotic adjust-ment substances in willow seedlings[J].Acta EcologicaSinica,37(24):8511-8517.]doi:10.5846/stxb201611082 263.
刘义玲,李天来,孙周平,陈亚东.2010.根际低氧胁迫对网纹甜瓜生长、根呼吸代谢及抗氧化酶活性的影响[J].应用生态学报,21(6):1439-1445.[Liu Y L,Li T L,Sun Z P,Chen Y D.2010.Impacts of root-zone hypoxia stress on muskmelon growth,its root respiratory metabolism,and antioxidative enzyme activities[J].Chinese Journal of App-lied Ecology,21(6):1439-1445.]doi:10.13287/j.1001-9332.2010.0227.
汪庆兵,陈光才,房娟,楼崇,张建锋.2014.速生柳树苗对土壤铅的耐性、积累与分配特性研究[J].植物研究,34(5):626-633.[Wang Q B,Chen G C,Fang J,Lou C,Zhang J F.2014.Characteristics of soil lead tolerance,accumula-tion and distribution in Salix babylonicaLinn.and Salix jiangsuensis J172[J].Bulletin of Botanical Research,34(5):626-633.]doi:10.7525/j.issn.1673-5102.2014.05.008.
王晓菲,高利盈,刘宁,程钧,王伟,谭彬,郑先波,叶霞,冯建灿,张郎郎.2024.桃基因PpNAC的鉴定及其在不同发育时期的表达分析[J].河南农业大学学报,58(3):412-423.[Wang X F,Gao L Y,Liu N,Cheng J,Wang W,Tan B,Zheng X B,Ye X,Feng J C,Zhang L L.2024.Identifi-cation and expression analysis of PpNAC genes during dif-ferent development stages of peach fruit[J].Journal of Henan Agricultural University,58(3):412-423.]doi:10.16445/j.cnki.1000-2340.20240301.002.
Ahmad M,Yan X H,Li J Z,Yang Q S,Jamil W,Teng Y W,Bai S L.2018.Genome wide identification and predicted func-tional analyses of NAC transcription factors in Asian pears[J].BMC Plant Biology,18(1):214.doi:10.1186/s 12870-018-1427-x.
An J P,Li R,Qu F J,You C X,Wang X F,Hao Y J.2018.An apple NAC transcription factor negatively regulates cold tolerance via CBF-dependent pathway[J].Journal of Plant Physiology,221:74-80.doi:10.1016/j.jplph.2017.12.009.
Bui L T,Shukla V,Giorgi F M,Trivellini A,Perata P,Licausi F,Giuntoli B.2020.Differential submergence tolerance between juvenile and adult Arabidopsis plants involves the ANAC017 transcription factor[J].The Plant Journal,104(4):979-994.doi:10.1111/tpj.14975.
Diao W P,Snyder J C,Wang S B,Liu J B,Pan B G,Guo G J,Ge W,Dawood M H S.2018.Genome-wide analyses of the NAC transcription factor gene family in pepper(Capsi-cum annuum L.):Chromosome location,phylogeny,struc-ture,expression patterns,cis-elements in the promoter,and interaction network[J].International Journal of Molecular Sciences,19(4):1028.doi:10.3390/ijms 19041028.
Han F X,Wang P Y,Chen X,Zhao H H,Zhu Q Y,Song Y T,Nie Y M,Li Y,Guo M N,Niu S H.2023.An ethylene-induced NAC transcription factor acts as a multiple abioticstressresponsor in conifer[J].Horticulture Research,10(8):uhad130.doi:10.1093/hr/uhad130.
Ju Y L,Yue X F,Min Z,Wang X H,Fang Y L,Zhang J X.2020.VvNAC17,a novel stress-responsive grapevine(Vitis vinifera L.)NAC transcription factor,increases sen-sitivity to abscisic acid and enhances salinity,freezing,and drought tolerance in transgenic Arabidopsis[J].Plant Phy-siol and Biochemistry,146:98-111.doi:10.1016/j.plaphy.2019.11.002.
Li M,Chen R,Jiang Q Y,Sun X J,Zhang H,Hu Z.2021a.GmNAC06,a NAC domain transcription factor enhances salt stress tolerance in soybean[J].Plant Molecular Bio-logy,105(3):333-345.doi:10.1007/s 11103-020-01091-y.
Li M,Wu Z Y,Gu H,Cheng D W,Guo X Z,Li L,Shi C Y,Xu G Y,Gu S C,Abid M,Zhong Y P,Qi X J,Chen J Y.2021b.AvNAC030,a NAC domain transcription factor,enhances salt stress tolerance in kiwifruit[J].International Journal of Molecular Sciences,22(21):11897.doi:10.3390/ijms222111897.
Liu G Z,Li X L,Jin S X,Liu X Y,Zhu L F,Nie Y C,Zhang X L.2014.Overexpression of rice NAC gene SNAC1 improves drought and salt tolerance by enhancing root development and reducing transpiration rate in transgenic cotton[J].PLoS One,9(1):e86895.doi:10.1371/journal.pone.0086895.
Mathew I E,Rhein H S,Green A J,Hirschi K D.2023.Genera-ting reproducing anoxia conditions for plant phenotyping[J].Bio-protocol,13(3):e4603.doi:10.21769/BioPro-toc.4603.
Nakashima K,Tran L S P,Van Nguyen D,Fujita M,Maruyama K,Todaka D,Ito Y,Hayashi N,Shinozaki K,Yamaguchi-Shinozaki K.2007.Functional analysis of a NAC-type transcription factor OsNAC6 involved in abiotic and biotic stress-responsive gene expression in rice[J].The Plant Journal,51(4):617-630.doi:10.1111/j.1365-313X.2007.0 3168.x.
Olsen AN,Ernst H A,Leggio L L,Skriver K.2005.NAC tran-scription factors:Structurally distinct,functionally diverse[J].Trends in Plant Science,10(2):79-87.doi:10.1016/j.tplants.2004.12.010.
Ooka H,Satoh K,Doi K,Nagata T,Otomo Y,Murakami K,Matsubara K,Osato N,Kawai J,Carninci P,Hayashizaki Y,Suzuki K,Kojima K,Takahara Y,Yamamoto K,Kiku-chi S.2003.Comprehensive analysis of NAC family genes in Oryza sativa and Arabidopsis thaliana[J].DNA Re-search,10(6):239-247.doi:10.1093/dnares/10.6.239.
Peng X J,Zhao Y,Li X M,Wu M,Chai W B,Sheng L,Wang Y,Dong Q,Jiang H Y,Cheng B J.2015.Genomewideidentification,classification and analysis of NAC type gene family in maize[J].Journal of Genetics,94(3):377-390.doi:10.1007/s 12041-015-0526-9.
Puranik S,Sahu P P,Srivastava P S,Prasad M.2012.NAC pro-teins:Regulation and role in stress tolerance[J].Trends in Plant Science,17(6):369-381.doi:10.1016/j.tplants.2012.02.004.
Souer E,van Houwelingen A,Kloos D,Mol J,Koes R.1996.The no apical meristem gene of petunia is required for pat-tern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J].Cell,85(2):159-170.doi:10.1016/s0092-8674(00)81093-4.
Thirumalaikumar V P,Devkar V,Mehterov N,Ali S,Ozgur R,Turkan I,Mueller-Roeber B,Balazadeh S.2018.NACtranscription factor JUNGBRUNNEN1 enhances droughttolerance in tomato[J].Plant Biotechnology Journal,16(2):354-366.doi:10.1111/pbi.12776.
Tran L S P,Nakashima K,Sakuma Y,Simpson S D,Fujita Y,Maruyama K,Fujita M,Seki M,Shinozaki K,Yamaguchi-Shinozaki K.2004.Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J].The Plant Cell,16(9):2481-2498.doi:10.1105/tpc.104.022699.
Wang N,Zheng Y,Xin H P,Fang L C,Li S H.2013.Compre-hensive analysis of NAC domain transcription factor gene family in Vitis vinifera[J].Plant Cell Reports,32(1):61-75.doi:10.1007/s00299-012-1340-y.
Wang Q,Guo C,Li Z Y,Sun J H,Deng Z C,Wen L C,Li X X,Guo Y F.2021.Potato NAC tanscription factor StNAC053 enhances salt and drought tolerance in transgenic Arabi-dopsis[J].International Journal of Molecular Sciences,22(5):2568.doi:10.3390/ijms22052568.
Xi Y,Ling Q Q,Zhou Y,Liu X,Qian Y X.2022.ZmNAC074,a maize stress-responsive NAC transcription factor,con-fers heat stress tolerance in transgenic Arabidopsis[J].Frontiers in Plant Science,13:986628.doi:10.3389/fpls.2022.986628.
Yang C F,Huang Y Z,LüP Y,Antwi-Boasiako A,Begum N,Zhao T J,Zhao J M.2022.NAC transcription factor GmNAC12 improved drought stress tolerance in soybean[J].International Journal of Molecular Sciences,23(19):12029.doi:10.3390/ijms231912029.
(责任编辑李洪艳)

