猪瘟病毒Erns蛋白原核表达及其多克隆抗体制备



摘要:【目的】制备猪瘟病毒(Classical swine fever virus,CSFV)Erns蛋白多克隆抗体,为进一步研究Erns蛋白结构和功能及解析CSFV的致病机理提供理论依据。【方法】采用生物信息学方法预测Erns蛋白结构。以真核表达载体pCMV-HA-Erns为模板,PCR克隆CSFV Erns基因,构建原核表达载体pET-32a-Erns。将pET-32a-Erns转化大肠杆菌BL21(DE3)感受态细胞,添加IPTG诱导Erns蛋白表达,确定Erns蛋白表达形式。利用Ni-NTA亲和层析法纯化蛋白,以获得高纯度的Erns蛋白。采用背部皮下多点注射法免疫小鼠,经4次免疫后采集小鼠血液,分离血清制备获得Erns蛋白多克隆抗体,并检测其效价和特异性。【结果】Erns蛋白不含信号肽和跨膜结构域,为亲水性蛋白,含有多个B细胞抗原表位;Erns基因片段大小为681 bp,其重组蛋白主要以包涵体形式表达;Erns蛋白多克隆抗体对原核表达的重组蛋白效价为1∶64000,对真核表达的重组蛋白效价为1∶1000,且能特异性识别CSFV。【结论】制备获得的Erns蛋白多克隆抗体具有效价高和特异性强等特点,可用于ELISA和Western blotting检测细胞中Erns蛋白水平。Erns蛋白多克隆抗体的制备有助于更好地理解Erns蛋白在CSFV感染和免疫过程中的作用,对深入研究Erns蛋白功能、CSFV生物学特性及猪瘟的防治和诊断方法的开发具有重要意义。
关键词:猪瘟病毒;Erns蛋白;原核表达;多克隆抗体
中图分类号:S828.89文献标志码:A文章编号:2095-1191(2024)09-2835-08
Prokaryotic expression ofErns protein of classical swine fever virus and preparation of its polyclonal antibody
SONG Dan-dan1,2,JIN Yi-xin1,2,HUANG Yuan-hui1,2,WANGWen-feng1,2,MIN Kai-jun1,2,ZHANG Chuan-liang1,2,LUO Ting-rong1,2*,LI Xiao-ning1,2*
(1College of Animal Science and Veterinary Medicine,Guangxi University,Nanning,Guangxi 530004,China;2Guangxi Engineering Research Center of Veterinary Biologics/Guangxi Key Laboratory of Livestock and PoultryBreeding and Disease Prevention and Control/Key Laboratory of Animal Disease Prevention and Control inGuangxi Universities,Nanning,Guangxi 530004,China)
Abstract:【Objective】The study aimed to prepare polyclonal antibody against the Erns protein of the classical swine fe-ver virus(CSFV),which could provide theoretical basis for further exploring the structure and function of the Erns pro-tein,as well as for elucidating the pathogenic mechanisms of CSFV.【Method】Bioinformatics methods were used to pre-dict the structure of the Erns protein.The CSFV Erns gene was cloned by PCR using the eukaryotic expression vector pCMV-HA-Erns as a template,and the prokaryotic expression vector pET-32a-Erns was constructed.The pET-32a-Erns vector was then transformed into Escherichia coli BL21(DE3)receptor cells,IPTG was added to induce the expression ofErns pro-tein,confirming the expression formofErns protein.The target protein was purified by Ni-NTA affinity chromatography toobtain high-purity Erns protein.Mice were immunized using the back subcutaneous multiple injection method,and after 4 immunizations,blood was collected to isolate serum for the preparation of polyclonal antibodies against the Erns protein,and their titer and specificity were assessed.【Result】The Erns protein lacked signal peptide and transmembrane domains,making it a hydrophilic protein that contained multiple B-cell epitopes.The size of the Erns gene fragment was 681 bp,and its recombinant protein was primarily expressed as inclusion bodies.The polyclonal antibodies against the Erns protein had titers of 1∶64000 for the prokaryotic expressed recombinant protein and 1∶1000 for the eukaryotic expressed recombinant protein,and they could specifically recognize CSFV.【Conclusion】The prepared polyclonal antibodies against the Erns pro-tein possess hightiter and strong specificity,making them suitable for detecting the expression levels of the Erns protein in cells using ELISA and Western blotting.The preparation ofErns protein polyclonal antibodies contributes to a better under-standing of the role of Erns protein in CSFV infection and immune processes.This has significant implications for further research into the function of Erns protein,the biological characteristics of CSFV,and the development of prevention and diagnostic methods for CSFV.
Key words:classical swine fever virus(CSFV);Erns protein;prokaryotic expression;polyclonal antibody
Foundation items:National Natural Science Foundation of China(32360869,31660722);Guangxi Natural Science Foundation(2023GXNSFDA026043,2021GXNSFAA220007)
0引言
【研究意义】猪瘟是由猪瘟病毒(Classical swinefever virus,CSFV)引起的一种高发病率、高死亡率传染病,具有急性、热性、接触性及全年性流行的特点,给全球养猪业带来巨大经济损失(杨晓颖等,2018),是世界动物卫生组织(OIE)规定必须上报的猪病之一,我国将其归为二类动物疫病(陈紫昱等,2023;邓俊花等,2023;Edwards et al.,2000)。在实际生产中,加强饲养管理、疫苗接种及加强疫病监测等方法未能有效的控制猪瘟传播(Mangen et al.,2001)。Erns蛋白是CSFV包膜蛋白中唯一具有RNA酶活性的蛋白,参与调节RNA的合成(Moormann et al.,2000)。在猪瘟感染过程中,Erns发挥着关键作用(Hulst etal.,1998)。研究表明,Erns具有特异性识别宿主细胞表面受体的能力,且该受体参与CSFV的侵染过程(Hulst etal.,1998)。因此,制备Erns蛋白多克隆抗体对CSFV的研究至关重要(李鹏等,2008;郭东光等,2014),能为研究Erns蛋白在CSFV感染和免疫过程中的作用及探究Erns蛋白的结构与功能提供理论依据。【前人研究进展】经典CSFV颗粒呈球形,具有二十面体核衣壳结构,表面有包膜,是一种单链RNA病毒。CSFV基因组只有1个开放阅读框(ORF)(Risatti et al.,2006;Fernandez-Sainz et al.,2015),编码由3898个氨基酸组成的多聚蛋白。多聚蛋白可被宿主细胞蛋白酶进一步切割,产生4个结构蛋白(C、Erns、E1和E2)和8个非结构蛋白(Npro、P7、NS2、NS3、NS4A、NS4B、NS5A和NS5B)(Li.et al.,2017)。其中,结构蛋白Erns和E2抗原性较强,可在天然宿主体内诱导中和抗体,产生保护性免疫(康恺,2015;Fernandez-Sainz et al.,2015;梅建国,2019)。CSFV的保护性免疫依赖于针对结构蛋白E2和Erns产生的中和抗体,该理论已应用于开发DIVA CSFV E2疫苗及其配套的基于Erns蛋白的ELISA(Panyasinget al.,2023)试剂盒。Erns蛋白又称E0蛋白,由ORF编码的227个氨基酸组成,存在9个潜在的糖基化位点,分子量44~48 kD(Wei et al.,2021);Erns蛋白高度糖基化,约50%质量由N-连接的糖基组成(Liu et al.,1998)。Erns是猪瘟病毒属的特异性蛋白,常以通过二硫键连接的同源二聚体形式存在(Hong et al.,2023);Erns蛋白可与多种类型细胞结合,在细胞培养过程能抑制CSFV和牛病毒性腹泻病毒感染,提示Erns蛋白可能参与病毒附着或进入易感细胞的过程(Lin et al.,2005);Erns蛋白参与CSFV的吸附和细胞自噬调控,且能通过与dsRNA/ssRNA结合而阻断TLR3/TLR7信号传导,进而抑制I型干扰素的合成(Honget al.,2023),引起持续性感染(Fatima et al.,2021)。Erns蛋白缺乏疏水跨膜区(Transmembrane region,TMR),与囊膜的结合较松散,在病毒囊膜上不稳定,属于可分泌蛋白,在CSFV感染的细胞上清、组织和血清中均能检测到(Zhang et al.,2022)。Erns是CSFV重要的结构蛋白,具有良好的免疫原性,能刺激机体产生中和抗体,可作为鉴别CSFV感染和标记疫苗免疫抗体的靶抗原(孙永芳,2017);除了作为CSFV的结构蛋白之外,Erns也是一种功能性蛋白,具有核糖核酸酶(RNase)活性,参与调节感染细胞RNA合成,能诱导宿主免疫抑制和病毒毒力减弱(Lamothe-Reyes,2023);Erns还具有免疫抑制活性,能诱导淋巴细胞的凋亡(Wang,2021)。【本研究切入点】猪瘟病毒Erns蛋白在病毒感染过程中的表达及其与宿主蛋白的相互作用对猪瘟的检测和预防至关重要,在实际生产中CSFV Erns抗体使用较多,但市场上尚缺乏商品化的CSFV Erns抗体。【拟解决的关键问题】通过克隆Erns基因片段,构建Erns蛋白原核表达载体,经表达纯化和复性浓缩后免疫小鼠制备Erns蛋白多克隆抗体,为进一步研究Erns蛋白的结构和功能及解析CSFV的致病机理提供理论依据。
1材料与方法
1.1试验材料
猪瘟病毒石门株(Shimen strain)、原核载体pET-32a(+)、真核载体pCMV-HA、HEK-293T细胞、PK-15细胞和Erns蛋白真核表达载体pCMV-HA-Erns由广西高校动物疫病预防与控制重点实验室保存提供;ClonExpress II一步克隆试剂盒、抗β-Actin鼠单克隆抗体和HRP标记山羊抗鼠IgG抗体购自艾比玛特医药科技(上海)有限公司;蛋白酶抑制剂、脱脂奶粉、30%制胶液、1.0 mol/L Tris-HCl(pH 6.8)、1.5 mol/L Tris-HCl(pH 8.8)和PAGE胶促凝剂购自北京索莱宝科技有限公司;碱性磷酸酶标记马抗小鼠IgG抗体购自北京中杉金桥生物技术有限公司;强RIPA裂解液、Bradford法蛋白浓度测定试剂盒、DMEM、OPTI-MEM和LipofectamineTM 2000购自赛默飞世尔科技有限公司;TEMED购自上海麦克林生化科技有限公司;胎牛血清购自上海诺宁生物科技有限公司;TMB底物显色液购自苏州新赛美生物科技有限公司。
1.2试验动物
35日龄SPF级雌性BALB/c小鼠购自斯贝福(北京)生物技术有限公司。动物试验由广西大学动物实验伦理委员会批准,批准号GXU2019-021;并参照GB/T 35892—2018《实验动物福利伦理审查指南》进行操作。
1.3蛋白结构预测
利用ProtScale预测Erns蛋白亲疏水性;使用IEDB预测Erns蛋白抗原表位;运用SignalP-4.1和TMHMM-2.0分别预测Erns蛋白氨基酸序列是否含有信号肽和跨膜区结构。
1.4引物设计与合成
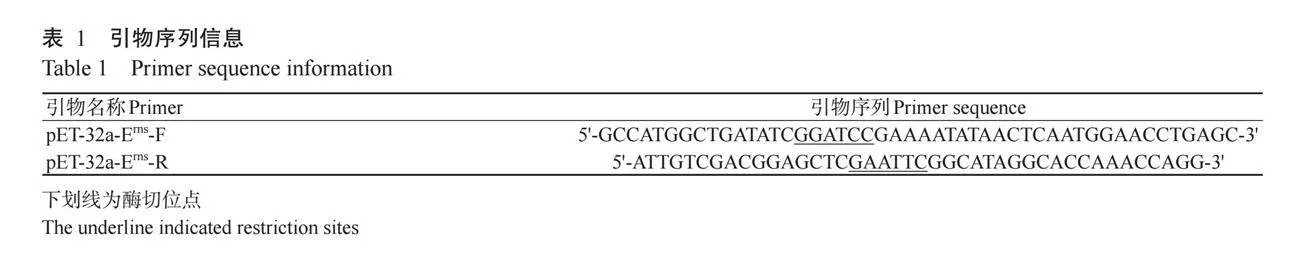
在GenBank下载Erns基因序列(KY816734.1),经DNAMAN碱基序列比对后,采用Primer 5.0设计含BamH I和EcoR I酶切位点的引物(表1),委托南宁捷尼斯生物科技有限公司合成,上游引物命名为pET-32a-Erns-F,下游引物命名为pET-32a-Erns-R,扩增目的片段大小681bp。
1.5原核表达载体构建
以pCMV-HA-Erns为模板,使用高保真酶对Erns基因进行PCR扩增。根据诺唯赞ClonExpress II一步克隆试剂盒说明及原核表达载体和目的基因浓度配制反应体系进行一步克隆,转化Top10感受态细胞,经菌液PCR鉴定,将鉴定结果呈阳性的菌液送至生工生物工程(上海)股份有限公司测序。将测序成功的菌液扩大培养,提取质粒,采用限制性内切酶BamH I和EcoR I进行双酶切鉴定。
1.6重组蛋白表达
以pET-32a-Erns转化大肠杆菌BL21(DE3)感受态细胞,37℃摇床培养12h,涂板并挑取单克隆菌斑接种于含氨苄抗性的LB液体培养基(5 mL)中,37℃摇床培养至OD600 nm达0.4~0.6,然后按1∶100的比例接种于LB液体培养基(20 mL)中,培养至OD600nm达0.4~0.6时加入IPTG至终浓度为0.5 mmol/L,诱导表达8 h。取诱导前后的菌液各2 mL,离心收集菌体,使用200μL菌体裂解液重悬,细胞破碎仪充分破碎后12000r/min离心10min,取上清液、沉淀及破碎的全菌液各200μL,加入40μL蛋白上样缓冲液,煮沸10 min,12000 r/min离心10 min。以空载质粒pET-32a(+)菌液为对照进行SDS-PAGE检测,考马斯亮蓝染色分析重组蛋白表达情况。
1.7重组蛋白纯化
重组蛋白Erns以包涵体形式表达为主,采用包涵体尿素洗涤法进行重组蛋白纯化,并进行复性处理。在构建重组原核表达质粒过程中,重组蛋白会融合载体pET-32a携带的多聚组氨酸(6×His)标签,可利用Ni2+金属螯合亲和层析法纯化重组蛋白,以Ni-NTA树脂为纯化介质,将纯化收集到的样品分别进行SDS-PAGE和Western blotting检测。
1.8多克隆抗体制备
4只雌性BALB/c小鼠先饲养3 d以适应新环境,参照赵祥秀等(2020)的方法,采用背部皮下多点注射法进行免疫,免疫周期按照1、7、21和35 d进行,共4次免疫,每次免疫150μg,一免为重组蛋白与弗氏完全佐剂等体积混合乳化,二免至四免为重组蛋白与弗氏不完全佐剂等体积混合乳化。四免后第7d眼球采血,分离血清并分装储存于-80℃冰箱。
1.9 Erns蛋白多克隆抗体效价和特异性检测
以pCMV-HA-Erns转化HEK-293T细胞,培养36 h后采用Western blotting检测细胞中的Erns蛋白表达情况。使用原核表达的重组蛋白Erns包被ELISA板,进行ELISA检测,以验证抗体特异性。
2结果与分析
2.1 Erns蛋白结构预测结果
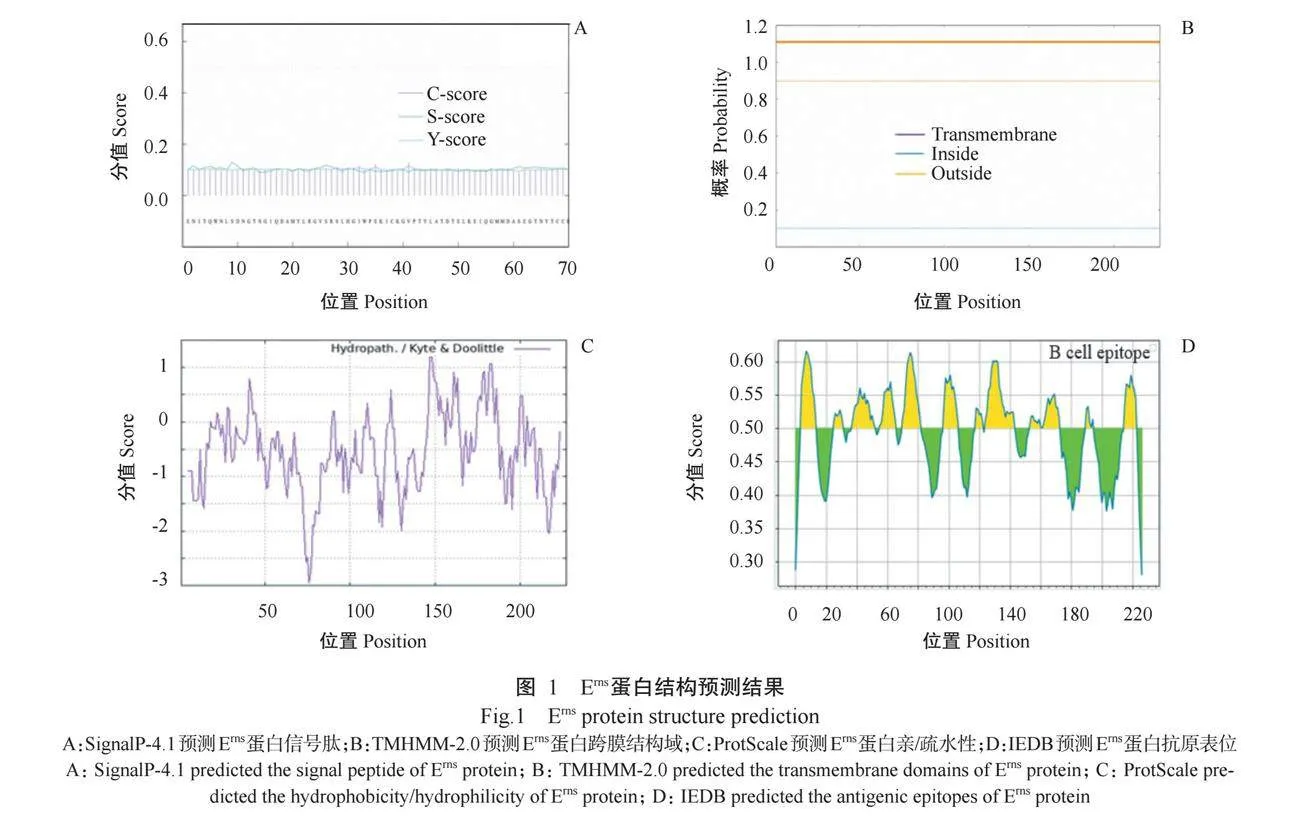
SignalP-4.1和TMHMM-2.0预测结果(图1-A和图1-B)显示,Erns蛋白不含信号肽和跨膜结构域,属于分泌型蛋白;ProtScale预测Erns蛋白亲/疏水性,评分大于0为疏水,小于0为亲水,结果(图1-C)显示,Erns蛋白氨基酸序列中最大疏水值为1.189,为第147和148位氨基酸,是疏水性最强的氨基酸,最强亲水性的氨基酸是第76位氨基酸,疏水值为-2.956,整条多肽链表现为亲水性;IEDB预测抗原表位,阈值为0.5,结果(图1-D)显示,Erns蛋白存在多个B细胞抗原表位。
2.2 Erns基因扩增结果
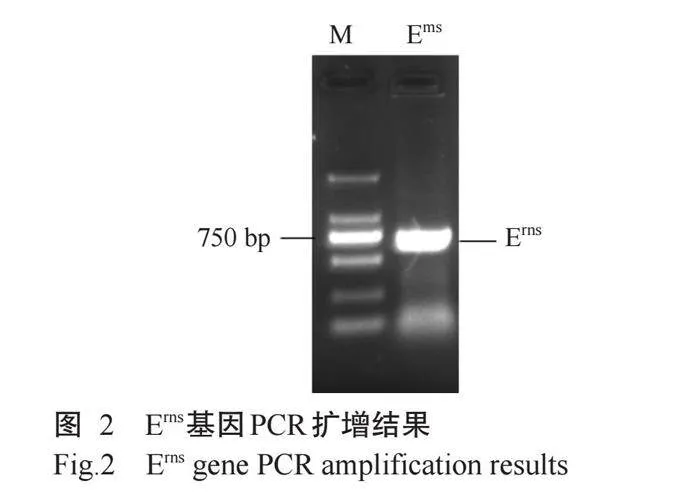
以pCMV-HA-Erns为模板,利用引物pET-32a-Erns-F和pET-32a-Erns-R进行PCR扩增,结果(图2)显示,目的基因片段大小约为700bp,与预期结果相符。
2.3 Erns原核表达载体构建与鉴定结果
将Erns基因克隆至载体pET-32a(+)中BamH I和EcoR I多克隆位点,随机挑取6个含有pET-32a-Erns的单克隆进行菌落PCR鉴定,结果(图3-A)显示,PCR产物大小约为700 bp,符合预期结果。用限制性内切酶BamH I和EcoR I对质粒进行双酶切鉴定,酶切结果(图3-B)与预期结果符合。将质粒送至生工生物工程(上海)股份有限公司进行测序,测序结果正确。表明Erns基因已成功克隆到pET-32a载体上,原核表达载体pET-32a-Erns构建成功。
2.4重组蛋白Erns表达形式鉴定结果
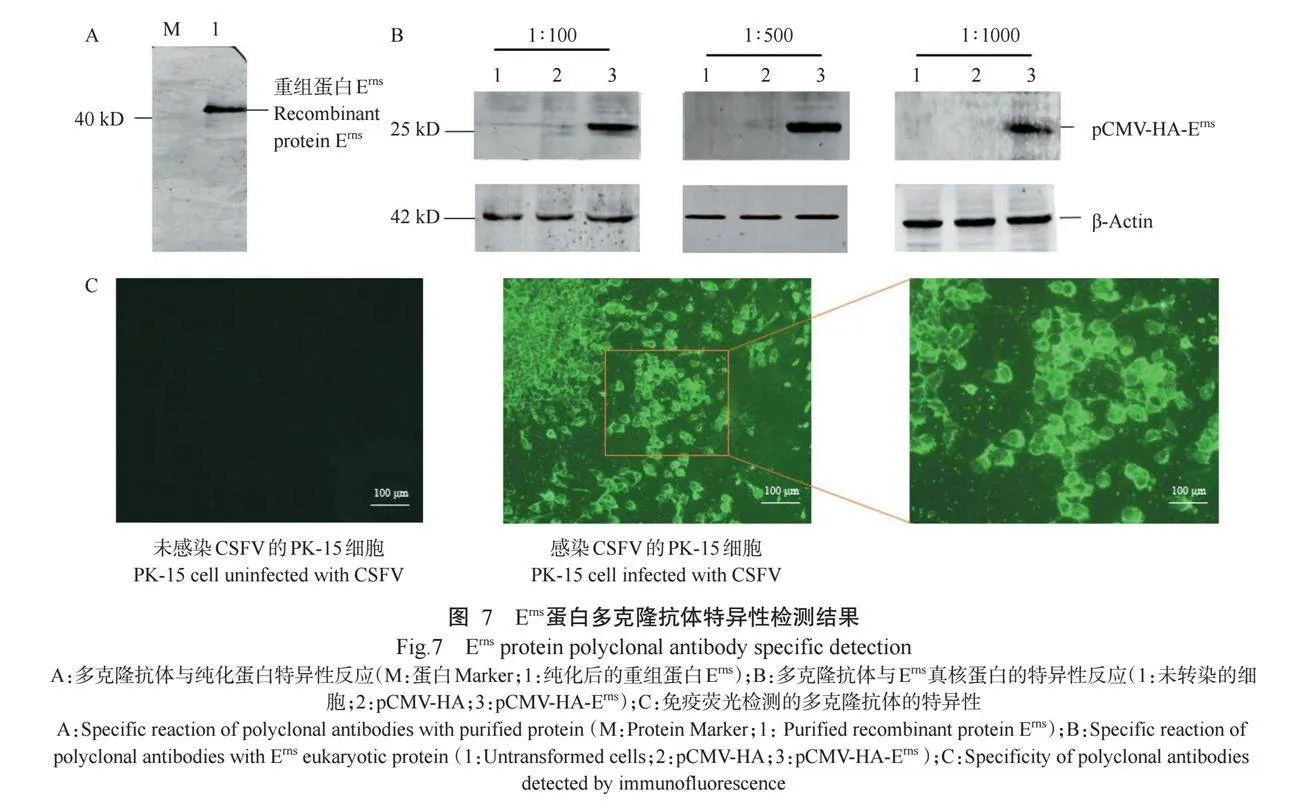
在大肠杆菌BL21(DE3)感受态细胞中诱导表达重组蛋白Erns,IPTG诱导浓度为0.5 mmol/L,诱导温度为30℃。诱导后取2 mL菌液,收集总菌液、上清和沉淀进行SDS-PAGE及Western blotting(一抗为His单克隆抗体)检测。结果(图4)显示,与未诱导重组菌相比,经IPTG诱导后能明显观察到约40 kD的Erns蛋白条带,且重组蛋白Erns主要以包涵体形式表达。
2.5重组蛋白Erns纯化与鉴定结果
重组蛋白Erns携带His标签,使用Ni-NTA亲和层析对其进行纯化。使用不同pH 6.3和4.5的咪唑溶液洗脱蛋白,SDS-PAGE和Western blotting鉴定纯化效果。结果(图5)显示,使用pH 4.5的咪唑溶液,约在40 kD处有目的条带,表明成功获得较高纯度的重组蛋白Erns。
2.6 Erns蛋白多克隆抗体效价检测结果
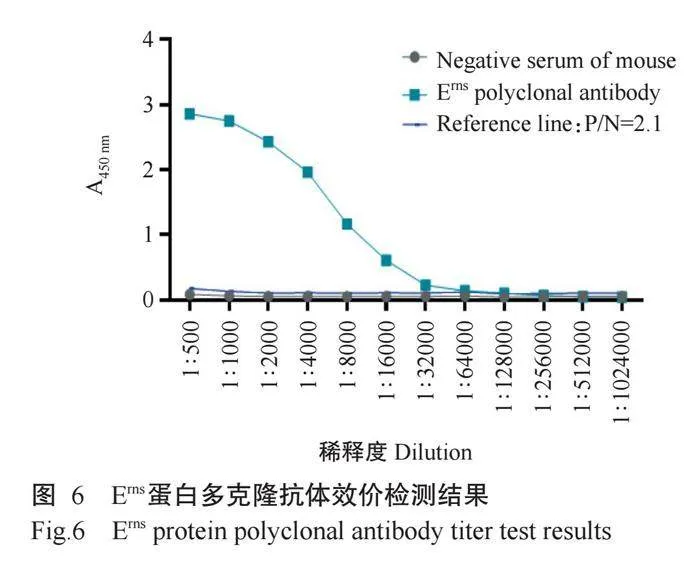
使用原核表达的重组蛋白Erns包被ELISA板以检测Erns蛋白多克隆抗体效价。为直观判定效价结果,以阴性血清A450 nm的2.1倍值建立参考线。结果(图6)显示,Erns蛋白多克隆抗体针对原核表达的重组蛋白Erns,在1∶64000稀释度时A450 nm大于2.1倍阴性血清值,判定Erns蛋白多克隆抗体的最高效价为1∶64000。
2.7 Erns蛋白多克隆抗体特异性检测结果
采用Western blotting验证Erns蛋白多克隆抗体与纯化的重组蛋白Erns是否发生反应,结果(图7-A)显示,Erns多克隆抗体的特异性良好。按照说明将pCMV-HA-Erns转化至HEK-293T细胞,培养36 h,收集蛋白样品。将制备获得的抗Erns蛋白多克隆抗体按1∶100、1∶500和1∶1000的比例稀释,Western blotting检测抗体效价,结果(图7-B)显示,Erns蛋白多克隆抗体能与蛋白Erns发生特异性反应,其抗体效价可达1∶1000。用CSFV感染PK-15细胞,用制备的多克隆抗体进行免疫荧光检测,结果(图7-C)显示,感染CSFV的PK-15细胞出现明显的绿色荧光,未感染CSFV的PK-15细胞未出现绿色荧光,表明Erns蛋白多克隆抗体能特异性识别CSFV。
3讨论
猪瘟在我国各地均有发生,给我国养猪业造成了巨大经济损失(闾志峰,2017)。随着CSFV C株疫苗株的问世(Luo et al.,2017)和猪场生物安全防控措施的加强,猪瘟在多数国家已被消灭,但在中国、印度和越南等养猪体量大的国家,仍存在慢性猪瘟和非典型猪瘟,且猪瘟的流行更加复杂多样(Edwards et al.,2000)。Erns是CSFV重要的结构蛋白,由227个氨基酸组成,经糖基化处理后,其分子量增加,形成分子量约为96 kD的由二硫键连接形成的同源二聚体(李玉霄等,2020)。Erns蛋白在CSFV引起的免疫抑制过程中扮演着重要角色,其RNase活性不仅影响宿主细胞中病毒RNA的复制,还会抑制动物感染早期的防御功能。目前已知的针对Erns的CSFV特异性单克隆抗体存在一定局限性,制备多克隆抗体对CSFV不同毒株Erns蛋白的研究至关重要(李鹏等,2008;郭东光等,2014)。
本研究利用原核表达载体系统成功构建了pET-32a-Erns,并到了高纯度的重组蛋白Erns,与利用昆虫细胞等真核表达系统表达病毒蛋白相比,本研究使用的原核表达系统pET-32a(+)具有培养成本低、操作简单、易于规模化生产、经济和高效等特点(杨忠东和何成,2011),能在短期内获得大量的特异性抗体(耿抒贤等,2020)。此外,本研究在构建原核表达载体时选用的一步克隆法,突破了传统的双酶切和连接过程,只需要一步重组法即可得到高效率克隆的重组载体。研究发现,利用原核表达系统表达纯化的抗原蛋白所制备的抗体具有更好的反应活性和特异性(张传亮等,2024)。因此,本研究建立的重组蛋白Erns原核表达系统能有效降低生产成本,提高生产效率(杨领弟等,2024)。本研究制备的Erns蛋白多克隆抗体效价为1∶64000,与贾俊杰等(2016)的研究结果相比,效价更高,提示其在体外试验中具有更高的活性。进一步研究表明,Erns蛋白多克隆抗体不仅适用于ELISA检测,在Western blotting检测中也表现出色,稀释度为1∶1000时即可检测到目的蛋白条带。
4结论
制备获得的Erns多克隆抗体具有效价高和特异性强等特点,可用于ELISA和Western blotting检测细胞中Erns蛋白水平。Erns多克隆抗体的制备有助于更好地理解Erns蛋白在CSFV感染和免疫过程中的作用,对深入研究Erns蛋白功能、CSFV生物学特性及猪瘟的防治和诊断方法的开发具有重要意义。
参考文献(References):
陈紫昱,徐璐,夏应菊,宋新宇,刘业兵.2023.猪瘟病毒致弱机制研究进展[J].中国兽药杂志,57(9):87-94.[Chen Z Y,Xu L,Xia Y J,Song X Y,Liu Y B.2023.Research progress on the attenuated mechanism of swine fever virus[J].Chinese Journal of Veterinary Drug,57(9):87-94.]doi:10.11751/ISSN.1002-1280.2023.09.12.
邓俊花,陈冬杰,魏方,吴绍强.2023.猪瘟病毒装甲RNA颗粒质控品的研制及评估[J].养殖与饲料,22(8):1-5.[Deng J H,Chen D J,Wei F,Wu S Q.2023.Development and evaluation of quality control products for swine fever virus armored RNA particles[J].Animals Breeding and Feed,22(8):1-5.]doi:10.3969/j.issn.1671-427X.2023.0 8.001.
耿抒贤,刘果,张娜,刘旻翾,燕苗苗,金丽,曾巧英,刘光亮.2020.NF-κB受体激活因子配体的表达及其多克隆抗体的制备[J].中国兽医科学,50(4):473-478.[Geng S X,Liu G,Zhang N,Liu M X,Yan M M,Jin L,Zeng Q Y,Liu G L.2020.Expression of porcine receptor activator fornuclear factor-κB ligand in Escherichia coli and prepa-ration of its polyclonal antibody[J].Chinese Veterinary Science,50(4):473-478.]doi:10.16656/j.issn.1673-4696.2020.0056.
郭东光,朱艳平,孙国鹏,岳峰,贾文科,王军,李鹏,王自浩,王选年.2014.猪瘟病毒E0蛋白的原核表达及鉴定[J].动物医学进展,35(5):31-35.[Guo D G,Zhu Y P,Sun G P,Yue F,Jia W K,Wang J,Li P,Wang Z H,Wang X N.2014.Prokaryotic expression and identification of E0 pro-tein of classical swine fever virus[J].Progress in Veteri-nary Medicine,35(5):31-35.]doi:10.16437/j.cnki.1007-5038.2014.05.004.
贾俊杰,张必凯,张莉,谢金鑫,郭焕成,龚文杰,涂长春.2016.猪瘟病毒E0蛋白的原核表达及多克隆抗体的制备[J].动物医学进展,37(5):5-10.[Jia J J,Zhang B K,Zhang L,Xie J X,Guo H C,Gong W J,Tu Z C.2016.Pro-karyotic expression of E0 protein of classical swine fever virus and preparation of its polyclonal antibodies[J].Prog-ress in Veterinary Medicine,37(5):5-10.]doi:10.16437/j.cnki.1007-5038.2016.05.002.
康恺.2015.猪瘟病毒复制与细胞自噬关系的研究[D].杨凌:西北农林科技大学.[Kang K.2015.Replication of classical swine fever virus and autophagy[D].Yangling:Northwest Aamp;F University.]
李鹏,张彦明,张志,李晓成,王晶钰,张燕霞.2008.猪瘟流行毒株E0蛋白的原核表达及其间接ELISA方法的建立[J].西北农林科技大学学报(自然科学版),(10):24-28.[Li P,Zhang Y M,Zhang Z,Li X C,Wang J Y,Zhang Y X.2008.Prokaryotic expression of CSFV E0 protein and establishment of an indirect ELISA for detection of anti-body[J].Journal of Northwest Aamp;F University(Natural Science Edition),(10):24-28.]doi:10.13207/j.cnki.jnwafu.2008.10.028.
李玉霄,唐榕泽,高跃美,冯佳佳,李晓泉,梁晶晶,李晓宁,罗廷荣.2020.ISG15蛋白泛素结合酶UBCH6的原核表达及多克隆抗体制备[J].动物医学进展,41(12):28-33.[Li Y X,Tang R Z,Gao Y M,Feng J J,Li X Q,Liang J J,Li X N,Luo T R.2020.Prokaryotic expression of ISG15 protein ubiquitin-binding enzyme UBCH6 and preparation of polyclonal antibodies[J].Progress in Veterinary Medi-cine,41(12):28-33.]doi:10.16437/j.cnki.1007-5038.2020.12.006.
闾志峰.2017.猪瘟流行特点及防控建议[J].畜牧兽医科技信息,(2):81-82.[LüZ F.2017.Epidemic characteristics and prevention and control suggestions of slassical swine fever virus[J].Chinese Journal of Animal Husbandry and Veterinary Medicine,(2):81-82.]doi:10.3969/J.ISSN.1671-6027.2017.02.074.
梅建国.2019.猪瘟病毒新型微载体悬浮培养技术研究[D].长春:吉林大学.[Mei J G.2019.Study on a new type of microcarrier suspension culture of classical swine fever virus[D].Changchun:Jilin University.]doi:10.27162/d.cnki.gjlin.2019.000048.
孙永芳.2017.猪瘟病毒E2蛋白单克隆抗体的制备及其表位鉴定分析[D].北京:中国兽医药品监察所.[Sun Y F.2017.Development of monoclonal antibody against classi-cal swine fever virus and identification of a novel epitope on E2 protein of CSFV[D].Beijing:China Institute of Ve-terinary Drug Control.]
杨领弟,李小梅,芦晓鸥,彭棋,孔令保,王宇.2024.猴痘病毒B20R蛋白原核表达及其多克隆抗体的制备[J].南方农业学报,55(1):217-225.[Yang L D,Li X M,Lu X Q,Peng Q,Kong L B,Wang Y.2024.Prokaryotic expressionand polyclonal antibody preparation of monkeypox virus B20R protein[J].Journal of Southern Agriculture,55(1):217-225.]doi:10.3969/j.issn.2095-1191.2024.01.022.
杨晓颖,李苗,蓝睿,孙显国,曾彩虹,杨润焕,王晓春,杨玉艾.2018.云南省部分地区猪瘟感染状况调查[J].上海畜牧兽医通讯,(5):18-20.[Yang X Y,Li M,Lan R,Sun X G,Zeng C H,Yang R H,Wang X C,Yang Y A.2018.Investigation of swine fever infection in some areas of Yun-nan Province[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,(5):18-20.]doi:10.14170/j.cnki.cn31-1278/s.2018.05.006.
杨忠东,何成.2011.NF-κB受体激活因子配体在大肠杆菌中的表达、纯化及其活性[J].中国生物制品学杂志,24(12):1385-1390.[Yang Z D,He C.2011.Expression ofreceptor activator of NF-κB ligand in E.coli and purifica-tion and activity of expressed product[J].Chinese Journal of Biologicals,24(12):1385-1390.]doi:10.13200/j.cjb.2011.12.10.yangzhd.001.
赵祥秀,黄茂发,高跃美,唐榕泽,胡仁俊,梁晶晶,李晓宁,罗廷荣.2020.猪源IKKγ在原核和真核表达系统中的表达及其多克隆抗体制备[J].南方农业学报,51(12):3099-3108.[Zhao X X,Huang M F,Gao Y M,Tang R Z,Hu R J,Liang J J,Li X N,Luo T R.2020.Expression of porcine IKKγin prokaryotic and eukaryotic expression systems and preparation of polyclonal antibodies[J].Journal of Southern Agriculture,51(12):3099-3108.]doi:10.3969/j.issn.2095-1191.2020.12.028.
张传亮,段辰星,宋丹丹,李晓宁,罗廷荣.2024.基于狂犬病病毒G蛋白Ⅳ区抗原位点的多克隆抗体制备[J].广西畜牧兽医,40(5):188-191.[Zhang C L,Duan C X,Song D D,Li X N,Luo T R.2024.Preparation of polyclonal anti-bodies based on the antigenic sites in the IV region of the rabies virus G protein[J].Guangxi Journal of Animal Hus-bandryamp;Veterinary Medicine,40(5):188-191.]doi:10.3969/j.issn.1002-5235.2024.05.002.
Edwards S,Fukusho A,Lefevre P C,Lipowski A,Pejsak Z,Roehe P,Westergaard J.2000.Classical swine fever:The global situation[J].Veterinary Microbiology,73(2-3):103-119.doi:10.1016/s0378-1135(00)00138-3.
Fatima M,Luo Y Z,Zhang L,Wang PY,Song H,Fu Y H,Li Y F,Sun Y,Li S,Bao Y J,Qiu H J.2021.Genotyping and molecular characterization of classical swine fever virus isolated in China during 2016-2018[J].Viruses,13(4):664.doi:10.3390/v 13040664.
Fernandez-Sainz I,Ramanathan P,O'Donnell V,Diaz-San Segundo F,Velazquez-Salinas L,Sturza D F,Zhu J,delos Santos T,Borca M V.2015.Treatment with interferon-alpha delays disease in swine infected with a highly viru-lent CSFV strain[J].Virology,483:284-290.doi:10.1016/j.virol.2015.04.024.
Hong T Q,Yang Y,Wang P Z,Zhu G Q,Zhu C R.2023.Pesti-viruses infection:Interferon-virus mutual regulation[J].Frontiers in Cellular and Infection Microbiology,13:1146394.doi:10.3389/fcimb.2023.1146394.
Hulst M M,Panoto F E,Hoekman A,van Gennip H G,Moor-mann R J.1998.Inactivation of the RNase activity of gly-coprotein Erns of classical swine fever virus results in a cytopathogenic virus[J].Journal of Virology,72(1):151-157.doi:10.1128/JVI.72.1.151-157.1998.
Lamothe-Reyes Y,Figueroa M,Sánchez O.2023.Host cell fac-tors involved in classical swine fever virus entry[J].Ve-terinary Research,54(1):115.doi:10.1186/s 13567-023-01238-x.
Li S,Wang J H,Yang Q,Naveed Anwar M,Yu S Q,Qiu H J.2017.Complex virus-host interactions involved in the regulation of classical swine fever virus replication:A minireview[J].Viruses,9(7):171.doi:10.3390/v9070171.
Lin M,Trottier E,Pasick J.2005.Antibody responses of pigs to defined Erns fragments after infection with classical swine fever virus[J].Clinical and Diagnostic Laboratory Immu-nology,12(1):180-186.doi:10.1128/CDLI.12.1.180-186.2005.
Liu J J,Wong M L,Chang T J.1998.The recombinant nucleo-capsid protein of classical swine fever virus can act as a transcriptional regulator[J].Virus Research,53(1):75-80.doi:10.1016/s0168-1702(97)00132-9.
Luo YZ,Ji S W,Lei J L,Xiang G T,Liu Y,Gao Y,Meng XY,Zheng G L,Zhang E Y,Wang Y M,Du M L,Li Y F,Li S,He X J,Sun Y,Qiu H J.2017.Efficacy evaluation of the C-strain-based vaccines against the subgenotype 2.1d cla-ssical swine fever virus emerging in China[J].Veterinary Microbiology,201:154-161.doi:10.1016/j.vetmic.2017.01.012.
Mangen M J,Jalvingh A W,Nielen M,Mourits M C,Klinken-berg D,DijkhuizenA A.2001.Spatial and stochastic simu-lation to compare two emergency-vaccination strategies with a marker vaccine in the 1997/1998 Dutch Classical Swine Fever epidemic[J].Preventive veterinary medicine,48(3):177-200.doi:10.1016/s0167-5877(00)00195-1.
Moormann R J,Bouma A,Kramps J A,Terpstra C,De Smit H J.2000.Development of a classical swine fever subunit marker vaccine and companion diagnostic test[J].Veteri-nary Microbiology,73(2-3):209-219.doi:10.1016/s0378-1135(00)00146-2.
Panyasing Y,Gimenez-Lirola L,Thanawongnuwech R,Prakob-suk P,KawilaphanY,KittawornratA,Cheng TY,Zimmer-man J.2023.Performance of a differentiation of infected from vaccinated animals(DIVA)classical swine fever virus(CSFV)serum and oral fluid Erns antibody Alpha-LISA assay[J].Animals(Basel),13(24):3802.doi:10.3390/ani 13243802.
Risatti G R,Holinka L G,Carrillo C,Kutish G F,Lu Z,Tulman E R,Sainz I F,Borca M V.2006.Identification of a novel virulence determinant within the E2 structural glycoprotein of classical swine fever virus[J].Virology,355(1):94-101.doi:10.1016/j.virol.2006.07.005.
Wang M M,Bohorquez J A,Hinojosa Y,Muñoz-González S,Gerber M,Coronado L,Perera C L,Liniger M,Ruggli N,Ganges L.2021.Abrogation of the RNase activity of Erns in a low virulence classical swine fever virus enhances the humoral immune response and reduces virulence,transmis-sibility,and persistence in pigs[J].Virulence,12(1):2037-2049.doi:10.1080/21505594.2021.1959715.
Wei Q,Liu Y C,Zhang G P.2021.Research progress and vhallenges in vaccine development against classical swine fever virus[J].Viruses,13(3):445.doi:10.3390/v 13030445.
Zhang L X,Lin J H,Weng M Y,Wen Y,Zhang Y M,Deng W.2022.RPLP1,an NS4B-interacting protein,enhances pro-duction of CSFV through promoting translation of viral genome[J].Virulence,13(1):370-386.doi:10.1080/2150 5594.2022.2033500.
(责任编辑 兰宗宝)

