基于Illumina MiSeq的海南近岸海湾浮游植物群落组成及其物种多样性分析



摘要:【目的】调查研究海南近岸海湾浮游植物群落组成及其物种多样性,探索导致浮游植物多样性差异的原因,为预测赤潮发生及改善水体质量提供参考依据。【方法】在陵水湾、海尾湾、清澜湾和三亚湾各设4个采样站位采集水环境样本,PCR扩增18S rRNA序列V4可变区,基于Illumina MiSeq高通量测序分析4个近岸海湾浮游植物群落组成及其物种多样性,并通过典型对应分析(CCA)、Mantel检验及Spearman相关分析探索浮游植物群落组成与环境因子的相关性。【结果】测序获得的542个浮游植物OTUs共注释到8门24纲147个属246种,角毛藻属、菱形藻属、近囊胞藻属、Ciliophrys、骨条藻属、海链藻属、斜纹藻属、原多甲藻属等为优势浮游植物属。硅藻门为陵水湾和三亚湾的优势物种,浮游植物群落多样性最高的属均为角毛藻属;清澜湾的优势物种为绿藻门,优势多样性最高的属为菱形藻属;海尾湾的优势物种为褐藻门,优势多样性最高的属为近囊胞藻属。陵水湾浮游植物群落的Shannon指数和Simpson指数与其他3个海湾间存在显著(Plt;0.05)或极显著(Plt;0.01)差异,而海尾湾、清澜湾与三亚湾间的多样性指数均无显著差异(Pgt;0.05)。4个海湾的浮游植物群落组成均受到不同环境因子的影响,其中总氮、总磷、电导率、盐度和水温是影响浮游植物组成的主要环境因子。【结论】海南近岸海湾浮游植物群落中硅藻门物种丰度最高,三亚湾的浮游植物群落多样性最高,陵水湾的浮游植物群落多样性最低且存在赤潮发生的风险。总氮、总磷、电导率、盐度和水温是影响海南近岸海湾浮游植物群落组成的主要环境因子,因此,在海洋资源开发利用过程中要实时监控水质污染及环境因子的变化,确保浮游植物等关键生态组分的健康与多样性,避免浮游植物群落失衡和赤潮等生态灾害发生,以保持海洋生态系统的稳定性。
关键词:浮游植物;群落结构;物种多样性;环境因子;Illumina MiSeq;海南近岸海湾
中图分类号:S917.3文献标志码:A文章编号:2095-1191(2024)09-2798-15
Phytoplankton community composition and species diversity in nearshore bays of Hainan based on Illumina MiSeq
LI Zhi-jie1,FEI Xiao-wen1,TIAN Ye1,ZHANG Xiu-xia2,HE Li-min1,WU Li-xian1,DENG Xiao-dong2*
(1School of Basic Medicine and Life Sciences,Hainan Medical College,Haikou,Hainan 571199,China;2Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Science/Key Laboratory of Biologyand Genetic Resources of Tropical Crops of China/Hainan Institute for Tropical Agricultural Resources/HainanProvincial Key Laboratory for Functional Components Research and Utilization of Marine Bio-resources,Haikou,Hainan 571101,China)
Abstract:【Objective】The study aimed to investigate phytoplankton community composition and species diversity in the nearshore bays of Hainan and to explore the reasons behind differences in phytoplankton diversity,providing refe-rence for predicting red tide occurrences and improving water quality.【Method】Water environment samples were col-lected from 4 sampling stations in each of Lingshui Bay,Haiwei Bay,Qinglan Bay and Sanya Bay.The V4 variable re-gion of the 18S rRNA gene was amplified using PCR,and the phytoplankton community composition and species diver-sity in the 4 nearshore bays were analyzed based on Illumina MiSeq high-throughput sequencing.Canonical correspon-dence analysis(CCA),Mantel test and Spearman correlation analysis were used to explore the correlation between phyto-plankton community composition and environmental factors.【Result】A total of 542 phytoplankton OTUs were obtained through sequencing,annotated to 8 phyla,24 classes,147 genera,and 246 species.The dominant phytoplankton genera included Chaetoceros,Nitzschia,Paraphysomonas,Ciliophrys,Skeletonema,Thalassiosira,Pleurosigma and Proto-peridinium.Bacillariophyta was the dominant phylum in Lingshui Bay and Sanya Bay,with the genus Chaetocerosexhibi-ting the highest diversity in the phytoplankton community.In Qinglan Bay,Chlorophyta was the dominant phylum,with Nitzschia showing the highest diversity;while in Haiwei Bay,Phaeophyta was the dominant,with Paraphysomonas ex-hibiting the highest diversity.The Shannon index and Simpson index of the phytoplankton community in Lingshui Bay showed significant(Plt;0.05)or extremely significant(Plt;0.01)differences compared to the other 3 bays,while no sig-nificant differences(Pgt;0.05)in diversity indexes were observed among Haiwei Bay,Qinglan Bay and Sanya Bay.The phytoplankton community composition in all 4 bays was influenced by various environmental factors,with total nitrogen,total phosphorus,conductivity,salinity and water temperature being the major environmental factors affecting phyto-plankton composition.【Conclusion】In the phytoplankton communities of Hainan nearshore bays,Bacillariophyta has the highest species abundance.Sanya Bay exhibits the highest phytoplankton diversity,while Lingshui Bay shows the lowest diversity and poses a potential risk of red tide occurrence.Total nitrogen,total phosphorus,conductivity,salinity and wa-ter temperature are identified as the major environmental factors affecting the composition of phytoplankton communities in the nearshore bays of Hainan.Therefore,in the process of marine resource development and utilization,it is crucial to monitor water quality pollution and changes in environmental factors in realtime to ensure the health and diversity of key ecological components such as phytoplankton,prevent imbalances in phytoplankton communities and ecological disasters like red tides,thereby maintaining the stability of marine ecosystems.
Key words:phytoplankton;community structure;species diversity;environmental factors;Illumina MiSeq;near-shore bays of Hainan
Foundation items:National Natural Science Foundation of China(82260669);Hainan Key Research and Develop-ment Plan Project(ZDYF2022SHFZ314);Hainan Natural Science Foundation(322RC766)
0引言
【研究意义】海洋浮游植物虽然生长繁殖在海洋上层,但其影响远超过其分布区域,约占地球净初级生产力的50%,对碳、氮、磷和硅等生物相关元素的生物地球化学循环作出了重大贡献(Brun et al.,2015)。浮游植物也是次要生产的基础,能为海洋中更大的生物群体包括鱼类和哺乳动物等提供食物源(Quéréet al.,2016)。在海洋生态系统中,浮游植物作为初级生产者,其群落结构如优势种、物种组成及数量的变化通常与相应的环境因子密切相关(黄圆等,2024)。因此,开展海洋浮游植物群落组成及其物种多样性分析可揭示海洋环境的现状与变化趋势。【前人研究进展】显微镜观察是浮游植物分类鉴别最直接、最常用的方法,形态学鉴定虽然提供了直观的参考数据,但对于细胞尺寸较小,尤其是缺乏独特和严格分类学特征及含量极少的物种难以准确鉴别(Yuetal.,2015)。此外,显微镜观察鉴定结果依赖于鉴定人员的经验,需要长时间的专业训练,且鉴定结果存在主观性,难以全面且准确地反映研究区域的浮游植物多样性。Illumina MiSeq平台是研究自然界微生物群落的代表性工具之一(Choi and Park,2020;张海耿等,2023),具有方便快速、准确率高、信息覆盖量大等优点,已广泛应用于微生物研究领域(廖娟等,2020;段明,2023)。Ma等(2015)通过Illumina MiSeq高通量测序技术揭示了我国9个焦化污水处理厂的微生物群落结构,发现微生物群落组成受污水运行方式、流速和温度的影响,并指出自养氨氧化细菌和亚硝酸氧化细菌的比例较低。Yang等(2015)基于Illumina MiSeq测序技术探究厦门海域赤潮期间细菌多样性,结果发现厦门海域赤潮期间的细菌多样性降低、物种均匀性增加,细菌群落结构已发生明显改变,为研究细菌与赤潮间的关系提供了新视角。Chen等(2019)将Illumina MiSeq高通量测序技术应用于渤海藻华期间的浮游植物群落结构研究,结果发现抑食金球藻(Aureococcus anophagefferens)是渤海浮游植物水华的主要致病物种,且褐潮暴发呈现出较强的年际变化,尤其是秦皇岛近海甲藻优势不断增强。18S rDNA测序已广泛用于研究环境微生物中真核微生物的群落多样性及其组成(Ribeiro et al.,2018;Vuorio et al.,2020),其中V4可变区在聚类分析方面具有明显优势(Stoeck et al.,2010;Mahéet al.,2015)。Li等(2022)基于18S rDNA序列的宏条形码分析南海和菲律宾海浮游生物的地理分布,结果表明,18S rDNA序列V4可变区引物在浮游生物分类方面表现出较高的分辨率;Li等(2024)通过基于18S rDNA序列V4可变区的环境DNA宏条形码分析荣成近岸海域浮游植物的多样性及其群落结构,结果发现甲藻在无养殖设施海湾外围的相对丰度较高,并识别出47种潜在的有害藻种,为海水养殖区的生态监测及有害藻华预测奠定了基础。【本研究切入点】三亚湾、清澜湾、海尾湾和陵水湾是我国海南省旅游开发和鱼虾养殖的重要海域(李斌等,2018;Wu et al.,2022),受此影响导致这4个海湾的水体质量逐年下降、环境压力不断增加(蔡廷禄等,2016;杜慧慧等,2017;崔振昂等,2020),特别是陵水湾曾发生赤潮事件(程玲,2012;梁泰尔等,2018)。富营养化水体和正常水体中的浮游植物优势种及物种多样性存在明显差异(Chalar,2009;Dzhembekova et al.,2018),因此,调查分析三亚湾、清澜湾、海尾湾和陵水湾的浮游植物群落组成对掌握这4个海湾生态环境的健康状况具有重要意义。【拟解决的关键问题】基于Illumina MiSeq高通量测序技术调查研究三亚湾、清澜湾、海尾湾和陵水湾4个近岸海湾的浮游植物群落组成及其物种多样性,同时测定4个近岸海湾的水质数据,探索导致浮游植物多样性差异的原因,为预测赤潮发生及改善水体质量提供参考依据。
1材料与方法
1.1样本采集
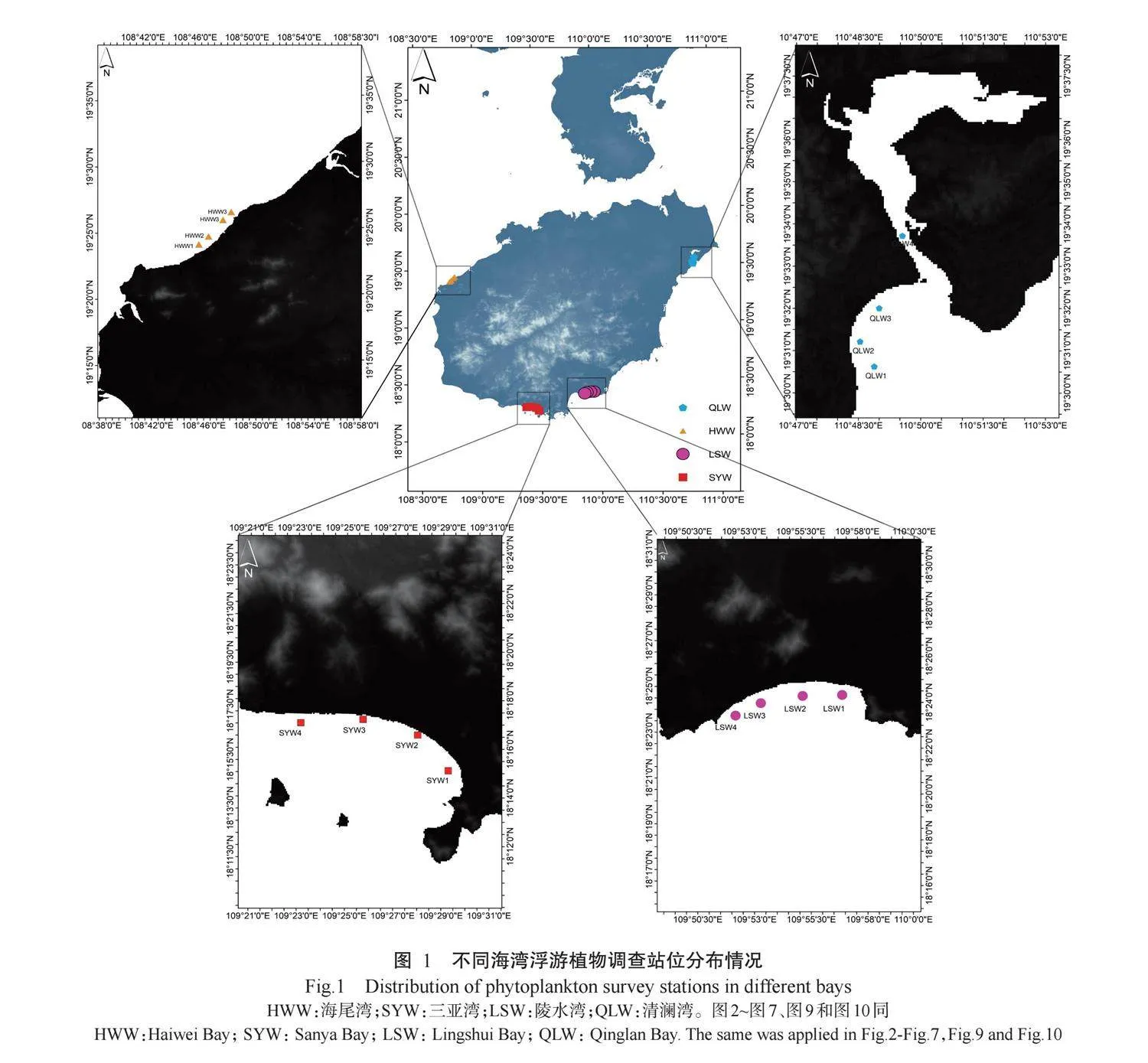
参照GB 12763—2007《海洋调查规范》的要求,在陵水湾、海尾湾、清澜湾和三亚湾各设4个采样站位,共16个站位。各站位的采样分布见图1。样品预处理及保存方法参照GB/T 12763.9—2007《海洋调查规范第9部分:海洋生态调查指南》的相关规定并结合4个海湾的实际情况。水温、盐度、透明度、溶解氧、pH和电导率在采样现场即刻测定;使用浅水III型浮游生物网(网长1.40 m,网口直径0.37 m,打捞绳长2.00 m)采集水环境样本。采集的水样过滤去除较大浮游动物和大型颗粒,取1 L水样置于标本瓶,4℃保存运回实验室;部分水样加入5%甲醛进行固定,混匀后取0.1 mL样品置于显微镜下观察计数,并参考《中国南海赤潮研究》《西太平洋浮游植物物种多样性》进行鉴定;另一部分水样采用孔径0.45μm的Whatman滤膜进行过滤,将滤膜(生物样本)封装于冻存管中液氮保存,过滤收集的水样使用哈希DR3900多参数水质检测仪测定总氮、总磷、氨氮、硝酸盐氮和亚硝酸盐氮含量。
1.2 DNA提取及PCR扩增测序
对48份样本进行总DNA提取,采用真核生物18S rDNA序列V4可变区引物进行PCR扩增。通过Illumina MiSeq测序平台完成双末端测序,测序获得的原始数据(Raw data)经拼接和质控过滤后,得到有效数据(Clean data),然后基于Clean data进行OTU聚类分析及物种分类注释。由于采用真核生物18S rDNA序列V4可变区进行高通量测序能得到大量物种,因此本研究进行结果分析时先去除浮游植物以外的OTUs,仅分析浮游植物的OTUs。
1.3数据分析
测序数据通过诺禾致源分析平台完成Alpha多样性分析、非度量多维尺度(NMDS)分析和相似性分析,采用典型对应分析(CCA)和Mantel检验探析浮游植物群落组成与环境因子间的关系;使用R软件包中的randomForest分析不同海湾浮游植物群落的变化情况,并以R软件包pheatmap绘制可视化热图;利用R软件包中的corrplot在纲和属分类水平下进行浮游植物群落组成与环境因子的Spearman相关分析。
2结果与分析
2.1高通量测序结果
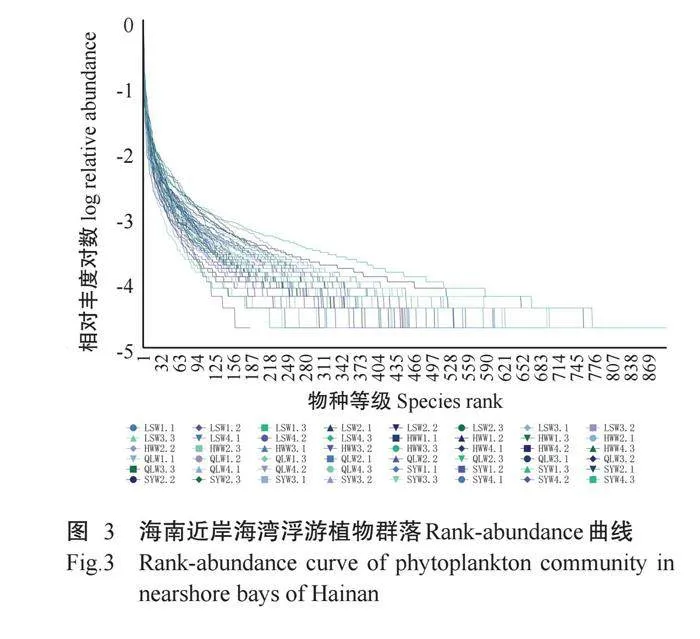
测序获得18S rRNA序列V4可变区的原始序列(Raw reads)4653106条,经过滤分析后获得有效序列(Clean reads)4493955条。除去2%未能拼接的Clean reads,并按照97%的序列相似性进行OTU聚类分析,结果获得3421个符合标准的OTUs;再去除代表原生动物及无法注释到真核生物和真菌的OTUs,最终确定获得542个浮游植物OTUs。由浮游植物群落OTUs稀释曲线(图2)可看出,曲线斜率平滑,变化较小,且趋向于平缓,表明样本测序数量充足,更高的测序深度将不再产生大量新的OTUs。Rank-Abundance曲线(图3)可直观反映样本中的物种丰度和均匀度,测序横轴跨度大,而垂直方向上曲线平缓,说明物种多样性较高且分布均匀。
2.2海南近岸海湾浮游植物群落组成
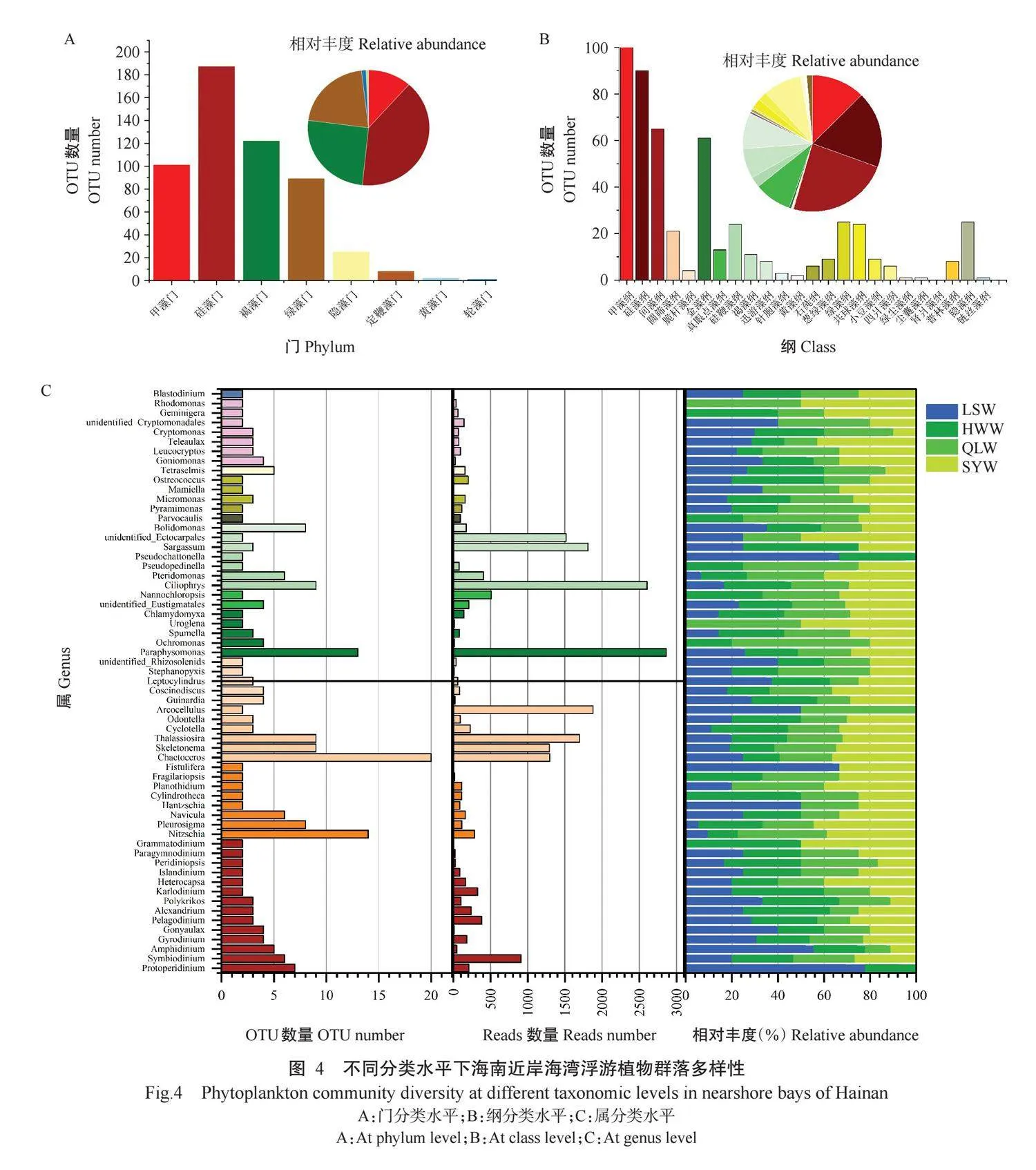
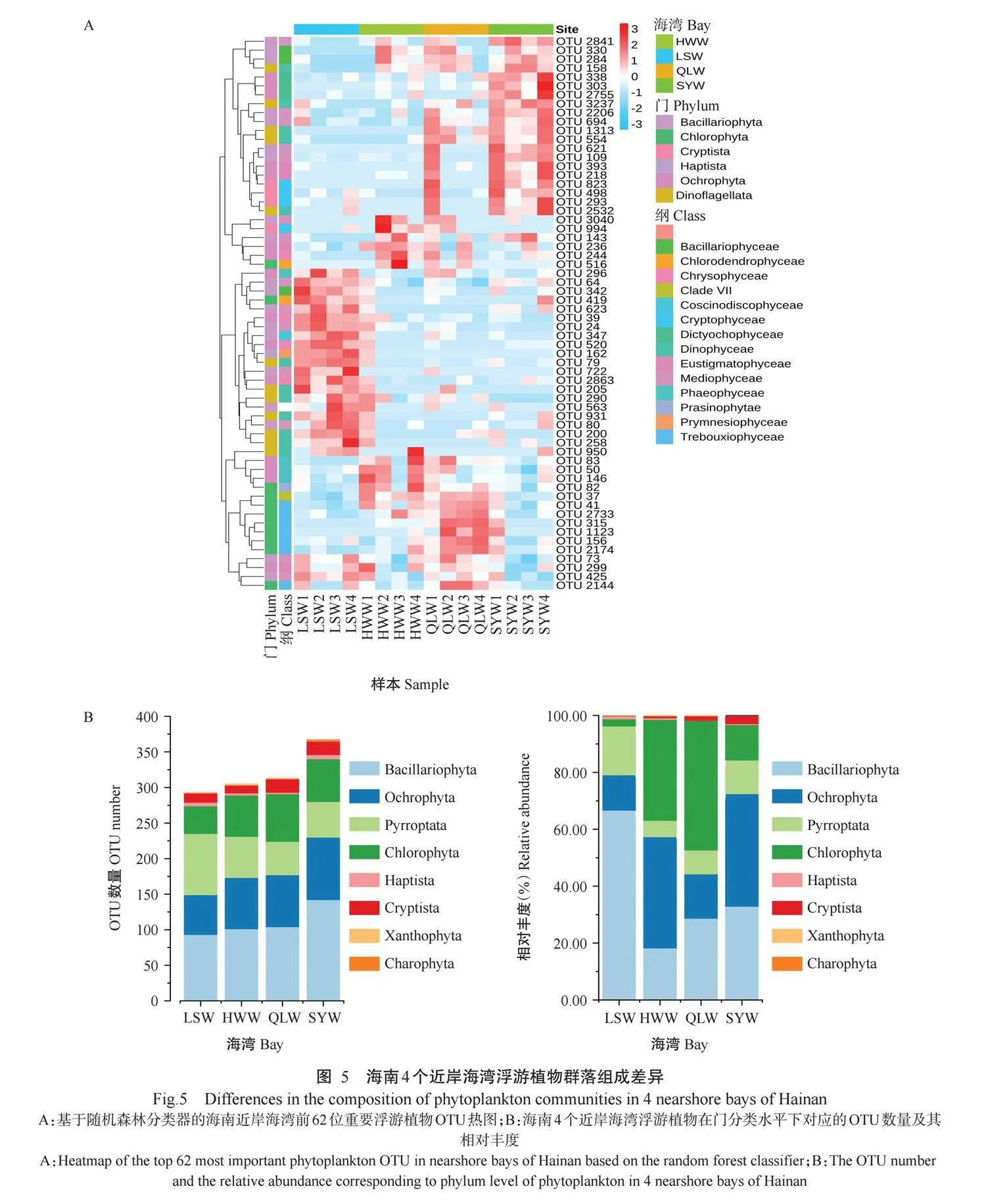
测序获得的542个真核浮游植物OTUs注释到8门24纲147属。由图4-A可看出,硅藻门(Bacil-lariophyta)含187个OTUs,占34.50%;褐藻门(Phaeo-phyta)含120个OTUs,占22.14%;甲藻门(Pyrrophyta)含107个OTUs,占19.74%;绿藻门(Chlorophyta)含90个OTUs,占16.61%;隐藻门(Cryptophyta)含25个OTUs,占4.61%;定鞭藻门(Haptophyta)含8个OTUs,占1.48%;黄藻门(Xanthophyta)含2个OTUs,占0.37%;轮藻门门(Charophyta)含1个OTU,占0.18%。
海南4个近岸海湾浮游植物OTUs共注释到24纲(图4-B),分别是黄藻纲(Xanthophyceae)、针胞藻纲(Raphidophyceae)、普林藻纲(Prymnesiophyceae)、真眼点藻纲(Eustigmatophyceae)、硅鞭藻纲(Dic-tyochophyceae)、褐藻纲(Phaeophyceae)、横裂甲藻纲(Dinophyceae)、隐藻纲(Cryptophyceae)、链丝藻纲(Klebsormidiophyceae)、金藻纲(Chrysophyceae)、迅游藻纲(Bolidophyceae)、石莼纲(Ulvophyceae)、葱绿藻纲(Prasinophyceae)、绿藻纲(Chlorophy-ceae)、共球藻纲(Trebouxiophyceae)、小豆藻纲(Mamiellophyceae)、四爿藻纲(Chlorodendrophyceae)、绿尘藻纲(Chloropicophyceae)、尘囊藻纲(Chloropi-cophyceae)、肾爿藻纲(Nephroselmidophyceae)、间藻纲(Mediophyceae)、硅藻纲(Bacillariophyceae)、圆筛藻纲(Coscinodiscophyceae)和羽纹纲硅藻(Fragi-lariophyceae)。相对丰度排名前10的优势浮游植物纲包括硅藻纲(90个OTUs,占16.61%)、间藻纲(65个OTUs,占11.99%)、金藻纲(61个OTUs,占11.25%)、绿藻纲(25个OTUs,占4.61%)、隐藻纲(25个OTUs,占4.61%)、硅鞭藻纲(24个OTUs,占4.43%)、共球藻纲(24个OTUs,占4.43%)、圆筛藻纲(21个OTUs,占3.87%)、真眼点藻纲(13个OTUs,占2.40%)及褐藻纲(11个OTUs,占2.03%)。
在相对丰度较高的61个浮游植物属中,以角毛藻属(Chaetoceros)的数量最多,其次是菱形藻属(Nitzschia)、近囊胞藻属(Paraphysomonas)、Cilioph-rys、骨条藻属(Skeletonema)、海链藻属(Thalassio-sira)和斜纹藻属(Pleurosigma)(图4-C)。含OTU数量排名前3的属分别是角毛藻属、菱形藻属和近囊胞藻属,分别含有20、14和13个OTUs,说明属内变异程度较高。此外,在属分类水平上盒形藻属(Bid-dulphia)、缝舟藻属(Rhaphoneis)及娄氏藻属(Laude-ria)等71个属仅含1个OTU(图4-C),表明这些属在海南近岸海湾的多样性较低。
2.3海南4个近岸海湾浮游植物群落组成差异
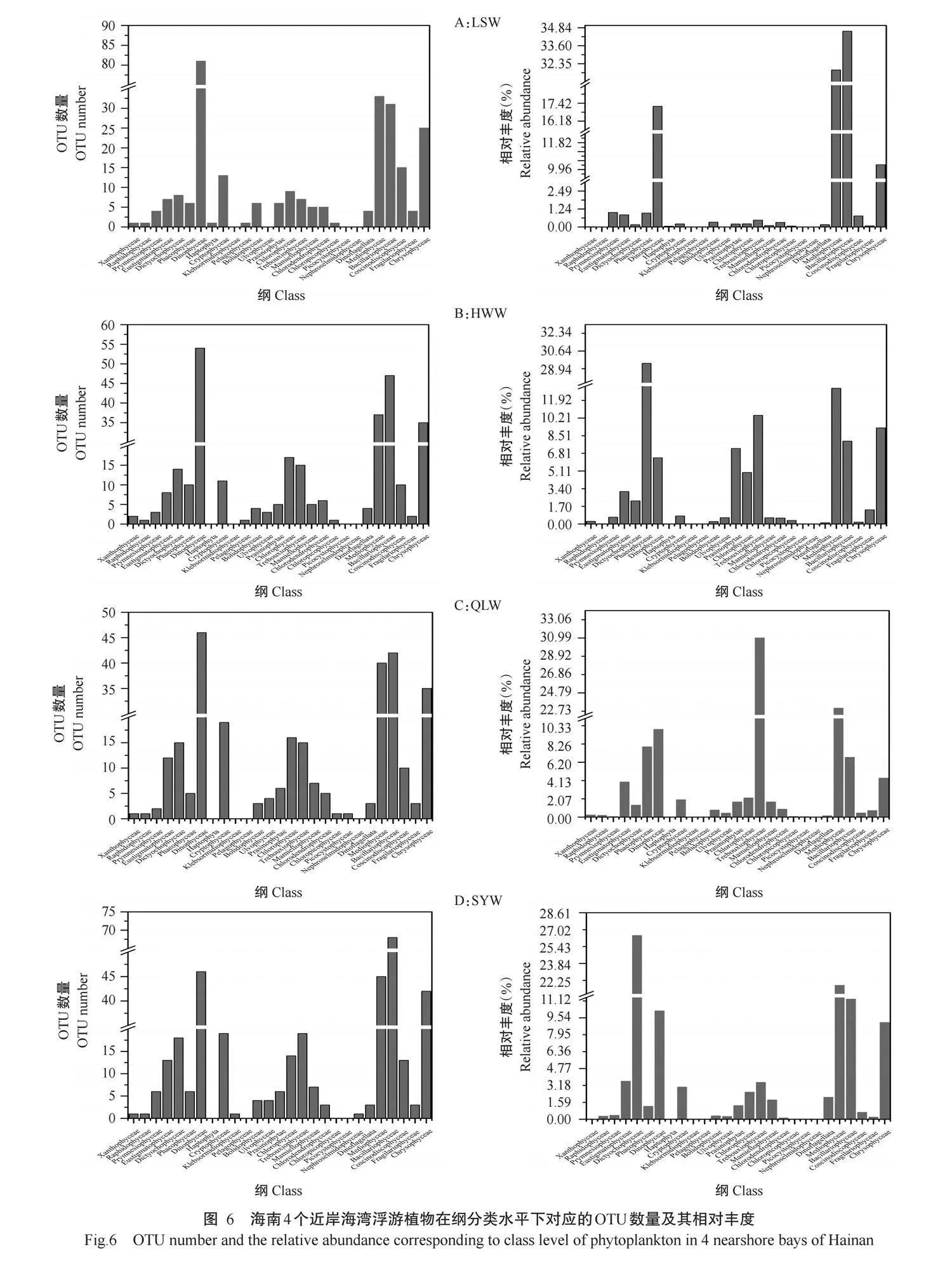
2.3.1陵水湾浮游植物群落组成陵水湾浮游植物OTU数量在4个海湾中最低,共注释到7门23纲。绿藻门含的OTU数量在4个海湾中也最低,但甲藻门含的OTU数量明显高于其他3个海湾(图5-A)。陵水湾浮游植物群落中,硅藻门的相对丰度(66.63%)最高,其次是甲藻门(16.99%)和褐藻门(10.17%),相对丰度最低的是黄藻门(0.02%)(图5-B)。在纲分类水平下,相对丰度较高的有横裂甲藻纲、间藻纲、硅藻纲和金藻纲(图6-A),其中,横裂甲藻纲含有81个OTUs,相对丰度达17.20%,但在其他3个海湾浮游植物群落中横裂甲藻纲的OTU数量和相对丰度均较低。OTU_79(共生藻属Symbiodinium)、OTU_162(棕囊藻属Phaeocystis)、OTU_200(共生藻属Symbiodinium sp.Clade C)、OTU_258(Chytrio-dinium sp.Atlantic)、OTU_39(近囊胞藻属Paraphy-somonas)等是造成陵水湾与其他3个海湾浮游植物群落组成差异的主要浮游植物属,且绝大部分隶属于甲藻门。
2.3.2海尾湾浮游植物群落组成海尾湾浮游植物OTUs共注释到7门23纲,以绿藻门含OTU数量最多(58个OTUs),相对丰度为34.70%,其次是褐藻门(含72个OTUs,相对丰度为38.26%)(图5-B)。在纲分类水平下,相对丰度较高的有褐藻纲、横裂甲藻纲、共球藻纲、间藻纲、硅藻纲、绿藻纲及金藻纲(图6-B),其中,横裂甲藻纲含OTU数量最多,但相对丰度较低;褐藻纲含有10个OTUs,相对丰度为29.46%,其相对丰度远高于其他海湾。OTU_146(匍扇藻属Lobophora)、OTU_516(Tetraselmis)和OTU_3040(小环藻属Cyclotella)等是造成海尾湾与其他3个海湾浮游植物群落组成差异的主要浮游植物属。
2.3.3清澜湾浮游植物群落组成清澜湾聚类获得315个浮游植物OTUs,共注释到7门23纲。绿藻门含有67个OTUs,相对丰度为46.62%;硅藻门含有104个OTUs,相对丰度为26.83%;褐藻门和甲藻门的相对丰度也较高,分别为24.13%和14.6%(图5-B)。在纲分类水平下,相对丰度较高的有横裂甲藻纲、共球藻纲、间藻纲、硅藻纲、隐藻纲、绿藻纲和金藻纲(图6-C)。其中,共球藻纲在清澜湾浮游植物群落中的相对丰度(31.00%)远高于其他3个海湾。OTU_315(未分类共球藻纲unidentified_Trebouxiophyceae)、OTU_1123(未分类共球藻纲unidentified_Treboux-iophyceae)及OTU_2174(Picochlorum)等是造成清澜湾与其他3个海湾浮游植物群落组成差异的主要浮游植物属,且均属于绿藻门,其中Picochlorum属于微微型浮游植物,镜检不易发现。
2.3.4三亚湾游植物群落组成三亚湾是4个海湾中OTU数量最多的海湾(367个OTUs),共注释到8门23纲。轮藻门仅在三亚湾被发现,含有1个OTU,相对丰度为0.01%(图5-B);相对丰度最高的门是褐藻门(39.57%),物种多样性最高的门是硅藻门(含有142个OTUs)。在纲分类水平下,相对丰度较高的有横裂甲藻纲、间藻纲、横裂甲藻纲、隐藻纲、共球藻纲、硅藻纲和金藻纲(图6-D),其中,硅鞭藻纲在三亚湾浮游植物群落中的相对丰度(26.46%)远高于其他3个海湾。OTU_303(Ciliophrys)、OTU_2841(海链藻属Thalassiosira)和OTU_3237(未分类横裂甲藻纲unidentified_Dinophyceae)等是造成三亚湾与其他3个海湾浮游植物群落组成差异的主要浮游植物属。
2.4海南近岸海湾浮游植物群落多样性
以Shannon指数和Simpson指数表征海南4个近岸海湾浮游植物群落多样性,Shannon指数越高表明群落多样性越高,Simpson指数越高则表明群落丰度越低。由图7可看出,陵水湾浮游植物群落的Shannon指数和Simpson指数与其他3个海湾间存在显著(Plt;0.05,下同)或极显著(Plt;0.01,下同)差异,海尾湾、清澜湾与三亚湾间的浮游植物群落Shannon指数和Simpson指数均无显著差异(Pgt;0.05,下同)。陵水湾的浮游植物群落多样性是4个海湾中最低的,仅聚类到274个OTUs;三亚湾的浮游植物群落多样性最高,聚类到367个OTUs;海尾湾的浮游植物群落多样性略低于清澜湾,分别聚类到295和315个OTUs。
2.5海南近岸海湾浮游植物镜检鉴定结果
通过显微镜对海南4个近岸海湾16个站位的浮游植物进行镜检,共鉴定出4门,分别为硅藻门、甲藻门、蓝藻门(Cyanophyta)和绿藻门。其中,硅藻门物种占总物种数的86.56%,其次为甲藻,占7.11%。4个海湾的浮游植物优势种各不相同,海尾湾鉴定出浮游植物优势种14种,三亚湾鉴定出9种,陵水湾鉴定出2种,清澜湾鉴定出6种。具有明显优势的浮游植物有大角管藻(Cerataulina daemon)、菱形海线藻(Thalassionema nitzschioides)、劳氏角毛藻(Chaeto-ceros lorenzianus)、拟旋链角毛藻(Chaetocerospseu-docurvisetus)、翼根管藻纤细变型(Rhizosolenia alataf.Gracillima)及奇异棍形藻(Bacillaria paradoxaGme-lin)等(图8),均隶属于硅藻门。通过比较高通量测序与显微镜鉴定结果发现,海南近岸海湾浮游植物群落均以硅藻为优势门类,高通量测序鉴定到8个门,较显微镜鉴别多出4个门。4个海湾浮游植物密度排名前10的物种分别是硅藻门的膜状缪氏藻(Meuniera membranacea)和角突弧眼藻(Arcocellu-lus cornucervis),褐藻门的羊栖菜(Sargassum fusi-forme)、黑顶藻(Sphacelaria_sp._UTEX_LB_800)和近囊孢藻属(Paraphysomonas),硅藻门的海链藻属,金藻门(Chrysophyta)的Ciliophrys infusionum,绿藻门的密球藻(Pycnococcus provasolii),硅藻门的骨条藻属,以及硅藻门的拟菱形藻(Pseudo-nitzschia),高通量测序得到密度较高的物种大部分属于微微型浮游植物,如膜状缪氏藻、角突弧眼藻及密球藻等,普通光学显微镜几乎无法识别鉴定。
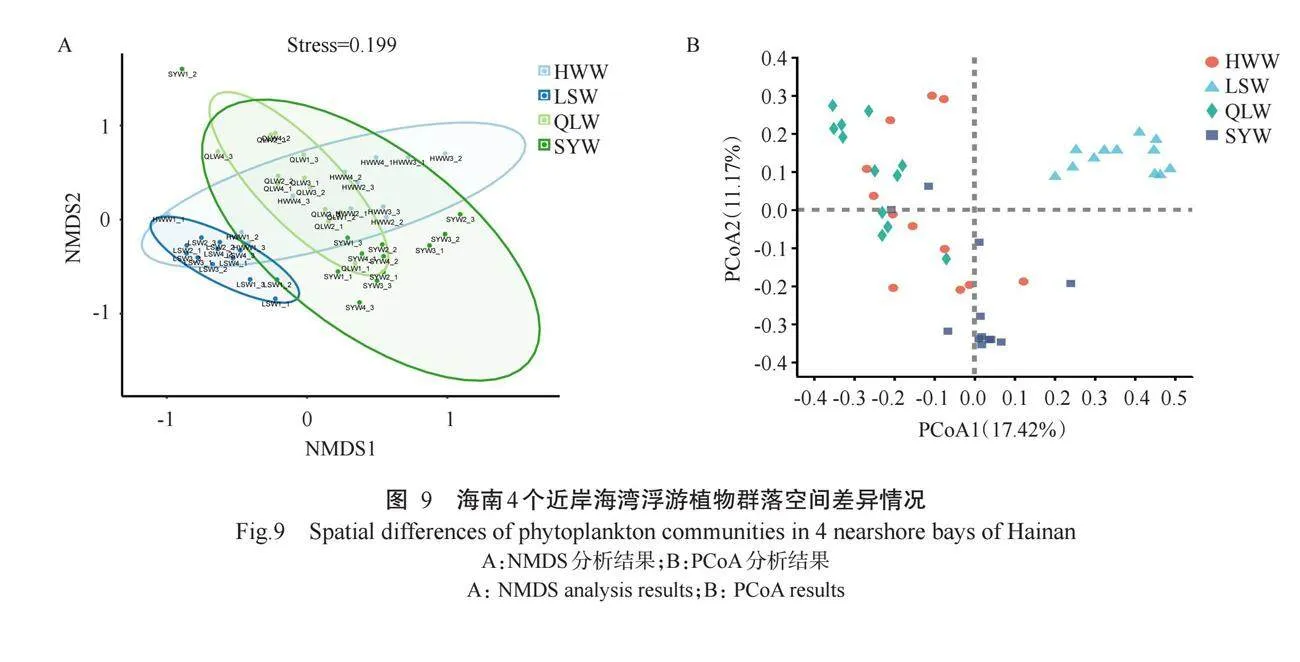
2.6海南4个近岸海湾浮游植物群落空间差异
通过NMDS分析海南4个近岸海湾浮游植物群落空间差异,结果(图9-A)显示,陵水湾样本单独聚类在一起,与其他3个海湾样本存在明显差异,而其他3个海湾样本的相似度较高。主坐标分析(PCoA)结果(图9-B)也显示,陵水湾样本单独聚类在一起,与其他3个海湾样本存在明显差异;海尾湾和清澜湾的物种差异较小,无明显差异。NMDS分析的Stress=0.199,小于0.200,说明分析结果可准确反映不同采样地点间的差异程度。此外,三亚湾样本间的距离较远,组间重复性较低;而陵水湾大部分样本间的距离较近,组间重复性较好。
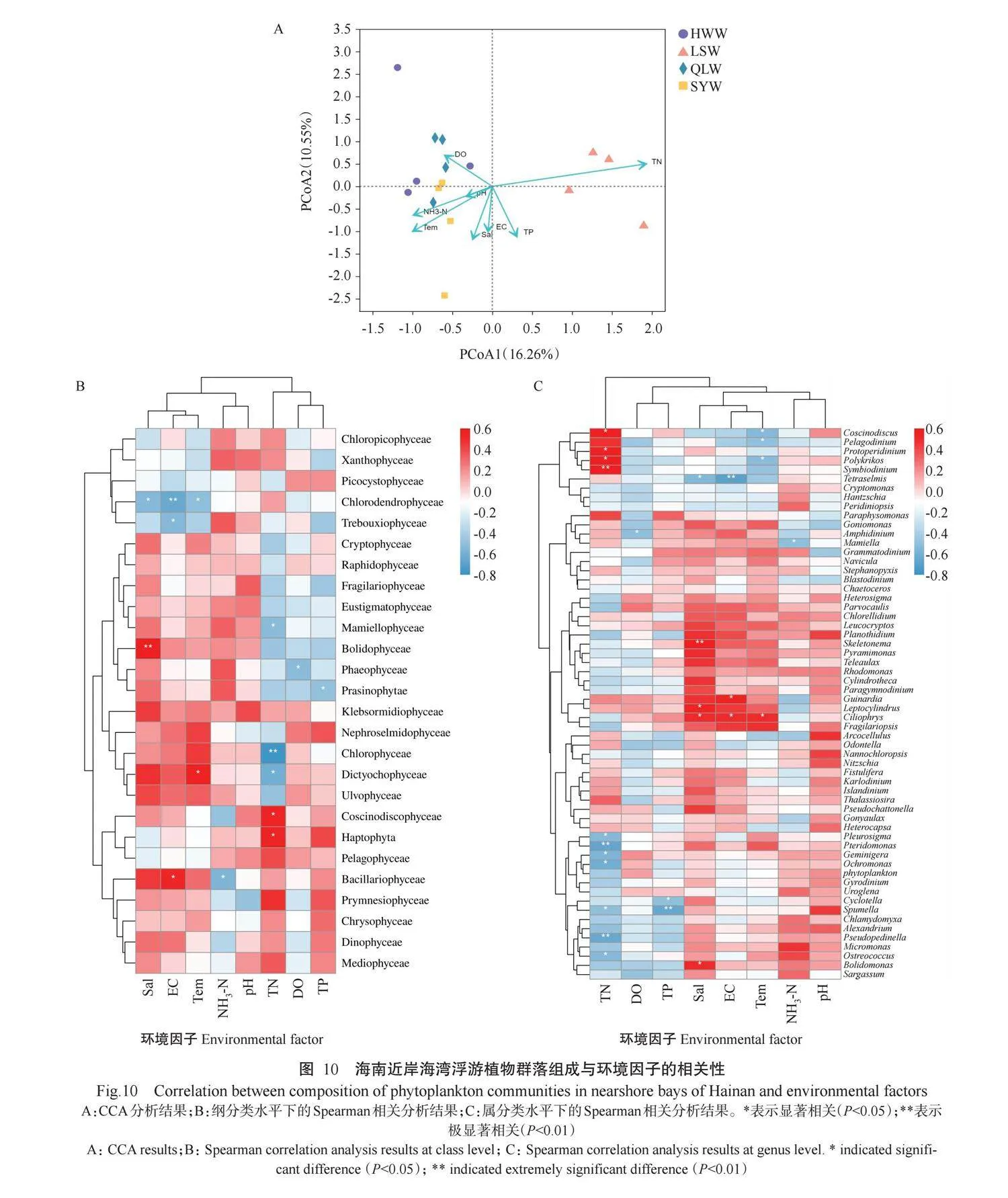
2.7海南近岸海湾浮游植物群落组成与环境因子的相关性
CCA分析结果显示,4个海湾的浮游植物群落组成均受到不同环境因子的影响(图10-A)。根据图中箭头的指向、长度及其与对应坐标轴的投影可看出,总氮(TN)和总磷(TP)影响陵水湾浮游植物群落组成,氨氮(NH3-N)、水温(Tem)、溶解氧(DO)则影响清澜湾、海尾湾和三亚湾浮游植物群落组成。其中,陵水湾浮游植物群落组成与总氮呈正相关,清澜湾、海尾湾浮游植物群落组成与溶解氧、氨氮和水温呈正相关,三亚湾浮游植物群落组成与氨氮、电导率(EC)、盐度(Sal)、溶解氧和水温呈正相关。为进一步了解海南近岸海湾浮游植物群落组成与环境因子的关联,分别在纲和属分类水平下进行浮游植物与环境因子[总磷、总氮、氨氮、pH、电导率、盐度、溶解氧和水温]的Spearman相关分析。在纲分类水平(图10-B)下,影响浮游植物群落组成的主要环境因子有总氮、总磷、氨氮、电导率、盐度、溶解氧和水温;在属分类水平(图10-C)下,影响浮游植物群落组成的主要环境因子包括总氮、电导率、盐度和水温。
3讨论
3.1高通量测序技术揭示海南近岸海湾浮游植物多样性
在海洋浮游植物群落结构及多样性研究领域,高通量测序技术具有很高的潜力,尤其是针对显微镜观察鉴定无法分离或过于微小且脆弱易被破坏的物种(Abad etal.,2016)。本研究采用高通量测序技术,从海南4个近岸海湾48份样本中测序获得3421个OTUs,得到大量显微镜无法检测的物种,增加了对海洋浮游植物多样性的了解。由于浮游植物种类庞大,且数据库中的条形码基因序列无法一一对应,因此很难将环境序列全部注释到属分类水平上(谢薇薇等,2013)。在测序获得的3421个OTUs中只有2101个OTUs可注释到属分类水平(占61.41%)。本研究鉴定得到的浮游植物群落结构与前人的相关研究报道(Gong et al.,2020;Wang et al.,2022)基本一致,均以硅藻门为主且物种丰度较高。其中,角毛藻属(含20个OTUs)、菱形藻属(含14个OTUs)、近囊胞藻属(含13个OTUs)、Ciliophrys(含9个OTUs)、骨条藻属(含9个OTUs)、海链藻属(含9个OTUs)、斜纹藻属(含8个OTUs)、原多甲藻属(Protoperi-dinium,含7个OTUs)等为优势浮游植物属。此外,本次调查研究还发现许多低丰度物种,Chrysone-bula、Poteriospumella、Rhizochromulina、Pyramido-dinium、Ankylochrisis、等鞭金藻(Isochrysis)、楔形藻(Licmophora)和盒形藻属均只含1个OTU。
王晓敏等(2017)对陵水湾浮游植物分布的调查研究发现,陵水湾浮游植物以硅藻门为主,其次为隐藻门和定鞭藻门。本次调查研究也显示陵水湾浮游植物以硅藻门为主,其次是甲藻门和褐藻门,即陵水湾浮游植物群落中甲藻门组成变化较明显。徐翠莲等(2019)在三亚湾采样后进行显微镜观察,发现硅藻门有18种,占浮游植物总丰度的99.7%,占据绝对优势,而甲藻门仅有4种(占浮游植物总丰度的0.3%)。本次调查研究发现,三亚湾浮游植物群落中相对丰度最高的是褐藻门,但物种丰度最高的依然是硅藻门。贺长皓等(2022)在海尾湾浮游植物群落结构调查中发现,浮游植物种类均以硅藻为主,甲藻次之;但本次调查研究发现以绿藻门丰度最高,包含115个OTUs,相对丰度为34.70%,其次是褐藻门(含76个OTUs,相对丰度为38.26%),究其原因可能是高通量测序发现较多的微微型浮游植物,由于细胞过于微小,一般的形态学鉴定极易忽略。于一雷等(2018)研究发现,清澜湾浮游植物群落注释到7门74属(种),分别为蓝藻门、硅藻门、绿藻门、隐藻门、裸藻门(Euglenophyta)、甲藻门和金藻门,优势门类为硅藻门和甲藻门。本次调查研究发现,清澜湾浮游植物群落中以绿藻门(含67个OTUs,相对丰度为46.62%)和硅藻门(含104个OTUs,相对丰度为26.83%)为优势门类。综上所述,海南4个近岸海湾浮游植物群落中的优势门类与前人的相关研究(王晓敏等,2017;于一雷等,2018;徐翠莲等,2019;贺长皓等,2022)存在明显差异,但各门类对应的物种丰度(OTU数量)分布中仍以硅藻门的物种丰度最高,说明通过高通量测序能更全面准确地反映浮游植物群落结构的物种分布情况。
3.2海南4个近岸海湾的浮游植物丰度差异
本次调查研究发现,陵水湾与其他3个海湾浮游植物丰度差异较明显的门类是绿藻门和甲藻门,4个海湾浮游植物群落中的绿藻门OTU数量及相对丰度分别为:陵水湾含有39个OTUs,相对丰度为2.51%;海尾湾含有58个OTUs,相对丰度为34.70%;清澜湾含有67个OTUs,相对丰度为46.62%;三亚湾含有60个OTUs,相对丰度为12.44%。无论是绿藻门的OTU数量还是相对丰度,均表现为陵水湾明显低于其他3个海湾,可能是陵水湾海水的总氮含量较高而影响了物种多样性。在绿藻门浮游植物中,如共球藻纲的Picochlorum虽然是一种耐盐微藻(Henley et al.,2004),但盐度的增加也会促使其分布显著降低。三亚湾的海水盐度较陵水湾高,但三亚湾有2条淡水河流注入,绿藻门浮游植物也随着淡水的进入,而导致三亚湾离河流最近采样点的绿藻门丰度比陵水湾高,但随河流进入的绿藻门浮游植物最终无法适应三亚湾盐度,导致绿藻门浮游植物相对丰度仍较低。此外,海尾湾的海水盐度与陵水湾相近,但海尾湾有2条淡水河流注入,导致海尾湾绿藻门浮游植物的丰度高于陵水湾,说明有淡水持续输入时绿藻门浮游植物分布将会增加(Bode et al.,2017;史海艺等,2022)。在4个海湾浮游植物群落中的甲藻门OTU数量及相对丰度分别表现为:陵水湾含有86个OTUs,相对丰度为16.99%;海尾湾含有58个OTUs,相对丰度为5.61%;三亚湾含有50个OTUs,相对丰度为11.84%;清澜湾含有49个OTUs,相对丰度为8.63%。陵水湾浮游植物群落中的甲藻门OTU数量及相对丰度均明显高于其他3个海湾,结合CCA分析发现,总氮是影响陵水湾浮游植物组成的主要环境因子,且甲藻门下相对丰度最高的Symbiodinium与总氮呈显著正相关,故推测陵水湾的甲藻门物种丰度较高与总氮偏高有关。
曾茹等(2021)对2019年秋季陵水湾浮游植物的鉴定发现,优势藻类包括环纹娄氏藻(L.annu-lata)、中心圆筛藻(Coscinodiscus centralis)、薛氏束毛藻(Trichodesmiumthiebautii)、扭链角毛藻(C.tor-tissimus)、双凹梯形藻(Climacodium biconcavum)、泰晤士扭鞘藻(Streptothece thamesis)和日本星杆藻(Asterionella japonica)。本次调查研究发现,陵水湾浮游植物群落中物种丰度最高的属是角毛藻属(含11个OTUs),其次是近囊孢藻属(含10个OTUs)和原多甲藻属(含7个OTUs);物种密度较高的物种有膜状缪氏藻、角突弧眼藻、Paraphysomonasimper-forata、灰甲原多甲藻(Protoperidinium pellucidum)、Symbiodinium sp.Clade及拟菱形藻,与曾茹等(2021)的研究结果存在明显差异。海尾湾浮游植物群落中物种丰度最高的属是近囊孢藻属(含9个OTUs),其次为角毛藻属(含7个OTUs)、Ciliophrys(含7个OTUs)和海链藻属(含6个OTUs);物种密度较高的物种有羊栖菜、黑顶藻、密球藻、膜状缪氏藻、蒲扇藻(L.variegata)及并基角毛藻(C.decipiens),与贺长皓等(2022)于2019—2020年对海尾湾浮游植物的鉴定结果相似。在三亚湾,物种丰度最高的属是角毛藻属(含16个OTUs),其次是菱形藻属(含12个OTUs)、近囊孢藻属(含11个OTUs)、骨条藻属(含9个OTUs)和海链藻属(含8个OTUs);物种密度较高物种有Ciliophrys infusionum、膜状缪氏藻、并基角毛藻和角突弧眼藻。这与程贤松等(2021)于2019年对三亚湾浮游植物的调查鉴定结果基本一致,即春季以角毛藻属为优势种,秋季以菱形藻属和骨条藻属为优势种。此外,Ciliophrys、近囊胞藻属、角毛藻属和骨条藻属在海南4个近岸海湾中的物种丰度均较高。
3.3海南4个近岸海湾的浮游植物群落多样性差异
陵水湾是4个海湾中物种多样性最低的海湾,Shannon指数和Simpson指数与其他3个海湾间存在显著或极显著差异,而海尾湾、清澜湾与三亚湾间的浮游植物群落Shannon指数和Simpson指数均无显著差异。进一步分析发现,硅藻纲、间藻纲、金藻纲、横裂甲藻纲的相对丰度均以陵水湾的最高,相对丰度之和为16.99%,而其他纲的相对丰度极低(小于2.00%),陵水湾浮游植物OTUs共注释到106个属。海尾湾浮游植物群落中有10个纲的相对丰度大于2.00%,占43.48%,海尾湾浮游植物OTUs共注释到109个属。清澜湾浮游植物群落中有8个纲的相对丰度超过2.00%,占34.78%,清澜湾浮游植物OTUs共注释到141个属。三亚湾浮游植物群落中有11个纲的相对丰度超过2.00%,占47.83%,三亚湾浮游植物OTUs共注释到143个属。此外,本次调查研究仅在陵水湾发现血红哈卡藻(Akashiwo sanguinea)、多纹膝沟藻(Gonyaulax polygramma),二者作为易引起赤潮的有害藻类,应提高警惕,避免赤潮发生。
3.4环境因子对海湾浮游植物群落组成的影响
海南4个近岸海湾浮游植物群落组成均受到不同环境因子的影响。分别在纲和属分类水平下进行浮游植物群落组成与环境因子的Spearman相关分析,结果显示,影响浮游植物组成的主要环境因子包括总氮、总磷、电导率、盐度和水温。其中,圆筛藻属(Coscinodiscus)、共生藻属、多沟藻属(Polykrikos)、原多甲藻属、斜纹藻属、羽膜滴虫属(Pteridomonas)、Geminigera、棕鞭藻属(Ochromonas)、Spumella、伪柄钟藻属(Pseudopedinella)及海洋真核微藻属(Ostreococcus)受到总氮的显著影响。
4结论
海南近岸海湾浮游植物群落中硅藻门物种丰度最高,三亚湾的浮游植物群落多样性最高,陵水湾的浮游植物群落多样性最低且存在赤潮发生的风险。总氮、总磷、电导率、盐度和水温是影响海南近岸海湾浮游植物群落组成的主要环境因子,因此,在海洋资源开发利用过程中要实时监控水质污染及环境因子的变化,确保浮游植物等关键生态组分的健康与多样性,避免浮游植物群落失衡和赤潮等生态灾害发生,以保持海洋生态系统的稳定性。
参考文献(References):
蔡廷禄,倪建宇,贾建军,刘毅飞,夏小明,范亦婷.2016.海南岛典型港湾沉积物化学特征及重金属污染评价[J].第四纪研究,36(1):93-102.[Cai T L,Ni J Y,Jia J J,Liu Y F,Xia X M,Fan Y T.2016.The characteristics of chemical parameters and the pollution evaluation of heavy metals insurficial sediments of four typical bays,Hainan Province[J].Quaternary Sciences,36(1):93-102.]doi:10.11928/j.issn.1001-7410.2016.09.
程玲.2012.海南近岸海域冬春季浮游植物群落结构及赤潮生物种群研究[D].广州:华南师范大学.[Cheng L.2012.Study on structure of phytoplankton and red tide algae in costal warers of Hainan Island in winter and spring[D].Guangzhou:South China Normal University.]
程贤松,李亚军,李兴涵,李江月,黄晓晴,邓晓东.2021.三亚湾春秋浮游植物分布及其与环境因子的关系[J].热带生物学报,12(1):15-24.[Cheng X S,Li Y J,Li X H,Li J Y,Huang X Q,Deng X D.2021.Phytoplankton distribu-tion and its relationship with related environmental factors in Sanya Bay in spring and autumn[J].Journal of Tropical Biology,12(1):15-24.]doi:10.15886/j.cnki.rdswxb.2021.01.003.
崔振昂,吴自军,李亮,张亮.2020.三亚湾海滩泥黑化调查评价[J].地质论评,66(S1):157-158.[Cui Z A,Wu Z J,Li L,Zhang L.2020.Investigation and evaluation on muddy and blacken in Sanya bay beach[J].Geological Review,66(S1):157-158.]doi:10.16509/j.georeview.2020.s1.060.
杜慧慧,王飞,赵琳琳.2017.三亚市海岸带水体污染研究[J].环球人文地理,(20):187-188.[Du H H,Wang F,Zhao L L.2017.Research on coastal water pollution in Sanya City[J].Cultural Geography,(20):187-188.]doi:10.3969/j.issn.2095-0446.2017.20.146.
段明.2023.基于Illumina MiSeq技术分析谷子根际丛枝菌根真菌群落多样性[J].江苏农业科学,51(6):222-229.[Duan M.2023.Study on arbuscular mycorrhizal fungi diversity in rhizosphere of foxtail millet based on Illumina MiSeq technology[J].Jiangsu Agricultural Sciences,51(6):222-229.]doi:10.15889/j.issn.1002-1302.2023.06.031.
贺长皓,李亚军,张秀霞,曾茹,黄晓晴,费小雯,邓晓东.2022.2019—2020年海南海尾湾浮游植物与环境因子的调查分析[J].南方农业学报,53(10):2766-2777.[He C H,Li Y J,Zhang X X,Zeng R,Huang X Q,Fei X W,Deng X D.2022.Investigation and analysis of phytoplank-ton and environmental factors in Haiwei Bay,Hainan from 2019 to 2020[J].Journal of Southern Agriculture,53(10):2766-2777.]doi:10.3969/j.issn.2095-1191.2022.10.007.
黄圆,岑竞仪,梁芊艳,吕颂辉,王建艳.2024.基于高通量测序技术的深圳湾真核浮游植物群落结构研究[J].热带海洋学报,43(2):21-33.[Huang Y,Cen J Y,Liang Q Y,LüS H,Wang J Y.2024.Study on the community structure of eukaryotic phytoplankton in Shenzhen Bay based on high-throughput sequencing technology[J].Journal of TropicalOceanography,43(2):21-33.]doi:10.11978/2023093.
李斌,陈国宝,于杰,王东旭,郭禹,王志超.2018.海南陵水湾口海域不同季节鱼类资源声学探查[J].水产学报,42(4):544-556.[Li B,Chen G B,Yu J,Wang D X,Guo Y,Wang Z C.2018.The acoustic survey of fisheriesresources for various seasons in the mouth of Lingshui Bay of Hainan Island[J].Journal of Fisheries of China,42(4):544-556.]doi:10.11964/jfc.20160910533.
梁泰尔,李洋,陈娴,薛东梁.2018.海南陵水湾水质环境质量分析及评价[J].广东化工,45(13):59-61.[Liang T E,Li Y,Chen X,Xue D L.2018.Analysis of water quality inthe Lingshui Bay[J].Guangdong Chemical Industry,45(13):59-61.]doi:10.3969/j.issn.1007-1865.2018.13.028.
廖娟,王钢,喻世刚,梁梓.2020.利用Illumina MiSeq测序平台分析沐川乌骨黑鸡空肠微生物多样性[J].江苏农业科学,48(24):178-182.[Liao J,Wang G,Yu S G,Liang Z.2020.Analysis of jejunum microbial diversity of Muchuan black bone chicken by Illumina MiSeq sequencing plat-form[J].Jiangsu Agricultural Sciences,48(24):178-182.]doi:10.15889/j.issn.1002-1302.2020.24.035.
史海艺,赵辉,孙东.2022.2021年春季北部湾北部近岸浮游植物叶绿素a分布特征及影响因子[J].广东海洋大学学报,42(5):62-71.[Shi H Y,Zhao H,Sun D.2022.Distri-bution characteristics and influencing factors of phyto-plankton chlorophyll-a in the northern coastal area of Beibu Gulf in spring 2021[J].Journal of Guangdong Ocean University,42(5):62-71.]doi:10.3969/j.issn.1673-9159.2022.05.008.
王晓敏,江涛,吕淑果,吕颂辉,江天久,王朝晖.2017.海南陵水湾与新村湾浮游植物光合色素及群落结构的时空分布特征[J].海洋环境科学,36(4):488-494.[Wang X M,Jiang T,LüS G,LüS H,Jiang T J,Wang Z H.2017.Thetemporal and spatial distribution of phytoplankton pig-ments and community in Lingshui Bay and Xincun Bay,Hainan Province[J].Marine Environmental Science,36(4):488-494.]doi:10.13634/j.cnki.mes.2017.04.002.
谢薇薇,龚伊,王志伟,孔繁翔,史小丽.2013.利用流式细胞仪分选技术研究湖泊真核超微藻的遗传多样性[J].环境科学,34(4):1485-1491.[Xie W W,Gong Y,Wang Z W,Kong F X,Shi X L.2013.Use of flow cytometric sorting to assess the diversity of eukaryotic picophytoplankton of lakes[J].Environmental Science,34(4):1485-1491.]doi:10.13227/j.hjkx.2013.04.027.
徐翠莲,王有军,胡思敏,李涛,黄晖,刘胜.2019.三亚湾近岸两种优势砂壳纤毛虫对硅藻的摄食初探[J].海洋环境科学,38(6):833-839.[Xu C L,Wang Y J,Hu S M,Li T,Huang H,Liu S.2019.Preliminary study on two dominant tintinnids feeding on diatoms in the coastal waters of Sanya bay[J].Marine Environmental Science,38(6):833-839.]doi:10.13634/j.cnki.mes.2019.06.003.
于一雷,郭菊兰,武高洁,吕诗昆.2018.清澜港红树林浮游植物群落结构及水质对应分析[J].水资源保护,34(2):102-110.[Yu Y L,Guo J L,Wu G J,LüS K.2018.Phyto-plankton community structure and water quality correspon-dence analysis of mangrove forests in Qinglan Harbor[J].Water Resources Protection,34(2):102-110.]doi:10.3880/j.issn.1004-6933.2018.02.16.
张海耿,吴小茜,姜世豪,宋红桥,张贺,於叶兵,张亚雷.2023.不同养殖模式对南美白对虾生长性能及肠道菌群的影响[J].渔业现代化,50(3):27-35.[Zhang H G,Wu X Q,Jiang S H,Song H Q,Zhang H,Yu Y B,Zhang Y L.2023.Growth performance and intestinal bacterial commu-nity structure of Litopenaeus vannamei under different cul-tivation systems[J].Fishery Modernization,50(3):27-35.]doi:10.3969/j.issn.1007-9580.2023.03.004.
曾茹,李亚军,何金曼,黄晓晴,邓晓东.2021.陵水湾春秋两季浮游植物群落结构及水质调查[J].热带生物学报,12(2):167-175.[Zeng R,Li Y J,He J M,Huang X Q,Deng X D.2021.Investigation of phytoplankton communitystructure and seawater quality in Lingshui Bay in spring and autumn[J].Journal of Tropical Biology,12(2):167-175.]doi:10.15886/j.cnki.rdswxb.2021.02.005.
Abad D,Albaina A,Aguirre M,Laza-Martínez A,Uriarte I,Iriarte A,Villate F,Estonba A.2016.Is metabarcoding suitable for estuarine plankton monitoring?A comparative study with microscopy[J].Marine Biology,163:149.doi:10.1007/s00227-016-2920-0.
Bode A,Varela M,Prego R,Rozada F,Santos M D.2017.The relative effects of upwelling and river flow on the phyto-plankton diversity patterns in the ria of A Coruña(NW Spain)[J].Marine Biology,164:1-16.doi:10.1007/s00227-017-3126-9.
Brun P,Vogt M,Payne M R,Gruber N,O'brien C J,Buitenhuis E T,Le QuéréC,LeblancK,Luo Y W.2015.Ecological niches of open ocean phytoplankton taxa[J].Limnology and Oceanography,60(3):1020-1038.doi:10.1002/lno.10074.
Chalar G.2009.The use of phytoplankton patterns of diversity for algal bloom management[J].Limnologica,39(3):200-208.doi:10.1016/j.limno.2008.04.001.
Chen Z F,Zhang Q C,Kong F Z,Liu Y,Zhao Y,Zhou Z X,Geng H X,Dai L,Zhou M J,Yu R C.2019.Resolving phy-toplankton taxa based on high-throughput sequencing du-ring brown tides in the Bohai Sea,China[J].Harmful Al-gae,84:127-138.doi:10.1016/j.hal.2019.03.011.
Choi J,Park J S.2020.Comparative analyses of the V4 and V9 regions of 18S rDNA for the extant eukaryotic community using the Illumina platform[J].Scientific Reports,10(1):6519.doi:10.1038/s41598-020-63561-z.
Dzhembekova N,Moncheva S,Ivanova P,Slabakova N,Nagai S.2018.Biodiversity of phytoplankton cyst assemblages in surface sediments of the Black Sea based on metabar-coding[J].Biotechnologyamp;Biotechnological Equipment,32(6):1507-1513.doi:10.1080/13102818.2018.1532816.
Gong F H,Li G H,Wang Y P,Liu Q Y,Huang F J,Yin K D,Gong J.2020.Spatial shifts in size structure,phylogeneticdiversity,community composition and abundance of small eukaryotic plankton in a coastal upwelling area of the northern South China Sea[J].Journal of Plankton Re-search,42(6):650-667.doi:10.1093/plankt/fbaa046.
Henley W J,Hironaka J L,Guillou L,Buchheim M,Buchheim J A,Fawley M W,Fawley K P.2004.Phylogenetic analy-sis of the‘Nannochloris-like’algae and diagnoses of Pico-chlorum oklahomensis gen.et sp.nov.(Trebouxiophyceae,Chlorophyta)[J].Phycologia,43(6):641-652.doi:10.2216/i0031-8884-43-6-641.1
Li J M,Liu F,Yan T,Chen N S,Liu L.2024.Diversity and dis-tribution characteristics of phytoplankton in typical mari-culture bays in northern China[J].Journal of Applied Phy-cology,23:1363-1376.doi:10.1007/s 10811-024-03185-2.
Li Q H,Chai Y M,Shao Q W,Wang Z M,Xie W,Zhou Y D,Sun D,Xie X H,Zhang D S.2022.Metabarcoding survey of meroplankton communities in the South China Sea and Philippine Sea:Shedding light on inter-basin biogeography in the West Pacific[J].Frontiers in Marine Science,9:968666.doi:10.3389/fmars.2022.968666.
Ma Q,Qu Y Y,Shen W L,Zhang Z J,Wang J W,Liu Z Y,Li D X,Li H J,Zhou J T.2015.Bacterial community composi-tions of coking wastewater treatment plants in steel indus-try revealed by illumina high-throughput sequencing[J].Bioresource Technology,179:436-443.doi:10.1016/j.bior-tech.2014.12.041.
MahéF J,Mayor J,Bunge J,Chi J Y,Siemensmeyer T,Stoeck T,Wahl B,Paprotka T,Filker S,Dunthorn M.2015.Com-paring high-throughput platforms for sequencing the V4 region of SSU-rDNA in environmental microbial eukaryo-tic diversity surveys[J].Journal of Eukaryotic Microbio-logy,62(3):338-345.doi:10.1111/jeu.12187.
QuéréC L,Buitenhuis E T,Moriarty R,Alvain S,Aumont O,Bopp L,Chollet S,Enright C,Franklin D J,Geider R J,Harrison S P,Hirst A G,Larsen S,Legendre L,Platt T,Prentice I C,Rivkin R B,Sailley S,Sathyendranath S,Ste-phens N,Vogt M,Vallina S M.2016.Role of zooplankton dynamics for Southern Ocean phytoplankton biomass and global biogeochemical cycles[J].Biogeosciences,13(14):4111-4133.doi:10.5194/bg-13-4111-2016.
Ribeiro C G,dos Santos A L,Marie D,Brandini F P,Vaulot D.2018.Small eukaryotic phytoplankton communities in tropical waters off Brazil are dominated by symbioses between Haptophyta and nitrogen-fixing cyanobacteria[J].The ISME Journal,12(5):1360-1374.doi:10.1038/s41396-018-0050-z.
Stoeck T,Bass D,Nebel M,Christen R,Jones M D M,Breiner H W,Richards T A.2010.Multiple marker parallel tag environmental DNA sequencing reveals a highly complex eukaryotic community in marine anoxic water[J].Molecu-lar Ecology,19(S1):21-31.doi:10.1111/j.1365-294x.2009.04480.x.
Vuorio K,MäkiA,Salmi P,Aalto S L,Tiirola M.2020.Consis-tency of targeted metatranscriptomics and morphological characterization of phytoplankton communities[J].Fron-tiers in Microbiology,11:96.doi:10.3389/fmicb.2020.00096.
Wang Z H,Liu L,Tang Y L,Li A F,Liu C,Xie C L,Xiao L J,Lu S H.2022.Phytoplankton community and HAB species in the South China Sea detected by morphological and metabarcoding approaches[J].Harmful Algae,118:102297.doi:10.1016/j.hal.2022.102297.
Wu K K,Chen K L,Gao Y,Jiang S,Huang H P.2022.Appl-ying a set of potential methods for the integrated assess-ment of the marine eco-environmental carrying capacity in coastal areas[J].Sustainability,14(8):4416.doi:10.3390/su14084416.
Yang C Y,Li Y,Zhou B J M,Zhou YY,Zheng W,Tian Y,van Nostrand J D,Wu L Y,He Z L,Zhou J Z,Zheng T L.2015.Illumina sequencing-based analysis of free-living bacterial community dynamics during an Akashiwo san-guine bloomin Xiamen sea,China[J].Scientific Reports,5:8476.doi:10.1038/srep08476.
Yu L Y,Zhang W J,Liu L M,Yang J.2015.Determining micro-eukaryotic plankton community around Xiamen island,southeast China,using Illumina MiSeq and PCR-DGGE techniques[J].PLoS One,10(5):e0127721.doi:10.1371/journal.pone.0127721.
(责任编辑 兰宗宝)

