肾素-血管紧张素系统可预测腹腔镜肾根治术后的急性肾损伤

关键词:急性肾损伤;根治性肾切除术;肾素-血管紧张素系统
腹腔镜根治性肾切除术(LRN)是治疗肾细胞癌的首选治疗方法,急性肾损伤(AKI)是术后常见的并发症,研究显示LRN术后AKI发生率为57.6%,与手术创伤导致机体产生氧化应激、术中切除患侧肾脏而导致肾单位损失等原因有关,且远期发生慢性肾功能不全和死亡率均高于非AKI患者,预后较差[1, 2]。因此探索发病机制为预防和降低LRN术后AKI的发生具有重要意义。
肾素-血管紧张素系统(RAS)是人体重要的体液调节系统[3, 4]。RAS分为两个通路,一个是由血管紧张素转化酶1(ACE 1)/血管紧张素II(Ang II)/醛固酮组成的常规RAS通路,研究表明醛固酮参与了肾脏损伤,包括肾脏炎症、氧化应激、肾纤维化、系膜细胞增殖和足细胞损伤[5]。另一个是由血管紧张素转化酶2(ACE 2)/血管紧张素1-7(Ang 1-7)组成的非常规RAS通路,该通路激活可以起到舒张血管、抗增殖、抗炎、抗纤维化、减轻肾损伤和抑制AKI发生的作用[4, 6, 7]。目前RAS通路是否参与LRN术后AKI的发生尚未可知,因此,本研究以全麻下接受LRN的患者为研究对象,通过观察患者围术期RAS的变化来探讨AKI的发病机制及其对AKI的预测作用。
1 资料和方法
1.1 研究对象
本研究已获得解放军总医院第三医学中心医学伦理委员会批准(伦理号:KY2023-015;中国临床实验注册中心注册号:ChiCTR2300078503),并已与患者或其监护人签署知情同意书。
纳入2023年12月~2024年3月在解放军总医院第三医学中心泌尿外科因肾细胞癌择期行LRN的患者82例为研究对象。纳入标准:全麻下行LRN的患者;40岁~75岁;性别不限;ASAⅠ~Ⅱ级;术前心、肝、肾功能正常者。排除标准:孤立肾患者;术前应用肾毒性药物;肾脏二次手术病史;术前有抢救病史;合并高血压或使用RAS抑制剂的患者;术中及术后出现重大并发症。
1.2 麻醉方法
患者入室后建立静脉通路,连接监护仪并常规监测血压、心率、脉搏血氧饱和度。采用统一诱导标准咪达唑仑0.03 mg/kg、依托咪酯0.3 mg/kg、丙泊酚1.5 mg/kg、舒芬太尼0.3 ug/kg、顺式阿曲库铵0.2 mg/kg,气管插管后采用容量控制呼吸,调节呼吸机参数:新鲜气体流量2 L/min,潮气量6~8 mL/kg,呼吸频率12~15次/min,吸呼比1∶2,吸入氧浓度60%,维持动脉血二氧化碳分压在35~45 mmHg。麻醉维持采用静-吸复合麻醉,吸入4%~5%地氟醚,静脉泵注丙泊酚4~12 mL·kg-1·h-1、瑞芬太尼5~15 μg·kg-1·h-1,维持脑电双频指数在40~60。诱导后行桡动脉穿刺监测动脉压,右侧颈内静脉穿刺并置入中心静脉导管。术中补液以6~8 mL·kg-1·h-1输注乳酸钠林格液。术中采用去氧肾上腺素、去甲肾上腺素、麻黄碱、乌拉地尔等维持动脉压。术后静脉镇痛采用舒芬太尼2 μg/kg、昂丹司琼0.4 mg/kg,配制100 mL,2 mL/h,Bolus 0.5 mL,间隔时间15 min。
1.3 临床资料收集
收集患者年龄、性别、ASA 分级、体质量指数(BMI)、术前合并疾病(高血压、糖尿病、心血管疾病)、术中情况(出血量、尿量、晶体量、手术时间),以及术前及术后48 h 的血清肌酐(sCr)、应用Cockcroft-Gault 公式估算肾小球滤过率(eGFR)。男性eGFR(mL/min)=(140-年龄)×体质量(kg)/[0.818×sCr(μmol/L)];女性eGFR(mL/min)=eGFR(男)×0.85。
1.4 指标检测
术前、术后24 h留取血液、尿液标本,采取酶联免疫吸附法进行尿醛固酮,血浆ACE 2、Ang 1-7、Nrf-2、IL-10检测。实验试剂盒均购自上海酶联,所有操作按照试剂盒说明进行。
1.5 AKI诊断标准及分期
根据KDIGO 指南诊断标准:术后48 h 内sCr 上升≥26.5 μmol/L或7 d内sCr上升至基线值的1.5倍,或尿量lt;0.5 mL·kg-1·h-1持续6 h及以上即诊断为AKI。
AKI分为I~Ⅲ期。Ⅰ期:48 h内sCr上升≥26.5 μmol/L,和(或)sCr≥基线值的1.5倍,7 d内尿量lt;0.5 mL·kg-1·h-1持续6~12 h;Ⅱ期:sCr≥基线值的2倍,尿量lt;0.5 mL·kg-1·h-1持续≥12 h;Ⅲ期:sCr≥基线值的3 倍或上升至≥353.6μmol/L或开始肾脏替代治疗,尿量lt;0.3 mL·kg-1·h-1持续≥24 h或无尿≥12 h。
1.6 统计学处理
采用Excel 2021 建立数据库,并用SPSS 22.0 和MedCalc 19.5.6 软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数(上下四分位数)表示,根据计量资料是否服从正态分布分别采用两独立样本t检验和两独立样本秩和检验。采用Spearman 相关分析评估尿醛固酮,血浆ACE 2、Ang 1-7、Nrf-2、IL-10与术后AKI发生有无的关系,评估上述指标与eGFR的关系。将单因素分析Plt;0.05的因素作为自变量,以术后是否发生AKI作为因变量,采用Logistic回归分析来确定术后AKI的危险因素,结果以优势比(OR)和95%置信区间(CI)表示。绘制受试者工作特征(ROC)曲线,根据曲线下面积(AUC)分析RAS系统对于术后AKI的预测价值。Plt;0.05为差异具有统计学意义。
2 结果
2.1 两组患者基线资料比较
本研究共纳入82例患者,根据KDIGO指南诊断标准进行分类,其中AKI患者为57例,非AKI患者为25例,AKI 的发病率为69.5%。AKI 组和非AKI 组的性别差异有统计学意义(Plt;0.05),其余均无统计学意义(Pgt;0.05,表1)。
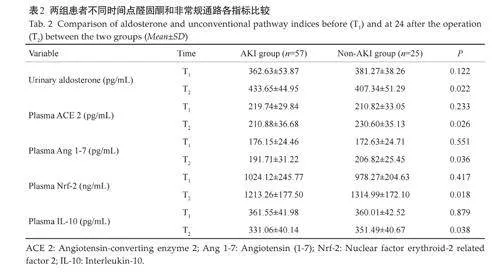
2.2 两组患者不同时间点醛固酮和非常规通路各指标比较
与非AKI组相比,AKI组术前尿醛固酮和非常规通路血浆ACE 2、Ang 1-7、Nrf-2和IL-10差异均无统计学意义(Pgt;0.05),术后24 h 尿醛固酮水平升高(Plt;0.05),非常规通路各指标降低(Plt;0.05,表2)。
2.3 术后24 h醛固酮和非常规通路各指标与eGRF的相关性分析
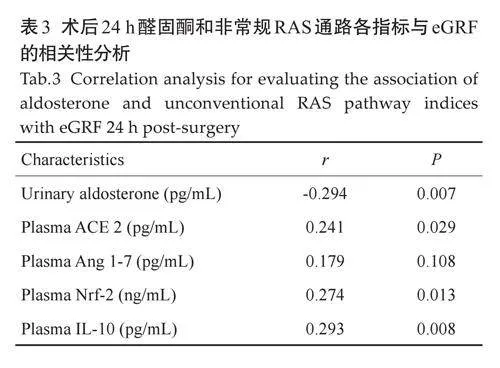
术后24 h 尿醛固酮水平与eGFR 成负相关(r=-0.294,P=0.007),血浆ACE 2、Nrf-2 和IL-10 的水平与eGFR 成正相关(r=0.241,P=0.029;r=0.274,P=0.013;r=0.293,P=0.008,表3)。
2.4 两组患者不同时间点醛固酮和非常规通路各指标与AKI的相关性分析
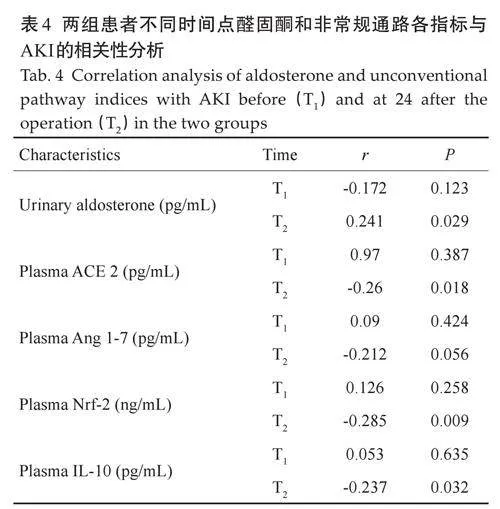
术前尿醛固酮水平与AKI 的发生相关性无统计学意义(Pgt;0.05),术后24 h 尿醛固酮水平与AKI的发生成正相关(r=0.241,P=0.029)。
术前非常规通路血浆ACE 2、Ang 1-7、Nrf-2 和IL-10 水平与AKI 的发生相关性无统计学意义(Pgt;0.05),术后24 h 血浆ACE 2、Nrf-2 和IL-10 的水平与AKI 的发生成负相关(r=-0.26,P=0.018;r=-0.285,P=0.009;r=-0.237,P=0.032,表4)。
2.5 AKI发生的影响因素分析
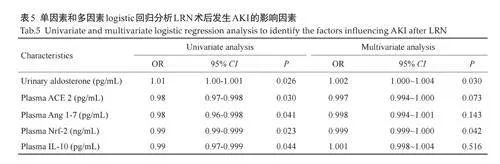
单因素Logistic 回归分析显示术后24 h 尿醛固酮是AKI发生的危险因素(OR=1.01,95% CI 1.00~1.001),术后24 h 非常规通路血浆ACE 2、Ang1-7、Nrf-2 和IL-10 是AKI 发生的保护因素(OR=0.98,95% CI 0.97~0.998;OR=0.98,95% CI 0.96~0.998;OR=0.99,95% CI0.99~0.999;OR=0.99,95% CI 0.97~0.999)。
多因素Logistic 回归分析显示术后24 h 尿醛固酮是AKI 发生的独立危险因素(OR=1.002,95% CI1.000~1.004),术后24 h 血浆Nrf-2(OR=0.999,95% CI0.990~1.000)是AKI发生的独立保护因素(表5)。
2.6 尿醛固酮和非常规通路各指标对AKI的预测价值
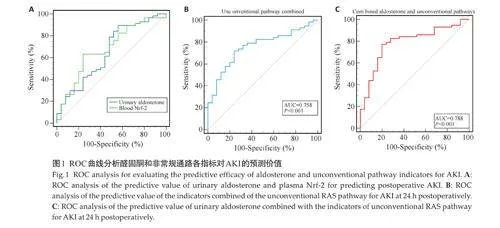
ROC曲线分析结果显示,术后24 h 尿醛固酮、血浆Nrf-2 敏感度分别为89.5%和63.2%,特异度分别为44% 和76%,95% CI 分别为0.538~0.753 和0.566~0.778,AUC分别为0.651和0.679(图1A)。
将非常规通路血浆ACE 2、Ang1-7、Nrf-2 和IL-10水平进行ROC 曲线联合分析,结果显示敏感度为71.93%,特异度为76%,95% CI为0.651~0.846,AUC为0.758(图1B)。将术后24 h尿醛固酮与非常规通路各指标进行ROC曲线联合分析,结果显示敏感度为77.2%,特异度为80%,95% CI 为0.685~0.872,AUC 为0.788(图1C)。
3 讨论
研究表明手术和麻醉因素可激活常规RAS系统,导致醛固酮水平增加,醛固酮通过促进肾脏炎症反应、氧化应激、纤维化、系膜增生和足细胞损伤从而导致AKI的发生。非常规RAS通路具有舒张血管、抗增殖、抗炎和抗纤维化作用,可减轻肾损伤和抑制AKI 发生[4, 8, 9]。本研究发现AKI患者术后24 h 尿醛固酮的水平显著高于非AKI 的患者,是AKI 发生的独立危险因素;非常规通路血浆中各指标水平显著降低,Nrf-2 是AKI发生的独立保护因素。将醛固酮联合非常规RAS通路各指标可用于预测AKI的发生。本研究发现LRN术后AKI的发生率为69.5%,与既往研究结果相似[10, 11]。
研究发现外源性给予醛固酮后,促炎因子骨桥蛋白、单核细胞趋化蛋白-1、IL-1β和IL-6显著增加,并且醛固酮可以通过激活盐皮质激素受体来影响肾纤维化[5, 12-14]。在新冠肺炎急性呼吸窘迫综合征的患者中,51%患者发生AKI,与非AKI 患者相比醛固酮显著升高[15]。因此常规RAS通路的激活与AKI密切相关。在缺血再灌注损伤的小鼠中发现,醛固酮水平显著升高,在使用醛固酮拮抗剂螺内酯治疗后小鼠的肾损伤和细胞凋亡显著减轻,产生肾保护作用[16]。研究表明血浆醛固酮水平升高与肾小球和肾小管损伤特异性标志物相关,并表明醛固酮水平与eGFR下降相关[17]。本研究选择醛固酮作为RAS系统常规通路的标志物进行检测,结果发现,AKI 患者术后24 h 醛固酮水平显著高于非AKI 患者,且与AKI 的发生成正相关,与eGFR成负相关,虽然多因素logistic 回归分析P值为0.03,但OR值仅为1.002,AUC为0.651,因此尿醛固酮作为AKI的独立危险因素的独立预测能力较低。
近年来对非常规RAS 通路的研究发现,ACE 2/Ang 1-7轴的激活可对抗肾损伤。ACE 2是非常规RAS轴的重要调节分子,在肾小管上皮细胞,肾小球上皮细胞和肾血管中高度表达,具有拮抗Ang II 肾损伤的作用[3, 18, 19]。ACE 2缺乏可导致糖尿病小鼠肾脏炎症和纤维化,加速肾损伤[20]。在缺血/再灌注损伤的AKI 小鼠中观察到,与野生型小鼠相比,ACE 2基因敲除的小鼠细胞炎症、促炎细胞因子的表达、细胞凋亡和氧化应激显著增加[6]。在Alport综合征的模型小鼠中发现ACE 2活性的降低可导致Ang II水平升高,Ang 1-7水平降低,促进模型小鼠的进行性肾损伤,给予外源性重组ACE 2治疗后可减轻Ang II升高,缓解肾脏纤维化、炎症、氧化应激的发展,减轻了肾损伤[21, 22]。本研究发现,AKI患者术后24 h 血浆ACE 2 水平显著低于非AKI 患者,并与AKI 的发生成负相关,单因素logistic 回归分析显示术后24 h ACE 2水平是AKI发生的保护因素,与既往研究结果一致参考。
Ang 1-7是非常规通路的重要组成因子,可反向调节常规RAS系统,起到舒张血管、抗增殖、抗炎、抗纤维化、减轻肾损伤的作用[3]。慢性缺氧可以导致肾脏抗纤维化因子减少,纤维化因子(TGF-b、CTGE、Ang II)表达增加,长期用Ang 1-7 治疗后CTFE 和TGF-b 的产生减少,从而改善纤维化,产生肾保护的作用[23]。在横纹肌溶解引起的大鼠肾损伤中发现,大鼠肾脏组织中Ang 1-7水平显著下降,Ang II水平显著升高,给予外源性Ang 1-7 治疗后,氧化应激和炎症标记物(丙二醛(MDA)、肿瘤坏死因子-α(TNF-α)、肿瘤坏死因子-4(TLR-4)、核因子-κB (NF-κB))均显著减低,抗氧化应激和抗炎水平[抗氧化剂(TAC)、Nrf-2、血红素加氧酶1(HO-1)、IL-10]显著升高[7]。脓毒症导致AKI的小鼠应用Ang 1-7后,可以减低Ang II水平,减轻炎症反应、氧化应激和脓毒症相关的AKI[24]。本研究发现术后24 h非AKI患者血浆内Ang 1-7水平显著高于AKI患者,与既往研究结果一致。
Nrf-2在调节细胞氧化应激和氧化还原动态平衡中起决定性作用,Nrf-2 的激活可以降低过量活性氧(ROS)水平,并通过增加细胞的抗氧化能力抑制促氧化化合物蛋白质编码基因的表达,从而减轻肾损伤的发生[25, 26]。既往研究表明敲除Nrf2后,加重了小鼠的肾损伤、氧化应激和细胞凋亡,并增加了小鼠对缺血再灌注损伤和肾毒性AKI 的易感性[27, 28]。在缺血再灌注损伤相关AKI中,白藜芦醇可上调Nrf-2,通过抑制Toll样受体4(TLR4)/NF-κB途径的激活减轻氧化应激、细胞凋亡和炎症[29]。外源性给予Ang1-7 可能会上调Nrf-2/HO-1 途径[7]。本研究选择检测Nrf-2 作为抗氧化的标记物,发现非AKI 患者Nrf-2 水平显著高于AKI 患者,且与AKI的发生成负相关,与上述研究结果一致,虽然多因素Logistic 回归分析P 值为0.04,但OR 值仅为0.999,AUC为0.679,故Nrf-2 单独作为AKI 的独立保护因素的独立预测能力也较低。
IL-10 可通过抑制促炎因子(IL-1、TNF-α、IL-6、IL-18)和肾小管上皮细胞中促凋亡因子的表达从而抑制急性和慢性肾损伤的进展[30, 31]。IL-10还能显著抑制转化生长因子-β诱导的纤维化相关miRNA(miRNA-21、-145 和-208)的表达,降低肾脏纤维化程度[32]。提高细胞外IL-10的稳定性,可显著减轻了缺血再灌注损伤导致的炎症反应,减弱了向慢性肾脏疾病的转化[31]。本研究发现AKI患者IL-10的水平显著低于非AKI患者,与AKI的发生成负相关,单因素logistics回归分析显示术后24 h IL-10 是AKI 发生的保护因素。非常规通路中血浆ACE 2、Nrf-2和IL-10的水平与GFR呈正相关,可能与该通路激活可以起到舒张血管、抗增殖、抗炎、抗纤维化、减轻肾损伤的作用相关,具体机制需进一步研究。
鉴于醛固酮与Nrf-2预测能力均较低,表明作为单一指标的诊断效能不高,因此我们将各指标进行ROC曲线联合分析,发现醛固酮联和非常规通路各指标联合分析的AUC值为0.788,非常规通路各个指标联合分析AUC值为0.758,诊断效能均显著增强,表明联合指标预测可用于预测LRN术后AKI 的发生。
术前使用RAS抑制剂治疗可显著降低AKI的发生率,AKI的风险可降低0.92倍,术前使用RAS抑制剂大于2 周的患者与AKI 的发生率降低有更高的相关性[16, 33],因此本研究将术前服用RAS抑制剂患者排除,以减少混杂因素干扰。
本研究存在一定的局限性,主要包括以下几个方面:本研究为单中心、小样本研究,可能结果存在偏倚;未评估长期肾功能的变化。因此后续研究需进行多中心,扩大样本量进一步研究,进行远期肾功能的评估。
综上所述,LRN术后AKI患者RAS常规通路活性增强,非常规通路活性减弱,可能通过影响eGFR参与了AKI的发生;醛固酮联合非常规通路各指标可用于预测LRN术后AKI 的发生。

