人鼻粘膜类器官冠状病毒感染模型可用于抗病毒药物的筛选和评价


关键词:类器官;鼻粘膜;病毒感染;疾病模型
虽然新型冠状病毒大流行已经结束,全球仍有新型变异毒株不断出现,成为威胁人类健康的全球性公共健康问题。鼻腔作为病毒进入人体的首要靶器官,其病毒感染方式、复制变异规律和致病机制尚不清楚[1, 2]。然而,传统体外模型如2D培养的永生化鼻粘膜上皮细胞系缺乏组织结构和生理功能[3, 4],动物模型也存在与人的种属差异大,成本高,通量低等限制[5-9]。
类器官是一种利用干细胞体外培养而成具有三维结构的微器官[10-12],具有与体内高度相似的分子特征与组织结构,并能部分模拟来源组织器官的生理功能。基于以上优势,类器官近年被广泛用于发育生物学研究、疾病建模、再生医学与气管移植研究、药物发现、疗效评估以及毒理学等的研究[13-15]。
目前已有许多研究使用呼吸道类器官分析冠状病毒感染及其相关机制[16-19]。但将鼻粘膜类器官用于冠状病毒感染相关研究尚未见报道。鼻粘膜类器官含有纤毛细胞、分泌细胞和基底细胞等多种细胞成分[20, 21],具备典型的假复层柱状纤毛上皮的组织学特征。其具有分泌功能的腺腔结构,节律摆动的纤毛和粘液毯共同组成的粘液纤毛传输系统,可完整重现鼻粘膜的组织形态与功能。
本研究基于鼻粘膜类器官,采用包括新冠病毒在内的两种冠状病毒对鼻粘膜类器官进行感染,以期更真实地模拟病毒在鼻腔内的感染过程;并建立了抗病毒药物体外筛选与评价的技术体系,通过分子对接与三维结构模拟,对药物抗病毒机制进行预测与研究。研究结果表明,鼻粘膜类器官可以作为抗病毒药物开发的有力模型,用以推进冠状病毒感染人上呼吸道的相关基础研究与药物研发。
1 材料和方法
1.1 样本来源
本课题的样本来源为南方医科大学南方医院生物样本库冻存的鼻粘膜类器官。根据南方医院生物样本库出入库管理规定,填写样本提取申请表,提取冻存不超过1 年的鼻粘膜类器官样本共14 例,复苏成功率为85.7%(表1)。
Transwell 板、Matrigel(Corning);IV型胶原酶、III型胶原酶(Worthington);DNA酶、透明质酸酶、分散酶、抗β-tubulin(sigma);抗-MUC5AC、抗-ZO-1、抗-AQP5、抗-SFTPC、抗-CK5、抗-Sodium Potassium ATPase 抗体、山羊抗兔二抗(Abcam)。 类器官培养基主要细胞因子:R-Sponding1、 Noggin、Human EGF、不含Vit A的 B27、Y-27632、A83-01、SB202190 (Peprotech)、Nacetylcysteine、Nicotinamide(sigma)等;使用真空滤膜过滤除菌,4 ℃保存。佛手柑素(Bergamottin),卡莫司他(Camostat,MCE);海肾荧光素酶报告基因检测试剂盒(碧云天)。
相关引物均购自苏州金唯智生物科技有限公司。qRT-PCR对差异表达miRNA的引物序列:
SARS-CoV-2 RBD (primers 5'-CAATGGTTTAACAGGCACAGG-3' 和5'-CTCAAGTGTCTGTGGATCACG-3')。HCoV-OC43(primers 5'-ATGTTAGGCCGATAATTGAGGACTAT-3' 和5'-AATGTAAAGATGGCCGCGTATT-3')。Human GAPDH (primers 5'- TCCTTGGAGGCCATGTGGGCCAT-3' 和5'-TGATGACATCAAGAAGGTGGTGAAG-3')
病毒:SARS-CoV-2假病毒(SARS-CoV-2 pv)是以VSV 为骨架外包SARS-CoV-2,WT株S蛋白的假病毒;人冠状病毒OC43(HCoV-OC43 pv 病毒);由武汉病毒所王薇教授团队提供。
病毒:SARS-CoV-2 WT(2019-nCoV-WIV04)、SARS-CoV-2(B. 1.1.7,IVCAS6.7552)、SARS-CoV-2(B.1.351,NPRC2.062100001)均由武汉病毒所国家病毒资源库保藏中心提供,活病毒相关操作均在武汉病毒研究所生物安全三级实验室进行。
细胞培养箱(Thermo Fisher Scientific),-80 ℃超低温冰箱、生物安全柜(Biobase),全自动细胞计数仪(Bodboge),普通光学显微镜(Olympus),低速离心机(Eppendorf),荧光定量PCR仪(Thermo),多功能酶标仪、高通量活细胞成像系统(BioTek),100 μm细胞过滤器(JET BIOFIL)。
1.2 人鼻粘膜类器官模型的建立培养和鉴定
用于培养人鼻粘膜类器官的组织均取自南方医科大学南方医院,相关研究均通过南方医科大学南方医院伦理委员会伦理审批(伦理批号:NFSC-2020-157)。
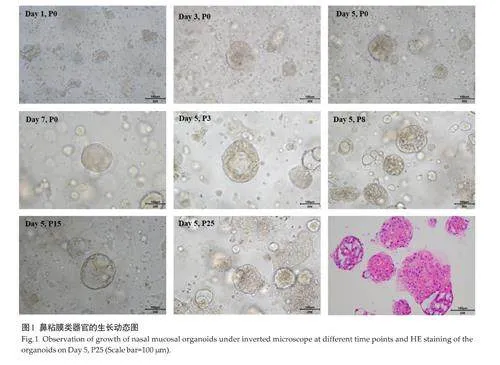
无菌条件下将人鼻粘膜组织放入含1%青霉素和链霉素的4 ℃预冷HBSS溶液中清洗数次并置于冰盒上剪切至1 mm3的组织块,在37 ℃下在已修改配制的消化酶中消化2 h。消化后,用100 μm细胞过滤器过滤上清液,并以200 g离心5 min。将细胞重新悬浮在培养基中,并与Matrigel以1∶1.5(v/v)的比例混合,随后滴入Transwell板中,加入扩增培养基并每2~3 d更换新鲜培养基。我们使用酶消化法和机械分离法相结合,每培养7 d对鼻粘膜类器官进行传代处理,传代过程中,鼻粘膜类器官或被消化为2~3个细胞团,或被吹散解离为多个片段,最终形成多个完整的类器官结构,并于此后体积逐渐增大。
1.3 鼻粘膜类器官病毒感染模型的建立
将鼻粘膜类器官按2.0×104/孔的细胞密度接种至96孔板,100 μL/孔,放入37 ℃培养箱培养3 d,待细胞活性良好时进行实验。将待感染的病毒液加入96 孔板,放入37 ℃细胞培养箱中感染2 h。2 h后吸出病毒液,替换成100 μL类器官培养基,放置37℃细胞培养箱继续培养24 h。使用荧光显微镜观察病毒感染情况;海肾荧光素酶法检测假病毒的感染情况;收集Matrigel外培养液进行细胞内病毒RNA的检测。
1.3.1 鼻粘膜类器官对SARS-CoV-2 毒株易感性的研究 分别将3D培养的鼻粘膜类器官按照细胞密度约2.0×104/孔铺入96孔板,100 μL/孔,放入37 ℃培养箱培养3 d,待细胞活性良好时进行实验。制备SARS-CoV-2假病毒和HCoV-OC43假病毒,将病毒液分别加入96孔板中,每孔感染体积为30 μL,放入37 ℃细胞培养箱中感染2 h,2 h后吸出病毒液,替换成100 μL类器官培养基,放置37 ℃细胞培养箱继续培养24 h;收集Matrigel外培养液,采用荧光定量PCR检测进行培养液中病毒RNA检测含量变化。
分别设置高感染复数组(MOI=10)与低感染复数组(MOI=1)的感染条件,将病毒液加入鼻粘膜类器官中,放入37 ℃细胞培养箱中分别感染2 h、24 h。感染后吸出病毒液,替换成100 μL类器官培养基,放置37 ℃细胞培养箱继续培养24 h;收集Matrigel 外培养液,进行培养液中病毒RNA检测。
1.3.2 免疫荧光法病毒感染鉴定鉴定实验 病毒感染24 h 后,弃去培养基及基质胶, 离心收集类器官沉淀,4%甲醛固定,将样本进行脱水梯度脱水,之后进行透明和浸蜡。包埋切片,将鼻粘膜类器官石蜡切片脱蜡、水化后,转移至PBS溶液中清洗3次/5 min,滴加3%过氧化氢,洗去残留于切片的抗原修复液;滴加血清封闭液,室温静置20 min,滴加病毒核衣壳蛋白(NP)一抗4 ℃过夜(稀释比例1∶200)。次日,放入37 ℃烘箱复温45 min;移入PBS洗去一抗,滴加二抗37 ℃(稀释比例1∶500),1 h,PBS洗去二抗,DAPI染核,移入PBS洗去残留于切片上的DAPI,防淬灭胶封片。通过高内涵细胞定量成像分析系统分析。
1.4 鼻粘膜类器官用于药物的抗病毒功效作用的验证
选择活性良好的鼻粘膜类器官,用Tryple在低温环境下进行类器官消化。待类器官消化至20~30 μm的细胞团时终止消化,离心收集细胞,将Matrigel与培养基按1∶1.5的体积比例混合,然后加入细胞悬液。细胞密度应保持在1.0×105/mL。在96 孔板中每孔接种一个20 μL的胶滴,转移到37 ℃的培养箱中,倒置30 min,以提高类器官的立体性。每孔加入100 μL类器官培养基,置于37 ℃下进行培养。根据细胞生长情况,在传代后的2~3 周后,可以将样品带入P3 实验室。使用类器官培养基稀释药物,在感染前1h 将维持培养基换为含药物培养基。使用SARS-CoV-2 WT感染鼻粘膜类器官,在胶滴外加入病毒原液,感染2 h 后换为含药物的培养基,在37 ℃培养至感染后4 h 收样。弃去胶滴外的培养基,使用500 μL 的Trizol 裂解胶滴。通过qPCR实验检测病毒载量,以评估药物对病毒感染的抑制效果。
1.5 分子对接
本实验采用人源ACE2 蛋白三维结构(PDB ID:1o86)作为生物大分子结构,并使用ChemDraw软件绘制佛手柑素、卡莫司他与赖诺普利的三维分子结构,使用iGEMDOCK软件[22]对潜在的小分子抑制剂与ACE2蛋白进行分子对接实验,分析其潜在结合位点并计算结合能,并通过PyMol软件进行结构分析与绘制。
1.6 统计学方法
所获得的数据均进行了3次及以上的重复验证,数据表示为均数±标准差,使用 GraphPad Prism 8.0 进行统计学分析。当两组实验数据进行比较时,采用t-test分析,多组比较,采用单因素方差分析,以Plt;0.05 表示差异有统计学意义。
2 结果
2.1 鼻粘膜类器官的长期培养
按照上述培养体系将鼻粘膜组织切割消化后,细胞在EGF、Wnt-3a 等基本生长因子存在的条件下持续的快速生长形成细胞团,培养3 d直径即可从20 μm生长至200 μm左右实心球或空心泡状结构(图1)。鼻粘膜类器官的传代效率(1∶3)和持续扩增时间可达到6个月以上,实现了对鼻粘膜类器官的连续传代和长期扩增。HE染色显示鼻粘膜类器官与来源组织的具有高度一致性(图1)。
2.2 鼻粘膜类器官可感染SARS-CoV-2 假病毒和HCoV-OC43假病毒
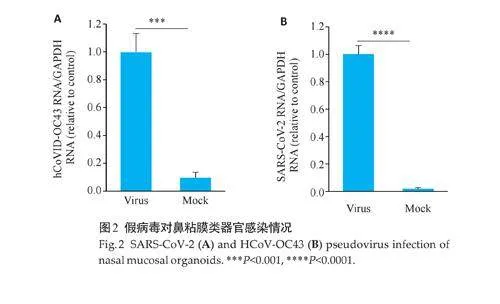
与对照组相比,HCoV-OC43假病毒和SARS-CoV-2假病毒感染组的病毒mRNA 的表达升高(Plt;0.001,图2),证明成功建立人鼻粘膜上皮类器官感染SARSCoV-2(BSL-3)及同属β冠状病毒科人易感的冠状病毒HCoV-OC43(BSL-2)模型。
2.3 荧光定量PCR法检测鼻粘膜类器官可感染SARSCoV-2 活病毒
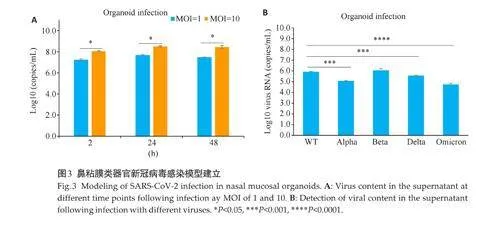
通过对不同病毒暴露载量的测试,发现MOI=10感染的上清中的SARS-CoV-2的拷贝数高于MOI=1的类器官上清中的拷贝数,说明病毒暴露载量和鼻粘膜细胞病毒感染率、复制传播能力呈正相关(P=0.027)。SARS-CoV-2活病毒感染类器官24 h后,培养基上清中拷贝数,高于感染2 h后上清拷贝数,(图3A)。
不同变异株,包括新冠原始株(WT)、alpha变异株、beta 变异株、delta 变异株和Omicron 变异株检测,结果显示感染后2 h,病毒拷贝数升高至在105~106 copies/mL,感染后24 h 更换培养基后,病毒拷贝数轻度升高(Plt;0.05,图3B)。
2.4 免疫组化及免疫荧光检测鼻粘膜类器官可感染SARS-CoV-2 的细胞类型
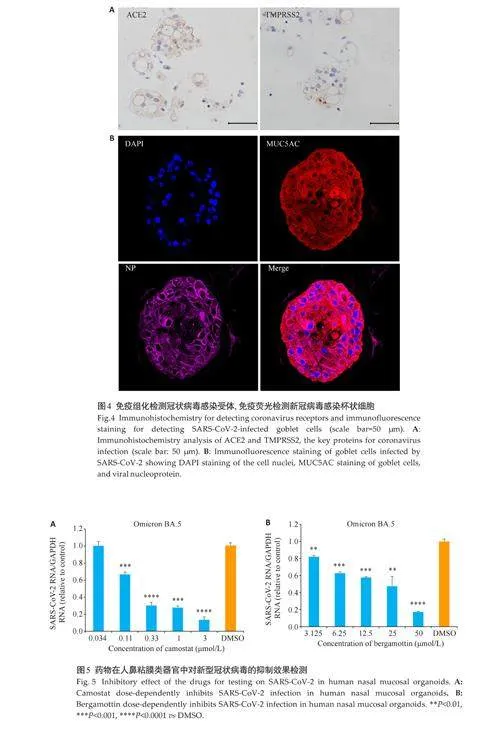
免疫组织化学(IHC)结果显示鼻粘膜类器官中的冠状病毒感染关键蛋白ACE2及TMPRSS2的均有表达(图4A),具备病毒感染的基本条件。进而,免疫荧光实验显示,病毒衣壳蛋白主要在鼻粘膜类器官的杯状细胞表达(图4B)。
2.5 抗病毒药物对鼻粘膜类器官中新型冠状病毒感染具有抑制效果
在3 μmol/L浓度下,卡莫司他可出现剂量依赖性的抑制SARS-CoV-2感染鼻粘膜类器官的效果;在浓度为0.11 μmol/L时,即可达到抑制效果(P=0.0003,图5A)。佛手柑素可剂量依赖的抑制SARSCoV-2在鼻粘膜类器官中的感染,50 μmol/L的佛手柑素对SARS-CoV-2 的抑制效果显著(Plt;0.0001,图5B)。
2.6 抗病毒药物对鼻粘膜类器官中新型冠状病毒感染具有抑制效果
分子对接实验显示佛手柑素(图6A)与卡莫司他(图6B)均能与人ACE2 蛋白有较强的结合能力,跟已知的小分子抑制剂赖诺普利具有相同的结合口袋(图6C,D),其结合能稍弱于赖诺普利,但仍有很好的结合强度(图6E)。
3 讨论
鼻腔是呼吸道病毒的首要靶器官,鼻粘膜既是病毒入侵与复制的第一站,也是免疫反应的激活点。作为新冠病毒感染的首个损伤部位,鼻粘膜类器官成为研究其感染机制的理想模型[9]。假病毒是通过重组技术构建的,具备野生病毒的结构和特征,但不具自我复制能力的病毒学研究的重要工具[23],其生物安全性高,且可引入报告基因,便于检测。HCoV-OC43 和SARS-CoV-2均为β冠状病毒,前者在1967年首次被分离,能引发人类及动物的多种疾病[24, 25]。我们利用假病毒感染实验,验证鼻粘膜类器官对冠状病毒的稳定易感性。
鼻粘膜由柱状纤毛细胞、杯状细胞和基底细胞构成,其中ACE2和TMPRSS2的高表达,使其成为新冠病毒的主要感染与复制部位。病毒通过杯状细胞的分泌和纤毛细胞的摆动传播[26, 27]。因此鼻粘膜不仅是病毒的靶器官,也是高效传播的源头。
接着我们进一步验证了鼻粘膜类器官能够被SARS-CoV-2 野生病毒感染,且病毒暴露载量(MOI=1和MOI=10)和鼻粘膜细胞病毒感染率、复制传播能力呈正相关。免疫荧光实验显示,病毒衣壳蛋白主要在鼻粘膜类器官的杯状细胞表达,说明杯状细胞对新冠病毒的易感性高于其他细胞类型,这与其他感染实验中的研究结果一致[27]。由于杯状细胞具有分泌功能,新冠病毒基因产物在杯状细胞的高表达,提示病毒可能在细胞内持续复制,并被随分泌物排出,进入培养基。通过SARS-CoV-2 活病毒单次感染鼻粘膜类器官后,培养基上清中病毒基因拷贝数不断增加,说明病毒不但能够有效感染,而且随着类器官的生长不断复制扩增,并对外分泌病毒颗粒。这进一步说明鼻粘膜类器官能够模拟病毒从侵入细胞、到胞内复制、分泌传播的完整生命周期。
此外,研究发现卡莫司他能够阻断SARS-CoV- 2刺突蛋白介导的膜融合,抑制病毒进入宿主细胞[28]。同时,我们的前期研究发现佛手柑素通过降低病毒RNA合成,抑制病毒复制,显著降低感染动物鼻甲及肺组织中的病毒滴度[29]。本研究结果表明,两者在鼻粘膜类器官中均显示出良好的抗病毒活性,可以显著降低病毒对鼻粘膜类器官的感染能力。最后,本研究还通过分子对接实验,预测卡莫司他与佛手柑素可能通过结合ACE2蛋白,阻断其与冠状病毒S蛋白结合,从而抑制病毒对鼻粘膜细胞的感染。这些结果也证实鼻粘膜类器官病毒感染模型用于药物评价的可行性。
成人鼻粘膜面积可达150 cm²,具有丰富的血液循环,适合经鼻给药,操作方便且吸收迅速[30-33],新冠疫情后,多种鼻腔给药的抗病毒药物进入研发,但临床前模型的缺陷仍是主要瓶颈。有些企业高价采购灵长类动物,而有的研究者则用人类肠道类器官进行测试[16]。成功建立鼻粘膜感染模型后,我们具备了低成本、高通量的药物评价手段,可以快速测试多种药物的抗病毒效果。
综上,本研究建立的鼻粘膜类器官新冠病毒感染模型,具有高仿生和人源化特征,适用于新冠病毒感染机制的研究与抗病毒药物的筛选,为经鼻给药的预防和治疗提供了新的思路与实验证据。

