胚胎植入前遗传学检测结合三代测序在阻断遗传性痉挛性截瘫中的成功应用
关键词:遗传性痉挛性截瘫;SPAST基因;植入前遗传学诊断;第三代基因测序技术;单核苷酸多态性
遗传性痉挛性截瘫(HSP),作为一种神经系统退行性疾病,也被称为家族性痉挛性截瘫。临床上,该疾病表现为双下肢肌张力显著升高,腱反射过度活跃,患者的步态常常呈现出剪刀步态[1,2]。根据人类孟德尔遗传数据库(OMIM)记录,目前已发现80个以上的致病基因突变位点,大约有60个致病基因被克隆,数量还在不断增加,突出了HSP高度遗传异质性[3]。基因型是根据痉挛性截瘫致病基因和位点进行分类,再按照发现的顺序依次命名为SPG1~SPG83。HSP的遗传方式主要包括常染色体显性遗传(AD)、常染色体隐性遗传(AR)和X连锁遗传,其中最为常见的遗传形式是AD-HSP[4]。
截止目前,已鉴定出超过80个基因与HSP相关联,而AD-HSP 的常见致病基因有SPAST、ATL1、REEP1和KIF5A等,其中SPAST基因变异是引起SPG4型的主要致病原因[3]。在HSP的多种遗传方式中,由SPAST基因突变所导致的HSP 4 型(SPG4)占所有HSP 病例的25%以上和常染色体显性HSP患者的50%以上[5, 6]。在HSP的发病机制中,SPAST基因中扮演了重要的角色。SPAST基因位于2号染色体短臂,cDNA全长9.4 kb,含17个外显子,编码含有616个氨基酸的spastin蛋白,该基因主要负责编码M1(68 000)和M87(60 000)两种异构体,这些异构体具有微管剪切活性,对于维持微管的动态平衡至关重要[7, 8]。然而,当SPAST基因发生突变时,可能导致编码的spastin蛋白质功能异常,进而干扰神经细胞的正常功能,引发HSP的症状[9-11]。HGMD数据库迄今已经收集了742种关于SPAST不同类型基因变异,错义变异是最常见的变异形式,其次为无义变异、小缺失变异、剪接位点变异、插入变异等[3]。
HSP亚型多且表型复杂,确诊依赖于基因检测,只有将临床表型和遗传型联系起来并联合应用多种测序技术才能更好地诊断疾病。HSP 4 型呈常染色体显性遗传,患者的子女中将有50%的患病风险,且男女患病的机会相等[17-19]。因此,建议家系中的患者生育时行植入前遗传学诊断筛选出其中不携带致病基因的胚胎或进行产前诊断,以阻断遗传病向子代传递[20-24]。目前对于完整的家系临床上普遍采用致病基因变异位点的直接检测并联合第2 代测序(NGS)和单核苷酸多态性(SNP)的连锁分析技术以保证检测结果的准确性,避免因等位基因脱扣(ADO)、基因重组等因素导致的诊断不明[21, 22]。而对于新发突变的患者或家系样本采集不全的家庭,常规的家系连锁分析的方法无法成功构建单体型。这类患者,以往可通过胚胎互推或单精子方法构建单体型,但这两种方法价格昂贵、过程漫长,且构建失败概率高。同时,第2 代测序(NGS)读长短,采用序列拼接的方法组装数据,在构建SNP连锁单体型时常需包含第2代人完整家系来构建模型,因此存在局限性。因此,本研究在面对家系样本采集不全且为新发突变的情况下,运用第3代测序方法(TGS),利用该技术单分子检测与长读长测序的特点,成功构建单体型,并结合PGTM帮助其成功活产健康婴儿,阻断了单基因病在家系中的垂直传递。
1 资料和方法
1.1 研究对象
夫妻双方2022年就诊于我院,无孕育史,性生活正常,未避孕未孕1年余。女方B超检测结果提示双侧卵巢多囊样改变,染色体正常。男方精液检查正常,染色体正常。男方父亲青年出现痉挛性行走障碍,现已去世。有一姐姐,因乳腺癌去世,未出现相关症状。男方20岁开始出现步态异常,逐年加重。
1.2 研究方法
1.2.1 全外显子测序与Sanger测序 对男方行全外显子测序(WES)检测,提示SPAST 基因c. 1699Ggt;T(p.Glu567Ter)杂合变异,该位点突变为首次报道突变,可能致病为痉挛性截瘫4型。为阻断该基因的垂直传递,夫妻双方于我院生殖医学中心经过遗传咨询并完全知情同意后,我院生殖医学中心为该夫妇制定了详细的PGT-M助孕方案。本研究经我院伦理委员会的批准(伦理批号2022DZWJWKT-004)。为验证SPAST基因在特定先证者中的突变位点,我们采集了男女双方的外周血样本,并进行了Sanger测序分析。取先证者基因组DNA,打断后构建基因组DNA文库,对基因组DNA文库进行人类全外显子捕获并对捕获序列进行测序、生物信息学分析及数据库注释,并按照美国医学遗传学与基因组学会(ACMG)指南对变异位点进行致病性分析。
1.2.2 SNP单体型构建 为了更深入地分析该家系的遗传特征,设计突变位点引物和反应体系,对该家系进行突变位点检测以及查看胚胎的突变携带情况,进行SNP单体型构建。对于单基因病家系,常规的预实验需要采集夫妻双方、致病基因携带方父母的样本,或患儿,或家族其他致病基因携带成员的样本。而该家系的样本采集不全,常规的家系连锁分析的方法无法成功构建单体型。因此,我们选用第3 代测序方法,利用该技术单分子检测与长读长测序的特点,成功构建单体型。
1.2.3 胚胎培养、活检及囊胚玻璃化冷冻 行拮抗剂方案,使用促性腺激素释放激素(GnRH)拮抗剂,抑制内源性黄体生成素(LH)峰进行促排卵后,获取卵母细胞。采用卵细胞质内单精子注射(ICSI)对卵母细胞进行授精,挑选出其中正常受精的卵母细胞继续培养至第5天或第6天形成囊胚,最终获得可活检的囊胚。取囊胚滋养外胚层(TE)细胞进行活检,对活检的囊胚单管单枚玻璃化冷冻。
1.2.4 PGT-M治疗 对活检细胞使用基于多次退火环状循环扩增技术(MALBAC)的单细胞全基因组扩增(WGA),可以完成单个细胞的高精度全基因组测序。采用Sanger测序直接检测SPAST基因突变,通过SNP连锁分析将高通量测序数据比对到人类参考基因组(hg19),进一步分析家系及检测样本全基因组SNP 位点,在致病基因上下游1~2 Mb内挑选SNP位点鉴别胚胎是否携带染色体突变,同时进行染色体拷贝数变异(CNV)分析胚胎染色体非整倍性。最后根据胚胎突变基因的SNP位点连锁分析结果、基因点突变位点验证结果以及胚胎的染色体整倍性结果综合考虑,挑选合适的胚胎。
1.2.5 FET和随访评估 使用激素替代周期(HRT),在女方月经周期的3~5 d开始给予雌激素4~6 mg/d口服,随后定期行B超监测内膜发育,在内膜达到合适厚度后给予孕激素进行黄体期的内膜转化,模拟女方在生理排卵状态下的内膜种植窗,并对其进行胚胎解冻移植(FET)。
2 结果
2.1 家系预实验基因分析
根据ACMG 遗传变异分类标准与指南,提示c.1699Ggt;T该突变位点评级为LP(PVS1+PM2)。通过Sanger 测序技术的检测,发现先证者携带有SPAST基因的c.1699Ggt;T杂合变异,而该变异在先证者的配偶中未检出(图1、2)。且对女方进行了WES检测,女方样本在SPAST基因上并未显示出明确的致病性或可能致病的变异。
2.2 体外受精结果
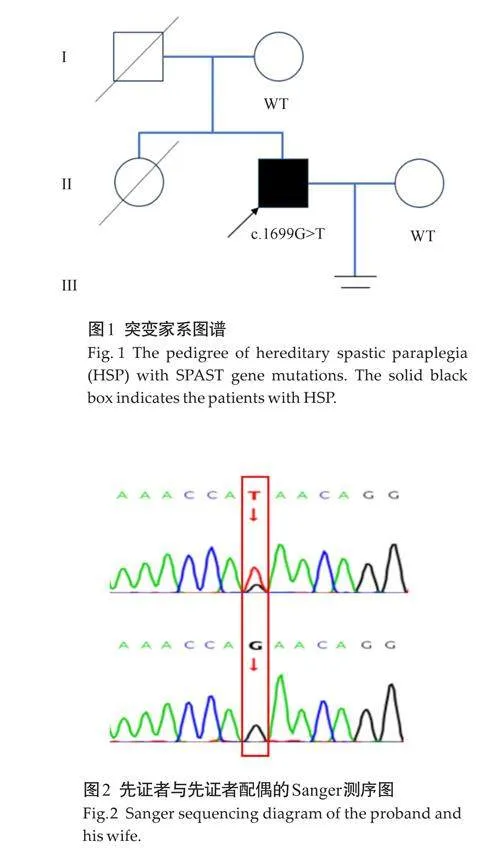
行拮抗剂方案后共获卵20枚,MⅡ数19枚,正常受精数18枚,卵裂数19枚,优良胚胎数16枚,囊胚培养数18枚,囊胚形成数13枚,囊胚冷冻数12枚,冷冻的胚胎分别编号为E-1~E-12。
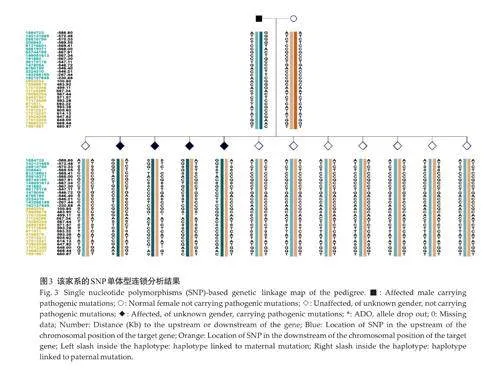
2.3 SNP连锁分析
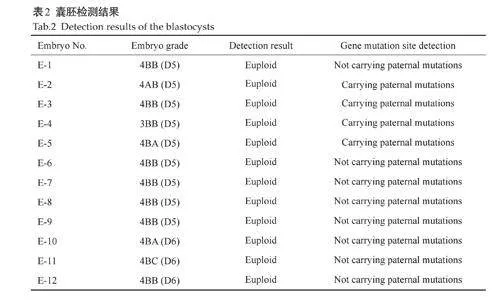
选取男女双方共30个可用位点的SNP位点进行连锁分析,分析胚胎突变位点上下游的SNP位点,其中蓝色rs所示为突变位点上游的可用位点,黄色rs所示为突变位点下游的可用位点(图3,表1)。
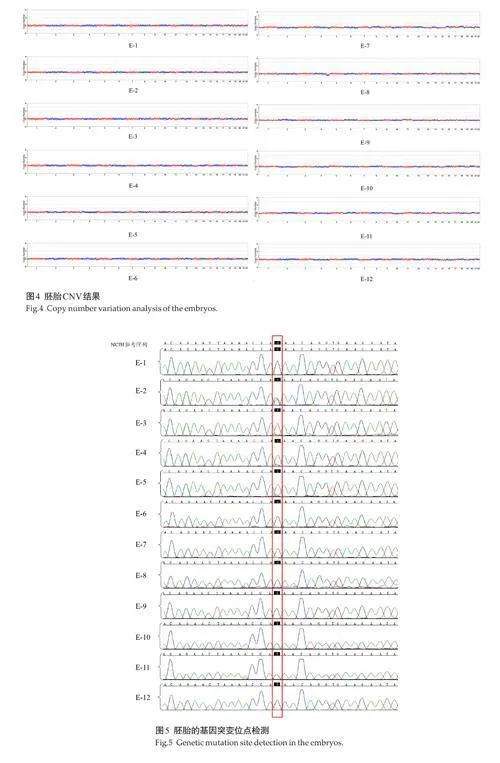
2.4 胚胎CNV分析
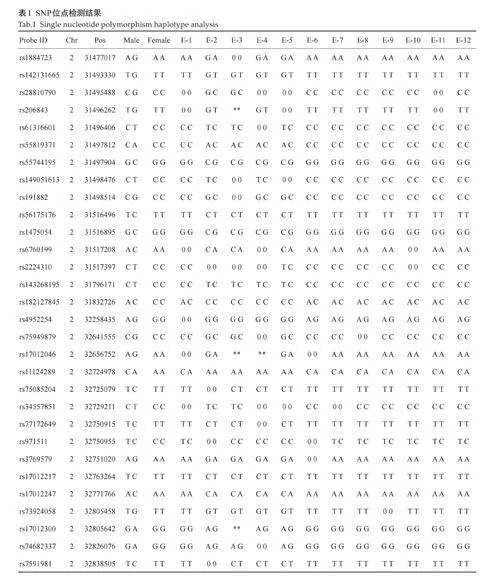
对获取的12枚囊胚分别标记并进行活检,活检结果显示均成功扩增, 12枚胚胎均为整倍体,未发现常染色体和性染色体非整倍体异常和4M碱基以上片段重复或缺失(图4)。对胚胎进行直接扩增Sanger 测序与SNP连锁分析,其中有4枚携带父源突变基因,其余8枚不携带父源突变基因(图5、表2)。
2.5 移植结果
在进行遗传咨询后,对患者进行冻融胚胎移植,经内膜准备后,选择一枚未检测到突变的优质整倍体胚胎,形态学评分为4BB,编号,成功移植到母体。在移植14 d 后取外周血查血人绒毛膜促性腺激素(hCG)为3893 IU/L,确认妊娠;移植后4周经阴道B超见一大小为43 mm×35 mm的孕囊;移植后6 周经阴道B超见一大小为51.3 mm×40 mm的孕囊,可见胚芽与胎心。孕19+周行羊水穿刺获得胎儿DNA,Sanger测序结果显示未检测到SPAST基因c.1699Ggt;T突变,PGT结果得到验证。孕39+3周顺产一正常女婴,体质量3470 g,身长50 cm,健康状况良好。
3 讨论
HSP又称家族性痉挛性截瘫或家族性痉挛性下肢轻瘫,属于具有家族遗传性的神经系统退行性疾病[1,2]。HSP作为一种罕见的遗传性疾病,其遗传模式涵盖了常染色体显性遗传(AD)、常染色体隐性遗传(AR)及X连锁等方式,其中AD-HSP为主要遗传形式[4-6]。HSP的典型特征为慢性进行性无力和痉挛性下肢瘫痪,但其确切的发病机制尚未完全阐明。该疾病多在儿童期或青春期发病,但也可能影响其他年龄段,且男性患者略多于女性[7,8]。在临床表现上,HSP患者常表现出双下肢的缓慢进行性痉挛性肌无力,伴有肌张力增高、腱反射亢进、膝踝阵挛、病理征阳性以及剪刀步态等症状。此外,患者还可能伴随视神经萎缩、视网膜色素变性、锥体外系症状、小脑性共济失调、感觉障碍、痴呆、精神发育迟缓、耳聋、肌萎缩以及自主神经功能障碍等一系列并发症,这些症状的出现使得HSP的病情更加复杂多样。疾病分为单纯型和复杂型两种类型,单纯型主要表现为双下肢僵硬、走路容易跌倒、呈剪刀步态等,而复杂型则常伴随不同程度的帕金森、小脑共济失调、肌张力障碍、肌萎缩、听力障碍、癫痫等表现。HSP的诊断主要依据家族史、临床表现及相关检查结果[14-16]。在检查方面,诱发电位、肌电图及MRI等检查有助于明确病变部位及程度。在诊断时,医生需考虑患者的家族史、发病年龄、临床表现及排除其他疾病等因素。目前,HSP尚无特效治疗方法可以预防、延缓或逆转其进行性功能残疾。治疗目标主要是减少残疾和预防并发症。药物治疗如巴氯芬、肉毒毒素、抗胆碱能等可用于对症治疗,缓解不适症状。此外,肌力训练、伸展训练及有氧训练等康复治疗措施也有助于改善患者的肌肉力量、关节活动度及生活质量[17-19]。由于HSP是一种遗传性疾病,无法完全治愈,但进展缓慢,护理得当的患者可长期生存。
单基因遗传病就是由于一个基因突变所导致的遗传性疾病。已明确致病基因的单基因病超过6000 多种。很多单基因病会导致肢体残疾、智力障碍、功能障碍等,仅5%单基因病有治疗手段,且绝大多数价格昂贵,疗效差。没有遗传病家族史的夫妻,可以进行隐性遗传病携带者筛查明确生育隐性遗传病患儿的风险。若孕前已明确双方为致病基因携带者,存在生育遗传病患儿风险,可以通过PGT-M技术提前预防生育遗传病患儿。PGT-M是植入前胚胎遗传学检测技术的一种,利用活检的胚胎细胞,结合高通量测序、生物信息学分析及其他分子生物学检测手段有效鉴别获得胚胎是否具有单基因遗传病患病风险,进一步选择正常胚胎植入宫腔,在孕前阻断单基因病的传递[21-24]。PGT-M技术检测和分析内容包括了致病基因变异位点检测、基于SNP位点的家系和胚胎样本基因单倍体型分析和胚胎染色体非整倍性分析[25, 26]。PGT-M技术可以检测胚胎是否携带某些可导致单基因病的突变基因,如地中海贫血、遗传性耳聋、白化病等,也可以有效避免家族性遗传病的垂直传递,提高试管婴儿成功率和健康婴儿出生率。
对于单基因病家系,常规的预实验需要采集夫妻双方、致病基因携带方父母的样本,或患儿,或家族其他致病基因携带成员的样本。而对于新发突变的患者或家系样本采集不全的家庭,常规的家系连锁分析的方法无法成功构建单体型。这类患者,以往可通过胚胎互推或单精子方法构建单体型,但这两种方法价格昂贵、过程漫长,且构建失败概率高。因此,面对家系样本采集不全或新发突变的患者,可以运用三代测序方法,利用该技术单分子检测与长读长测序的特点,成功构建单体型[24-32]。
综上所述,本研究应用PGT-M技术,构建家系及胚胎SNP单体型,结合CNV分析胚胎染色体非整倍性,挑选出优质整倍体胚胎移植,成功阻断SPAST基因向子代的垂直传递,避免了单基因遗传病对患者家庭造成的影响。同时,我们还发现了SPAST基因的一个新突变位点,丰富了其突变谱。

