补肾中药通过AMPK-mTOR通路提高肾精亏虚大鼠睾丸间质细胞自噬能力






摘 要:为了探究补肾中药提高肾精亏虚大鼠睾丸间质细胞自噬能力的机制,采用单因素电刺激法建立肾精亏虚大鼠模型,免疫组化及Western blot检测各组睾丸细胞自噬标志蛋白Beclin1、p62、LC3B表达水平以及AMPK和mTOR表达变化.基于肾精亏虚与衰老的密切联系,通过自由基氧化损伤法建立睾丸间质细胞(Leydig细胞)衰老模型,联合AMPK抑制剂,探究何首乌饮激活细胞自噬的分子机制.结果显示:何首乌饮可上调睾丸组织Beclin1蛋白、LC3B表达,下调p62蛋白表达,促进AMPK磷酸化并抑制mTOR激活(P<0.05);细胞实验表明,何首乌饮可通过激活AMPK-mTOR信号通路提高Leydig细胞自噬能力(P<0.05),促进肾精亏虚大鼠睾丸Leydig细胞自噬进程.
关键词:何首乌饮;肾精亏虚;睾丸组织;自噬;AMPK-mTOR
中图分类号:Q291"" 文献标志码:A"" 文章编号:10001565(2024)06063310
Kidney-tonifying Chinese medicine improves autophagy of Leydig cells in rats with kidney essence deficiency through AMPK-mTOR pathway
LI Chaoying1, LI Sirui2, ZHANG Wei3, MA Haofei2, NIU Shuang2, DUAN Yulei2, NIU Siyun2
(1. Department of Neonatology, Affiliated Hospital of Hebei University, Baoding 071000, China;2. School of Basic Medical Sciences, Hebei University, Baoding 071000, China;3. Medical Engineering Center, Affiliated Hospital of Hebei University, Baoding 071000, China)
Abstract: In order to explore the mechanism of kidney-tonifying Chinese medicine in improving autophagy of testicular mesenchymal cells in rats with kidney-essence deficiency, a rat model of kidney-essence deficiency was established by single-factor electrical stimulation. Immunohistochemistry and Western blot were used to detect the expression levels of autophagy marker proteins Beclin1, p62, LC3B, AMPK and mTOR in testicular cells of each group. Based on the close relationship between kidney essence deficiency and aging, Leydig cell aging model of testicular mesenchymal cells was established by free radical oxidative damage method, and AMPK inhibitor was combined to explore the molecular mechanism of Heshouwuyin activating autophagy. The results showed that Heshouwuyin could up-regulate the expression of Beclin1 protein and LC3B in testicular tissue, down-regulate the expression of p62 protein,promote AMPK phosphorylation and inhibit mTOR activation (Plt;0.05). Cell experiments showed that Heshouwuyin could affect the autophagy ability of Leydig cells by activating AMPK-mTOR signaling pathway (Plt;0.05).Therefore, Heshouwuyin may promote the autophagy process of Leydig cells in rats with kidney essence deficiency by activating AMPK-mTOR signaling pathway.
Key words: Heshouwuyin; kidney essence deficiency; testicular tissue; autophagy; AMPK-mTOR
收稿日期:2024 0219;修回日期:20240508
基金项目:
国家自然科学基金资助项目(82374180);河北省中医药管理局科研项目(2020234);河北省重点研发计划项目-中医药创新专项(223777134D);河北大学医学学科培育项目(2023B10);河北省高等学校科学技术研究项目(ZD2022060)
第一作者: 李朝英(1980—),女,河北大学附属医院主治医师,主要从事早产儿营养评估.E-mail:lizhaoying725@126.com
通信作者:段豫磊(1994—),男,河北大学实验师,主要从事中药药理方向研究.E-mail:dyl15771@163.com
牛嗣云(1967—),女,满族,河北大学教授,博士,博士生导师,主要从事生殖衰老方向研究.E-mail:nsy1688@163.com
不孕不育是威胁人类健康的第三大类疾病[1],其中男性因素占50%[2].晚婚晚育已成为普遍的社会现象,高龄是生殖功能下降的重要因素之一.Leydig细胞合成睾酮能力随着增龄而显著降低,进而导致血清睾酮水平下降[3],且睾酮水平降低与糖尿病、骨质疏松、心血管疾病和睡眠障碍等老年疾病密切相关[4].目前,常使用睾酮替代疗法干预男性血清睾酮下降,但其带来的副作用会超过其潜在的健康益处[5].因此,新的增加内源性睾酮分泌的策略有待开发.中医临床中,“补肾益精”提高男性生殖能力疗效显著,但作用机制不明.研究证明,细胞自噬在调节Leydig细胞睾酮合成过程中起着重要作用,并与Leydig细胞功能呈正相关[6-7].而本课题组前期研究表明,补肾中药何首乌饮可促进生精细胞增殖[8]、促进Leydig细胞睾酮分泌[9],提高衰老大鼠精子质量[10].基于此,本文探讨了补肾中药提高肾精亏虚大鼠睾丸细胞自噬能力可能的分子机理,为“补肾益精”中药的临床应用提供了科学依据.
1 材料与方法
1.1 实验动物
2月龄SPF级Wistar雄性大鼠(220~260 g)50只,购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006.适应性饲养1周,控制温度在22 ℃左右,正常给予食物和水.
1.2 试剂与仪器
Beclin1、p62一抗(中国生工生物工程股份有限公司);LC3B一抗(美国abcam公司);p-AMPK、AMPK、p-mTOR、mTOR、GAPDH一抗(中国abways公司);细胞衰老β-半乳糖苷酶染色试剂盒(中国碧云天生物有限公司);免疫组化SP两步法试剂盒、DAB显色试剂盒(中国中杉金桥生物技术有限公司);50×柠檬酸钠抗原修复液、BCA蛋白浓度测定试剂盒、蛋白Marker(中国索莱宝科技有限公司);EASYspin Plus 组织/细胞RNA快速提取试剂盒(中国艾德莱生物科技公司);PrimeScript RT reagent Kit with Gdna Eraser试剂盒、TB GreenTM Premix Ex TaqTM Ⅱ试剂盒(Tli RNaseH Plus)(日本 TaKaRa 公司).
1.3 实验药物
何首乌饮组方:制首乌、怀牛膝、肉苁蓉、丹参、茯苓、淫羊藿,以生药质量比3∶3∶2∶5∶3∶2混合.本实验采用广东一方公司中药饮片速溶成品,成品与生药质量比为:制首乌1∶10,怀牛膝1∶5,肉苁蓉1∶10,丹参1∶10,茯苓1∶5,淫羊藿1∶20.前期研究表明,大鼠灌胃的最佳给药量(生药)为48 g/kg,换算为成品颗粒为6.13 g/kg[11],现用现配.
1.4 造模与给药
2月龄Wistar大鼠分为正常组、模型组和何首乌饮组(n=10).模型组和何首乌饮组大鼠模拟“房劳”法建立“肾精亏虚”大鼠模型,通过单因素电刺激,使用电针疗仪(华佗,SDZ-Ⅱ)电针接触大鼠大腿内侧部,采用连续电波模式,脉冲频率40 Hz,电流2 mA.刺激支配大腿内侧和会阴部的生殖股神经,使精囊、提睾肌、大腿内侧皮肤兴奋,引起射精神经的兴奋,进而阴茎勃起,最后射精,达到人工耗精的目的.每日刺激时间为20∶00,连续刺激7 d,休息3 d,10 d为1个周期,连续进行3个周期,共30 d;而后于每个月的后10 d重复刺激,耗精至10月龄.正常组不做处理.何首乌饮组5月龄开始灌胃何首乌饮,一日2次,正常组和模型组灌等量的生理盐水,连续60 d.7、8月不做任何处理,从9月龄开始,何首乌饮组继续灌胃30 d,正常组和模型组连续灌胃生理盐水30 d.
腹腔注射戊巴比妥钠溶液(50 mg/kg)麻醉,取出双侧睾丸组织,左侧快速置于-80 ℃冰箱保存,右侧于40 mg/mL多聚甲醛溶液固定、脱水、石蜡包埋.
1.5 含药血清制备
选取2月龄Wistar雄性大鼠20只,分别灌胃何首乌饮(n=10)与等量生理盐水(n=10),给药剂量同“1.3实验药物”部分,连续7 d,第7 天给药1 h后麻醉内眦取血.将收集到的血静置30 min,低温离心机3 000 r/min离心10 min,分离血清.分别获得何首乌饮大鼠含药血清与大鼠空白血清,通过0.22 μm过滤器过滤,并无菌分装,-80 ℃保存待用.
1.6 Leydig细胞分离培养及处理
采用Ⅰ型胶原酶处理17~25 d Wistar大鼠睾丸分离原代Leydig细胞[12],将细胞接种于含体积分数10%胎牛血清的DMEM/F12培养液中,以1×107个/mL的密度铺匀,1 h换液.Leydig细胞80%融合度时传代,第3代接种密度为1×106个/mL,通过自由基氧化损伤法建立Leydig细胞衰老模型[13].
1.7 CCK8实验
上述获得的大鼠Leydig细胞,通过CountStart细胞计数仪计数后,以8 000个/孔的密度接种于96孔板中.将AMPK抑制剂Compound C浓度梯度设置为0、1、5、10、20、30 μmol/L,每个浓度梯度设置6个复孔.共设置3个作用时间:24、48、72 h.作用完成后,每孔加入10 μL CCK8试剂,37 ℃孵育2 h,采用酶标仪450 nm检测吸光度,计算细胞活力.
细胞活力=A样/A0×100%,
式中:A样为各浓度下的吸光度;A0为0 μmol/L时的吸光度.
1.8 石蜡切片免疫组织化学染色
免疫组化法检测睾丸组织p16、Beclin1蛋白表达.睾丸石蜡切片脱蜡水化,柠檬酸钠抗原修复,体积分数10% H2O2溶液室温封闭10 min.切片上滴加50 μL配置好的p16一抗(1∶300)、Beclin1一抗稀释液(1∶500).为消除假阳性结果,设置阴性对照组切片,阴性对照切片只滴加相等体积的p16、Beclin1一抗稀释液.4 ℃孵育过夜后,羊抗兔二抗 37 ℃孵育30 min.DAB显色液孵育3 min,苏木素染色、封片.正置显微镜下观察切片并进行拍照.Image J 软件IHC Profiler 插件进行免疫组化分析,根据不同的DAB染色强度进行评分,规则为强阳性3分,阳性2分,弱阳性1分,阴性0分.每个视野的得分指数=各等级细胞所占的百分比×相应评分.IHC评分为各组中所有视野的得分指数平均值.
1.9 β-半乳糖苷酶染色
各组大鼠睾丸组织切片脱蜡,复水.使用β-半乳糖苷酶(β-Gal)对kit染色处理.固定液固定组织切片15 min, PBS清洗3次,每次5 min;将试剂盒内自带的染液A 10 μL、染液B 10 μL、染液C 930 μL以及X-Gal 50 μL混合后滴加于组织切片上,37 ℃避光,静置16 h;为消除假阳性结果设置阴性对照组切片,阴性对照组切片只滴加相等体积的生理盐水.PBS清洗3次,每次3 min,苏木素染色5 min,稀盐酸乙醇浸泡1 s,淡氨水返蓝30 s,流水冲洗10 min,染色完成后脱水,中性树脂封片.每组切片选取5个组织,选择相同部位3张连续切片,随机在每个切片中取10个视野,拍照(200×),统计阳性细胞数.
1.10 细胞处理及分组
Leydig细胞分为正常组、模型组、何首乌饮组、正常+抑制剂组、模型+抑制剂+何首乌饮组,处理方式见表1.
1.11 荧光定量PCR
睾丸组织100 mg或Leydig细胞1×107个,北京艾德莱生物科技公司生产的RNA快速提取试剂盒提取总RNA,超微量分光光度计测定RNA纯度和浓度.PrimeScript RT reagent 试剂盒进行普通PCR反转录cDNA.使用荧光染料SYBR,荧光定量PCR仪进行RT-qPCR,β-acting为内参基因.利用SPSS 19.0 软件、2-△△Ct 法对各组阈值循环数(Cydethreshold,Ct值)进行统计学分析.Beclin1、β-acting基因引物序列(表2)由Thermo Fisher公司合成.
1.12 免疫印迹法
将睾丸组织100 mg或Leydig细胞1×107个,1 mL RIPA(含1 μL PMSF),匀浆后冰上静置裂解10 min, 4 ℃ 13 000 r/min 离心 10 min.吸取上清液,用考马斯亮蓝对蛋白裂解液进行蛋白定量.用裂解液以及loading buffer将所有蛋白裂解液统一稀释成4 mg/mL蛋白样品溶液,在100 ℃ 煮沸5 min变性后分装.电泳采用体积分数10% 分离胶体系,进样体积20 μL,恒压90 V 30 min转120 V 60 min.电泳后切胶,恒流280 mA 2 h转PVDF膜.质量分数5% 脱脂奶粉的 PBST 溶液 37 ℃ 封闭 2 h.PBST溶液稀释Beclin1(1∶1 000)、p62(1∶500)、LC3B(1∶2 000)、AMPK(1∶500)、p-AMPK(1∶1 000)、mTOR(1∶1 000)、p-mTOR(1∶1 000)、GAPDH(1∶2 000),一抗稀释液 4 ℃ 孵育过夜.PBST溶液清洗3次,每次5 min.PBST配制的羊抗小鼠二抗(1∶200 00)孵育 2 h,PBST溶液清洗3次,每次5 min.ECL化学发光液(现用现配)孵育PVDF膜,凝胶成像系统显影并拍照.Image J软件对目的条带与内参条带进行灰度值测定,重复3次独立实验.
1.13 统计分析
实验数据用平均值±标准差表示.各实验数据采用正态性检验,数据分布满足正态进行单因素方差分析,Plt;0.05有统计学意义.若方差齐则采用最小显著差法两两比较,若不齐则用Dunnett’s T3法.
2 结果
2.1 何首乌饮对肾精亏虚大鼠睾丸组织细胞β-Gal和p16蛋白表达的影响
通过检测睾丸组织衰老标记物β-Gal和衰老标记蛋白p16表达,分析了何首乌饮对肾精亏虚大鼠睾丸组织衰老的影响(图1).结果显示:β-Gal阳性产物为蓝绿色,主要定位于间质细胞细胞质中,模型组β-Gal明显高于正常组(Plt;0.05);何首乌饮干预后β-Gal表达明显低于模型组(Plt;0.05),免疫组化结果显示:p16蛋白于各级生精细胞和Leydig细胞细胞核中表达,阳性细胞核呈黄色.模型组中p16 IHC评分明显高于正常组(Plt;0.05);何首乌饮组p16的表达水平显著下降,IHC评分显著低于模型组(Plt;0.05).
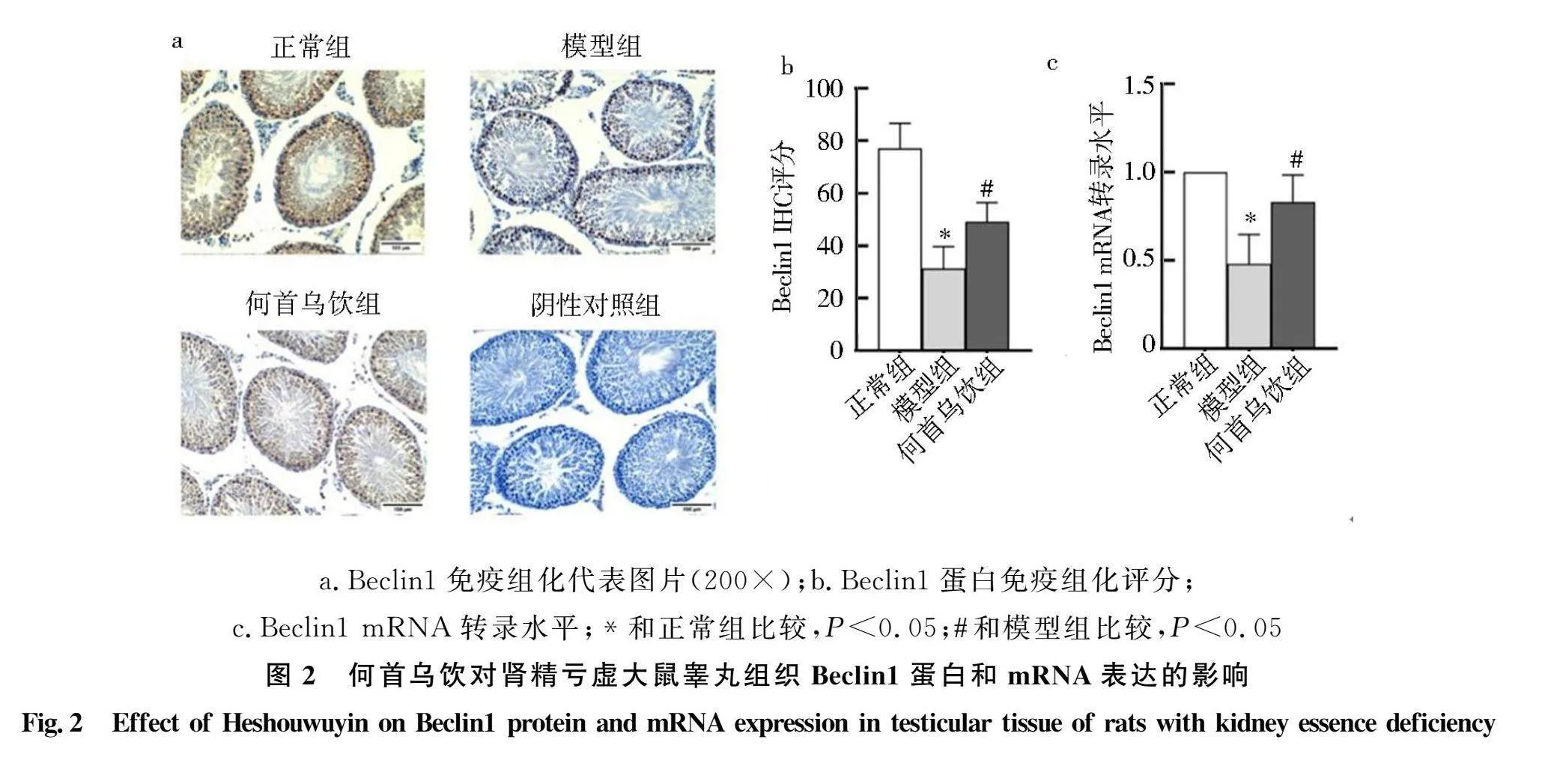
2.2 何首乌饮对肾精亏虚大鼠睾丸Beclin1蛋白和mRNA表达的影响
为探讨何首乌饮对肾精亏虚大鼠睾丸自噬的影响,检测了自噬标志因子Beclin1蛋白和mRNA表达情况,免疫组化结果显示:Beclin1蛋白主要定位于细胞质,表达于各级生精细胞及间质细胞中,同时通过染色发现,模型组中睾丸结构松散、生精细胞脱落(图2a),何首乌饮干预可改善这一现象.分析显示:与正常组相比,模型组Beclin1 蛋白和mRNA转录水平均显著降低(Plt;0.05),何首乌饮可显著提高Beclin1蛋白表达和转录水平(Plt;0.05)(图2b、c).
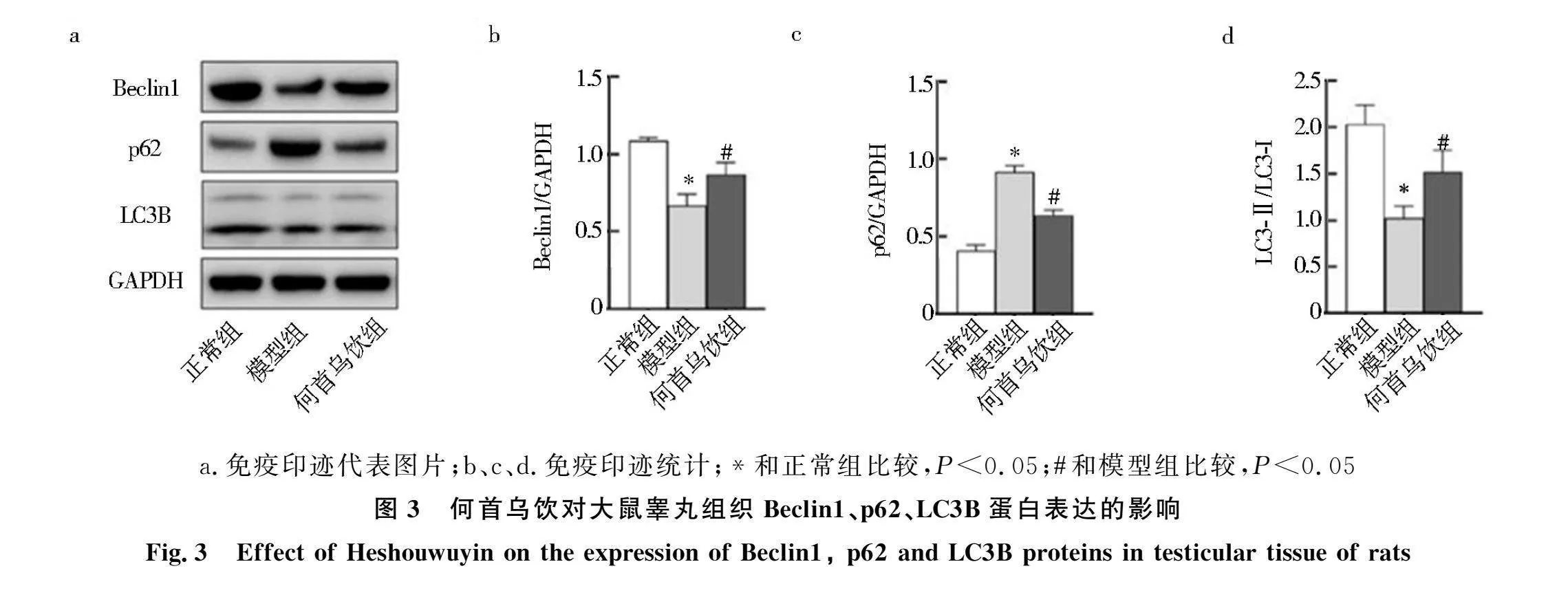
2.3 何首乌饮对肾精亏虚大鼠睾丸Beclin1、p62、LC3B蛋白表达的影响
为进一步探讨何首乌饮对肾精亏虚大鼠睾丸组织自噬的影响,免疫印迹检测自噬标志蛋白Beclin1、p62以及LC3B的表达情况,结果如图3所示:与正常组相比,模型组Beclin1蛋白表达和LC3-Ⅱ/ LC3-Ⅰ水平显著降低(Plt;0.05),p62蛋白表达显著增高(Plt;0.05);何首乌饮可显著提高模型组大鼠睾丸Beclin1蛋白表达和LC3-Ⅱ/ LC3-Ⅰ水平(Plt;0.05),显著降低p62蛋白水平(Plt;0.05).
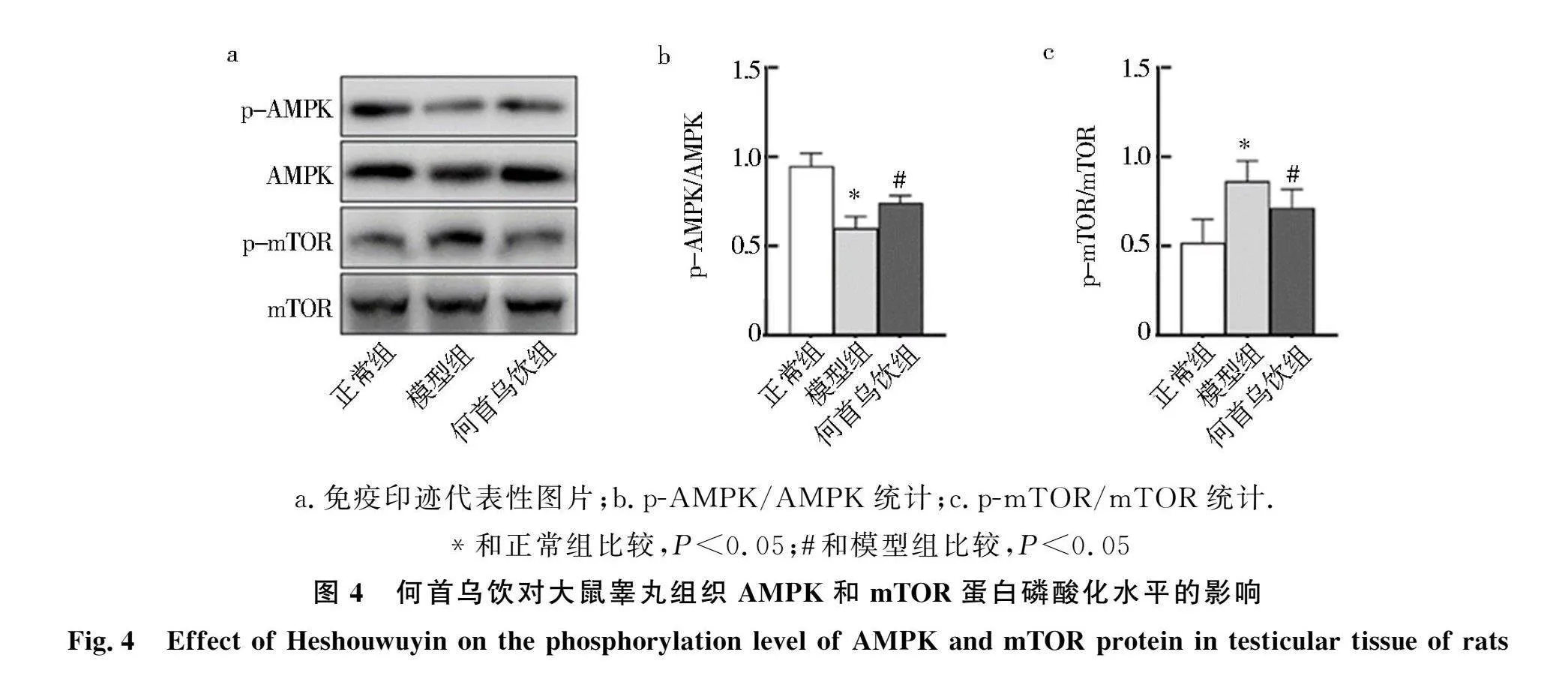
2.4 何首乌饮对肾精亏虚大鼠睾丸AMPK、mTOR蛋白磷酸化水平的影响
Western blot检测了AMPK及mTOR蛋白磷酸化情况,结果如图4所示:与正常组相比,模型组p-AMPK水平降低(Plt;0.05),何首乌饮治疗可显著提高p-AMPK水平(Plt;0.05);模型组p-mTOR水平高于正常组(Plt;0.05),何首乌饮可显著抑制p-mTOR水平(与模型组比较Plt;0.05).基于此,推测何首乌饮通过调节AMPK和mTOR的活性,影响睾丸组织细胞自噬,进而以Leydig细胞为研究对象,探讨了何首乌饮通过AMPK-mTOR通路调节自噬的分子机制.
2.5 Compound C浓度与作用时间的选择
为验证何首乌饮是否通过AMPK-mTOR通路调节自噬,采用AMPK抑制剂Compound C作用Leydig细胞进行机制验证,首先筛选其最佳作用浓度与时间.CCK8结果(图5)显示:当Compound C浓度为30 μmol/L时,细胞出现大量死亡;浓度为20 μmol/L时,在各作用时间下,细胞活力为50%以下,对细胞的生存活性产生影响;浓度为10 μmol/L时,作用24 h,细胞活力较好,达到80%以上.故确定Compound C的最佳作用浓度为10 μmol/L,作用时间为24 h.
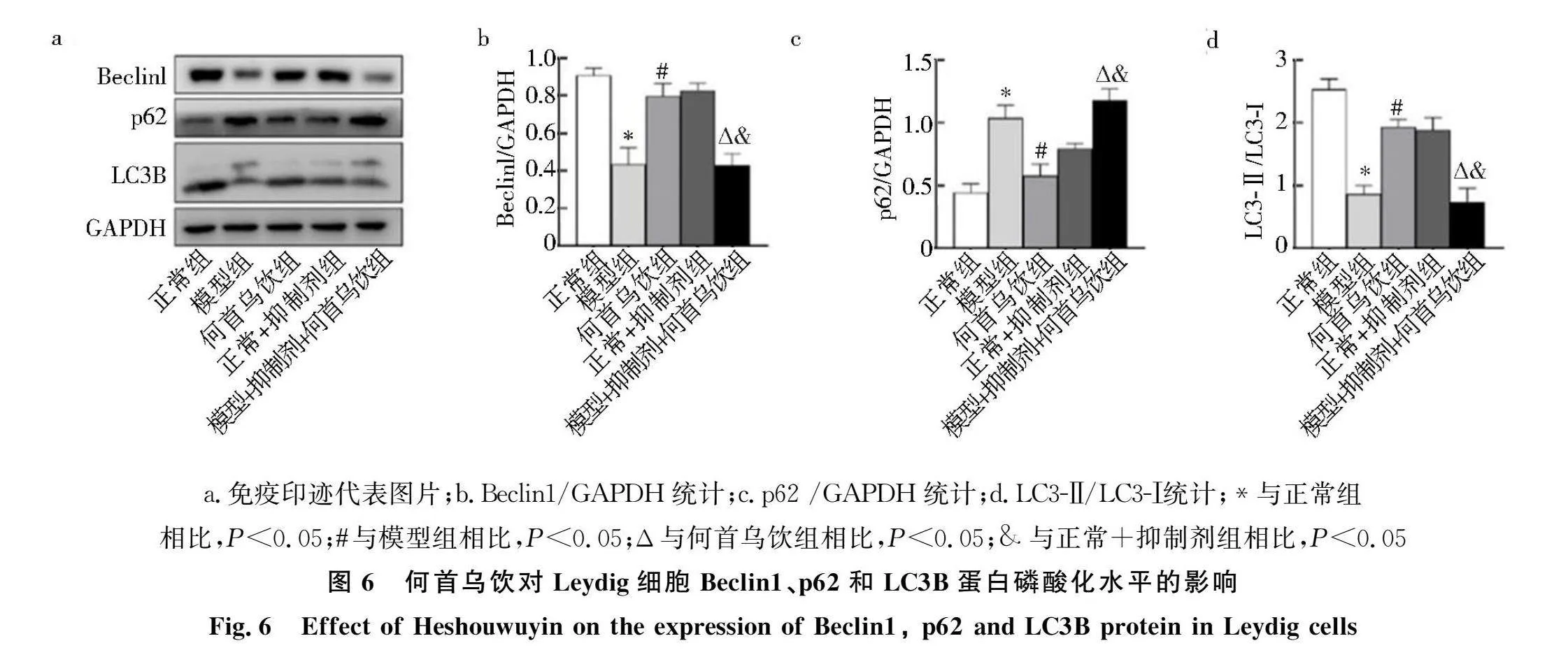
2.6 何首乌饮对大鼠Leydig细胞Beclin1、p62、LC3B蛋白表达的影响
Western blot结果如图6所示:Leydig细胞衰老模型组中Beclin1蛋白和LC3-Ⅱ/LC3-Ⅰ水平低于正常组(Plt;0.05),p62蛋白水平高于正常组(Plt;0.05).与模型组相比,何首乌饮组中Beclin1蛋白表达和LC3-Ⅱ/LC3-Ⅰ水平显著升高(Plt;0.05),p62蛋白表达水平显著降低(Plt;0.05).同时,与何首乌饮组相比,何首乌饮+抑制剂组Beclin1蛋白和LC3-Ⅱ/LC3-Ⅰ水平降低(Plt;0.05),p62蛋白表达升高(Plt;0.05),表明抑制剂可明显抑制何首乌饮对细胞自噬的调控作用.
2.7 何首乌饮对大鼠Leydig细胞AMPK、mTOR蛋白磷酸化水平的影响
为了验证何首乌饮是否通过AMPK-mTOR通路激活自噬途径,Western Blot检测了p-AMPK、AMPK、p-mTOR、mTOR在大鼠Leydig细胞的表达水平.结果如图7所示:模型组p-AMPK表达水平低于正常组(Plt;0.05),p-mTOR表达水平高于正常组(Plt;0.05).与模型组相比,何首乌饮组p-AMPK水平显著升高(Plt;0.05),p-mTOR水平显著降低(Plt;0.05).同时,与何首乌饮组相比,何首乌饮+抑制剂组中p-AMPK水平显著降低(Plt;0.05),p-mTOR水平显著升高(Plt;0.05),表明抑制剂可抑制何首乌饮的干预作用.
3 讨论与结论
中医理论认为,肾精亏虚是生殖功能下降和机体衰老的主要病机,“房劳”是肾精亏虚的主要诱因.有研究者[14]对老年人有“肾精亏虚”症患者进行全基因组基因芯片筛查,发现“肾精亏虚”症与老年性疾病之间存在多种共性基因.本课题组采用单因素电刺激法刺激大鼠过度排精模拟“房劳”建立肾精亏虚大鼠模型.发现肾精亏虚大鼠睾丸组织各级生精细胞层数减少且排列紊乱,生精小管内出现空泡,连接松散等现象.同时已有研究表明,“肾精亏虚”鼠精神萎靡、毛色暗沉、反应迟钝,同时出现生育力降低、精液质量下降、精子密度和活力降低,精子DNA损伤加剧等现象[15-16].本研究补肾复方何首乌饮方包括制首乌、肉苁蓉、怀牛膝、淫羊藿、丹参、茯苓6味中药.前期基因芯片筛查发现,何首乌饮可调控衰老大鼠睾丸组织912个基因的表达,其中包括调节细胞自噬进程的AMPK和mTOR蛋白基因[17],但机制尚不清楚.
AMPK与mTOR是调节细胞自噬的重要因子[18],其中,AMPK蛋白激酶起到调节细胞能量稳态和调节自噬的重要作用,可调节mTORC1磷酸化.mTOR是组成mTORC1复合体的关键蛋白,mTORC1磷酸化介导自噬蛋白的失活,从而抑制细胞自噬以及多种细胞功能.磷酸化的AMPK可抑制mTOR及mTORC1复合体,进而上调细胞自噬进程[19].细胞自噬与男性生殖功能密切相关,自噬进程不仅参与男性性腺轴的调节,亦对精原干细胞的分化、更新、精母细胞的减数分裂以及精子发生进程起重要调节作用[20].基于此,笔者检测了各组睾丸组织自噬标志性蛋白Beclin1、p62、LC3B的表达情况以及AMPK和mTOR蛋白的磷酸化水平[21],来评估何首乌饮对肾精亏虚大鼠睾丸自噬的影响和可能的作用机制.结果显示,过度排精诱导的肾精亏虚大鼠睾丸组织中自噬水平表现出明显的下调,而何首乌饮可显著改善这一情况,同时发现其可激活AMPK蛋白磷酸化水平并抑制mTOR的激活,初步证明了何首乌饮可通过AMPK-mTOR途径调控肾精亏虚大鼠睾丸自噬.
自噬不仅调控生精细胞的精子发生进程,同样对调控Leydig细胞的睾酮的产生和维持至关重要[22]:激活Leydig细胞中自噬进程可增加类固醇生成急性调节蛋白的表达并促进睾酮生成[23];阻碍自噬可增强氧化应激并抑制睾酮的产生[24].同时,Leydig细胞的衰老在男性性腺功能衰退机制中起核心作用,随着年龄的增长,Leydig 细胞的睾酮合成能力降低,从而导致血清睾酮水平与年龄相关的下降[25].而自噬与细胞衰老之间关系密切,伴随着衰老进程,细胞自噬功能逐渐减弱,自噬小体形成减少,自噬溶酶体的融合也发生错误[26].同样,作为细胞的自身保护性机制,自噬的增强可维持蛋白稳定性并调节代谢,减少衰老特征的发生,延缓细胞衰老进程[27].因此推测细胞自噬在男性Leydig 细胞衰老中起重要调控作用.笔者前期研究发现,何首乌饮可调控衰老大鼠睾丸组织衰老标志物 p53、p16 蛋白的表达;提高睾酮合成关键酶 p450scc 和 StAR 表达,促进睾酮合成;提高衰老大鼠精子质量[10,28];延缓Leydig 细胞衰老进程[29],但具体干预机制尚不明确.基于此,笔者采用自由基氧化损伤法建立原代Leydig细胞衰老模型,并给与何首乌饮含药血清进行干预,同时采用AMPK抑制剂Compound C[30]作用Leydig细胞,进一步探究何首乌饮是否通过激活Leydig细胞中AMPK-mTOR通路诱导自噬发挥功效.结果表明:何首乌饮可激活衰老Leydig细胞AMPK、抑制mTOR、上调自噬进程,但Compound C可明显逆转何首乌饮的作用功效,表明何首乌饮可能通过激活AMPK-mTOR通路介导细胞自噬,延缓间质细胞衰老进程.
参 考 文 献:
[1] LI L H, YUAN Y, SHA J H. Potential clinical value of in vitro spermatogenesis[J]. Biol Reprod, 2022, 107(1): 95-100. DOI:10.1093/biolre/ioac076.
[2] WANG L, ZHU Y, WANG T, et al. Feasibility analysis of incorporating infertility into medical insurance in China[J]. Front Endocrinol, 2022, 13: 967739. DOI:10.3389/fendo.2022.967739.
[3] MIDZAK A S, CHEN H L, PAPADOPOULOS V, et al. Leydig cell aging and the mechanisms of reduced testosterone synthesis[J]. Mol Cell Endocrinol, 2009, 299(1):23-31. DOI: 10.1016/j.mce.2008.07.016.
[4] ERENPREISS J, FODINA V, POZARSKA R, et al. Prevalence of testosterone deficiency among aging men with and without morbidities[J]. Aging Male, 2020, 23(5):901-905. DOI: 10.1080/13685538.2019.1621832.
[5] PATAKY M W, YOUNG W F, NAIR K S. Hormonal and metabolic changes of aging and the influence of lifestyle modifications[J]. Mayo Clin Proc, 2021, 96(3):788-814. DOI: 10.1016/j.mayocp.2020.07.033.
[6] PI H F, LI M, ZOU L Y, et al. AKT inhibition-mediated dephosphorylation of TFE3 promotes overactive autophagy independent of MTORC1 in cadmium-exposed bone mesenchymal stem cells[J]. Autophagy, 2019, 15(4):565-582. DOI: 10.1080/15548627.2018.1531198.
[7] GAO F Y, LI G P, LIU C, et al. Autophagy regulates testosterone synthesis by facilitating cholesterol uptake in Leydig cells[J]. J Cell Biol, 2018, 217(6):2103-2119. DOI: 10.1083/jcb.201710078.
[8] WANG H J, SHAN B Y, DUAN Y L, et al. Effects of Heshouwuyin on gene expression of the insulin/IGF signalling pathway in rat testis and spermatogenic cells[J]. Pharm Biol, 2020, 58(1):1199-1210. DOI:10.1080/13880209.2020.1839511.
[9] 王建明,孙静,齐峰,等.何首乌饮对大鼠睾丸间质细胞类固醇激素合成急性调节蛋白和细胞色素P450胆固醇侧链裂解酶蛋白表达的影响[J].解剖学报,2017, 48(1):30-36. DOI:10.16098/j.issn.0529-1356.2017.01.006.
[10] NIU S Y, CHEN J B, DUAN F, et al. Possible mechanism underlying the effect of Heshouwuyin, a tonifying kidney herb, on sperm quality in aging rats[J]. BMC Complement Altern Med, 2014, 14:250. DOI: 10.1186/1472-6882-14-250.
[11] 王小杰,牛嗣云,张艳青,等.何首乌饮对雄性衰老大鼠生殖功能的保护作用[J].时珍国医国药, 2011, 22(3):532-535.
[12] 李少华,牛双,董子怡,等.齐墩果酸对衰老大鼠睾丸间质细胞胰岛素/IGF1通路关键基因表达的影响[J].河北大学学报(自然科学版),2022,42(4):403-410.DOI:10.3969/j.issn.1000-1565.2022.04.010.
[13] 李少华,姜丽萍,牛佳瑶,等.二苯乙烯苷调控胰岛素/IGF-1信号通路延缓大鼠睾丸间质细胞衰老的作用机制[J].河北大学学报(自然科学版),2021,41(3):297-303.DOI:10.3969/j.issn.1000-1565.2021.03.012.
[14] 辛华,郑洪新,谢晚晴,等.“异病”(原发性骨质疏松症和老年性痴呆)“同证”(肾精亏虚证)患者差异表达基因的同源性分析[J].辽宁中医药大学学报,2019,21(9):80-86.
[15] 孙洁,周安方,周艳艳,等.肾虚对雄性小鼠及其雄性仔鼠精子DNA损伤的影响[J].中华中医药学刊, 2010, 28(5):1044-1047. DOI: 10.13193/j.archtcm.2010.05.150.sunj.023.
[16] 孙洁,周安方,周艳艳,等.肾精亏虚对雄性小鼠及其雄性仔鼠生育力的影响[J].中华男科学杂志, 2007, 13(8): 754-757.
[17] 回陈红,刘昊坤,杜云帆,等.衰老大鼠睾丸组织受何首乌饮调控差异表达基因的筛选[J].时珍国医国药, 2017, 28(7):1583-1586.
[18] KE Y, ZHAN L H, LU T T, et al. Polysaccharides of dendrobium officinale kimura amp; migo leaves protect against ethanol-induced gastric mucosal injury via the AMPK/mTOR signaling pathway in vitro and vivo[J]. Front Pharmacol, 2020, 11:526349. DOI: 10.3389/fphar.2020.526349.
[19] GE Y C, ZHOU M, CHEN C, et al. Role of AMPK mediated pathways in autophagy and aging[J]. Biochimie, 2022, 195:100-113. DOI: 10.1016/j.biochi.2021.11.008.
[20] WANG M, ZENG L, SU P, et al. Autophagy: a multifaceted player in the fate of sperm[J]. Hum Reprod Update, 2022, 28(2):200-231. DOI: 10.1093/humupd/dmab043.
[21] VARGAS J N S, HAMASAKI M, KAWABATA T, et al. The mechanisms and roles of selective autophagy in mammals[J]. Nat Rev Mol Cell Biol, 2023, 24(3):167-185. DOI: 10.1038/s41580-022-00542-2.
[22] YAN Q, ZHANG Y, WANG Q, et al. Autophagy: a double-edged sword in male reproduction[J]. Int J Mol Sci, 2022, 23(23):15273. DOI: 10.3390/ijms232315273.
[23] ZHANG J L, YE R R, GRUNBERGER J W, et al. Activation of autophagy by low-dose silica nanoparticles enhances testosterone secretion in leydig Cells[J]. Int J Mol Sci, 2022, 23(6):3104. DOI: 10.3390/ijms23063104.
[24] XU R F, WANG F, ZHANG Z H, et al. Diabetes-induced autophagy dysregulation engenders testicular impairment via oxidative stress[J]. Oxid Med Cell Longev, 2023, 2023(1):4365895. DOI: 10.1155/2023/4365895.
[25] MIDZAK A S, CHEN H L, PAPADOPOULOS V, et al. Leydig cell aging and the mechanisms of reduced testosterone synthesis[J]. Mol Cell Endocrinol, 2009, 299(1):23-31. DOI: 10.1016/j.mce.2008.07.016.
[26] FU G Q, DAI J, LI Z, et al. The role of STAT3/p53 and PI3K-Akt-mTOR signaling pathway on DEHP-induced reproductive toxicity in pubertal male rat[J]. Toxicol Appl Pharmacol, 2020, 404: 115151. DOI: 10.1016/j.taap.2020.115151.
[27] CAO W Y, LI J H, YANG K P, et al. An overview of autophagy: Mechanism, regulation and research progress[J]. Bull Cancer, 2021, 108(3):304-322. DOI: 10.1016/j.bulcan.2020.11.004.
[28] 郭凯华,高福禄,牛嗣云,等.何首乌饮对衰老大鼠睾丸组织细胞Rb/p53 信号转导通路的影响[J].解剖学报, 2010, 41(3):435-439.
[29] 李少华,姜丽萍,刘靓云,等.何首乌饮延缓大鼠睾丸间质细胞衰老与调控胰岛素/胰岛素样生长因子-1信号通路的关系[J].解剖学报,2020, 51(5):751-757. DOI: 10.16098/j.issn.0529-1356.2020.05.019.
[30] DASGUPTA B, SEIBEL W. Compound C/dorsomorphin: its use and misuse as an AMPK inhibitor[J]. Methods Mol Biol, 2018, 1732:195-202. DOI: 10.1007/978-1-4939-7598-3_12.
(责任编辑:梁俊红)

