敲低TMCO1对肝癌细胞增殖和侵袭的影响






摘 要:为探讨跨膜和卷曲螺旋结构域 1 (transmembrane and coiled-coil domains 1,TMCO1)对肝癌细胞的增殖和侵袭的影响,构建肝癌细胞HuH-7和Li-7的过表达和敲低TMCO1细胞模型,采用Transwell、细胞克隆、线粒体通透性转换孔(mPTP)探针、线粒体膜电位(JC-1)探针、Actin-Tracker Green-488染色、 Western blot和免疫共沉淀实验检测敲低TMCO1对肝癌细胞增殖、侵袭、线粒体功能、骨架重塑及VDAC1表达的影响.结果显示:敲低TMCO1可抑制肝癌细胞的增殖、侵袭,影响线粒体功能和骨架重塑,并下调VDAC1的表达.
关键词:肝癌细胞;TMCO1;VDAC1;mPTP;增殖
中图分类号:R735.7"" 文献标志码:A"" 文章编号:10001565(2024)06064310
Effects of TMCO1 knockdown on the proliferation, invasion of hepatocellular carcinoma cells
LENG Junzhi, LIU Di, WANG Genwang, LIU Kejun, JIN Dong, WANG Qi, HUI Yongfeng
(Department of Hepatobiliary Surgery,General Hospital of Ningxia Medical University, Yinchuan 750004,China)
Abstract: To explore the effects of transmembrane and coiled-coil domains 1 (TMCO1) knockdown on the proliferation and invasion of hepatocellular carcinoma cells, overexpression and knockdown cell models of TMCO1 in hepatocellular carcinoma cell lines HuH-7 and Li-7 were constructed. Transwell, colony formation, mitochondrial permeability transition pore (mPTP) probes, mitochondrial membrane potential (JC-1) probes, Actin-Tracker Green-488 staining, Western blotting and co-immunoprecipitation tests were used to detect the effects of TMCO1 knockdown on hepatocellular carcinoma cells proliferation, invasion, mitochondrial function, cytoskeletal remodeling, and VDAC1 expression. The results indicated that TMCO1 knockdown inhibited the proliferation and invasion of hepatocellular carcinoma cells, affected mitochondrial function and cytoskeletal remodeling, and downregulated VDAC1 expression.
Key words: hepatoma cells; TMCO1; VDAC1; mPTP; proliferation
收稿日期:20240522;修回日期:20240914
基金项目:
宁夏回族自治区重点研发计划项目(2021BEG03067);宁夏自然科学基金资助项目(2022AAC03545)
第一作者:冷君志(1987—),男,宁夏医科大学总医院主治医师,主要从事肝癌细胞转移机制研究.E-mail:lengjunzhi@163.com
通信作者:惠永峰(1977—),男,宁夏医科大学总医院主任医师,主要从事肝胆胰肿瘤机制及微创治疗的研究.E-mail:huiyf0951@163.com
原发性肝癌的早期误诊率高达40%,肝癌患者的平均生存期不足2年[1-2].肝癌早、中期治疗以手术为主,晚期主要为全身治疗.随着分子病理和靶向治疗技术取得显著成果[3],靶向治疗已成为新的辅助治疗方案,使晚期肝癌治疗取得了突破性进展[4-5],因此,寻找肝癌细胞转移中的关键基因成为靶向治疗的关键.
Ca2+作为细胞的第二信使,调控基因转录、细胞周期、细胞增殖等多种生理活动,Ca2+介导的信号通路在细胞增殖、细胞凋亡、基因转录和迁移的调节中至关重要[6-7],Ca2+浓度的异常升高可以激活癌细胞的活性,促进癌细胞的增殖和迁移[8].跨膜和卷曲螺旋结构域1(transmembrane and coiled-coil domains 1,TMCO1)又称内质网钙过载激活的Ca2+通道,是一种内质网跨膜蛋白,在维持Ca2+稳态中起着关键作用[9].TMCO1参与多种生物功能的调节[10],并与人类多种疾病有关,包括青光眼、畸形和肿瘤发生等[11-13].有研究报道显示,抑制TMCO1表达可显著抑制肺腺癌细胞的增殖和迁移能力,并影响细胞凋亡[14].文献[15]表明,TMCO1 在胶质瘤中过表达,上调TMCO1 可通过促进上皮间质转化 (EMT)诱导胶质瘤细胞迁移和侵袭,敲低TMCO1 可抑制 U87 和 U251 细胞的增殖并诱导细胞凋亡.然而,目前鲜见TMCO1与肝癌关系的相关研究报道.
电压依赖性阴离子通道蛋白 (voltage-dependent anion channel 1,VDAC1)是线粒体外膜上含量极为丰富的孔状蛋白,是形成线粒体和细胞质之间代谢物交换的共同途径,控制着线粒体代谢产物的进出,进而对调节线粒体Ca2+水平也至关重要[16].研究认为,VDAC1在内质网和线粒体Ca2+稳态调节机制中发挥着关键作用[17].乳腺癌研究中,敲低VDAC1抑制了乳腺癌细胞的增殖和迁移,促进了乳腺癌细胞的死亡[18].MCU 与 VDAC1 相互作用,MCU敲低抑制了VDAC1 过表达诱导的初级小脑颗粒神经元细胞死亡[19].在肝癌细胞研究中,VDAC1可介导线粒体膜通透性转换孔(mPTP)开放影响线粒体功能[20].TMCO1与VDAC1是否存在调节关系并不清楚.
本研究通过分析TMCO1对肝癌细胞增值、侵袭的影响,检测线粒体功能、骨架重塑及VDAC1表达的变化.表明TMCO1可通过调节线粒体膜电位水平及mPTP开放影响线粒体功能和细胞骨架,敲低TMCO1抑制肝癌细胞增殖和侵袭,这种作用可能与下调VDAC1表达有关.
1 材料与方法
1.1 材料
1.1.1 细胞培养及处理
肝癌细胞系 HuH-7和Li-7均购自中国科学院细胞库(https://www.cellbank.org.cn).HuH-7细胞培养于含10%(体积分数,下同)胎牛血清和1%青霉素/链霉素以及1% L-alanyl-L-glutamine和1% Sodium Pyruvate的DMEM培养液中;Li-7细胞培养于含10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养液中,所有细胞均在37 ℃、5%CO2恒温培养箱中培养.本实验分为4组,shRNA-NC组(敲低TMCO1的阴性对照),OE-NC组(转染过表达空载体),shRNA-TMCO1组(敲低TMCO1),OE-TMCO1组(转染TMCO1过表达质粒).
1.1.2 主要试剂
培养细胞用的胎牛血清、体积分数1%青霉素/链霉素、DMEM培养液和RPMI-1640购自美国Gibco公司;线粒体膜电位(货号:M8650)购自北京索莱宝科技有限公司;Lipofectamine 8000转染试剂(货号:C0533FT)、线粒体通透性转换孔(mPTP)检测试剂盒(货号:C2009S)、Actin-Tracker Green-488(货号:C2201S)均购自上海碧云天生物技术有限公司;Transwell细胞培养小室购自美国Corning公司;TMCO1 (货号:27757-1-AP)和VDAC1(货号:55259-1-AP)均购自Proteintech公司;Western blot的二抗购自北京中杉金桥公司;TMCO1慢病毒及其阴性对照以及TMCO1过表达质粒均由上海生工生物工程股份有限公司设计合成;BCA 蛋白定量试剂盒(货号:PT0001)购自北京雷根生物技术有限公司.
1.2 方法
1.2.1 TMCO1过表达质粒和沉默序列模型的构建
上海生工生物工程股份有限公司合成TMCO1沉默序列(shRNA)和阴性对照: shRNA-TMCO1#2(TRCN0000062125:5’-CCCTAATGGGAATGTTCAATT-3’),shRNA-NC(TRCN0000072243:5’-CTTCGAAATGTCCGTTCGGTT-3’).将TMCO1全长克隆到pcDNA3.1载体上,以空载体(OE-NC)作为对照.Control组为正常培养细胞,没有进行转染.
1.2.2 线粒体膜电位实验
将HUH-7和Li-7细胞接种于6孔板,加入1 mL细胞培养液和提前配制好的1 mL JC-1 染色工作液,混匀后在细胞培养箱中37 ℃孵育20 min,在孵育期间根据说明书配置适量的JC-1染色缓冲液.孵育结束后,吸除上清, 使用 JC-1染色缓冲液洗涤细胞.在荧光显微镜下观察.绿色荧光表明线粒体膜电位下降,红色荧光表明线粒体膜电位正常,通过红色荧光强度和绿色荧光强度的比值来表示线粒体膜电位.并用IPP6.0软件进行分析.
1.2.3 细胞克隆
Li-7和HuH-7细胞接种于3.5 cm板中,然后按照各组要求,将处理后的细胞培养15 d至形成可见菌落.去除上清液,用PBS洗涤细胞2次.随后,用质量分数4%多聚甲醛在室温下固定细胞15 min,用质量分数0.1%结晶紫在室温下放置20 min,用PBS洗涤2次,风干.拍照并计数.
1.2.4 线粒体通透性转换孔(mPTP)检测
取各组处理后的HuH-7和Li-7细胞,先用PBS洗涤2次,加入提前配置好的荧光探针钙黄绿素乙酰甲酯(calcein acetoxymethyl ester,Calcein AM)染色液及荧光淬灭工作液,Ionomycin作为对照.在37 ℃避光孵育40 min,孵育结束后,更换为37 ℃预热的培养液,在37 ℃避光孵育30 min.用PBS清洗2~3次,荧光显微镜下观察,并拍照.
1.2.5 Transwell实验
Transwell实验检测细胞的侵袭能力,在Transwell上室中预涂50 μL Matrigel基质胶,然后在室温下进行风干.将细胞在无血清培养基中饥饿24 h,用无血清培养基重悬至细胞浓度1×105个/mL.在上室加入200 μL细胞悬液,下室加入600 μL的培养液,在37 ℃,体积分数5%CO2常规培养48 h.孵育结束后,用质量分数4%多聚甲醛溶液固定10 min,结晶紫染色20 min,随机取中央及四周5个视野计数.
1.2.6 Western blot实验
从细胞中提取蛋白质,通过BCA 蛋白质,抗体与抗体稀释液的体积比,并利用BCA试剂盒进行蛋白定量.用十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)进行电泳,分离蛋白质至PVDF膜上.将膜与质量分数5%脱脂奶粉封闭2 h,加入一抗TMCO1 (1∶500)、VDAC1(1∶2000),在4 ℃下分别孵育过夜.第2天加入山羊抗兔IgG辣根酶(1∶5 000)标记的二抗,室温孵育1 h,再用TBST洗膜3次,使用ECL试剂盒显影,利用Image-J软件分析蛋白质的灰度值.
1.2.7 细胞骨架
按照Actin-Tracker Green-488的说明书进行操作.Li-7和HuH-7细胞(5×105个/孔)进行爬片处理.室温下,用质量分数3.7%甲醛在PBS中固定20 min,然后与Actin-Tracker Green-488溶液孵育30 min,荧光显微镜下观察.最后用DAPI染色液在室温下重新染色5 min.使用Image-Pro Plus Software 6.0软件进行定量.
1.2.8 免疫共沉淀
先将细胞裂解,并在4 ℃下以13 000g离心20 min,收集上清液,50 μL作为Input阳性对照组,2 μL用于测定浓度,其余上清液备用.分别使用3 μgTMCO1抗体和VDAC1抗体,并使用相应量的正常IgG作为阴性对照组.加入100 μL Protein A+G琼脂糖珠,并在4 ℃下旋转2 h,然后在4 ℃下,1 000g离心5 min,收集沉淀物.将细胞裂解物分别加入抗体或正常IgG的Protein A+G琼脂糖珠中,在4 ℃下旋转过夜,使蛋白与抗体结合.将样品在4 ℃下1 000g离心5 min,除去上清液.将沉淀物用PBS洗涤4次,每次1 mL.在沉淀中加入负载缓冲液,将细胞裂解后的沉淀物和50 μL上清液煮沸5 min.再1 000g离心5 min,收集上清液,用于蛋白质印迹检测.
1.3 统计学分析
采用 SPSS17.0 软件分析处理,所有数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较采用独立样本t检验.以P<0.05表示差异有统计学意义.
2 结果
2.1 Western blot法检测TMCO1敲低和过表达效果及TMCO1对肝癌细胞侵袭的影响
构建并验证3条shRNA-TMCO1(shRNA-TMCO1#1、shRNA-TMCO1#2、shRNA -TMCO1#3)序列转染肝癌细胞HuH-7和Li-7效果,结果表明:TMCO1过表达组与OE-NC相比,转染效果显著(P<0.001,图1a-d);与shRNA-NC组相比,shRNA-TMCO1#2转染效果较为显著(P<0.001,图1e-h),后续作为实验序列.Tanswell侵袭实验结果显示:与OE-NC组相比,过表达TMCO1(OE-TMCO1)可促进肝癌细胞侵袭能力;敲低TMCO1(shRNA-TMCO1)显著抑制肝癌细胞侵袭能力(P<0.001图1i-k).表明TMCO1可调节肝癌细胞的侵袭能力.
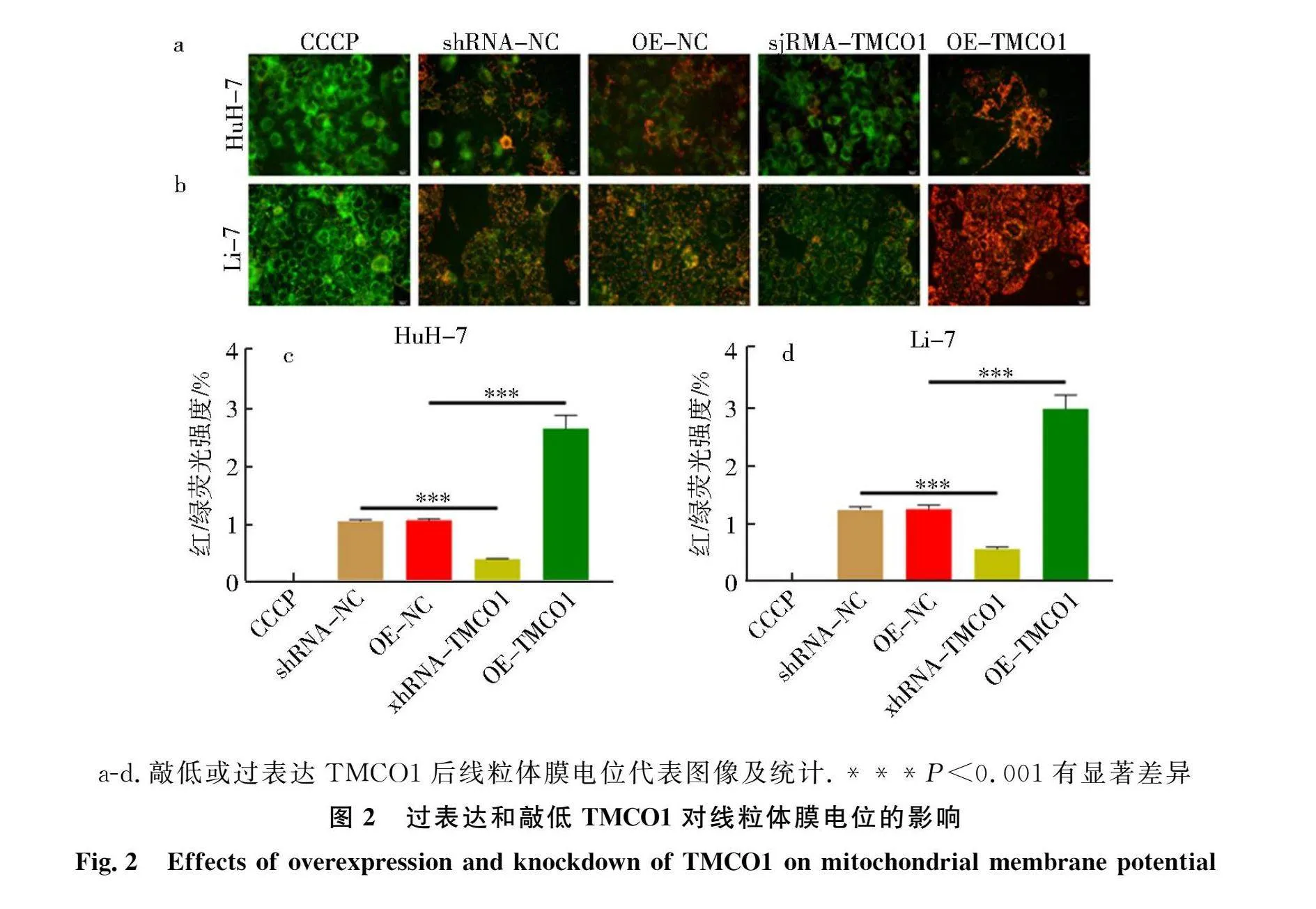
2.2 TMCO1对线粒体膜电位的影响
线粒体膜电位(JC-1)实验结果如图2所示:与OE-NC组相比,过表达TMCO1可增强红色荧光强度,减弱绿色荧光强度,表明过表达TMCO1可显著上调肝癌细胞线粒体膜电位水平(P<0.001);与shRNA-NC组相比,敲低TMCO1可降低红色荧光强度,增强绿色荧光强度,表明敲低TMCO1显著降低肝癌细胞线粒体膜电位水平(P<0.001).CCCP作为线粒体膜电位缺失的对照组.
2.3 TMCO1调节mPTP的开放状态
mPTP荧光探针实验结果如图3所示:过表达TMCO1可显著抑制肝癌细胞mPTP开放(绿色荧光增强);敲低TMCO1可显著促进mPTP开放(绿色荧光降低)(P<0.001).表明TMCO1可调节mPTP的开放和关闭,进一步说明TMCO1可影响线粒体功能.Calcein AM作为mPTP关闭的对照组,而lonomycin作为mPTP开放的对照组.
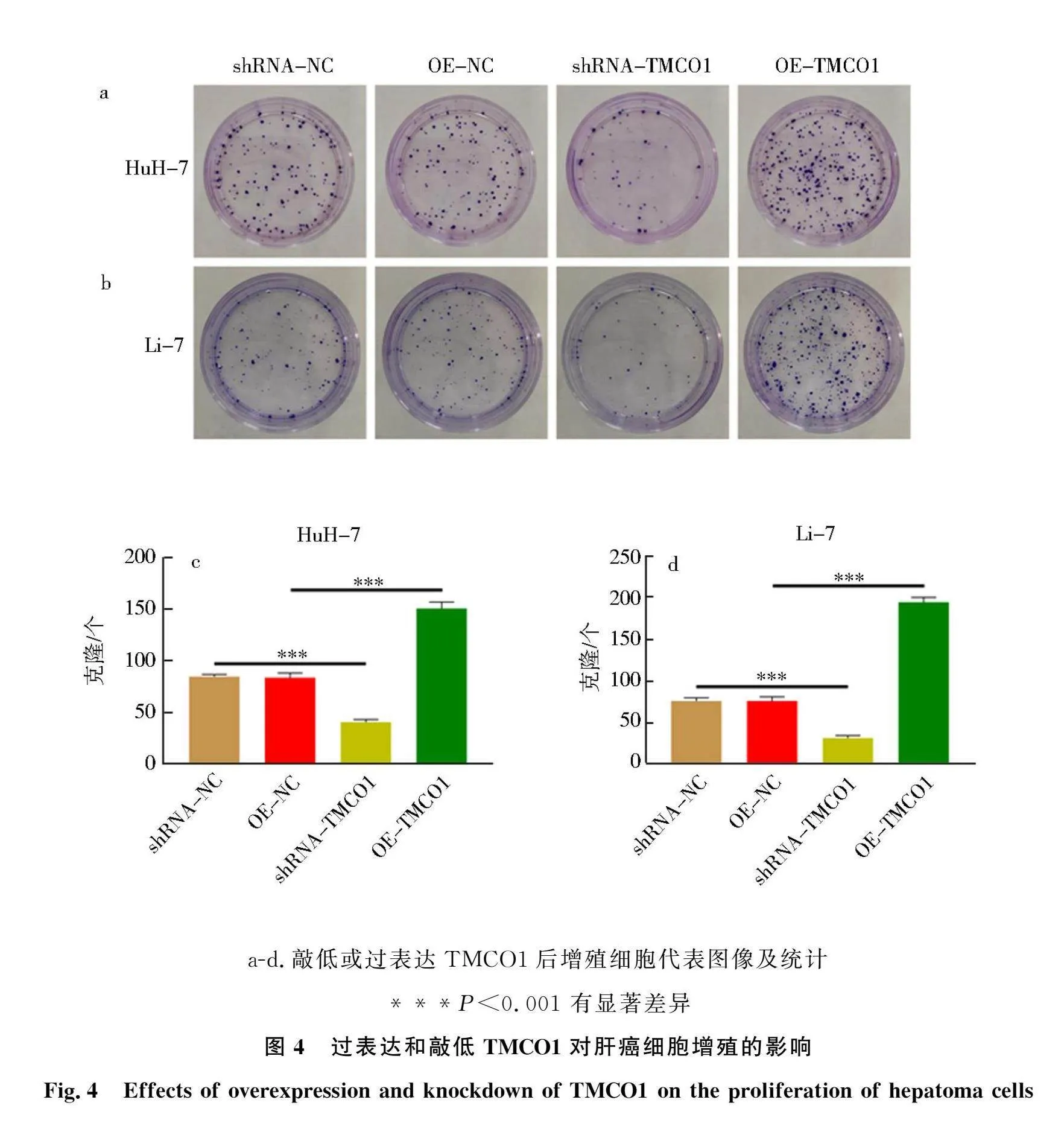
2.4 TMCO1对肝癌细胞增殖的影响
细胞克隆实验结果如图4所示:与OE-NC组相比,过表达TMCO1组细胞集落形成数量增加;相反,敲低TMCO1,细胞集落数量显著减少,与shRNA-NC组相比有统计学差异(P<0.001).表明TMCO1可调节肝癌细胞的增殖能力.
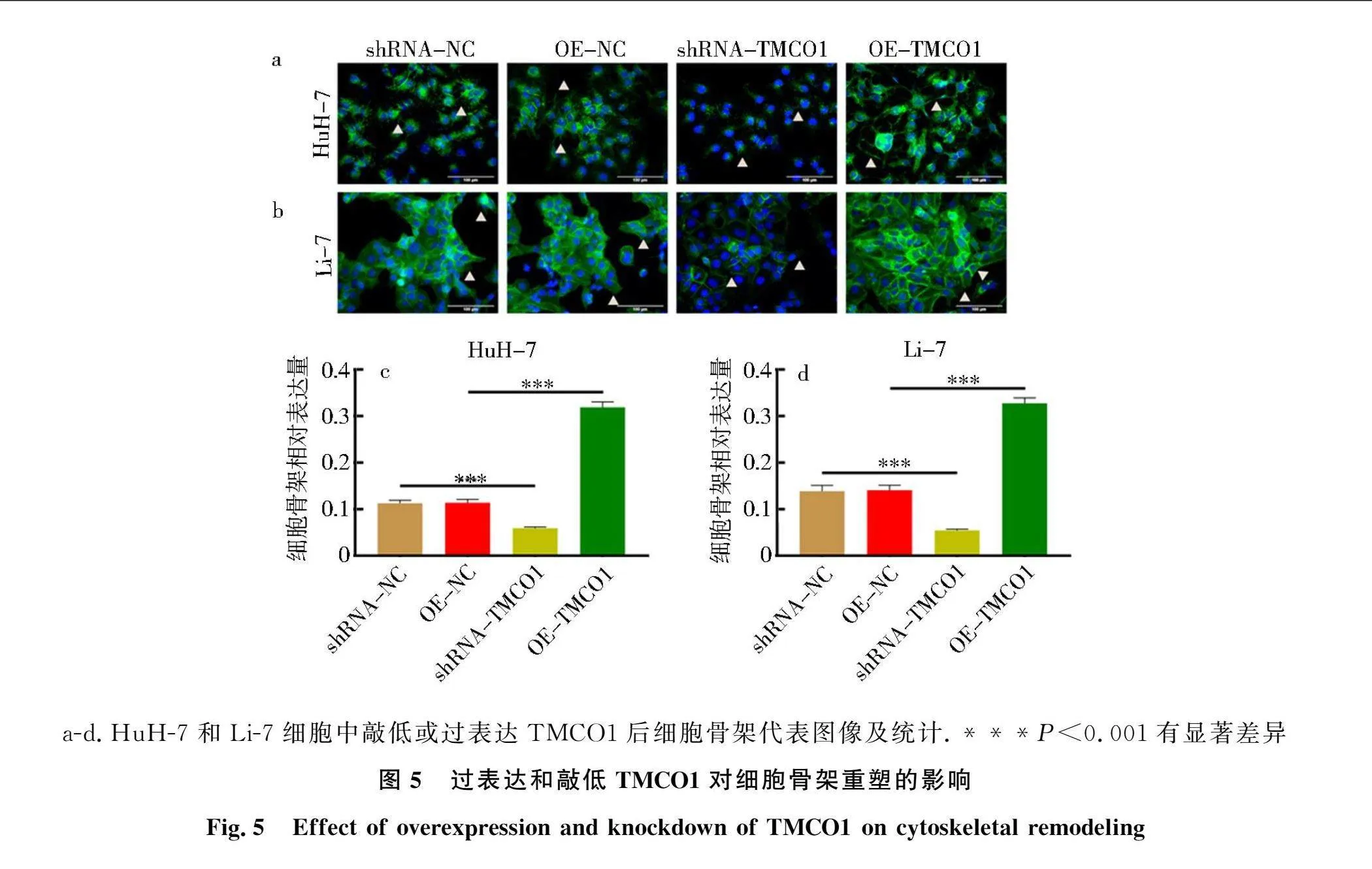
2.5 TMCO1对细胞骨架的影响
使用Actin-Tracker Green-488荧光探针检测,结果如图5所示:过表达TMCO1显著促进肝癌细胞微丝(绿色)增多和伪足形成;相反,敲低TMCO1显著抑制肝癌细胞微丝荧光强度和伪足形成(P<0.001).表明TMCO1可调节肝癌细胞骨架重塑.
2.6 TMCO1对VDAC1蛋白表达的影响
Western blot实验结果如图6所示:过表达TMCO1显著上调VDAC1的蛋白表达水平;相反,敲低TMCO1显著降低VDAC1的蛋白表达(P<0.001,图6a-f).此外,免疫共沉淀结果显示,TMCO1与VDAC1存在相互作用(图6g、h).表明TMCO1可调节线粒体外膜蛋白VDAC1的表达,推测TMCO1通过调节VDAC1影响线粒体功能.
3 讨论与结论
探索和阐述肝癌进展中的关键基因作用是靶向治疗的关键.Ca2+稳态调节机制一直是癌症研究的热点,尤其是内质网与线粒体之间的作用蛋白调节机制,有望成为靶向治疗的关键点[21].本研究中,通过构建过表达和敲低TMCO1细胞模型,表明TMCO1可通过介导线粒体膜电位和mPTP开放影响线粒体功能;TMCO1可调节细胞骨架重塑、细胞增殖和细胞侵袭能力.上述实验表明,敲低TMCO1可抑制肝癌细胞增殖和侵袭,这可能与下调VDAC1表达有关.
在肿瘤细胞增殖过程中,Ca2+稳态与肿瘤细胞增殖以及肿瘤的发生发展有关,尤其是内质网Ca2+稳态可通过影响内质网蛋白质合成和膜脂质生物发生,直接参与细胞增殖[16].在胶质瘤研究中,TMCO1可促进U87和U251细胞上皮-间质转化(EMT)诱导细胞迁移和侵袭,然而,敲低TMCO1可发挥抑制作用[15].本研究通过基因修饰TMCO1发现,TMCO1可调节HuH-7和Li-7细胞的增殖能力,同时观察到敲低TMCO1可显著抑制肝癌细胞的侵袭能力,该结果与齐顺利等[22]在结肠癌细胞中的研究结果相似.本实验发现,TMCO1可通过调节线粒体膜电位水平和线粒体通透性转换孔(mPTP)开放,影响肝癌细胞线粒体功能.揭示了TMCO1可能参与内质网-线粒体轴的调节作用机制.然而,本研究并没有关注内质网应激的改变,主要关注线粒体相关内质网膜(MAM)结构,因为内质网-线粒体轴被认为是细胞器间系统的代表,参与多种细胞内信号通路,并增强癌细胞对抗癌药物敏感性和调节免疫细胞活性[23].
VDAC1位于线粒体外膜,控制着大多数阴离子呼吸底物、ATP、ADP和少部分阳离子通量,维持线粒体功能[24].在胃癌细胞中BAP31通过影响VDAC1的寡聚化和泛素化调控细胞的增殖和铁死亡[25].乳腺癌研究中,通过抑制VDAC1的泛素化降解,促进线粒体代谢,加速乳腺癌的发展[26].在肝癌细胞中,利用小分子抑制剂抑制VDAC1表达可降低肝癌细胞线粒体膜电位水平并抑制细胞增殖[27].结肠癌研究中,VDAC1表达与细胞骨架和细胞周期相关[28].综上所述,VDAC1通过影响线粒体功能发挥抗癌作用.本实验中,TMCO1可调节肝癌细胞VDAC1表达,与此同时,TMCO1影响肝癌细胞骨架重塑.本研究还采用免疫共沉淀方法验证了TMCO1与VDAC1之间的相互作用关系,进一步证实这种作用可能与调节VDAC1表达密切相关.并推测TMCO1可能是VDAC1的上游调节因子,并且其通过调节VDAC1表达影响线粒体功能.
VDAC1参与mPTP的合成,mPTP是线粒体外膜上的一个关键孔,参与代谢产物的信号转导和转运[29-30] .在非肿瘤研究中,VDAC1通过调控mPTP的开闭治疗帕金森病[31].丹参酮ⅡA通过VDAC1调节mPTP 开放改善缺氧/复氧对心肌细胞线粒体的损伤[32].在卵巢癌耐药机制研究中,GRP75通过促进内质网肌醇1,4,5-三磷酸受体(IP3R)和VDAC1之间相互作用形成复合物,是促进MAM形成的关键系链,敲低GRP75破坏系链导致MAM完整性降低,减少了内质网向线粒体Ca2+转移,促进mPTP开放,加速了顺铂诱导的线粒体功能障碍,增强了顺铂触发的卵巢癌细胞凋亡[33].本实验中TMCO1可以调节肝癌细胞mPTP开放和关闭,并且这种作用与调控VDAC1表达相反,这可能是除了IP3R与VDAC1作用外,又一内质网蛋白与VDAC1之间相互作用且影响癌细胞进展的作用路径.由此推测,TMCO1可能通过线粒体外膜基因VDAC1表达介导mPTP开放,影响线粒体相关内质网膜结构的完整性.这为研究线粒体相关内质网膜结构提供了一些参考.当然,未来将通过膜片钳实验以及拯救实验进一步验证.
综上,实验证明了TMCO1通过介导线粒体膜电位、mPTP开放影响线粒体功能和细胞骨架重构.敲低TMCO1可下调VDAC1表达抑制肝癌细胞增殖和侵袭.这为肝癌开发靶点治疗提供了新的参考.
参 考 文 献:
[1] CHEN W, CHIANG C L, DAWSON L A. Efficacy and safety of radiotherapy for primary liver cancer[J]. Chin Clin Oncol, 2021, 10(1): 9. DOI: 10.21037/cco-20-89.
[2] ZHAO B, LV X C, ZHAO X Q, et al. Tumor-promoting actions of HNRNP A1 in HCC are associated with cell cycle, mitochondrial dynamics, and necroptosis[J]. Int J Mol Sci, 2022, 23(18): 10209. DOI: 10.3390/ijms231810209.
[3] YUAN D Y, CHEN J, HAO Q Y, et al. Methyltransferase-like 3 aggravates HCC development via mediating N6-methyladenosine of ubiquitin-specific protease 7[J]. J Oncol, 2022, 2022: 6167832. DOI: 10.1155/2022/6167832.
[4] NIU M K, YI M, LI N, et al. Advances of targeted therapy for hepatocellular carcinoma[J]. Front Oncol, 2021, 11: 719896. DOI: 10.3389/fonc.2021.719896.
[5] YANG C, ZHANG H L, ZHANG L M, et al. Evolving therapeutic landscape of advanced hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2023, 20(4): 203-222.DOI: 10.1038/s41575-022-00704-9.
[6] BERRIDGE M J, LIPP P, BOOTMAN M D. The versatility and universality of calcium signalling[J]. Nat Rev Mol Cell Biol, 2000, 1(1): 11-21. DOI: 10.1038/35036035.
[7] VAZ C V, RODRIGUES D B, SOCORRO S, et al. Effect of extracellular calcium on regucalcin expression and cell viability in neoplastic and non-neoplastic human prostate cells[J]. Biochim Biophys Acta, 2015, 1853(10 Pt A): 2621-2628. DOI: 10.1016/j.bbamcr.2015.07.006.
[8] WANG Q C, ZHENG Q X, TAN H Y, et al. TMCO1 is an ER Ca(2+) load-activated Ca(2+) channel[J]. Cell, 2016, 165(6): 1454-1466. DOI: 10.1016/j.cell.2016.04.051.
[9] PAREKH A B. Store-operated CRAC channels: function in health and disease[J]. Nat Rev Drug Discov, 2010, 9(5): 399-410.DOI: 10.1038/nrd3136.
[10] SUN Z S, ZHANG H, WANG X, et al. TMCO1 is essential for ovarian follicle development by regulating ER Ca2+ store of granulosa cells[J]. Cell Death Differ,2018, 25(9):1686-1701. DOI: 10.1038/s41418-018-0067-x.
[11] XIN B Z, PUFFENBERGER E G, TURBEN S, et al. Homozygous frameshift mutation in TMCO1 causes a syndrome with craniofacial dysmorphism, skeletal anomalies, and mental retardation[J]. Proc Natl Acad Sci USA, 2010, 107(1): 258-263. DOI: 10.1073/pnas.0908457107.
[12] KONDKAR A A, MOUSA A, AZAD T A, et al. Polymorphism rs7555523 in transmembrane and coiled-coil domain 1 (TMCO1) is not a risk factor for primary open angle glaucoma in a Saudi cohort[J]. J Negat Results Biomed, 2016, 15(1): 17. DOI: 10.1186/s12952-016-0060-1.
[13] GAO L,YE Z, LIU J H, et al. TMCO1 expression promotes cell proliferation and induces epithelial-mesenchymal transformation in human gliomas[J]. Med Oncol, 2022, 39(5): 90. DOI: 10.1007/s12032-022-01687-y.
[14] YANG C, WANG Y, BAI J Q, et al. Mechanism of transmembrane and coiled-coil domain 1 in the regulation of proliferation and migration of A549 cells[J]. Oncol Lett, 2020, 20(5): 159. DOI: 10.3892/ol.2020.12020.
[15] SIGAL M, LOGAN C Y, KAPALCZYNSKA M, et al. Stromal R-spondin orchestrates gastric epithelial stem cells and gland homeostasis[J]. Nature, 2017, 548(7668): 451-455. DOI: 10.1038/nature23642.
[16] CHEN Y F, CHEN Y T, CHIU W T, et al. Remodeling of calcium signaling in tumor progression[J]. J Biomed Sci, 2013, 20(1): 23. DOI: 10.1186/1423-0127-20-23.
[17] ZHANG C Y, LIU B W, SHENG J X, et al. Potential targets for the treatment of MI: GRP75-mediated Ca2+transfer in MAM[J]. Eur J Pharmacol, 2024, 971: 176530. DOI: 10.1016/j.ejphar.2024.176530.
[18] ZHANG F, QI C X, YAO Z P, et al. Identification and validation of a novel necroptosis-related molecular signature to evaluate prognosis and immune features in breast cancer[J]. Apoptosis, 2023, 28(11/12): 1628-1645. DOI: 10.1007/s10495-023-01887-5.
[19] LIAO Y J, HAO Y M, CHEN H, et al. Mitochondrial calcium uniporter protein MCU is involved in oxidative stress-induced cell death[J]. Protein Cell, 2015, 6(6): 434-442. DOI: 10.1007/s13238-015-0144-6.
[20] WO L L, ZHANG X, MA C N, et al. LncRNA HABON promoted liver cancer cells survival under hypoxia by inhibiting mPTP opening[J]. Cell Death Discov, 2022, 8(1): 171. DOI: 10.1038/s41420-022-00917-6.
[21] BASSOT A, CHEN J S,TAKAHASHI-YAMASHIRO K, et al. The endoplasmic reticulum kinase PERK interacts with the oxidoreductase ERO1 to metabolically adapt mitochondria[J]. Cell Rep, 2023, 42(1): 111899. DOI: 10.1016/j.celrep.2022.111899.
[22] 齐顺利,赵团结,于晓倩,等.结肠癌中TMCO1、CALR的表达及对转移的影响[J].临床与实验病理学杂志, 2021, 37(12): 1411-1420. DOI: 10.13315/j.cnki.cjcep.2021.12.002.
[23] AN G, PARK J, SONG J, et al. Relevance of the endoplasmic reticulum-mitochondria axis in cancer diagnosis and therapy[J]. Exp Mol Med, 2024, 56(1): 40-50. DOI: 10.1038/s12276-023-01137-3.
[24] WU N N, WANG L F, WANG L, et al. Site-specific ubiquitination of VDAC1 restricts its oligomerization and mitochondrial DNA release in liver fibrosis[J]. Exp Mol Med, 2023, 55(1): 269-280. DOI: 10.1038/s12276-022-00923-9.
[25] ZHOU Q Q, LIU T F, QIAN W J, et al. HNF4A-BAP31-VDAC1 axis synchronously regulates cell proliferation and ferroptosis in gastric cancer[J]. Cell Death Dis, 2023, 14(6): 356. DOI: 10.1038/s41419-023-05868-z.
[26] HUANG L,WEI B, ZHAO Y R, et al. DYNLT1 promotes mitochondrial metabolism to fuel breast cancer development by inhibiting ubiquitination degradation of VDAC1[J]. Mol Med, 2023, 29(1): 72. DOI: 10.1186/s10020-023-00663-0.
[27] HESLOP K A, BURGER P, KAPPLER C, et al. Small molecules targeting the NADH-binding pocket of VDAC modulate mitochondrial metabolism in hepatocarcinoma cells[J]. Biomed Pharmacother, 2022, 150: 112928. DOI: 10.1016/j.biopha.2022.112928.
[28] FREITAS S, MARTINS R, COSTA M, et al. Hierridin B isolated from a marine cyanobacterium alters VDAC1, mitochondrial activity, and cell cycle genes on HT-29 colon adenocarcinoma cells[J]. Mar Drugs, 2016, 14(9): 158. DOI: 10.3390/md14090158.
[29] ZHOU H, ZHANG Y, HU S Y, et al. Melatonin protects cardiac microvasculature against ischemia/reperfusion injury via suppression of mitochondrial fission-VDAC1-HK2-mPTP-mitophagy axis[J]. J Pineal Res, 2017, 63(1): e12413. DOI: 10.1111/jpi.12413.
[30] JIANG L,WANG H, CHEN G B, et al. WDR26/MIP2 interacts with VDAC1 and regulates VDAC1 expression levels in H9c2 cells[J]. Free Radic Biol Med, 2018, 117: 58-65. DOI: 10.1016/j.freeradbiomed.2017.12.015.
[31] HE Y J, WANG W J, YANG T, et al. The potential role of voltage-dependent anion channel in the treatment of Parkinson’s disease[J]. Oxid Med Cell Longev, 2022, 2022: 4665530. DOI: 10.1155/2022/4665530.
[32] HU T, ZOU H X, LE S Y, et al. Tanshinone IIA confers protection against myocardial ischemia/reperfusion injury by inhibiting ferroptosis and apoptosis via VDAC1[J]. Int J Mol Med, 2023, 52(5): 109. DOI: 10.3892/ijmm.2023.5312.
[33] LI J, QI F Z, SU H S, et al. GRP75-faciliated mitochondria-associated ER membrane (MAM) integrity controls cisplatin-resistance in ovarian cancer patients[J]. Int J Biol Sci, 2022, 18(7): 2914-2931. DOI: 10.7150/ijbs.71571.
(责任编辑:梁俊红)

