柴胡皂苷诱导人卵巢癌SKOV3细胞凋亡的作用机制
刘炼++张丽芳++方志南+++王曦烨

[摘要] 目的 探讨柴胡皂苷对卵巢癌SKOV3细胞增殖、自噬及凋亡的影响。 方法 将SKOV3细胞分为对照组(正常培养SKOV3细胞)、低剂量组(SKOV3细胞+10 μmol/L柴胡皂苷)和高剂量组(SKOV3细胞+20 μmol/L柴胡皂苷)进行培养。采用四甲基偶氮唑蓝(MTT)法检测各组细胞24、48、72 h细胞增殖情况;采用流式细胞仪检测各组细胞凋亡情况;采用酶联免疫吸附法(ELISA)检测各组细胞中Bcl-2、Bax和Caspase-3表达情况;采用Western blot技术检测各组细胞LC3-Ⅰ、LC3-Ⅱ及Beclin-l表达情况。 结果 与对照组比较,低剂量组和高剂量组可抑制SKOV3细胞生长并促进凋亡(P < 0.05);柴胡皂苷干预治疗SKOV3细胞后,细胞中Bax/Bcl-2比值升高,Caspase-3表达增多(P < 0.05);柴胡皂苷可使SKOV3细胞中LC3-Ⅰ/LC3-Ⅱ比值降低,Beclin-l表达升高,差异有统计学意义(P < 0.05)。 结论 柴胡皂苷可通过增强卵巢癌细胞自噬强度,导致细胞凋亡,从而达到抑制人卵巢癌SKOV3细胞生长的作用。
[关键词] 柴胡皂苷;卵巢癌;SKOV3细胞;自噬;凋亡
[中图分类号] R329 [文献标识码] A [文章编号] 1673-7210(2017)01(b)-0025-04
Study on the apoptosis of ovarian cancer SKOV3 cells induced by saikosaponin
LIU Lian1 ZHANG Lifang1 FANG Zhinan1 WANG Xiye2
1.Department of Obstetrics and Gynecology, Hubei Space Hospital, Hubei Province, Xiaogan 432100, China; 2.Key Laboratory of Natural Product Chemistry and Functional Molecular Synthetic Autonomous Region, Inner Mongolia University for the Nationalities, Inner Mongolia Autonomous Region, Tongliao 028000, China
[Abstract] Objective To investigate the effects of saikosaponin on proliferation, autophagy and apoptosis in ovarian cancer SKOV3 cells. Methods The SKOV3 cells were divided into control group (normal cultured SKOV3 cells), low dose group (SKOV3 cells+10 μmol/L saikosaponin) and high dose group (SKOV3 cells + 20 μmol/L saikosaponin) and cultured. The proliferation of cells in each group was detected by four methyl AZO (MTT) method at 24, 48, 72 h; the apoptosis of cells was measured by flow cytometry; the expression of Bcl-2, Bax and Caspase-3 were detected by ELISA method; the expression of LC3-Ⅰ, LC3-Ⅱ and Beclin-l were analyzed by Western blot method. Results Compared with the control group, the proliferation of SKOV3 cells were decreased and the apoptosis rate of SKOV3 cells were promoted in the low dose group and high dose group (P < 0.05). After intervention of SKOV3 cells with saikosaponin, the Bax/Bcl-2 ratio were increased and the expression of Caspase-3 were also increased (P < 0.05); the LC3-I/LC3-II ratio were decreased, the expression of Beclin-l were increased, with statistically significant difference (P < 0.05). Conclusion Saikosaponin can inhibit the growth of SKOV3 cells, enhance the autophagy intensity of ovarian cancer cells and lead to cell apoptosis.
[Key words] Saikosaponin; Ovarian cancer; SKOV3 cells; Autophagy; Apoptosis
卵巢癌是婦科常见的恶性疾病,占妇科癌症的20%,5年生存率仅为30%,死亡率较高[1]。卵巢癌临床症状多表现为绝经后阴道出血,目前多以手术、化疗治疗为主,但效果并不理想;因此,寻找治疗卵巢癌的有效药物是目前亟待解决的问题。有研究表明,中药柴胡中的有效成分柴胡皂苷可干扰肿瘤细胞S期DNA合成及蛋白质代谢的作用,明显抑制肿瘤细胞增殖[2]。本团队提出柴胡皂苷可能通过影响卵巢癌SKOV3细胞自噬相关蛋白,从打破卵巢癌细胞凋亡/抗凋亡平衡,进而影响卵巢癌细胞增殖的科学假说;并应用不同浓度的柴胡皂苷干预卵巢癌SKOV3细胞后,观察自噬标志物LC3-Ⅰ、LC3-Ⅱ及Beclin-l的表达及对凋亡的影响,为使用中药提取物柴胡皂苷治疗卵巢癌提供理论依据。
1 资料与方法
1.1 一般资料
①柴胡皂苷(内蒙古民族大学天然产物化学及功能分子合成内蒙古自治区重点实验室);②SKOV3细胞(ATCC公司,美国);③光学显微镜(Olympus,日本);④一氧化氮检测仪(NO-501,IMN,日本);⑤水平摇床(WD-9405B,六一公司,北京);⑥anti-LC3-Ⅰ、anti-LC3-Ⅱ、anti-Beclin-l、GAPDH内参抗体(ABCAM公司);⑦Annexin V细胞凋亡试剂盒(SIGMA,美国);⑧Bcl-2、Bax和Caspase-3 ELISA试剂盒(SIGMA,美国);⑨RPMI 1640(GIBCO,美国)。
1.2 细胞培养与分组
将SKOV3细胞加入到10%灭活小牛血清的MEM培养液中,于37℃,5%体积分数CO2饱和湿度的培养箱中贴壁生长,每2~3天传代1次,待细胞培养至对数生长期后,经过0.25%胰酶消化后,过滤成单细胞悬浊液[3]。将细胞悬浊液以5×104/孔的密度接种于96孔培养板中,每孔100 μL培养基,细胞数5×103个。将细胞分为对照组(正常培养SKOV3细胞)、低剂量组(SKOV3细胞+10 μmol/L柴胡皂苷培养30 min)和高剂量组(SKOV3细胞+20 μmol/L柴胡皂苷培养30 min)。
1.3 观察指标
1.3.1 细胞增殖率
实验前用台盼蓝拒染法确认SKOV3细胞拒染率在95%以上,调整细胞数为4×107/L,取200 μL接种于96孔板中(每组细胞5个复孔),設对照组、空白载体组、实验组,培养24、48、72 h后,每孔加入5 g/L四甲基偶氮唑蓝(MTT)20 μL,继续培养4 h后去上清,逐一加入DMSO 100 μL后震荡混匀,待蓝色晶体完全溶解反应后,应用酶标仪测定570 nm 处的吸光度值(OD值)[4]。抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.3.2细胞凋亡率
分别收集72 h培养的SKOV3细胞培养液,经消化、PBS冲洗、悬浮、300目尼龙网过滤细胞后加入300 μL Binding Buffer悬浊细胞,加入5 μL Annexin V-FITC混合,再加入10 μL Propidium Iodide并充分混匀;常温下避光反应20 min;采用流式细胞仪检测并应用软件分析结果[5]。
1.3.3 Bcl-2、Bax及Caspase-3表达
采用酶联免疫吸附法(ELISA)检测Bcl-2、Bax及Caspase-3的表达,严格按照说明书操作[6],具体步骤如下:①配制标准品液;②计算标准曲线;③加样;④洗板;⑤孵育;⑥洗板;⑦暗反应;⑧计算OD值;⑨计算结果。
1.3.4 LC3-Ⅰ、LC3-Ⅱ及Beclin-l表达
Western blot检测步骤:①蛋白质抽提;②蛋白质定量;③SDS-PAGE;④转印至PVDF膜;⑤封闭;⑥孵育一抗;⑦孵育二抗;⑧ECL底物发光;⑨图像保存。普通抗体的封闭液、一抗孵育液、二抗孵育液为5%脱脂奶粉溶液。检测各组细胞中LC3-Ⅰ、LC3-Ⅱ及Beclin-l的表达[7]。
1.4 统计学方法
采用SPSS17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两两比较采用t检验,多组之间两两比较采用q检验,以P < 0.05为差异有统计学意义。
2 结果
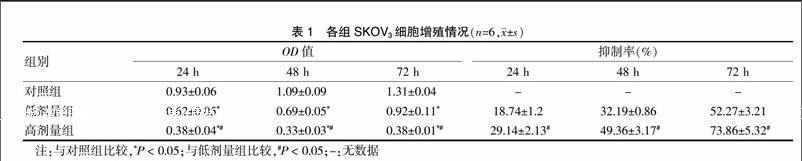
2.1 各组SKOV3细胞增殖情况
与对照组比较,低、高剂量组均对SKOV3细胞有抑制生长作用(P < 0.05);与低剂量组相比较,高剂量组对SKOV3细胞生长抑制率更高(P < 0.05)。见表1。
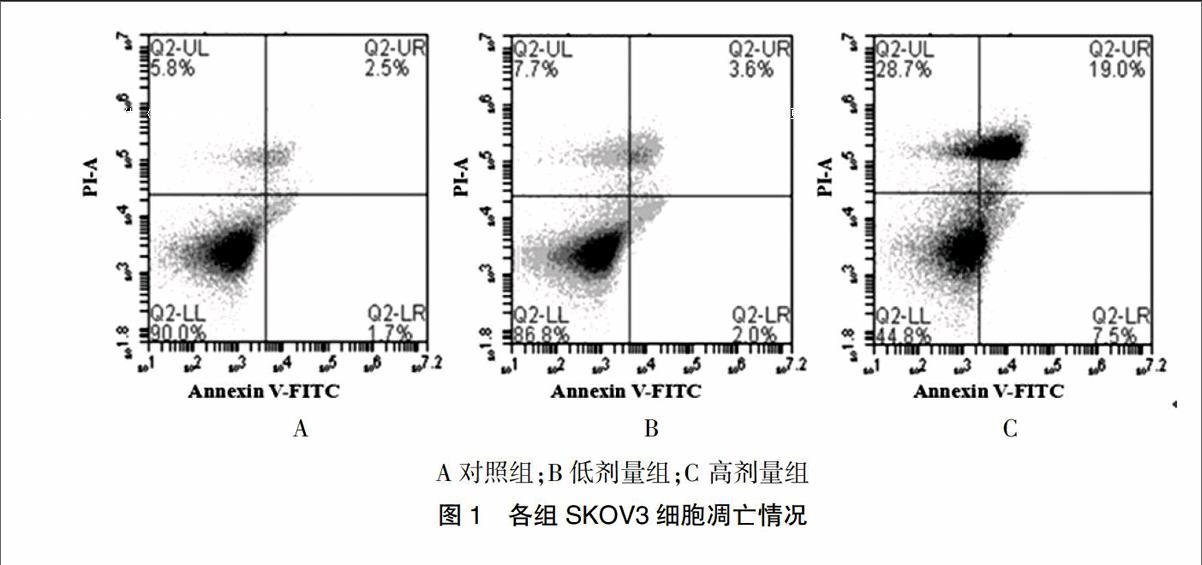
2.2 各组SKOV3细胞凋亡情况
与对照组细胞凋亡率(2.98±0.31)%相比,低剂量组细胞凋亡率(5.21±0.31)%明显上升,差异有统计学意义(P < 0.05),而与低剂量组比较,高剂量组细胞凋亡率(29.74±3.21)%增加明显(P < 0.05)。见图1。
2.3 各组SKOV3细胞中Bax、Bcl-2及Caspase-3表达情况
与对照组比较,低、高剂量组Bax/Bcl-2值及Caspase-3表达水平均升高(P < 0.05);与低剂量组相比,高剂量组Bax/Bcl-2值及Caspase-3表达水平更高(P < 0.05)。见表2。
2.4 各组SKOV3细胞中LC3-Ⅰ、LC3-Ⅱ及Beclin-l表达情况
与对照组比较,应用柴胡皂苷干预后,低、高剂量组LC3-Ⅰ/LC3-Ⅱ比值降低,且低剂量组比值较高剂量组更低,差异有统计学意义(P < 0.05);与对照组比较,低、高剂量组Beclin-1表达明显增高,且高剂量组比低剂量组表达更高,差异有统计学意义(P < 0.05)。见图2、表3。
3 讨论
因卵巢癌发现时多为中晚期,预后极差,现阶段手术治疗效果欠佳,临床治疗多以化疗为主[8]。但化疗药物毒副作用强、靶向性不明确、易产生耐药性,在临床应用中受到诸多限制[9]。因此,寻找高效、靶向治疗卵巢癌的方法不仅是目前的研究热点,更是亟待解决的问题。柴胡皂苷是中药柴胡的主要有效成分,研究证实柴胡皂苷具有抗病毒、抗过敏、抗炎、抗肿瘤和抑制细胞黏附等作用[10]。现阶段研究认为[11-12],柴胡皂苷抗肿瘤作用可能是通过增强巨噬细胞游走、吞噬能力,抑制肿瘤细胞分裂、生长,并诱导凋亡等机制实现的。Lee等[13]通过实验发现,柴胡皂苷对胃癌、乳腺癌、肝癌细胞均有较强的杀伤作用,其中对于胃癌细胞的杀伤作用最强。但在目前还没有柴胡皂苷治疗卵巢癌的深入研究。
自噬是细胞自身保护的方法之一,具有动态性和多面性等特征。对于肿瘤细胞而言,适度的自噬可通过降解细胞内大分子为细胞的生存、生长提供能量;过度活化的自噬则导致细胞死亡的发生[14]。在细胞内,LC3-Ⅰ可转变为LC3-Ⅱ,而后者又可与自噬体膜相结合,故LC3-Ⅰ/LC3-Ⅱ常被看作自噬的进展程度[15]。
Beclin-l可与Vps34形成复合体,该复合体使磷脂酰肌醇磷酸化,产生三磷酸磷脂酰肌醇以引导自噬相关蛋白的定位[16]。故Beclin-l也被看做自噬发生的重要因子。通常自噬与凋亡之间的关系大致分为3种:促进、拮抗和合作[17]。自噬和凋亡协作引起细胞死亡,两者可能同时发生;或者当其中一个程序受到阻碍或抑制时,另一个程序被激活并继续完成细胞死亡过程[18]。
本研究发现,应用柴胡皂苷干预卵巢癌SKOV3细胞后,可明显抑制卵巢癌细胞增长,且其抑制SKOV3细胞增殖;经流式细胞仪检测发现,细胞凋亡率随柴胡皂苷剂量增加而增加,说明柴胡皂苷通过增加细胞凋亡而起到抑制卵巢癌细胞增长的作用。为了深入探究柴胡皂苷对卵巢癌SKOV3细胞的作用,本研究进一步检测了凋亡相关因子Caspase-3、Bcl-2和Bax,及自噬相关因子LC3-Ⅰ、LC3-Ⅱ和Beclin-l的表达情况,发现应用柴胡皂苷干预后Caspase-3表达升高、Bax/Bcl-2比值升高,说明柴胡皂苷可打破卵巢癌细胞凋亡/抗凋亡平衡,并促进卵巢癌SKOV3细胞凋亡,这与步世忠[2]的研究结果相似。Western blot检测结果发现,应用柴胡皂苷干预治疗后,卵巢癌细胞中LC3-Ⅰ/LC3-Ⅱ比值明显降低,而Beclin-l的表达明显升高。Beclin-l是一种重要的自噬调节因子,后被人们发现可与Bcl-2相互作用[19],Beclin-1/Bcl-2是确定的自噬与凋亡的分子连接。当Beclin-l表达水平升高时,可将促凋亡蛋白BAK/BAX从与Bcl-2的结合中释放出来,从而促进细胞凋亡[20-21],这可能是柴胡皂苷促进卵巢癌SKOV3细胞自噬、凋亡的原因之一。
因此,柴胡皂苷对卵巢癌SKOV3细胞增殖有明显的抑制作用,其机制可能是通过促进自噬与凋亡相关因子表達,进而引发细胞凋亡,抑制卵巢癌细胞生长。但柴胡皂苷是单纯通过影响自噬相关因子进而诱导细胞凋亡,还是同时影响SKOV3细胞自噬及凋亡需进一步实验证明。
[参考文献]
[1] 刘文彬,闫海山,牛红卫.紫杉醇联合顺铂治疗晚期卵巢癌的临床疗效观察[J].肿瘤药学,2012,2(3):220-222.
[2] 步世忠,许金康,孙继虎,等.柴胡皂甙d上调人急性早幼粒白血病细胞糖皮质激素受体mRNA对细胞生长的影响[J].中国中西医结合杂志,2000,20(5):350.
[3] 魏彩,秦宜德,郑欣,等.乳源免疫调节肽体外抑制人卵巢癌细胞侵袭和转移[J].中国药理学通报,2013,29(1):42-48.
[4] 徐国才,张莘,相媛媛,等.雷帕霉素联合顺铂对卵巢癌细胞株SKOV3凋亡和自噬的影响[J].医药导报,2013, 32(4):446-449.
[5] 黄亮,唐正严,李东杰,等.氯胺酮诱导人膀胱SV-HUC-1细胞凋亡的实验研究[J].中南大学学报:医学版,2014, 39(7):703-707.
[6] 王伊林,单晓彤,柴花,等.丹参酮ⅡA磺酸钠腹腔注射对阿霉素心肌病大鼠心功能及左室纤维化的影响[J].山东医药,2016,56(7):34-36.
[7] 王伊林,赵雅君,杨洋,等.磷酸肌酸钠对慢病毒介导Calumenin蛋白沉默阿霉素损伤心肌细胞内质网应激信号通路的作用[J].临床心血管病杂志,2015,31(10):1119-1122.
[8] 刘曼,胡明英,王晓莉,等. AKT基因沉默对人卵巢癌细胞增殖及Fas、FasL、Caspase-3蛋白表达的影响[J].山东医药,2016,56(7):29-31.
[9] 王伊林,崔晓雪,柴花,等.丹参酮ⅡA磺酸钠对阿霉素心肌病大鼠心室肌闰盘保护作用[J].临床心血管病杂志,2016,32(8):843-847.
[10] 叶晓平,送纯清.柴胡皂苷药理研究进展[J].中草药,2004,35(12):1443-1436.
[11] 吴克勤.柴胡皂苷D联合奥沙利铂对A549细胞荷瘤裸鼠的抑瘤作用及其机制[J].中国药科大学学报,2015, 46(3):355-358.
[12] Wong VK,Zhang MM,Zhou H,et al. Saikosaponin-d enhances the anticancer potency of TNF-α via overcoming its undesirable response of activating NF-Kappa B Signalling in cancer cells [J]. Evid Based Complement Alternat Med,2013,12(12):85-93.
[13] Lee KJ,Xu MY,Shehzad O,et al. Separation of triterpenoid saponins from the root of Bupleurum falcatum by counter current chromatography:the relationship between the partition coefficients and solvent system composition [J]. J Sep Sci,2014,37(23):3587-3594.
[14] 赵大海,陆友金.抑制自噬促进培美曲赛对A549细胞的增殖抑制作用[J].中国药理学通报,2015,31(5):664-668.
[15] Shvets E,Elazar Z. Flow cytometric analysis of autophagy in living mammalian cells[J]. Methods Enzy Mol,2009,452(1):131-141.
[16] Kihara A,Kabeya Y,Ohsumi Y,et al. Beclin -phosphatidylinos-itol3-kinase complex functions at the trans Golgi network [J]. EMBO Rep,2001,2(4):330-335.
[17] 王月霞,陈敏.自噬性细胞死亡及其与细胞凋亡、坏死关系研究进展[J].中国公共卫生,2016,32(10):1433-1436.
[18] 刘辉,李晓强,朱人大,等.自噬激活如何影响大鼠内皮祖细胞凋亡、增殖和周期的变化?[J].中国组织工程研究,2015,19(1):67-71.
[19] LiangXH,Kleeman LK,Jiang HH,et al. Protection against fatal Sindbis virus encephalitis by beclin,a novel Bcl-2-interacing protein [J].J Virol,1998,72(11):8586-8596.
[20] 段振玲,王赞宏,彭芝兰.自噬基因Beclin1在SKOV3细胞中的表达及其调控相关信号传导途径的研究[J].昆明医学院学报,2010,31(9):7-10.
[21] 张茂娜,汤志杰,陈莉.自噬-凋亡通路在肿瘤靶向治疗中的意义[J].肿瘤学杂志,2014,20(5):413-418.
(收稿日期:2016-10-15 本文编辑:李岳泽)

