激活ALDH2通过上调SIRT1/PGC-1α信号通路减轻小鼠缺氧性肺动脉高压
摘要:目的 探讨激活线粒体乙醛脱氢酶2(ALDH2)是否可以通过SIRT1/PGC-1α信号通路减轻缺氧性肺动脉高压。方法 在体水平:选取8周龄C57 BL/6小鼠40只,随机分成Control组、Hypoxia组、Hypoxia +Alda-1灌胃组及ALDH2特异性敲除组(Hypoxia+ALDH2-/-),10只/组,Hypoxia组小鼠暴露于缺氧条件下(10%O2,90%N2),维持每日12 h/12 h的暗/光循环4周,Hypoxia+Alda-1组同时予以Alda-1腹腔注射处理4周,Control组予以常氧环境并给与同等量的溶剂(DMSO+PBS)干预4周。利用超声心动图、右心室导管实验评估右心功能及压力,以右心室压代替肺动脉压;HE评估肺血管重构及右心室损伤情况,免疫荧光检测α-SMA表达,评估肺远端小动脉肌化情况,WGA染色检测右心室横截面积,评估心肌细胞肥大程度,测量右心肥厚指数。检测ALDH2、SIRT1、PGC-1α、P16INK4A、P21CIP1蛋白表达。体外水平:分别设置Control组、Hypoxia组上、Hypoxia+Alda-1组上、Hypoxia+Alda-1+EX527组。利用β半乳糖染色评估各分组小鼠肺动脉平滑肌细胞衰老情况,Western blotting评估各分组蛋白表达情况。结果 与Control组相比,Hypoxia组右心室收缩压(RVSP)增高、右室游离壁厚度(RVFWT)增厚、P16INK4A、P21CIP1表达增加(Plt;0.05)。与Hypoxia组相比,Hypoxia+Alda-1组RVSP降低、RVFWT变薄、P16INK4A、P21CIP1表达降低(Plt;0.05)。与Hypoxia组相比,Hypoxia+ALDH2 -/-组RVSP增高、RVFWT增厚、P16INK4A、P21CIP1蛋白表达增加(Plt;0.01)。与Control组相比,Hypoxia组细胞衰老比例增加、P16INK4A、P21CIP1表达增加(Plt;0.01)。与Hypoxia组相比,Hypoxia+Alda-1组细胞衰老比例降低(Plt;0.01),P16INK4A、P21CIP1 (Plt;0.05)表达降低。与Hypoxia+Alda-1 组相比,Hypoxia+Alda-1+EX527 组细胞衰老比例增加(Plt;0.01),P16INK4A、P21CIP1 表达增高(Plt;0.05)。结论 ALDH2通过调控SIRT1/PGC-1α信号通路,减轻小鼠肺动脉平滑肌细胞衰老,从而减轻缺氧型肺动脉高压。
关键词:线粒体乙醛脱氢酶2;SIRT1;PGC-1α;平滑肌细胞衰老;肺动脉高压
肺动脉高压(PAH)是一种进行性肺血管疾病,其特征是严重的远端肺小动脉(PA)重塑和肺血管阻力增加,最终导致右心衰竭、肺动脉内皮功能障碍、平滑肌细胞增生和肥大、细胞外基质沉积和血管周围炎性浸润,导致PA重塑[1]。在2018 年第6 届世界肺动脉高压大会(WSPH)中,肺动脉高压被重新定义为平均肺动脉压大于20 mm Hg,缺氧型PAH为最新临床分类的3类,患者无肺部疾病,而是由缺氧引起的PAH[2]。肺动脉高压暂时无法根治,目前治疗药物主要为缓解症状[3],PAH患者的预后较差,与PAH进展有关的病理生理基础、分子靶点、信号通路仍在探索中,开发新的药物和治疗手段来改善缺氧性肺动脉高压相关疾病是必要的。
肺动脉高压伴随着肺动脉平滑肌细胞的衰老、异常的增殖[4]。有文献报道,肺动脉收缩压会随着年龄的增长和机体自然衰老而增加,每10 年增加约1 mmHg[5]。可见,肺动脉高压与肺动脉平滑肌细胞的衰老有一定的相关性[6, 7]。线粒体是血管平滑肌细胞的能量中心,通过多种机制参与血管重塑,过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)介导的线粒体生物发生可防止血管平滑肌细胞增殖和衰老[8]。脱乙酰酶sirtuin1(SIRT1)激活剂白藜芦醇可以激活线粒体中生物发生主要调节因子PGC-1α,减轻肺动脉平滑肌细胞增殖,逆转右心室压力增加和右心室心肌细胞肥大[9]。以上研究表明,SIRT1/PGC-1α可能参与了肺动脉平滑肌细胞衰老引起的肺动脉压力增高及右心室的重构。
线粒体醛脱氢酶2(ALDH2),是乙醛脱氢酶家族中的一员,由12q24号染色体上具有13个外显子的核基因编码,定位在线粒体上,除了其还原酶和酯酶活性外,主要作为脱氢酶[10]。ALDH2是解毒乙醇衍生的乙醛和内源性脂醛(如4-羟基壬戌醛或丙二醛)的关键酶[11]。ALDH2在心血管疾病中的有益作用可能是通过调节氧化应激、细胞代谢、炎症反应、细胞凋亡和自噬来介导的,ALDH2的缺乏会加速血管平滑肌细胞的衰老促进动脉粥样硬化斑块不稳定[12]。但是ALDH2关于肺动脉平滑肌细胞衰老的相关研究尚少,已有研究表明,激活ALDH2可以减轻小鼠肺动脉高压[13],但是其机制并不完全清楚。
因此,本研究通过小鼠在体和体外水平实验,旨在探索ALDH2是否可以通过激活SIRT1/PGC-1α信号通路减轻肺动脉平滑肌细胞衰老从而减轻肺动脉高压。
1 材料和方法
1.1 仪器与试剂
动物呼吸机(ALC-V9上海奥尔科特生物科技有限公司),小动物超声仪Vevo 2100(VisualSonics),生理采集系统(成都仪器厂RM6240E),化学发光成像系统(FluorChem M),德赛红外成像系统(Li-CorBiosciences),光学显微镜(NIKON ECLIPSE E100)和荧光显微镜(奥林巴斯)。异氟烷(瑞沃德生命科技有限公司),戊巴比妥钠(北京普博斯生物有限公司),SIRT1特异性抑制剂EX-527(MCE),Alda-1(MCE),ALDH2兔抗鼠抗体(Abcam),P16INK4A 兔抗鼠抗体(Invitrogen),P21CIP1(ABclonal),PGC1- α、SIRT1、β-actin、GAPDH(Affinity),山羊抗小鼠二抗、山羊抗兔二抗(Biosharp),DAPI(Beyotime Biotechnology),BCA蛋白测定试剂盒细胞衰老β-半乳糖苷酶染色试剂盒(Beyotime)。
1.2 实验动物及细胞
本研究经蚌埠医学院伦理委员会审核批准(伦理批号:2019-094号),动物的养护及处理严格遵守《实验动物管理条例》进行。选取8周龄、体质量20~24 g的雄性C57BL/6 小鼠30 只,购自南京市江宁区青龙山动物繁殖场,C57BL/6JGpt-Aldh2em1cd/Gpt,ALDH2 敲除小鼠2 只(雌、雄),购至江苏集萃药康生物科技股份有限公司,培育至10只,采用蛋白免疫印迹法对小鼠进行基因型鉴定敲除成功。小鼠原代肺动脉平滑肌细胞,由成熟小鼠肺动脉分离及酶解后培养提纯(购至武汉普诺赛生命科技有限公司),经α-SMA免疫荧光鉴定,为高纯度肺动脉平滑肌细胞。
1.3 实验分组与肺动脉高压模型的构建
在体水平:将30只C57BL/6随机分成正常对照组(Control)10只、缺氧(Hypoxia)组10只、缺氧+Alda-1灌胃组10 只及符合标准的缺氧+ALDH2 特异性敲除组(Hypoxia+ALDH2 -/-)10只,缺氧组小鼠暴露于缺氧条件下(10%O2,90%N2),维持每日12 h/12 h 的暗/光循环4周,自由地获得水和饮食,以诱导肺动脉高压,Hypoxia+Alda-1组同时予以Alda-1[(浓度剂量为10 mg/(kg∙d),溶剂的量为10%的DMSO+90%生理盐水[13, 14]]腹腔注射处理4周,Control组常氧清洁级环境及饮食,予以同等量的溶剂干预4周。
体外水平:将原代肺动脉平滑肌细胞分别设置Control 组、Hypoxia 组、Hypoxia+Alda-1 组,Hypoxia+Alda-1+SIRT1 组特异性抑制剂(EX-527)组,Hypoxia组细胞予以2%O2持续缺氧72 h[15],诱导肺动脉平滑肌细胞衰老,Hypoxia+Alda-1 组同时予以Alda-1(20 μmol/L[13]),Hypoxia+Alda-1+EX-527组同时予以Alda-1(20 μmol/L)和EX-527(20 μmol/L[16]),Control予以95% O2和5% CO2,37 ℃培养,同时加入与Hypoxia+Alda-1+EX-527组相同剂量的DMSO作为对照。
1.4 超声心动图
利用小动物超声仪提供的30 MHz 换能器,对小鼠进行经胸超声心动图检查。将各组小鼠依次放置在麻醉诱导盒中,用2%异氟烷麻醉,调整仪器流速为2 L/min,麻醉成功后迅速关闭诱导盒麻药气流,打开面罩通气,调整异氟烷流速1L/min维持,将小鼠固定在载鼠板上接通面罩,胸部予以备皮,四肢涂抹导电糊,胸前涂抹导超声耦合剂,选取MS-400超声探头,将探头固定在支架上,摆好位置,在B-M模式下找寻右心室长轴切面,切换至M模测量右心室游离壁厚度(RVFWT),调整探头位置在左心室短轴切面,找到肺动脉,切换至Color模式,框出测量区域后选择PW模式,分别测肺动脉血流加速时间(PAT),肺动脉射血时间(PET),以PAT/PET比值大小评估各分组肺动脉压力变化。
1.5 右心室压力测量
各分组小鼠造模结束后予以超声心动图检测相关指标,检测完成后予以开胸测量右心室收缩压(RVSP),以RVSP代替肺动脉压,同用RM6240E多道生理信号采集处理系统测量出右室压力最大上升速率(dP/dt(+)max)。各分组小鼠依次在戊巴比妥钠麻醉下,行气管插管,选取22 G气管插管导管,将小鼠固定在泡沫板上,光源对准小鼠颈部气管中央,用止血钳打开小鼠口腔,看见随着呼吸张合的气道入口,将气管插管针插入小鼠气道,用棉球判断气管插管导管是否在位,连接小动物呼吸机,调整呼吸频率105 次/min,呼吸比1∶1,潮气量为2,打开腹腔,剪开膈肌,延两侧肋骨剪开暴露心脏,22 G针头连接压力放大器及多通道生理采集系统,插入右心室记录10 min,记录结束后立即予以颈脱位处死小鼠组织取材备用。
1.6 右心肥厚指数
右心室压力测定结束后行颈椎脱位安乐死,取心脏和肺作进一步检查。测量右心肥厚指数(RVHI),RVHI=右心室游离壁质量/(左心室+室间隔质量),取好的心脏用PBS 冲洗残留血液,去除左右心耳,用眼科剪延右心室边缘剪开,完整取下右心室游离壁,并用滤纸吸干水分后称重,剩余组织为左心室及室间隔质量。
1.7 组织切片与染色
用冰冻固定组织,在切片机上切片(厚度3μm),复温后组织固定液固定15 min,分别行苏木素染色和伊红染色(HE),脱水封片,显微镜检后进行图像采集观察血管壁肌化面积/血管总面积[PA thickness(wall/totalarea)];血管壁厚度占血管直径百分比(WT%)。免疫荧光染色时,先将组织石蜡切片脱蜡至水,再进行抗原修复,自发荧光淬灭后血清封闭30 min,加入一抗(1∶500)4°孵育过夜,次日洗涤后加入二抗(1∶300),室温避光孵育50 min,DAPI复染细胞核,封片,镜检拍照分析,观察α-SMA 的相对荧光强度百分比;小麦胚芽凝集素(WGA)统计右心室心肌细胞横截面积。
1.8 Western blotting
检测小鼠肺动脉蛋白表达水平。小鼠肺组织,用高速研磨机研磨后加入组织裂解液RIPA,冰上裂解40 min钟后加入蛋白上样缓冲液,蛋白变性,BCA蛋白测定试剂盒定量后,分别用10%和12.5% SDS-PAGE,90 V恒定电压电泳2 h 使蛋白分离,并转移到PVDF 膜,以400 mA恒定电流,持续转膜40 min,取出条带经快速封闭液封闭30 min,经TBS-T洗膜后将膜与指定的一抗在4 ℃下孵育过夜,第2天洗膜后敷对应的二抗, 2 h后取出条带,洗膜3 次,使用奥德赛红外成像系统分析蛋白质水平,并使用imagej 软件对每组的条带进行量化。Western blotting 采用以下抗体:ALDH2、P16INK4A、P21CIP1、PGC1-α、SIRT1、β-actin,1∶1000稀释,采用山羊抗小鼠二抗、山羊抗兔二抗(1∶5000稀释)。
1.9 肺动脉平滑肌细胞免疫荧光鉴定
将小鼠原代细胞以4×104均匀的种在共聚焦小皿中,待细胞贴壁后,取出小皿,固定15 min,透膜封闭30 min,清洗后敷一抗(1∶200)4 ℃冰箱过夜,次日于37 ℃水浴锅敷二抗(1∶100)30 min,最后染DAPI,拍摄。
1.10 β-半乳糖苷酶染色
选取3~4 代原代小鼠肺动脉平滑肌细胞4×104/孔均匀种植在6孔板中,不同分组的细胞分别干预72 h后予以吸出培养基,染色固定液固定15 min后,每孔分别加入1 mL染色工作液,37 ℃避光孵育12 h,次日光学显微镜观察,并拍照。
1.11 统计学处理
所有数据均采用GraphPadPrism9 进行统计分析,定量数据以均数±标准差表示,采用单因素方差分析使用Tukey检验,进行多组间比较。Plt;0.05为差异具有统计学意义。
2 结果
2.1 从功能学水平比较各组小鼠右心室压力、超声心动图变化
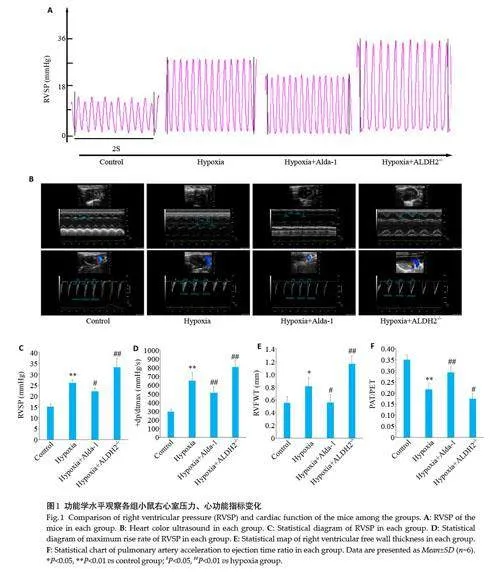
与Control组相比,Hypoxia组RVSP 、dP/dt(+)max升高(Plt;0.05)、PAT/PET 降低(Plt;0.01)RVFWT 增厚(Plt;0.05);与Hypoxia 组相比,Hypoxia+Alda-1 组RVSP、dP/dt(+)max 降低(Plt;0.05)、PAT/PET增高(Plt;0.01)、RVFWT 变薄(Plt;0.05),Hypoxia+ALDH2 -/- 组RVSP、dP/dt(+)max 升高(Plt;0.01)、PAT/PET 降低(Plt;0.05)、RVFWT增厚(Plt;0.01,图1)。
2.2 从组织学水平比较各组小鼠肺动脉HE和免疫荧光染色,评估肺动脉重构情况
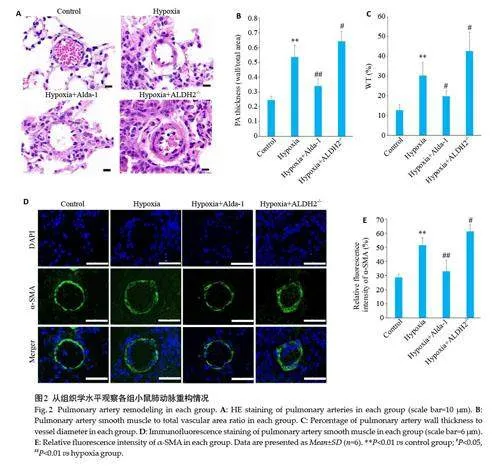
与Control 组相比,Hypoxia 组PA thickness (wall/total area)增高(Plt;0.01)、WT%升高(Plt;0.01)、相对免疫荧光密度α-SMA%增高(Plt;0.01),肺动脉周围区域炎性细胞浸润;与Hypoxia 组相比,Hypoxia+ Alda-1 组PA thickness (wall/total area)降低(Plt;0.01)、WT%降低(Plt;0.05)、相对免疫荧光密度α-SMA%降低(Plt;0.01),炎性细胞渗出减少,Hypoxia+ALDH2 -/-组PA thickness(wall/total area)增高(Plt;0.05)、WT%升高(Plt;0.05)、相对免疫荧光密度α-SMA%增高(Plt;0.05),炎性细胞增多(图2)。
2.3 比较各组小鼠右心室HE、WGA染色和右心室肥厚指数,评估右心室重构情况
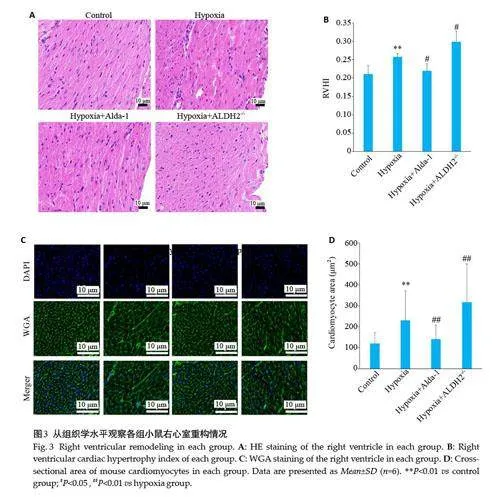
心肌组织HE染色可见Control组心肌细胞排列规则,大小正常,结构清晰,未见炎细胞浸润,Hypoxia组心肌细胞排列紊乱,心肌细胞肥大,部分结构不清晰,少部分肌纤维出现溶解断裂,可见炎性细胞浸润Hypoxia+Alda-1组上述情况减轻,Hypoxia+ALDH2-/-组心肌细胞结构不清晰,心肌细胞肥大加重,大量肌纤维出现溶解断裂,变性和坏死,可见炎性细胞浸润,与Control组相比,Hypoxia 组RVHI 增高(Plt;0.01)、Cardiomyocytearea增大(Plt;0.01);与Hypoxia组相比,Hypoxia+Alda-1组RVHI 降低(Plt;0.05)、Cardiomyocyte area 减小(Plt;0.01),Hypoxia+ALDH2 -/- 组RVHI 增高(Plt;0.05)、Cardiomyocyte area增大(Plt;0.01,图3)。
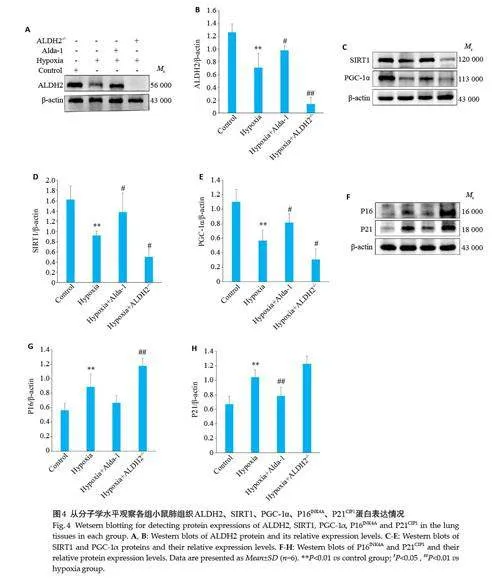
2.4 Western blotting 检测各组小鼠肺组织ALDH2、SIRT1、PGC-1α、P16INK4A、P21CIP1的表达
与Control 组相比,Hypoxia 组小鼠肺组织ALDH2、调节线粒体功能相关通路蛋白SIRT1、PGC-1α 蛋白表达减少(Plt;0.01)及衰老相关标志性蛋白P16INK4A、P21CIP1蛋白表达增加(Plt;0.01),与Hypoxia组相比,Hypoxia+Alda-1组ALDH2蛋白表达增加(Plt;0.01)、SIRT1、PGC-1α蛋白表达增加(Plt;0.05),而P16INK4A蛋白表达减少(Plt;0.05)、P21CIP1 蛋白表达减少(Plt;0.01),Hypoxia+ALDH2-/-组ALDH2 蛋白表达减少(Plt;0.01)、SIRT1、PGC-1α蛋白表达减少(Plt;0.05),P16INK4A蛋白表达增加(Plt;0.01)、P21CIP1蛋白表达增加(Plt;0.05,图4)。
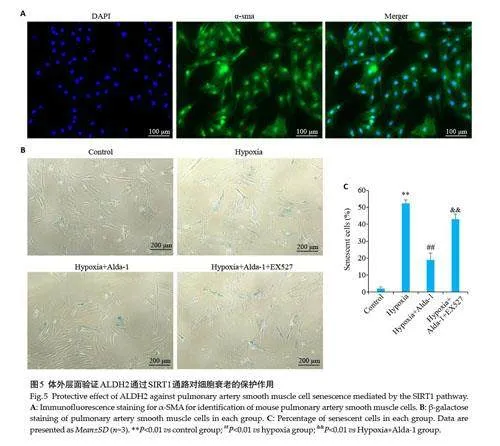
2.5 β-半乳糖染色验证ALDH2通过SIRT1通路对细胞衰老的保护作用
经免疫荧光鉴定实验用细胞为小鼠肺动脉平滑肌细胞;与Control相比,Hypoxia组衰老细胞增多(Plt;0.01),与Hypoxia 组相比Hypoxia+Alda-1 组衰老细胞减少(Plt;0.01),与Hypoxia+Alda-1组相比Hypoxia+Alda-1+EX-527组衰老细胞增多(Plt;0.01,图5)。
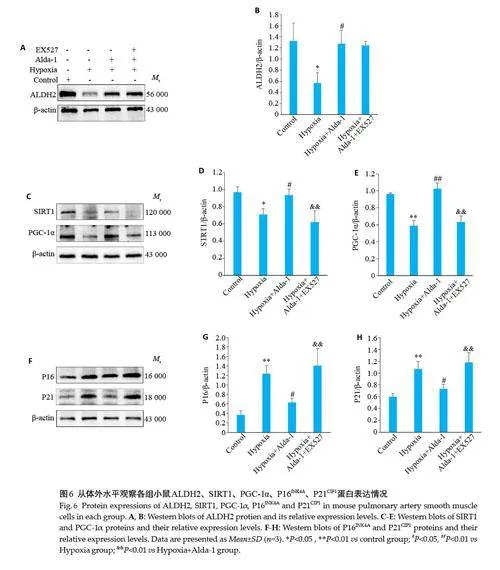
2.6 Western blotting 验证ALDH2 通过SIRT1/PGC-1α通路对细胞衰老的保护作用
与Control组相比,Hypoxia组P16INK4A、P21CIP1蛋白表达增加(Plt;0.01),ALDH2(Plt;0.05)、SIRT1(Plt;0.05)、PGC-1α(Plt;0.01)表达降低。与Hypoxia 组相比,Hypoxia+Alda-1组P16INK4A、P21CIP1 (Plt;0.01)蛋白表达降低,ALDH2(Plt;0.05)、SIRT1(Plt;0.05)、PGC-1α(Plt;0.01)表达增高。与Hypoxia+Alda-1组相比,Hypoxia+Alda-1+EX527 组ALDH2 表达差异无统计学意义,SIRT1、PGC-1α表达降低(Plt;0.01),P16INK4A、P21CIP1(Plt;0.01)蛋白表达增高(图6)。
3 讨论
肺动脉高压是一种无法治愈的肺动脉进行性血管病变,其中新内膜血管重塑的特征形式逐渐阻塞肺动脉,病变中,弹性层崩解,血管壁和血管周围区域发炎和纤维化[17, 18]。在DNA损伤的背景下,从过度增殖、促凋亡表型到生长停滞、细胞凋亡抵抗和促炎环境的转变表明细胞衰老在PAH的不可逆性中起作用[19]。细胞衰老其发生的潜在机制包括线粒体平衡的破坏、炎症因子的产生、ROS的积累、自噬通量的失衡、SASP的分泌等[20]。根据上述相关研究,我们推测通过调控肺动脉平滑肌细胞衰老相关机制的发生,可逆转PAH的发展。通过相关文献及课题组前期的研究发现激活ALDH2 可以调控线粒体平衡、减轻炎症、ROS累积、增加醛类物质代谢、调控自噬通量等作用[21-23],但是其在肺动脉平滑肌中的作用研究尚少,因此我们提出通过激活ALDH2来减轻肺动脉平滑肌细胞的衰老,从而减轻PAH。
本研究发现,在功能学水平上根据RVSP与小动物心脏彩超数据分析表明,缺氧引起的肺动脉压力增高进而引起的右心室代偿肥厚及右心室收缩能力降低[24, 25],被ALDH2 过表达逆转,而ALDH2 敲除后小鼠这种损伤进一步加重;在组织学水平观察各组小鼠肺动脉重构情况发现,ALDH2过表达改善了缺氧引起的肺动脉平滑肌细胞的增殖,肺动脉管腔的狭窄,炎性细胞的浸润,而ALDH2敲除小鼠肺动脉重构情况加重,导致管腔进一步狭窄,肺动脉周围炎性细胞浸润加重,而这种炎性细胞的增加又促进了肺动脉平滑肌细胞的增殖及纤维化的发生,引起细胞的衰老[25]。小鼠的慢性缺氧引起肺动脉压力增高,导致右心室后负荷加重,进而引起右心室心肌细胞的肥大[26],而与细胞衰老密切相关的属性是细胞体肿大或“肥大”,这种特性是许多衰老特征背后的驱动表型,如细胞器含量增加、细胞质稀释,可能还有永久性细胞周期停止[27, 28]。我们还观察到右心室游离壁大量肌纤维出现溶解断裂,变性和坏死,炎性细胞浸润,右心室游离壁的增厚,这种改变最终引起了右心室收缩及舒张功能的降低,右心衰竭,此种疾病的发生发展在上述心脏彩超及HE染色中可直观观察,在ALDH2 过表达小鼠中这种病理性的变化被逆转,而ALDH2敲除小鼠病变进一步加重,可见ALDH2参与了PAH的发生及由PAH引发的右心室重构和右心功能障碍。
ALDH2如何参与PAH的进程,其机制并非完全清楚。ALDH2作为乙醛脱氢酶家族的重要成员,在心血管疾病及细胞代谢中扮演着重要角色[29]。本研究发现,在缺氧环境下,ALDH2的表达显著降低,这进一步提示ALDH2可能参与了缺氧性肺动脉高压的进程。进一步的研究证实,ALDH2不仅通过直接代谢毒性醛类物质来减轻缺氧造成的损伤[30, 31],还通过调节下游信号通路来发挥保护作用,我们发现SIRT1/PGC1-α在缺氧小鼠中表达降低,同时衰老相关标记蛋白P16INK4a和P21CIP1显著升高,而在ALDH2 激活剂Alda-1 干预下SIRT1/PGC1-α的表达明显增多,P16INK4a、P21CIP1的表达相比于缺氧组明显降低,同时我们观察在ALDH2基因敲除小鼠中与单纯缺氧组对比SIRT1/PGC1-α的表达进一步降低,P16INK4a、P21CIP1的表达进一步的升高,同时体外实验,在应用ALDH2激动剂和SIRT1抑制剂后发现,缺氧模型诱导下ALDH2/SIRT1/PGC1‑α 表达均降低,P16INK4a、P21CIP1表达增多,肺动脉平滑肌细胞衰老比例增多,可见ALDH2/SIRT1/PGC1-α参与了肺动脉平滑肌细胞衰老的调控,经过ALDH2 激动剂治疗后,ALDH2/SIRT1/PGC1-α表达增多,P16INK4a、P21CIP1表达减少,同时肺动脉平滑肌细胞衰老比例减少,可见ALDH2参与了SIRT1/PGC1-α的调控,且激动ALDH2可以减轻肺动脉平滑肌细胞衰老,而在ALDH2激动剂的基础上给予SIRT1特异性抑制剂发现ALDH2的表达并无明显变化,但SIRT1/PGC1-α表达降低,P16INK4a、P21CIP1表达增多,同时肺动脉平滑肌细胞衰老比例增多,由此可见ALDH2为SIRT1的上游,ALDH2通过正向调控SIRT1/PGC1-α的表达从而对肺动脉平滑肌细胞衰老起保护作用,结合本实验功能学及组织学结果可见,这种调控机制也在影响着肺动脉及右心室的重构进而引起肺动脉压力和右心功能的改变。
SIRT1是NAD+依赖性脱乙酰酶家族的成员,一种组蛋白去乙酰化酶,在细胞能量代谢和氧化应激反应中发挥着重要作用,被认为是衰老相关疾病的潜在治疗靶点[32]。PGC-1α属于转录调节因子PGC家族成员,没有DNA结合结构域,不具有内在的组蛋白乙酰转移酶活性,PGC-1α通过为具有组蛋白乙酰转移酶活性的蛋白质提供对接平台,更多地充当转录调节因子,间接促进转录[33]。SIRT1主要影响线粒体功能,目前有两种通路:PGC-1α依赖性和PGC-1α非依赖性通路[34]。在PGC-1α依赖性通路中,SIRT1通过脱乙酰激活PGC-1α,活化的PGC-1α可作为线粒体转录因子A(TFAM)的共激活因子,其被认为可促进SIRT1 和PGC-1α转运到线粒体中,在那里它们与mtDNA的D环区域形成复合物,D环区调节线粒体DNA复制和转录[35]。SIRT1 通过调节ROS的产生和积累,减弱相关的氧化应激,ROS 积累同时也会导致线粒体功能障碍,氧化应激、线粒体功能障碍被认为是细胞衰老的主要致病因素[36, 37] 。
综上,本研究证实当ALDH2激活时SIRT1/PGC-1α表达增多,平滑肌细胞衰老减轻,进而引起肺动脉高压的减轻,肺动脉及右心室重塑减轻,表明其机制可能是通过或部分通过SIRT1 脱乙酰化激活PGC-1α减轻氧化应激,同时调控线粒体功能,发挥抗衰老作用,为治疗肺动脉高压提出了一个新的思路。
参考文献:
[1] Rabinovitch M. Molecular pathogenesis of pulmonary arterial
hypertension[J]. J Clin Invest, 2012, 122(12): 4306-13.
[2] Simonneau G, Montani D, Celermajer DS, et al. Haemodynamic
definitions and updated clinical classification of pulmonary
hypertension[J]. Eur Respir J, 2019, 53(1): 1801913.
[3] Sitbon O, Gomberg-Maitland M, Granton J, et al. Clinical trial
design and new therapies for pulmonary arterial hypertension[J].
Eur Respir J, 2019, 53(1): 1801908.
[4] Liu LM, Wei YQ, Giunta S, et al. Potential role of cellular
senescence in pulmonary arterial hypertension[J]. Clin Exp
Pharmacol Physiol, 2022, 49(10): 1042-9.
[5] Semen KO, Bast A. Senescence in pulmonary arterial hypertension:
is there a link?[J]. Curr Opin Pulm Med, 2022, 28(4): 303-6.
[6] Noureddine H, Gary-Bobo G, Alifano M, et al. Pulmonary artery
smooth muscle cell senescence is a pathogenic mechanism for
pulmonary hypertension in chronic lung disease[J]. Circ Res, 2011,
109(5): 543-53.
[7] Wang AP, Yang F, Tian Y, et al. Pulmonary artery smooth muscle cell
senescence promotes the proliferation of PASMCs by paracrine IL-6
in hypoxia-induced pulmonary hypertension[J]. Front Physiol,
2021, 12: 656139.
[8] Xia Y, Zhang X, An P, et al. Mitochondrial homeostasis in VSMCs as
a central hub in vascular remodeling[J]. Int J Mol Sci, 2023, 24(4):
3483.
[9] Zurlo G, Piquereau J, Moulin M, et al. Sirtuin 1 regulates pulmonary
artery smooth muscle cell proliferation: role in pulmonary arterial
hypertension[J]. J Hypertens, 2018, 36(5): 1164-77.
[10] Jin JY, Chen JY, Wang YP. Aldehyde dehydrogenase 2 and
arrhythmogenesis[J]. Heart Rhythm, 2022, 19(9): 1541-7.
[11] Zhu WZ, Feng DC, Shi X, et al. The potential role of mitochondrial
acetaldehyde dehydrogenase 2 in urological cancers from the
perspective of ferroptosis and cellular senescence[J]. Front Cell
Dev Biol, 2022, 10: 850145.
[12]Zhu H, Wang Z, Dong Z, et al. Aldehyde dehydrogenase 2
deficiency promotes atherosclerotic plaque instability through
accelerating mitochondrial ROS-mediated vascular smooth muscle
cell senescence[J]. Biochim Biophys Acta Mol Basis Dis, 2019,
1865(7): 1782-92.
[13]Xu T, Liu SY, Ma TT, et al. Aldehyde dehydrogenase 2 protects
against oxidative stress associated with pulmonary arterial
hypertension[J]. Redox Biol, 2017, 11: 286-96.
[14]Liu HR, Hu Q, Ren K, et al. ALDH2 mitigates LPS-induced cardiac
dysfunction, inflammation, and apoptosis through the cGAS/STING
pathway[J]. Mol Med, 2023, 29(1): 171.
[15]Li D, Shao NY, Moonen JR, et al. ALDH1A3 coordinates
metabolism with gene regulation in pulmonary arterial hypertension
[J]. Circulation, 2021, 143(21): 2074-90.
[16]Qin ZR, Fang XW, Sun WH, et al. Deactylation by SIRT1 enables
liquid-liquid phase separation of IRF3/IRF7 in innate antiviral
immunity[J]. Nat Immunol, 2022, 23(8): 1193-207.
[17] van der Feen DE, Berger RMF, Bartelds B. Converging paths of
pulmonary arterial hypertension and cellular senescence[J]. Am J
Respir Cell Mol Biol, 2019, 61(1): 11-20.
[18]Stacher E, Graham BB, Hunt JM, et al. Modern age pathology of
pulmonary arterial hypertension[J]. Am J Respir Crit Care Med,
2012, 186(3): 261-72.
[19] van der Feen DE, Bossers GPL, Hagdorn QAJ, et al. Cellular
senescence impairs the reversibility of pulmonary arterial
hypertension[J]. Sci Transl Med, 2020, 12(554): eaaw4974.
[20]Roger L, Tomas F, Gire V. Mechanisms and regulation of cellular
senescence[J]. Int J Mol Sci, 2021, 22(23): 13173.
[21]Tan X, Chen YF, Zou SY, et al. ALDH2 attenuates ischemia and
reperfusion injury through regulation of mitochondrial fusion and
fission by PI3K/AKT/mTOR pathway in diabetic cardiomyopathy
[J]. Free Radic Biol Med, 2023, 195: 219-30.
[22]Zhang YM, Zou RJ, Abudureyimu M, et al. Mitochondrial aldehyde
dehydrogenase rescues against diabetic cardiomyopathy through
GSK3β-mediated preservation of mitochondrial integrity and Parkinmediated
mitophagy[J]. J Mol Cell Biol, 2024, 15(9): mjad056.
[23]李小荣, 鲜 维, 谭 鑫, 等. 线粒体ALDH2通过调控自噬对缺氧性肺
动脉高压的保护机制研究[J]. 蚌埠医学院学报, 2023, 48(1): 66-71.
[24]Masson B, Le Ribeuz H, Sabourin J, et al. Orai1 inhibitors as
potential treatments for pulmonary arterial hypertension[J]. Circ
Res, 2022, 131(9): e102-19.
[25]Al-Qazazi R, Lima PDA, Prisco SZ, et al. Macrophage-NLRP3
activation promotes right ventricle failure in pulmonary arterial
hypertension[J]. Am J Respir Crit Care Med, 2022, 206(5): 608-24.
[26]Veith C, Vartürk-Özcan I, Wujak M, et al. SPARC, a novel regulator
of vascular cell function in pulmonary hypertension[J]. Circulation,
2022, 145(12): 916-33.
[27]Neurohr GE, Terry RL, Lengefeld J, et al. Excessive cell growth
causes cytoplasm dilution and contributes to senescence[J]. Cell,
2019, 176(5): 1083-97. e18.
[28]Park CS, Kim SH, Yang HY, et al. Sox17 deficiency promotes
pulmonary arterial hypertension via HGF/c-met signaling[J]. Circ
Res, 2022, 131(10): 792-806.
[29]Zhang J, Guo YY, Zhao XK, et al. The role of aldehyde
dehydrogenase 2 in cardiovascular disease[J]. Nat Rev Cardiol,
2023, 20(7): 495-509.
[30]Chang SC, Wu J, Jin JF, et al. Aldehyde dehydrogenase 2 (ALDH2)
elicits protection against pulmonary hypertension via inhibition of
ERK1/2-mediated autophagy[J]. Oxid Med Cell Longev, 2022:
2555476.
[31]Zhao Y, Wang BL, Zhang J, et al. ALDH2 (aldehyde dehydrogenase
2) protects against hypoxia-induced pulmonary hypertension[J].
Arterioscler Thromb Vasc Biol, 2019, 39(11): 2303-19.
[32]Shahgaldi S, Kahmini FR. A comprehensive review of Sirtuins: with
a major focus on redox homeostasis and metabolism[J]. Life Sci,
2021, 282: 119803.
[33]Bost F, Kaminski L. The metabolic modulator PGC-1α in cancer[J].
Am J Cancer Res, 2019, 9(2): 198-211.
[34]Kong SF, Cai BL, Nie QH. PGC-1α affects skeletal muscle and
adipose tissue development by regulating mitochondrial biogenesis
[J]. Mol Genet Genomics, 2022, 297(3): 621-33.
[35]Abu Shelbayeh O, Arroum T, Morris S, et al. PGC-1α is a master
regulator of mitochondrial lifecycle and ROS stress response[J].
Antioxidants, 2023, 12(5): 1075.
[36]Singh V, Ubaid S. Role of silent information regulator 1 (SIRT1) in
regulating oxidative stress and inflammation[J]. Inflammation,
2020, 43(5): 1589-98.
[37]Teng WL, Huang PH, Wang HC, et al. Pterostilbene attenuates
particulate matter-induced oxidative stress, inflammation and aging
in keratinocytes[J]. Antioxidants, 2021, 10(10): 1552.
(编辑:吴锦雅)

