Nlrp6过表达通过调控AMPK-Srebp1c轴抑制脂质合成抑制肝癌细胞的增殖
摘要:目的 探讨Nlrp6通过调控脂质合成抑制肝细胞癌(HCC)进展的作用及其机制。方法 通过分析癌症基因组图谱(TCGA)数据库中的RNA-seq 数据和临床信息,评估Nlrp6 在不同病理分级的HCC组织中的表达变化,并进行Kaplan-Meier 生存分析及相关性分析。将腺病毒转染HepG2细胞过表达或敲低Nlrp6,使用棕榈酸(PA)构建肝脂肪变性模型。油红O染色评估Nlrp6对肝癌细胞HepG2 脂质沉积的影响,CCK-8、Edu 染色及克隆形成实验探讨Nlrp6 对HepG2 细胞增殖的影响,实时荧光定量PCR检测脂质合成相关基因的表达,Western blotting 检测AMPK-Srebp1c 轴相关蛋白的表达水平。使用肝脏特异性敲除Nlrp6 小鼠,进行高脂饮食喂养24周,构建动物肝脂肪变性模型。取小鼠肝脏进行组织学染色,检测纤维化及肝癌标志物相关基因的表达,同时验证AMPK-Srebp1c信号通路的变化。结果 生信分析结果显示在HCC患者肝脏组织中,Nlrp6的表达显著降低,且随着病理分级增加而进一步降低,同时Nlrp6 的表达与患者生存期显著相关(Plt;0.0001)。细胞实验结果显示,Nlrp6 过表达抑制了HepG2 细胞的脂质沉积和细胞增殖,而Nlrp6 敲低则产生相反效果(Plt;0.05)。q-PCR结果显示,Nlrp6 可抑制脂质合成相关基因的表达(Plt;0.05),Western blotting 结果表明过表达Nlrp6 可促进AMPK的磷酸化,抑制调控脂质合成的转录因子Srebp1c的表达(Plt;0.05)。而Nlrp6敲低则抑制AMPK的磷酸化,促进Srebp1c的活化(Plt;0.05)。动物组织病理学染色结果表明,肝脏特异性敲除Nlrp6 会促进肝脂肪变性及胶原沉积,q-PCR检测纤维化基因与染色结果一致(Plt;0.05),而肝癌标志物AFP 的表达水平明显上升(P=0.06)。肝脏组织样本Western blotting 结果证实Nlrp6 的缺失会抑制AMPK的磷酸化,上调Srebp1c 的表达(Plt;0.05)。结论 Nlrp6通过AMPK-Srebp1c轴抑制脂质合成,其可能是抑制肝癌细胞增殖的重要途径之一,进而改善HCC的进展。
关键词:Nlrp6;肝癌细胞;增殖;脂质合成;肝脂肪变性
肝癌是全球范围内最常见的恶性肿瘤之一,其发病率和病死率持续攀升。肝细胞癌(HCC)作为肝癌的主要类型,占据了肝癌病例的大部分[1]。肝癌的发展是一个多因素、多步骤的复杂过程,涉及基因突变、表观遗传学变化以及微环境的调控等多个方面[2, 3]。尽管近年来在肝癌的早期检测和治疗方面取得了显著进展,但由于肝癌的复杂性和异质性,其治疗效果仍然不尽人意,预后较差[4]。因此,深入探讨肝癌发生和发展的分子机制,尤其是寻找有效的分子靶点,对于提高肝癌治疗效果具有重要意义。
脂质代谢在肿瘤细胞的生长和增殖中具有重要作用[5]。肿瘤细胞通常表现出异常的脂质代谢,以满足其快速增殖所需的能量和结构物质[5, 6]。脂质不仅是细胞膜的重要组成部分,还参与信号传导、能量储存和代谢调控等多个方面[7]。近年来研究表明,脂质合成和代谢的异常变化与多种肿瘤的发生、发展密切相关[8]。探讨脂质代谢在肝癌中的具体作用机制,特别是其与肿瘤增殖之间的关系,对于开发新型治疗策略具有重要意义。
核苷酸结合寡聚化结构域样受体蛋白6(Nlrp6)是一种定位于胞浆中的模式识别受体,通过调节炎性信号在先天免疫反应、肿瘤发生等方面发挥了重要的作用[9, 10]。本课题组在前期研究中发现,肝脏特异性敲除Nlrp6加剧蛋氨酸和胆碱缺乏饮食诱导的非酒精性脂肪性肝炎和肝纤维化的进展[11]。然而,Nlrp6是否可以通过调节脂质合成抑制HCC的进展尚不明确。因此,本研究旨在探讨Nlrp6是否通过调控脂质合成抑制HCC进展,为肝癌的防治提供新的理论依据和实践指导。
1 材料和方法
1.1 实验材料
RPMI 1640 培养基(Cytiva);胎牛血清(BI);棕榈酸(Sigma-Aldrich);油红O 染色试剂盒(BASO);CCK-8试剂盒(同仁化学研究所);Edu试剂盒(锐博生物);逆转录试剂盒(TAKARA);Nlrp6一抗(ABclonal,1∶1000)、Srebp1c 一抗(ABclonal, 1∶1000)、Phospho-AMPKa1-T183/AMPKa2-T172 一抗(ABclonal,1∶1000);AMPKα 一抗(Cell Signaling Technology,1∶2000);β-tubulin一抗(Zen Bio Science,1∶4000)。
1.2 实验设备
生物安全柜(型号AC2-6S8-CN);二氧化碳培养箱(上海力康);低温高速离心机(上海力申);荧光倒置显微镜(德国徕卡);电泳仪(Bio-rad);微量核酸蛋白测定仪(BioPhotometer plus);化学发光仪(上海勤翔);全自动生化分析仪(德国罗氏公司)。
1.3 实验动物
本研究所用肝细胞特异性敲除Nlrp6小鼠(以下简称LKO小鼠)及其对照小鼠(以下简称Loxp小鼠)均由Cyagen Biosciences公司构建。本研究所用小鼠均饲养于本校实验动物中心SPF 级实验动物房。室内温度25 ℃,相对湿度55%±15%,昼夜交替周期12 h。本研究已通过动物伦理审查,且按照实验动物伦理规范进行相关操作(伦理审批号:202205010B)。
1.4 实验方法
1.4.1 细胞及实验动物造模 细胞造模:采用0.5 μmol/LPA刺激肝癌细胞HepG2 24 h构建脂肪变性模型;动物造模:选用8周龄雄性的 Loxp和 LKO小鼠(n=6),给予高脂饲料喂养,24周后进行取材。
1.4.2 油红O染色 将细胞给予腺病毒转染后,再经PA刺激24 h;吸弃培养基,用PBS洗3 次;加入4%多聚甲醛,室温固定 15 min,固定后用PBS洗 3次;加入油红O工作液,室温染色 30 min,用PBS清洗后,在显微镜下观察并采集图像。
1.4.3 CCK-8实验 将细胞给予腺病毒转染后,再经PA刺激24 h;吸弃培养基,PBS洗1次。避光条件下每孔加入100 μL的CCK-8工作液(完全培养基∶CCK-8试剂=9∶1),在37 ℃培养箱中孵育2 h,酶标仪检测在450 nm处的吸光度值。
1.4.4 克隆形成实验 取对数期的细胞约200 /孔接种到6 孔板中,给予腺病毒转染;用0.25 μmol/L PA持续刺激,将细胞置于培养箱中, 2 d/次进行换液,7 d后吸弃培养基,用4%多聚甲醛进行固定,PBS清洗后加入结晶紫进行染色拍照。
1.4.5 mRNA提取及实时荧光定量PCR 将细胞给予腺病毒转染后,再经PA刺激24 h;将6孔板置于冰上,向孔板中加入1 mL trizol,反复吹打使细胞充分裂解;加入200 μL氯仿,剧烈振荡,4 ℃,12 000 r/min条件下离心;吸取上层液体加入等量异丙醇离心后保留白色沉淀;用75% 乙醇(DEPC水配制)清洗沉淀后加入适量DEPC水溶解,并检测RNA浓度。
检测RNA浓度后,逆转录体系使用Takara逆转录试剂盒说明书中的20 μL体系,体系中所用 RNA总量为1000 ng。逆转录后采用SYBR Green法检测 mRNA的表达水平。
1.4.6 Western blotting 将细胞给予腺病毒转染后,再经PA刺激24 h;加入蛋白裂解收集细胞蛋白。将收集好的蛋白在配制好的凝胶中进行点样,在120 V恒压下进行电泳,直至溴酚蓝指示剂到达底部;随后使用PVDF膜进行转膜,在200 mA恒流电转2 h;转膜结束后,取出PVDF膜置于封闭液中,室温封闭1 h。将封闭好的PVDF膜置于抗体孵育盒中,加入适当比例稀释的一抗,4 ℃孵育过夜。TBST清洗后加入二抗室温孵育1 h;TBST清洗3次,加入ECL显影液进行显影。
1.4.7 组织学染色 小鼠取材后,置于10%中性福尔马林浸泡固定。经脱水、透明后,进行石蜡包埋、切片。按试剂盒操作说明进行HE、Masson及天狼猩红染色。
1.4.8 统计学方法 所有实验数据均采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差表示;两组间比较采用独立样本t检验,Plt;0.05 即认为差异具有统计学意义。
2 结果
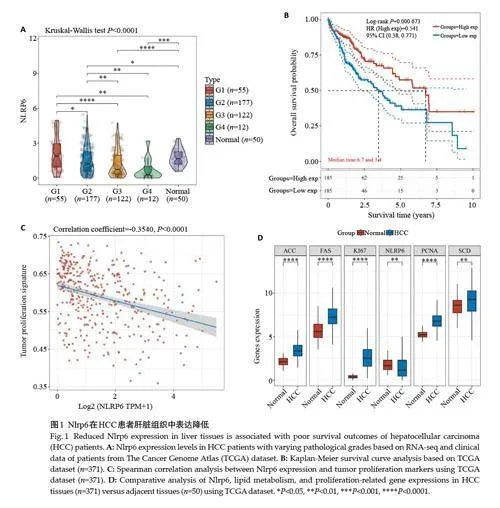
2.1 Nlrp6 在HCC患者肝脏组织中表达降低并改善患者生存期
TCGA数据库获得了肝脏肿瘤的RNA-seq数据和相应的临床信息,分析发现,HCC患者组织中Nlrp6的表达量显著低于癌旁组织。随着HCC病理分级增加,Nlrp6 的表达显著降低(图1A)。Kaplan-Meier 生存分析显示,Nlrp6 高表达患者生存期明显高于Nlrp6 低表达患者(图1B)。Spearman相关性分析结果显示,Nlrp6的表达与肿瘤增殖相关分子呈负相关(图1C)。同时,在HCC患者组织中,Nlrp6表达降低,而脂质合成相关基因(Acc、Fas、Scd-1)及增殖相关基因(Ki67、PCNA)显著增加。
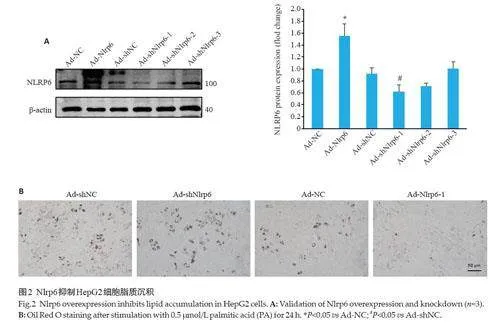
2.2 Nlrp6抑制肝癌细胞脂质沉积
Ad-Nlrp6 转染后显著上调Nlrp6 的表达,而AdshNlrp6-1具有较好的敲低效果,因此使用Ad-shNlrp6-1继续开展后续实验(Plt;0.05,图2A)。下调Nlrp6会促进HepG2 细胞脂质沉积,而上调Nlrp6 则抑制细胞脂质沉积(图2B)。
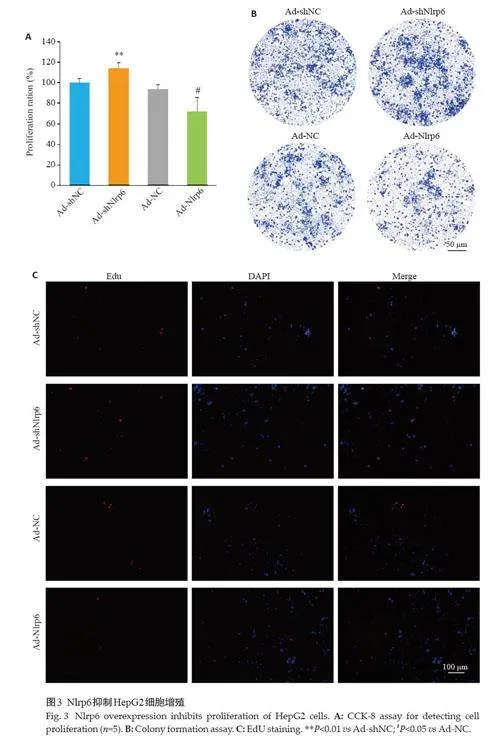
2.3 Nlrp6抑制HepG2细胞增殖
下调Nlrp6会促进HepG2细胞增殖,而上调Nlrp6则抑制肝癌细胞增殖(Plt;0.05,图3)。
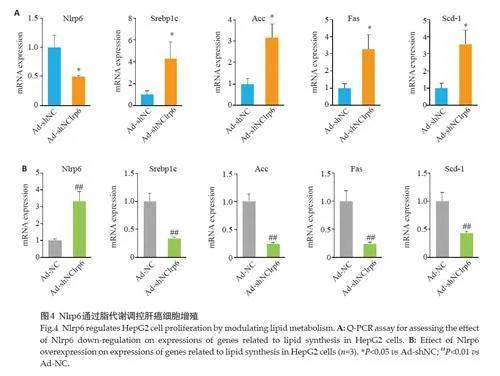
2.4 Nlrp6通过脂代谢调控肝癌细胞增殖
下调Nlrp6会促进脂质合成基因表达,而上调Nlrp6则抑制脂质合成基因的表达(Plt;0.05,Plt;0.01,图4)。
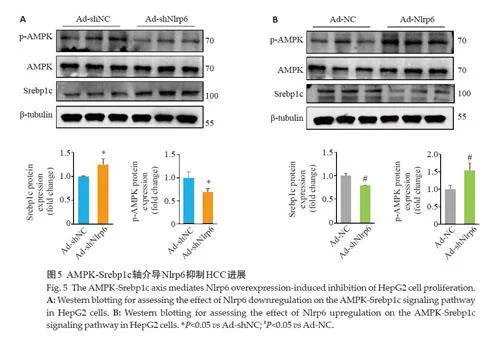
2.5 AMPK-Srebp1c轴介导Nlrp6抑制HepG2细胞增殖
Nlrp6的敲低抑制了AMPK的磷酸化,进而促进了Srebp1c 的活化,而过表达Nlrp6 可通过促进AMPK的磷酸化抑制Srebp1c的表达(Plt;0.05,图5)。
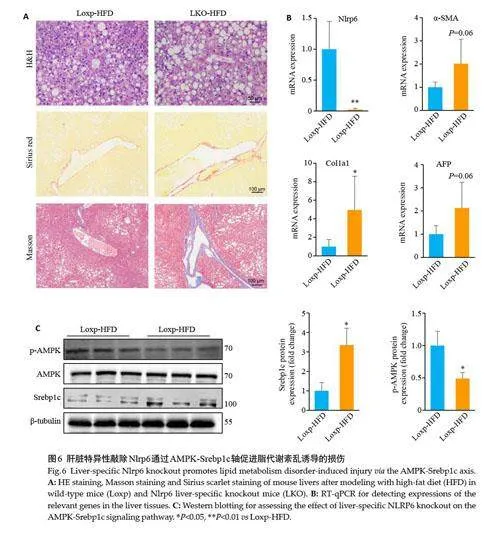
2.6 肝脏特异性敲除Nlrp6通过AMPK-Srebp1c轴促进脂代谢紊乱诱导的损伤
造模24 周后,HE染色显示LKO小鼠肝脏脂质沉积显著加剧,Masson及天狼猩红染色结果表明,与对照小鼠相比,LKO小鼠胶原沉积更为明显(图6A),同时纤维化相关基因的检测结果也与染色一致(图6B)。此外,肝癌标志物AFP的表达水平明显上升(图6B)。肝脏特异性敲除Nlrp6抑制AMPK的磷酸化激活,进而促进Srebp1c的表达(图6C)。
3 讨论
Nlrp6是NLR家族中的一员,最初被发现为肠道健康和免疫调节的重要调控因子[12]。近年来,关于Nlrp6在肿瘤及癌症中的作用逐渐受到关注。其在癌症中的作用复杂多样,既有抑制肿瘤生长的功能,也存在促进肿瘤发展的潜在风险[13, 14]。在肿瘤微环境中,髓源性抑制细胞(MDSCs)已成为免疫调节的关键因素,研究发现在结直肠癌肝转移模型中,Nlrp6缺失可调节单核细胞MDSC诱导的免疫抑制微环境抑制结直肠癌肝转移生长[15]。同时,Zhi等[16]研究发现Nlrp6的缺失会抑制胶质母细胞瘤细胞在体外和体内的增殖、细胞迁移和肿瘤生长,其机制与Nlrp6通过选择性自噬促进p85α降解,从而推动肿瘤发生相关。而在胃癌的研究中,Wang等[17]研究发现Nlrp6 通过Pyrin 结构域与GRP78 结合,进而促进GRP78的多泛素化抑制胃癌细胞的增殖及迁移。此外,研究还发现Nlrp6在保护上皮屏障的完整性中发挥了重要作用,其通过调节组织修复来抑制炎症和结直肠癌发生[18]。然而Nlrp6在HCC中作用尚未明确。
脂质代谢紊乱与HCC的发生密切相关,在HCC发生的初期阶段,脂质代谢紊乱可能导致脂质过氧化、细胞膜的结构和功能异常,从而增加细胞的恶性转化风险[5, 19]。同时,脂质代谢紊乱可能通过调节细胞凋亡和增殖信号通路,影响肝细胞的生长和增殖,进而促进肿瘤的形成[20]。此外,脂质代谢紊乱还可能影响肝细胞的免疫调节功能,从而降低机体对肿瘤细胞的识别和清除能力,进一步促进肝细胞癌的发展[21]。
本研究通过提取数据库中肝癌患者的临床数据综合分析,发现Nlrp6 在肝癌组织中的表达水平显著降低,并且随着肿瘤分级的增加而进一步下降,同时Nlrp6的表达水平与肿瘤增殖相关分子呈负相关,提示Nlrp6 可能通过抑制肿瘤细胞增殖等过程抑制肝癌的进展。而进一步的实验结果表明,Nlrp6过表达能够抑制肝癌细胞HepG2 的脂质沉积,而Nlrp6 的敲低则促进了细胞脂质沉积。脂质合成或摄取的增强会促进癌细胞的快速生长和肿瘤的形成。因此,Nlrp6通过调节脂质合成水平可能是其抑制肝癌细胞增殖的一个重要机制。
脂质合成过程涉及多个关键酶和信号通路的调节,包括乙酰辅酶A羧化酶(Acc)、脂肪酸合成酶(Fas)、硬脂酰辅酶A去饱和酶-1(Scd-1)等[22]。而Srebp1C作为重要的转录因子,可直接调控Acc、Fas和Scd-1等关键脂质合成酶的基因表达[23, 24]。在肝细胞癌中,这些脂质合成相关基因的异常表达可导致脂质合成途径的过度激活,进而促进肿瘤细胞的增殖[25-27]。而本研究显示,Nlrp6 的过表达能够抑制肝癌细胞HepG2 的增殖。进一步检测相关基因的表达发现,Nlrp6抑制脂质合成相关基因(如Srebp1c、Acc、Fas、Scd-1)的表达。因此,Nlrp6可能通过调节脂质代谢水平抑制肝癌细胞增殖。
为了进一步探讨Nlrp6 对肝癌细胞脂质合成的调控机制,我们检测了AMPK-Srebp1c信号通路,结果表明Nlrp6 敲减抑制了AMPK 的磷酸化,进而促进了Srebp1c 的活化,而过表达Nlrp6 可通过促进AMPK的磷酸化抑制Srebp1c的表达,因此AMPK-Srebp1c信号通路是Nlrp6 调控脂质合成的重要机制。肝癌的发生和发展是一个复杂的过程,可能受到多种调控方式以及多个信号通路的调控,例如,除了脂质合成,过量的脂肪酸摄取也会导致细胞内脂质沉积,进而调节细胞信号传导、能量代谢和细胞周期等关键生物过程[25, 28]。因此,有关Nlrp6 对HCC进展更为全面的机制有待进一步探究。
综上所述,本研究揭示了Nlrp6 在HCC中的重要作用及其调控机制。Nlrp6通过AMPK-Srebp1c轴介导的脂质合成,其可能是抑制肝癌细胞的增殖的重要途径之一,从而改善肝癌的进展。本研究为进一步理解肝癌发生和发展的分子机制提供了新的思路,并为开发新型的肝癌治疗策略提供了理论基础。
参考文献:
[1] Naing C, Ni H, Aung HH, et al. Gene therapy for people with
hepatocellular carcinoma[J]. Cochrane Database Syst Rev, 2024, 6
(6): CD013731.
[2] Su XR, Li YX, Ren YP, et al. A new strategy for overcoming drug
resistance in liver cancer: Epigenetic regulation[J]. Biomedecine
Pharmacother, 2024, 176: 116902.
[3] Hu N, Li HY, Tao CC, et al. The role of metabolic reprogramming in
the tumor immune microenvironment: mechanisms and
opportunities for immunotherapy in hepatocellular carcinoma[J].
Int J Mol Sci, 2024, 25(11): 5584.
[4] Urquijo-Ponce JJ, Alventosa-Mateu C, Latorre-Sánchez M, et al.
Present and future of new systemic therapies for early and
intermediate stages of hepatocellular carcinoma[J]. World J
Gastroenterol, 2024, 30(19): 2512-22.
[5] Cao LQ, Xie YH, Fleishman JS, et al. Hepatocellular carcinoma and
lipid metabolism: novel targets and therapeutic strategies[J]. Cancer
Lett, 2024, 597: 217061.
[6] Maurotti S, Geirola N, Frosina M, et al. Exploring the impact of lipid
droplets on the evolution and progress of hepatocarcinoma[J]. Front
Cell Dev Biol, 2024, 12: 1404006.
[7] Zhang JQ, Zhang ZC, Wu ZF, et al. The switch triggering the
invasion process: Lipid metabolism in the metastasis of
hepatocellular carcinoma[J]. Chin Med J, 2024, 137(11): 1271-84.
[8] Karin M, Kim JY. MASH as an emerging cause of hepatocellular
carcinoma: current knowledge and future perspectives[J]. Mol
Oncol, 2024: 13685.
[9] Sharma BR, Kanneganti TD. Inflammasome signaling in colorectal
cancer[J]. Transl Res, 2023, 252: 45-52.
[10]Venuprasad K, Theiss AL. NLRP6 in host defense and intestinal
inflammation[J]. Cell Rep, 2021, 35(4): 109043.
[11]Huang CY, Liu QH, Tang Q, et al. Hepatocyte-specific deletion of
Nlrp6 in mice exacerbates the development of non-alcoholic
steatohepatitis[J]. Free Radic Biol Med, 2021, 169: 110-21.
[12]Angosto-Bazarra D, Molina-López C, Pelegrín P. Physiological and
pathophysiological functions of NLRP6: pro- and anti-inflammatory
roles[J]. Commun Biol, 2022, 5(1): 524.
[13]Chang LZ, Tian YY, Xu L, et al. Spotlight on NLRP6 and tumor
research situation: a potential cancer participant[J]. J Immunol Res,
2023, 2023: 6613064.
[14]Karki R, Man SM, Kanneganti TD. Inflammasomes and cancer[J].
Cancer Immunol Res, 2017, 5(2): 94-9.
[15]Chang LZ, Xu L, Tian YY, et al. NLRP6 deficiency suppresses
colorectal cancer liver metastasis growth by modulating M-MDSCinduced
immunosuppressive microenvironment[J]. Biochim
Biophys Acta Mol Basis Dis, 2024, 1870(3): 167035.
[16]Zhi F, Li BW, Zhang CX, et al. NLRP6 potentiates PI3K/AKT
signalling by promoting autophagic degradation of p85α to drive
tumorigenesis[J]. Nat Commun, 2023, 14(1): 6069.
[17]Wang XY, Wu XW, Wang QQ, et al. NLRP6 suppresses gastric
cancer growth via GRP78 ubiquitination[J]. Exp Cell Res, 2020,
395(1): 112177.
[18]Normand S, Delanoye-Crespin A, Bressenot A, et al. Nod-like
receptor pyrin domain-containing protein 6 (NLRP6) controls
epithelial self-renewal and colorectal carcinogenesis upon injury[J].
Proc Natl Acad Sci U S A, 2011, 108(23): 9601-6.
[19]Rivera-Esteban J, Muñoz-Martínez S, Higuera M, et al. Phenotypes
of metabolic dysfunction-associated steatotic liver diseaseassociated
hepatocellular carcinoma[J]. Clin Gastroenterol Hepatol,
2024, 22(9): 1774-89. e8.
[20]Feng TY, Li SQ, Zhao G, et al. DDX39B facilitates the malignant
progression of hepatocellular carcinoma via activation of SREBP1-
mediated de novo lipid synthesis[J]. Cell Oncol, 2023, 46(5):
1235-52.
[21]Banerjee A, Das D, Mukherjee S, et al. Comprehensive study of the
interplay between immunological and metabolic factors in hepatic
steatosis[J]. Int Immunopharmacol, 2024, 133: 112091.
[22]Zhang XY, An T, Zhang XY, et al. DDX17 protects hepatocytes
against oleic acid/palmitic acid-induced lipid accumulation[J].
Biochem Biophys Res Commun, 2022, 612: 169-75.
[23]Yuan YM, Xu JT, Jiang QX, et al. Ficolin 3 promotes ferroptosis in
HCC by downregulating IR/SREBP axis-mediated MUFA synthesis
[J]. J Exp Clin Cancer Res, 2024, 43(1): 133.
[24]Li N, Li XD, Ding YF, et al. SREBP regulation of lipid metabolism
in liver disease, and therapeutic strategies[J]. Biomedicines, 2023,
11(12): 3280.
[25]Wu KZ, Lin FZ. Lipid metabolism as a potential target of liver cancer
[J]. J Hepatocell Carcinoma, 2024, 11: 327-46.
[26]Feng SH, Han M, Zhou L, et al. NS5ABP37 inhibits liver cancer by
impeding lipogenesis and cholesterogenesis[J]. Cancer Sci, 2017,
108(1): 12-22.
[27]Onorato AM, Fiore E, Bayo J, et al. SPARC inhibition accelerates
NAFLD-associated hepatocellular carcinoma development by
dysregulating hepatic lipid metabolism[J]. Liver Int, 2021, 41(7):
1677-93.
[28]Hong J, Liu J, Zhang YN, et al. MiR-3180 inhibits hepatocellular
carcinoma growth and metastasis by targeting lipid synthesis and
uptake[J]. Cancer Cell Int, 2023, 23(1): 66.
(编辑:经 媛)

