槲皮素通过抑制NLRP3/Caspase-1/GSDMD信号通路抑制小鼠成纤维细胞焦亡

摘要:目的 探究槲皮素通过NOD样受体热蛋白结构域相关蛋白3(NLRP3)/含半胱氨酸的天冬氨酸蛋白水解酶1(Caspase-1)/消皮素D(GSDMD)信号通路调控小鼠成纤维细胞(NIH-3T3)焦亡的影响及其机制。方法 实验分为对照(Control)组、模型(Model)组、槲皮素(HPS)组、NLRP3特异性抑制剂(MCC950)组。CCK-8法检测槲皮素对NIH-3T3细胞活力的影响。光镜下观察细胞形态变化,ELISA检测白细胞介素(IL)-18、IL-1β 含量,Western blotting 和qRT-PCR检测NLRP3、活化半胱氨酸蛋白酶 1(Cleaved caspase-1)、GSDMD-N蛋白表达及NLRP3、Caspase-1、GSDMD mRNA水平。TUNEL染色及乳酸脱氢酶(LDH)释放实验检测细胞焦亡情况。结果 槲皮素作用于NIH-3T3 细胞最佳干预浓度和时间分别是20 μmol/L和24 h。与Control组相比,Model 组细胞出现明显肿胀、破裂、细胞内容物流出,IL-18、IL-1β 含量和NLRP3、Cleaved caspase-1、GSDMD-N蛋白表达及NLRP3、Caspase-1、GSDMD mRNA 水平均明显升高(Plt;0.001,Plt;0.0001),TUNEL 染色的阳性细胞数及LDH 释放量增加(Plt;0.0001)。与Model组相比,HPS组和MCC950组细胞焦亡情况改善,IL-18、IL-1β含量和NLRP3、Cleaved caspase-1、GSDMD-N蛋白表达及NLRP3、Caspase-1、GSDMD mRNA水平显著降低(Plt;0.01,Plt;0.001),TUNEL染色阳性细胞数及LDH释放量明显减少(Plt;0.0001)。结论 槲皮素可能通过抑制NLRP3/Caspase-1/GSDMD信号通路抑制成纤维细胞焦亡,下调炎症因子释放从而发挥治疗作用。
关键词:槲皮素;细胞焦亡;NLRP3;成纤维细胞
慢性输卵管炎(CS)是妇科常见疾病,多因支原体、沙眼衣原体、淋病奈瑟菌等病原体感染逆行至输卵管所致[1]。研究显示,育龄期妇女的发病率为0.6%~11%[2]。炎症长期刺激可导致输卵管组织纤维化,使其拾卵、运卵等功能受阻,进而诱发不孕。目前临床多用抗生素治疗,但副作用较大,炎症引起的纤维化病变亦无明显改善。因此,探索CS发病机制,寻找有效的治疗靶点具有重要意义。
细胞焦亡是一种促炎性细胞死亡[3, 4],NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体是细胞焦亡的关键分子[5],在呼吸、消化、免疫等多个系统的炎症性疾病中均被证实存在NLRP3 炎症小体的异常激活[6-8]。研究发现,NLRP3 炎症小体介导的经典焦亡途径在CS的发病机制中扮演重要角色[9]。输卵管炎性大鼠中存在NLRP3炎症小体活化,促使含半胱氨酸的天冬氨酸蛋白水解酶1(Caspase-1)剪切体形成,进而诱导消皮素D(GSDMD)裂解,引起细胞膜破裂,白细胞介素(IL)-18 和IL-1β 释放,加重CS 大鼠输卵管组织损伤[10, 11]。因此,通过调控NLRP3/Caspase-1/ GSDMD信号通路,可能是抑制CS细胞焦亡发生的关键环节。
课题组前期研究发现膈下逐瘀汤加减方治疗CS疗效显著[2, 12],可有效改善患者输卵管通畅度、提高妊娠率,同时缓解CS大鼠输卵管肿胀、管壁增厚、盆腔粘连等炎症情况,降低IL-6、IL-8以及转化生长因子等的表达,抑制炎性损伤。目前中药复方疗效确切,槲皮素为其主要有效成分[13],具有较好的抗炎功效,在多种炎症性疾病中应用广泛[14-16]。研究表明,槲皮素可通过抑制NLRP3 炎症小体激活减轻炎症反应,同时根据生物信息学分析发现,NLRP3可能是CS的关键调控因子[11],但槲皮素是否通过抑制NLRP3/Caspase-1/GSDMD来改善CS,进而抑制输卵管纤维化的发生,目前尚未见报道。此外,对于CS的机制研究多集中在体内实验,缺乏有效的体外细胞实验验证。MCC950是一种特异性小分子抑制剂,可选择性阻断NLRP3炎症小体激活[17]。基于此,本实验选取小鼠成纤维细胞(NIH-3T3)为研究对象,采用脂多糖(LPS)联合三磷酸腺苷(ATP)诱导成纤维细胞焦亡模型,观察槲皮素处理后的变化,并与MCC950进行阳性对照,以揭示槲皮素调控CS的分子机制。
1 材料和方法
1.1 细胞
小鼠胚胎成纤维细胞(武汉梓杉生物)。
1.2 药品与试剂
LPS(上海语纯);三磷酸腺苷(北京金克隆);槲皮素(MCE);MCC950(MCE);DMEM高糖培养基、胎牛血清、青链霉素混合液(武汉塞维尔);二甲基亚砜DMSO(BioFroxx);胰酶消化液、磷酸盐缓冲液、无血清细胞冻存液、CCK-8试剂盒、通用型细胞组织固定液、逆转录试剂盒、qRT-qPCR试剂盒、BCA 蛋白浓度测定试剂盒、彩色快速凝胶配制试剂盒(北京赛文);RIPA裂解液(上海碧云天),Trizol 试剂(Thermo);小鼠IL-18、IL-1β酶联免疫吸附测定试剂盒(江莱生物);GSDMDantibody N-terminal(ImmunoWay);NLRP3 Antibody(武汉Proteintech),Cleaved caspase-1(Ala317) p10antibody(江苏Affinity Biosciences)、GAPDH antibody(上海爱必信);HRP Goat Anti-Rabbit IgG(H+L)(Immunoway);一步法TUNEL 细胞凋亡检测试剂盒(上海碧云天);乳酸脱氢酶(LDH)活性检测试剂盒(北京索莱宝)。
1.3 仪器
超微量分光光度计(Implen);酶标仪(PerkinElmer);荧光倒置显微镜(奥林巴斯);数显恒温振荡器(江苏金坛吉特);荧光定量Pcr仪(Roche),电子分析天平(OHAUS),电泳仪、半干转印电泳槽、凝胶成像仪(BIO-RAD);离心机(Beckman Coulter)等。
1.4 细胞培养
NIH-3T3 细胞置于含有10%胎牛血清、0.5%青链霉素混合液的DMEM培养基,于37 ℃、5%CO2的恒温箱内培养,隔日更换1 次培养基,待细胞生长密度于80%~90%时进行传代及后续实验操作。
1.5 细胞分组与处理
细胞分为4组:对照(Control)组,模型(Model)组,槲皮素(HPS)组,NLRP3 特异性抑制剂(MCC950)组。干预方法如下:Control组给予完全培养基培养;Model组采用1 μg/mL LPS联合5mmol/L ATP制备细胞焦亡模型;HPS组于LPS联合ATP诱导的焦亡模型前,根据“1.6CCK-8法检测槲皮素对细胞活力的影响”的实验结果,给予20 μmol/L的槲皮素预处理24 h;MCC950组在Model组的基础上给予1 μmol/L的NLRP3特异性抑制剂MCC950预处理1 h。
1.6 CCK-8法检测槲皮素对细胞活力的影响
将细胞计数后接种至96 孔培养板,细胞密度为3000(/ 100 μL·孔),依次设置0、5、10、20、40、80、160 μmol/L浓度的槲皮素处理细胞,每个浓度设置5 个复孔,培养24、48、72 h 后,每孔加入10 μL的CCK-8 溶液,恒温箱孵育2 h,酶标仪测450 nm处各孔的吸光度,并计算相对于对照组的细胞活性百分比。
1.7 细胞形态学观察
将NIH-3T3细胞接种至6孔板中(1×105/mL,2 mL/孔)。待细胞长满孔底后,给予“1.5细胞分组与处理”所述方法干预,处理结束后在光学显微镜下观察各组细胞形态,并于200倍数采集图像。
1.8 ELISA检测IL-18、IL-1β含量
将NIH-3T3细胞按照“1.5细胞分组与处理”所述方法处理后,采用EP管收集各组细胞上清液,按照ELISA试剂盒说明书进行操作,待测样品及标准品均设置3个复孔,最后在酶标仪测定450 nm处的吸光值,根据公式计算出各组细胞上清液IL-18、IL-1β含量。
1.9 实时荧光定量PCR(qRT-PCR)检测NIH-3T3 细胞内NLRP3、Caspase-1、GSDMD mRNA表达
采用Trizol 法提取细胞RNA,通过分光光度计测定所提取RNA浓度及质量,根据逆转录试剂盒说明书将mRNA逆转录为cDNA,以此为模版,进行荧光定量PCR检测。反应程序如下:95 ℃预变性30 s,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共45个循环。扩增结果采用2‐ΔΔCt法分析。实验所需引物均由安徽通用生物公司提供,引物序列:NLRP3,正向-GACCAGCCAGAGTGGAATGA,反向-CTTCAAGGCTGTCCTCCTGG;GSDMD,正向-AGTGCTCCAGAACCAGAACCG,反向-TCTGCCCTGAATGTTCCCATC;Caspase-1,正向-CTATGGACAAGGCACGGGAC,反向-TCAGCTGATGGAGCTGATTGA;β-actin,正向-AGCCATGTACGTAGCCATCCA,反向-TCTCCGGAGTCCATCACAATG。
1.10 Western blotting 检测NIH-3T3 细胞内NLRP3、Cleaved caspase-1、GSDMD-N蛋白表达
各组细胞加入总蛋白提取试剂(RIPA裂解液+蛋白酶抑制剂),冰上裂解30 min,4 ℃条件下12 000 r/min离心5 min,取上清液。采用BCA蛋白检测试剂盒检测蛋白浓度。蛋白经100 ℃变性后上样,每孔20 μg,SDS⁃PAGE 凝胶电泳分离样品蛋白,转印至聚偏二氟乙烯(PVDF)膜,5%脱脂奶粉封闭2 h 后,加入一抗NLRP3(1∶ 1000)、Cleaved caspase-1(1∶ 1000)、GSDMD-N(1∶1000)、GAPDH(1∶10 000),4℃孵育过夜,TBST洗膜后加入Goat Anti-Rabbit IgG(1∶10 000),摇床室温孵育1 h。洗膜后经ECL化学发光剂显影,应用ImageJ软件计算条带的灰度值进行定量分析。
1.11 TUNEL染色检测细胞DNA损伤情况
各组细胞采用4%多聚甲醛固定30 min,清洗后加入含0.3% Triton X-100 的PBS,室温孵育5 min。每组样本加入50 μL TUNEL检测液,37 ℃避光孵育60 min。PBS清洗,加入抗荧光淬灭封片液封片,荧光显微镜200倍数下观察各组细胞染色情况并采集图像。
1.12 乳酸脱氢酶(LDH)释放实验检测细胞膜损伤情况
按照LDH活性检测试剂盒说明书操作,测定组、对照组和标准组均设置3 个复孔,配制相应溶液,混合均匀,室温放置3 min后在酶标仪450 nm下测定吸光度,根据公式计算出各组细胞上清液中LDH释放量。
1.13 统计学方法
采用SPSS 25.0 和GraphPad Prism 9 软件统计分析,计量数据以均数±标准差表示,多组间比较应用单因素方差分析,以Plt;0.05为差异具有统计学意义。
2 结果
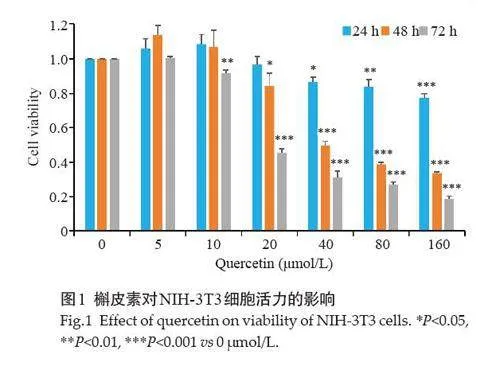
2.1 槲皮素对NIH-3T3细胞活力的影响
将浓度0、5、10、20、40、80、160 μmol/L的槲皮素作用于NIH-3T3 细胞24、48、72 h 后。与0 μmol/L相比,除5、10 μmol/L外,槲皮素其余浓度处理细胞后,细胞活力呈现剂量和时间依赖性,即随着时间及药物浓度的增加,细胞活力逐渐降低。当药物浓度立 20 μmol/L,处理24 h,细胞活力最接近对照组,为减少药物干扰作用,故选此用于后续实验的干预条件(图1)。
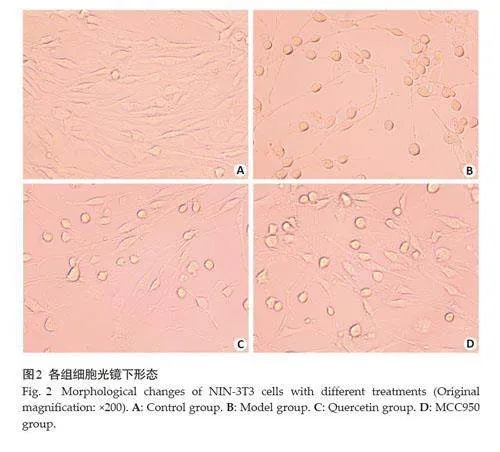
2.2 细胞焦亡形态观察
与Control 组相比,Model 组、HPS 组、MCC950 组细胞形态均发生改变,Model组细胞肿胀、扩张较为明显,细胞膜出现破裂,胞质皱缩,泡状内容物流出,此为细胞焦亡的典型表现。HPS组和MCC950组细胞肿胀、破裂等情况呈现不同程度改善(图2)。
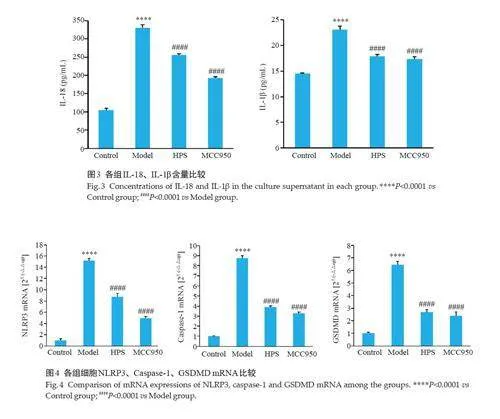
2.3 槲皮素对NIH-3T3细胞IL-18、IL-1β的影响
ELISA检测结果显示,与Control组相比,Model组细胞上清液中IL-18、IL-1β含量明显升高(Plt;0.0001);与Model 组相比,HPS 组和MCC950 组的IL-18、IL-1β含量显著下降(Plt;0.0001,图3)。
2.4 槲皮素对NIH-3T3 细胞焦亡相关mRNA 水平的影响
qRT-PCR检测结果显示,与Control组相比,Model组细胞内NLRP3、Caspase-1、GSDMD mRNA 水平显著升高(Plt;0.0001);与Model组相比,HPS组和MCC950组的各mRNA水平均明显降低(Plt;0.0001,图4)。
2.5 槲皮素对NIH-3T3细胞焦亡相关蛋白表达的影响
Western blotting检测结果显示,与Control组相比,Model 组细胞中NLRP3、Cleaved caspase-1、GSDMDN的蛋白表达显著升高(Plt;0.001,Plt;0.0001);与Model组相比,HPS组和MCC950组各蛋白表达降低(Plt;0.01,Plt;0.001,图5)。
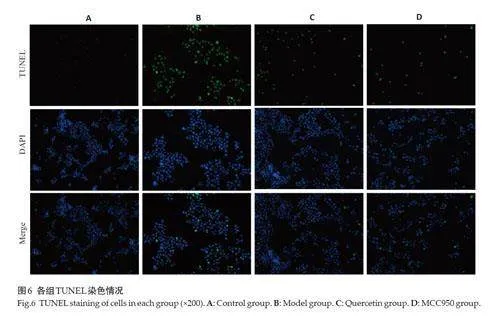
2.6 TUNEL染色检测NIH-3T3细胞DNA损伤情况
TUNEL 染色检测结果显示,与Control 组相比,Model 组细胞阳性细胞明显增多。槲皮素和MCC950组阳性细胞数明显低于Model组(图6)。
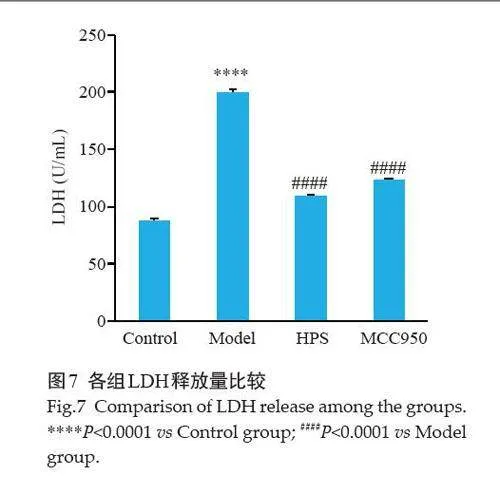
2.7 LDH释放实验检测NIH-3T3细胞膜损伤情况
LDH释放实验结果显示,与Control组相比,Model组细胞上清液中LDH 含量明显升高(Plt;0.0001);与Model 组相比,HPS 组和MCC950 组LDH含量均显著降低(Plt;0.0001,图7)。
3 讨论
成纤维细胞是炎症和纤维化的主要效应细胞[18],慢性炎症的持续存在,刺激成纤维细胞分化为肌成纤维细胞,分泌趋化因子、活性氧等,加重炎症反应,引起细胞外基质沉积,组织纤维化。抑制成纤维细胞激活可能是调控炎症、减轻纤维化的重要途径。在肺、肝、肾等器官的炎症性疾病中,NLRP3 炎症小体介导的细胞焦亡是引起组织炎症-纤维化病变的关键靶点[19-21]。本实验选用LPS联合ATP构建体外细胞焦亡模型,给予槲皮素干预,与MCC950进行对照,在细胞水平上探索CS的发病机制。
目前LPS联合ATP是体外细胞焦亡模型的常用方法[22, 23]。LPS作为细菌外壁的组成成分,可通过信号转导系统激活免疫细胞,释放多种炎性介质,诱发炎症反应。ATP是体内能量储存物质,亦是炎症反应重要内源性信号分子,与LPS联合可激活NLRP3炎症小体介导的经典焦亡途径。细胞经LPS联合ATP处理后,光学显微镜下可见其发生明显肿胀,部分细胞膜破裂,泡状内容物流出等形态改变,与Liu等[24]描述的形态相似。给予槲皮素和MCC950干预后,上述状况明显减轻。在细胞焦亡过程中,伴随着DNA 断裂和细胞膜穿孔[25]。TUNEL染色可检测DNA断裂以证明细胞损伤[26],研究结果显示Model 组细胞TUNEL染色阳性细胞数明显高于HPS组和MCC950组。同时,LDH可通过孔隙释放到胞外,因而通过检测细胞上清液中LDH含量,可量化细胞膜损伤情况。经槲皮素和MCC950 处理后,LDH的释放量明显减少,间接证实细胞膜损伤情况较Model组少。相似的结果也发生在肺损伤和肠道损伤等的体外研究中,兰悦嘉等[27]采用LPS 联合ATP 处理THP-1 细胞,细胞焦亡率、LDH 释放量均显著增加。Zhang等[28]应用槲皮素干预LPS+ATP联合诱导的大鼠肠道微血管内皮细胞,结果显示细胞焦亡水平明显改善,与MCC950 的作用类似。上述结果表明LPS 联合ATP诱导成纤维细胞发生焦亡损伤,出现形态改变,而槲皮素可抑制这一作用。
NLRP3 是机体免疫和炎症反应的关键调节蛋白,经受外来病原体和内源性危险信号而激活,进而启动NLRP3 炎症小体(NLRP3-ASC-Caspase-1)组装。Caspase-1 是NLRP3 炎症小体的效应蛋白,活化前,以无活性的procaspase-1存在于胞内,通过炎症小体的组装,裂解为Cleaved caspase-1,之后将致炎因子前体pro-IL-18、pro-IL-1β剪切为成熟的IL-18、IL-1β[29-31]。另一方面,Cleaved caspase-1可识别并切割焦亡的关键执行蛋白——GSDMD特定位点,高亲和力的结合具有抑制性的GSDMD-C 结构域并释放GSDMD-N结构域[32]。后者附着于细胞膜,并发生寡聚化以形成焦亡孔,IL-1β和IL-18等胞内容物经焦亡孔流出,随后招募炎症细胞聚集,诱发炎症级联反应[33]。在CS 的研究中发现,NLRP3炎症小体的激活及其介导的经典细胞焦亡途径是重要调控靶点。刘梅等研究证实通过抑制NLRP3/Caspase-1细胞焦亡通路,可降低炎性因子的释放,进而减轻CS 炎症反应和组织损伤[10]。本研究结果显示,LPS 联合ATP 处理细胞后NLRP3、Cleaved caspase-1、GSDMD-N的蛋白表达及NLRP3、Caspase-1、GSDMDmRNA水平明显上升,细胞上清液IL-18、IL-1β含量增加。槲皮素可逆转上述变化,表明槲皮素能够抑制成纤维细胞的炎性损伤和细胞焦亡。同时,采用MCC950对焦亡模型细胞进行干预,发现上述焦亡相关分子水平与槲皮素干预的结果相似。以上结果从分子水平上表明,槲皮素通过抑制NLRP3炎症小体的激活来抑制焦亡损伤。目前关于槲皮素通过抑制NLRP3/Caspase-1/GSDMD信号通路介导细胞焦亡在其他炎性细胞中已有证明,Luo等[34]采用槲皮素干预LPS+ATP诱导THP-1巨噬细胞焦亡模型,发现NLRP3、Cleaved caspase-1、GSDMD-N、IL-1β等焦亡相关分子均明显下调,与本研究结果一致。Zhao等[28]研究发现槲皮素还可缓解乙醇诱导的肝细胞焦亡及NLRP3炎症小体的活化,说明槲皮素在不同疾病中通过抑制NLRP3炎症小体的激活,达到治疗疾病的目的。
综上所述,本研究发现NLRP3/Caspase-1/GSDMD信号通路介导的细胞焦亡在CS的发病过程中具有重要作用,槲皮素可通过下调相关基因的表达,抑制细胞焦亡,减少促炎因子释放,降低输卵管炎症损伤,这为今后槲皮素治疗慢性输卵管炎提供了参考。
参考文献:
[1] Jännebring J, Liv P, Knuts M, et al. Impact of patient-reported
salpingitis on the outcome of hysterectomy and adnexal surgery: a
national register-based cohort study in Sweden[J]. Acta Obstet
Gynecol Scand, 2024, 103(6): 1153-64.
[2] Xijiao HU, Shuoxi LI, Yang DX, et al. Modified Gexiazhuyu
Decoction alleviates chronic salpingitis p38 signaling pathway[J].
Chung I Tsa Chih Ying Wen Pan, 2022, 42(2): 213-20.
[3] Zhang RN, Sun ZJ, Zhang L. Pyroptosis in inflammatory bone
diseases: molecular insights and targeting strategies[J]. FASEB J,
2022, 36(12): e22670.
[4] Hachim MY, Khalil BA, Elemam NM, et al. Pyroptosis: the missing
puzzle among innate and adaptive immunity crosstalk[J]. J Leukoc
Biol, 2020, 108(1): 323-38.
[5] Coll RC, Schroder K, Pelegrín P. NLRP3 and pyroptosis blockers for
treating inflammatory diseases[J]. Trends Pharmacol Sci, 2022, 43
(8): 653-68.
[6] Sefik E, Qu RH, Junqueira C, et al. Inflammasome activation in
infected macrophages drives COVID-19 pathology[J]. Nature,
2022, 606(7914): 585-93.
[7] Arrè V, Scialpi R, Centonze M, et al. The 'speck'-tacular oversight of
the NLRP3-pyroptosis pathway on gastrointestinal inflammatory
diseases and tumorigenesis[J]. J Biomed Sci, 2023, 30(1): 90.
[8] Hsu CG, Chávez CL, Zhang CY, et al. The lipid peroxidation
product 4-hydroxynonenal inhibits NLRP3 inflammasome
activation and macrophage pyroptosis[J]. Cell Death Differ, 2022,
29(9): 1790-803.
[9] 洪金妮, 林达涛, 陈仔颖, 等. 少腹逐瘀汤对输卵管炎性不孕大鼠
NLRP3 炎症小体的作用研究[J]. 药物评价研究, 2022, 45(12):
2486-93.
[10]刘 梅, 谢 星, 匡继林. 通管方对输卵管炎性不孕模型大鼠NLRP3/
Caspase-1细胞焦亡通路的影响[J]. 中医药导报, 2023, 29(2): 8-13.
[11]袁孟珂, 刘进哲, 穆姿辰, 等. 膈下逐瘀汤加减方通过lncRNAs/
NLRP3炎症小体通路抑制慢性输卵管炎大鼠细胞焦亡[J]. 中华中
医药杂志, 2024, 39(5): 2582-6.
[12]刘 丽, 袁孟珂, 陈 婧, 等. 针药联合治疗输卵管炎性不孕症临床观
察[J]. 辽宁中医药大学学报, 2020, 22(8): 4-7.
[13]李 杨, 刘 丽. 基于网络药理学探讨膈下逐瘀汤加减方治疗慢性盆
腔炎性疾病的作用机制[J]. 世界中西医结合杂志, 2021, 16(10):
1858-64.
[14]王月田, 刘鑫国, 杨 恿. 槲皮素调控p38 MAPK/NF-κB/NLRP3信号
通路对大鼠分泌性中耳炎的作用机制[J]. 中国药理学通报, 2023,
39(4): 672-8.
[15]杨昊若, 任军华, 张 昱, 等. 槲皮素通过激活Keap1/Nrf2信号通路减
轻脂多糖诱导的大鼠急性肾损伤[J]. 中国临床药理学杂志, 2023,
39(21): 3134-8.
[16]祝珊珊, 谭博文, 秦 飞, 等. 槲皮素通过PTEN/PI3K/JNK信号通路
减轻小鼠RAW264.7 巨噬细胞炎症[J]. 中国病理生理杂志, 2023,
39(3): 510-9.
[17]Li H, Guan YL, Liang B, et al. Therapeutic potential of MCC950, a
specific inhibitor of NLRP3 inflammasome[J]. Eur J Pharmacol,
2022, 928: 175091.
[18]Song ZH, Gong Q, Guo JW. Pyroptosis: mechanisms and links with
fibrosis[J]. Cells, 2021, 10(12): 3509.
[19]Gan C, Cai QY, Tang CW, et al. Inflammasomes and pyroptosis of
liver cells in liver fibrosis[J]. Front Immunol, 2022, 13: 896473.
[20]Kang JY, Xu MM, Sun Y, et al. Melatonin attenuates LPS-induced
pyroptosis in acute lung injury by inhibiting NLRP3-GSDMD
pathway via activating Nrf2/HO-1 signaling axis[J]. Int
Immunopharmacol, 2022, 109: 108782.
[21]Sanz AB, Sanchez-Niño MD, Ramos AM, et al. Regulated cell death
pathways in kidney disease[J]. Nat Rev Nephrol, 2023, 19(5):
281-99.
[22]Dong ZP, Yang BN, Jia ME, et al. DDIT3/CHOP promotes LPS/ATPinduced
pyroptosis in osteoblasts via mitophagy inhibition[J].
Biochim Biophys Acta Mol Cell Res, 2024, 1871(4): 119712.
[23]Weng XZ, Luo X, Dai XY, et al. Apigenin inhibits macrophage
pyroptosis through regulation of oxidative stress and the NF- κB
pathway and ameliorates atherosclerosis[J]. Phytother Res, 2023, 37
(11): 5300-14.
[24]Wu WJ, Wu XH, Qiu LX, et al. Quercetin influences intestinal
dysbacteriosis and delays alveolar epithelial cell senescence by
regulating PTEN/PI3K/AKT signaling in pulmonary fibrosis[J].
Naunyn Schmiedebergs Arch Pharmacol, 2024, 397(7): 4809-22.
[25]冯桃花, 刘文康, 武 宁, 等. 益肾健脾泻浊中药对慢性肾脏病妊娠大
鼠肾脏NLRP3/caspase-1/IL-1β信号通路及细胞焦亡的影响[J]. 世
界科学技术-中医药现代化, 2021, 23(2): 451-61.
[26]邹长鹏, 郭 燕, 张长旺, 等. 补中益气汤中的有效成分槲皮素通过
GSTP1-JAK-STAT途径增强肺腺癌耐药细胞株A549/DDP对顺铂
的敏感性[J]. 广州中医药大学学报, 2023, 40(10): 2606-14.
[27]兰悦嘉, 孟宪丽, 吴嘉思. 黄芩素调控NLRP3/Caspase-1/GSDMD通
路介导的焦亡减轻小鼠急性肺损伤作用 [J]. 中草药, 2023, 54(20):
6694-703.
[28]Zhang HX, Li YY, Liu ZJ, et al. Quercetin effectively improves LPSinduced
intestinal inflammation, pyroptosis, and disruption of the
barrier function through the TLR4/NF‑κB/NLRP3 signaling
pathway in vivo and in vitro[J]. Food Nutr Res, 2022,
ecollection. 66.
[29]Mulay SR. Multifactorial functions of the inflammasome
component NLRP3 in pathogenesis of chronic kidney diseases[J].
Kidney Int, 2019, 96(1): 58-66.
[30]Platnich JM, Muruve DA. NOD-like receptors and inflammasomes:
a review of their canonical and non-canonical signaling pathways
[J]. Arch Biochem Biophys, 2019, 670: 4-14.
[31]Li Z, Guo JL, Bi LQ. Role of the NLRP3 inflammasome in
autoimmune diseases[J]. Biomed Pharmacother, 2020, 130: 110542.
[32]Wang K, Sun Q, Zhong X, et al. Structural mechanism for GSDMD
targeting by autoprocessed caspases in pyroptosis[J]. Cell, 2020,
180(5): 941-55.e20.
[33] Jorgensen I, Rayamajhi M, Miao EA. Programmed cell death as a
defence against infection[J]. Nat Rev Immunol, 2017, 17(3):
151-64.
[34]Luo X, Bao XY, Weng XZ, et al. The protective effect of quercetin
on macrophage pyroptosis via TLR2/Myd88/NF‑κB and ROS/
AMPK pathway[J]. Life Sci, 2022, 291: 120064.
(编辑:吴锦雅)

