UBE2T通过调节性T细胞诱导肝细胞癌的放疗抵抗


摘要:目的 探索泛素结合酶2T(UBE2T)对肝细胞癌放疗敏感性的影响及机制。方法 采用空白对照载体或过表达UBE2T慢病毒载体转染小鼠Hepa1-6 肝癌细胞建立对照组(LV-Control)和过表达组(LV-UBE2T),qPCR以及Western blotting 检测上述细胞UBE2T表达情况;对两组细胞进行射线照射(IR)处理,克隆形成实验检测UBE2T过表达对Hepa1-6肝癌细胞放疗敏感性影响;分别在裸鼠和C57BL/6小鼠皮下注射上述细胞建立肝癌皮下荷瘤小鼠模型,对皮下瘤予IR处理,建立LV-Control组、LVControl+IR组、LV-UBE2T组和LV-UBE2T+IR组,5~6只/组,观察皮下瘤生长速度及体积。通过CIBERSORT算法分析肝癌免疫细胞浸润情况与UBE2T表达量的关系。流式细胞术检测上述4组小鼠的肝癌中CD4+T细胞以及调节性T细胞(Tregs)浸润情况。比色法测定细胞培养上清液中葡萄糖及乳酸的含量;癌症和肿瘤基因图谱(TCGA)的公共数据分析肝癌UBE2T表达量与糖酵解水平和Tregs 浸润关系。Western blotting检测UBE2T表达与糖酵解相关蛋白HK1、LDHA表达相关关系。体外共培养模型联合流式细胞术以及qPCR验证UBE2T过表达肝癌与Tregs 关系。结果 qPCR、Western blotting 结果显示过表达组中UBE2T表达显著升高(Plt;0.0001)。克隆形成实验、裸鼠肝癌皮下瘤实验显示UBE2T过表达导致肝细胞癌放疗抵抗(Plt;0.05),UBE2T导致的放疗抵抗在C57BL/6小鼠肝癌皮下瘤模型上更显著(Plt;0.01)。CIBERSORT分析提示UBE2T高表达组肝癌中树突状细胞(Plt;0.01)、滤泡辅助性T细胞(Plt;0.001)、M2型巨噬细胞(Plt;0.01)、单核细胞(Plt;0.05)、总体淋巴细胞(Plt;0.05)以及Tregs(Plt;0.0001)浸润比例上调。流式细胞术显示过表达UBE2T小鼠肝癌免疫微环境中Tregs数量上调(Plt;0.05),IR导致UBE2T组CD4+T 细胞以及Tregs 浸润增加(Plt;0.01 或Plt;0.001)。与对照组细胞培养上清液相比,过表达UBE2T 组的培养上清液葡萄糖浓度降低(Plt;0.05),乳酸浓度上调(Plt;0.01)。GSEA分析提示UBE2T高表达肝癌与糖酵解水平(Plt;0.001)、Tregs浸润水平呈正相关(Plt;0.001)。Western blotting 显示糖酵解相关蛋白HK1、LDHA表达水平与UBE2T表达水平相关。体外共培养模型显示UBE2T过表达肝癌使Tregs细胞内乳酸含量上调(Plt;0.001),增殖能力增加(Plt;0.05)以及免疫抑制功能上调(Il-10,Plt;0.05;TGF-β,Plt;0.001)。结论 UBE2T介导的肝癌细胞放疗抵抗可能与肝癌细胞糖酵解水平提高介导的免疫微环境中Tregs富集相关。
关键词:泛素结合酶2T;肝细胞癌;放疗抵抗;肿瘤免疫微环境;调节性T细胞
肝细胞癌(HCC)是我国常见的恶性肿瘤之一,发病率居恶性肿瘤第6位,死亡率居第2位,严重威胁我国人民生命健康[1]。70%以上肝癌患者确诊时已是中晚期,其5年生存率不足15%[2]。近年来,随着调强放疗、质子放疗等技术的不断发展及放疗剂量分割模式的变化,目前放疗在肝癌中得到广泛应用。多项临床研究表明,无论是在早期还是中晚期肝癌治疗,放疗均可使肝癌局部控制率得到显著的提高[3-6],然而,临床上仍有30%左右的肝癌患者对放疗不敏感[7]。因此,积极寻找介导肝癌放疗抵抗的关键靶点尤为重要。
传统观点认为放疗是通过诱导DNA损伤杀死肿瘤细胞达到肿瘤治疗目的[8]。近年来研究表明[9, 10],放疗还可以通过激活机体抗肿瘤免疫反应从而杀伤肿瘤。例如,放疗通过增强肿瘤细胞抗原呈递和免疫识别,动员CD8+T 等免疫细胞攻击肿瘤细胞,进而间接杀灭肿瘤[11, 12]。然而放疗对于免疫系统激活作用仍十分有限,其原因在于肿瘤细胞利用其内在促癌因子抑制放疗的免疫激活作用,最终导致肿瘤细胞的放疗抵抗[13]。
泛素结合酶2T(UBE2T)是泛素结合酶(E2)家族的一员,参与将泛素结合到底物上,并以E2-酶依赖的方式在多种病理过程中发挥重要作用[14, 15]。Zhu等[16]的研究揭示了UBE2T通过促进Akt的K63形式连接的多泛素化来增加嘧啶代谢,从而促进HCC的发展。本课题前期研究中发现,UBE2T介导的H2AX/γH2AX单泛素化促进细胞周期G2/M检查点阻滞,为辐射诱导的DNA修复提供足够的时间,从而导致HCC的放疗抵抗[17]。那么,UBE2T介导的HCC放疗抵抗是否与免疫微环境的改变相关?目前尚未发现有文献报道肝癌中UBE2T与肿瘤免疫微环境的关系。因此,本研究拟探索在肝癌细胞中UBE2T对肿瘤免疫微环境的影响,从而探讨UBE2T通过调控肿瘤免疫微环境影响肝癌细胞的放疗敏感性及分子机制,为提高HCC治疗效果提供实验依据。
1 材料和方法
1.1 材料
鼠源性肝癌细胞株Hepa1-6 从中国科学院上海细胞库购得。胎牛血清(Gibco);DMEM 高糖培养基(Gibco);胰蛋白酶(Gibco);PerCP/Cyanine5.5 CD45抗体、FITC CD3 抗体、Brilliant Violet 510TM CD4 抗体、APC FoxP3 抗体、PE CD25 抗体 、FITC Ki67 抗体、APC TGF-β抗体(BioLegend)(稀释比例均为1∶200);细胞因子刺激剂(BD);CD3/CD28 刺激抗体(STEMCELL);IL-2(Gibco);小鼠Tregs 分选试剂盒(Biolegend);2-脱氧-D-葡萄糖(2-DG)(MCE);流式破膜试剂盒(BD);葡萄糖检测试剂盒(Abcam);乳酸检测试剂盒(Abcam);乳酸检测试剂盒II(Sigma-Aldrich)。
1.2 方法
1.2.1 小鼠肝癌细胞培养
将鼠源Hepa1-6 细胞于37 ℃,5%CO2饱和湿度条件下培养,用含有10%FBS的DMEM培养基进行常规培养和传代。当细胞生长融合度达到90%以上时,用0.25%的胰蛋白酶消化后传代,取对数生长期的细胞用于后续实验。
1.2.2 qPCR
检测小鼠肝癌细胞转染情况 Trizol 提取LV-Control 组以及LV-UBE2T 组细胞的总RNA,逆转录成cDNA,RT-PCR检测Ube2t mRNA水平。Ube2t引物序列见前期报道[16]。检测Tregs Il-10表达情况 Trizol提取共培养后的Tregs 总RNA,逆转录成cDNA,RTPCR检测Il-10 mRNA水平,引物序列见表1。
1.2.3 Western blotting
检测UBE2T、LDHA、HK1蛋白表达 待细胞长满约80% 密度时,PBS 清洗后加入RIPA裂解液,冰上裂解10 min,每5 min剧烈涡旋震荡1次,12 000 r/min 离心10 min 后吸取上清,加入5×SDS混匀后沸水浴8 min,所得蛋白按照实验室先前方法进行Western blot实验[17]。
1.2.4 克隆形成实验
将细胞(1000/孔)置于6 孔板中,然后用不同剂量的IR(2~8 Gy)处理。细胞培养14 d,然后用甲醇固定,用结晶紫染色。具体分析方法参考实验室先前方法[17]。
1.2.5 实验动物和处理
由南方医科大学动物中心提供C57BL/6小鼠(n=36)以及裸鼠(4~6周龄,n=24),雌性与雄性数量相等,随机平均分为LV-Control、LV-Control+IR、LV-UBE2T和LV-UBE2T+IR组,分别将鼠源性肝癌细胞Hepa1-6(5×106个)皮下种植在C57BL/6小鼠以及裸鼠的右后背部,计算肿瘤体积:长×宽2/2。当肿瘤达到约300 mm3时进行射线照射治疗,2 d/次测量肿瘤体积。用于观察放疗疗效的目的,将终点指定为开始治疗后的第18天。用于流式细胞术验证瘤内浸润免疫细胞变化的目的,将终点指定为开始治疗后的第9天。本研究动物实验经南方医科大学南方医院实验动物伦理委员会批准(伦理批号:NFYY-2021-1118)。
1.2.6 流式细胞术分析瘤内浸润免疫细胞
麻醉后脱臼处死LV-Control、LV-UBE2T、LV-Control+IR 和LVUBE2T+IR组的小鼠,获取各组中的等体积皮下瘤,经酶消化液消化30 min后加入完全培养基重悬,于300 g/min离心5 min收集细胞。PBS洗涤2次后,细胞经PBS重悬调整浓度至1~5×106/mL,取100 μL细胞悬液,加入PerCP/Cyanine5.5 CD45 抗体、FITC CD3 抗体、Brilliant Violet 510TM CD4 抗体、PE CD25 抗体混匀,置于4 ℃条件下避光孵育40 min,PBS洗涤2次后,加入500 μL 1×fixation/permeabilization buffer,置于4 ℃条件下避光孵育40 min,800 μL perm/wash Buffer洗涤两次后,加入APC FoxP3抗体,置于4 ℃条件下避光孵育40 min,PBS洗涤2次后,置于流式细胞仪中检测分析。
1.2.7 肝癌细胞培养上清液葡萄糖及乳酸检测
培养72 h 后收集各组细胞培养上清液,于800 r/min 离心5 min收集上清。根据制造商提供的乳酸检测试剂盒使用说明操作,最后使用酶标仪检测各孔吸光度值A570 nm,计算各细胞培养上清液中葡萄糖以及乳酸含量。
1.2.8 CIBERSORT免疫细胞浸润相关性分析
将下载的基因表达矩阵进行归一化和整理,采用CIBERSORT法分析肝癌中22种免疫细胞的丰度,再将UBE2T以中位数分高、低表达组,分析在肝癌中与22种免疫细胞的差异,最后将每个免疫细胞与UBE2T 进行相关性分析[18]。22种免疫细胞包括:未成熟的B细胞、记忆B细胞、浆细胞、CD8+T细胞、未成熟的CD4+T细胞、静息记忆CD4+T细胞、活化记忆CD4+T细胞、滤泡辅助性T细胞、调节性T细胞、γδT细胞、静息NK细胞、活化NK细胞、单核细胞、M0型巨噬细胞、M1型巨噬细胞、M2型巨噬细胞、静息树突细胞、活化树突细胞、静息肥大细胞、活化肥大细胞、嗜酸性粒细胞、中性粒细胞。
1.2.9 生物信息学分析
利用TCGA肝细胞癌队列进行GSEA分析,以探索UBE2T影响肝细胞癌的潜在机制。参考基因集是来自分子特征数据库(MSigDB)中的C2(c2.cp.kegg.v7.0.symbols.gmt)。UBE2T的表达被注释为高或低的UBE2T表型。随机组合次数设置为1000次。当Plt;0.05,则该基因集被视为显着富集。
1.2.10 肝癌细胞与Tregs共培养处理
麻醉后脱臼处死小鼠,将小鼠脾脏制备成单细胞悬液,根据小鼠Tregs分选试剂盒说明书分选得到Tregs。体外使用CD3/CD28刺激抗体以及IL-2刺激活化Tregs 3 d,使Tregs达到实验所需数量。通过使用0.4 μm Transwell板进行肝癌细胞(下室)与Tregs(上室)共培养,并接受IR处理,进行IR前2 h将2-DG加入至下室。共培养48 h后收集上室中的Tregs进行下一步分析。
1.2.11 Tregs 细胞内乳酸含量检测
收集共培养后的Tregs,PBS洗涤2次后,根据制造商提供的乳酸检测试剂盒II使用说明操作,最后使用酶标仪检测各孔吸光度值A450 nm,计算各组Tregs细胞内乳酸含量。
1.2.12 流式细胞术分析Tregs
收集共培养后的Tregs,PBS洗涤2次后,使用细胞因子刺激剂于37 ℃孵育4 h。PBS 洗涤2 次后,加入500 μL 1×fixation/permeabilization buffer,置于4 ℃条件下避光孵育40 min,800 μL perm/wash Buffer 洗涤2 次后,加入FITC Ki67抗体或APC TGF-β抗体,置于4 ℃条件下避光孵育40 min,PBS洗涤2次后,置于流式细胞仪中检测分析。
1.2.13 统计学分析
运用SPSS 25.0软件对数据进行分析,计量资料以均数±标准差表示,采用t检验进行两组间均数比较;采用单因素方差分析进行多组间均数比较;Plt;0.05(双侧)为差异有统计学意义。所有实验都独立重复3次。
2 结果
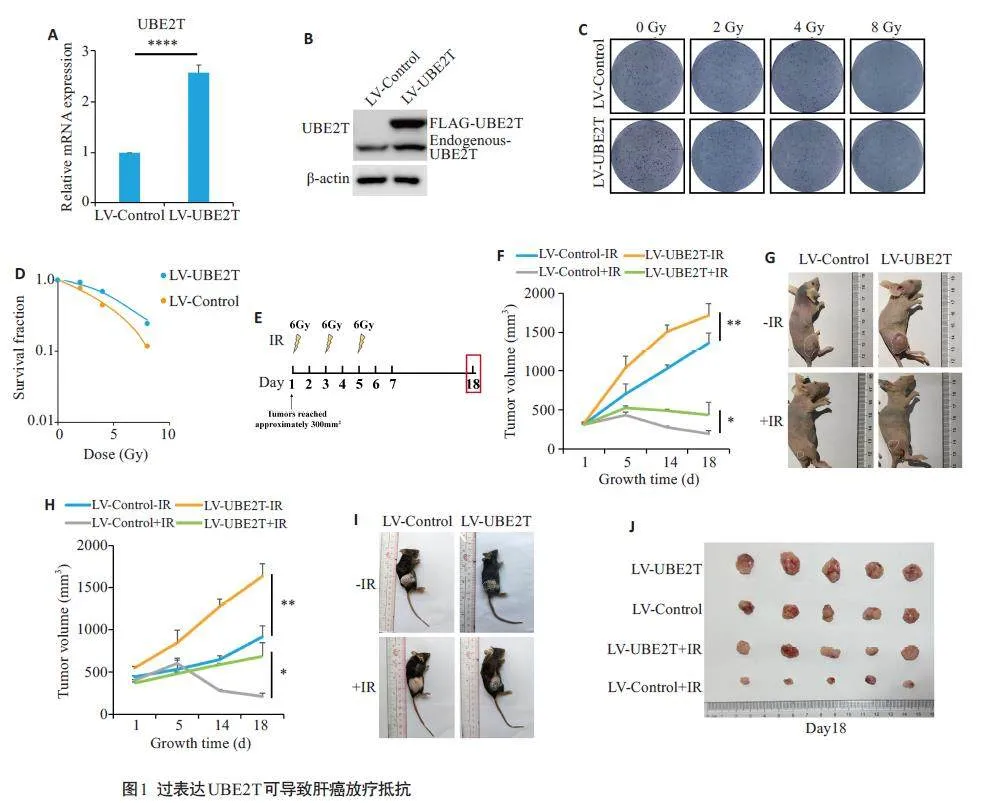
2.1 UBE2T导致肝癌细胞放疗抵抗
qPCR 及Western blot 结果显示,与对照组相比,LV-UBE2T 肝癌细胞中的UBE2T 表达量在mRNA水平以及蛋白水平都显著上调(图1A、B)。单克隆形成实验表明过表达UBE2T可使小鼠肝癌细胞在接受放疗后的存活比例升高(图1C、D)。同时,我们对裸鼠以及C57BL/6 小鼠的皮下瘤进行3 次剂量为6Gy 的射线照射,并在放疗开始的第18天结束观察(图1E)。在无射线照射的情况下,LV-UBE2T组的裸鼠皮下瘤体积显著高于LV-Control组(Plt;0.01);而射线照射对LV-Control组的皮下瘤的抑制作用显著优于LV-UBE2T组中的皮下瘤(Plt;0.05,图1F、G)。而在免疫正常的C57BL/6小鼠中,过表达UBE2T可促进小鼠皮下瘤增殖(Plt;0.01),而接受放疗后,LV-Control组的皮下瘤生长可以显著被抑制,而LV-UBE2T组中的皮下瘤则无法被抑制(Plt;0.01,图1H~J)。
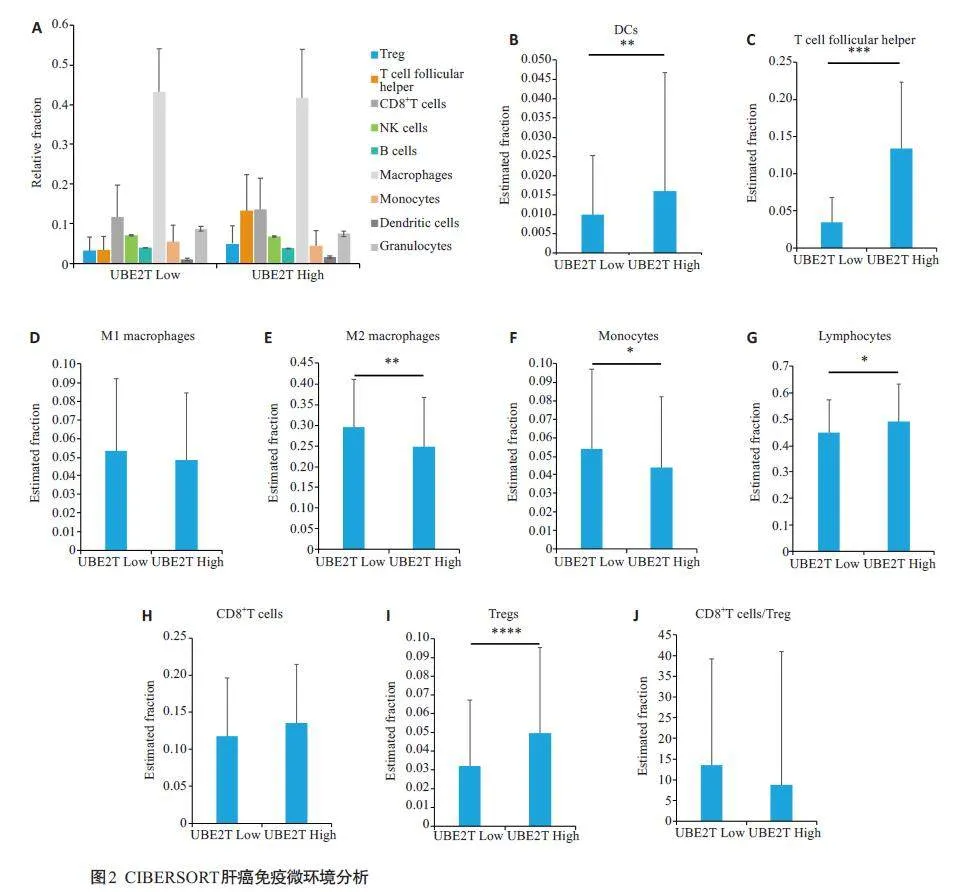
2.2 UBE2T 表达量与肝癌中免疫细胞浸润的相关性分析。
CIBERSORT 分析结果显示,在肝癌中的UBE2T表达水平与多种肿瘤浸润免疫细胞显著相关,其中树突状细胞(Plt;0.01),辅助性T细胞(Plt;0.001),总体淋巴细胞(Plt;0.05),调节性T 细胞(Tregs)(Plt;0.0001)在UBE2T高表达的肝癌中浸润显著增加(图2A~C、G、I)。而M2 型巨噬细胞(Plt;0.01)以及单核细胞(Plt;0.05)则在UBE2T高表达的肝癌中浸润减少(图2E、F)。M1型巨噬细胞、CD8+T细胞及CD8+T细胞/Tregs的比例在两组间无显著差异(图2D、H、J)。
2.3 UBE2T促进Tregs在肝癌中的浸润
对C57BL/6小鼠肝癌皮下瘤进行3次6Gy的射线照射,之后收集皮下瘤进行流式细胞术检测(图3A)。结果显示,无射线照射的两组皮下瘤中CD4+/CD3+的比例无显著差异,但Tregs的数量在LV-UBE2T组皮下瘤中显著增加(Plt;0.05,图3B~E)。而在接受射线照射后的皮下瘤中,CD4+/CD3+的比例(Plt;0.01)和Tregs 的数量(Plt;0.001)在LV-UBE2T组中均显著增多(图3B~E)。
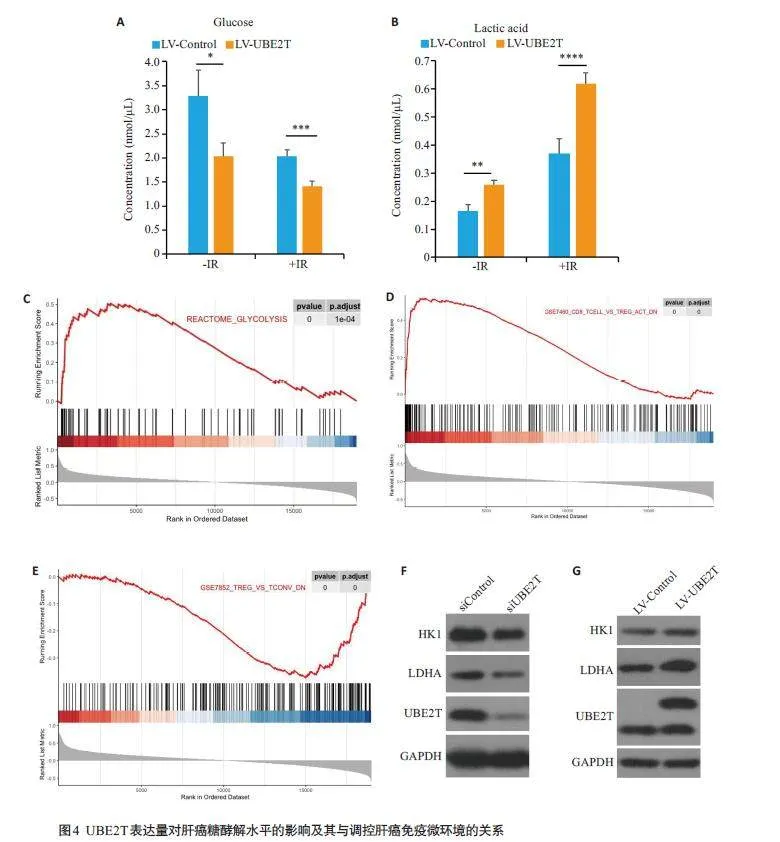
2.4 UBE2T提高肝癌细胞糖酵解水平
与LV-Control组相比,LV-UBE2T组中的肝癌细胞培养上清液中的葡萄糖浓度显著降低(Plt;0.05),而乳酸浓度显著增高(Plt;0.01),在接受放疗后,LV-UBE2T组上清液中的葡萄糖浓度降低以及乳酸浓度增高更为显著(葡萄糖,Plt;0.001;乳酸,Plt;0.0001)(图4A、B)。同时,基因富集分析结果显示UBE2T表达量与糖酵解以及Tregs 相关表达基因高度正相关(Plt;0.0001,图4C~E)。Western blotting结果显示,敲低肝癌细胞中的UBE2T后,与糖酵解相关的蛋白HK1以及LDHA表达水平下降,而过表达UBE2T后,HK1 以及LDHA表达增加(图4F~G)。
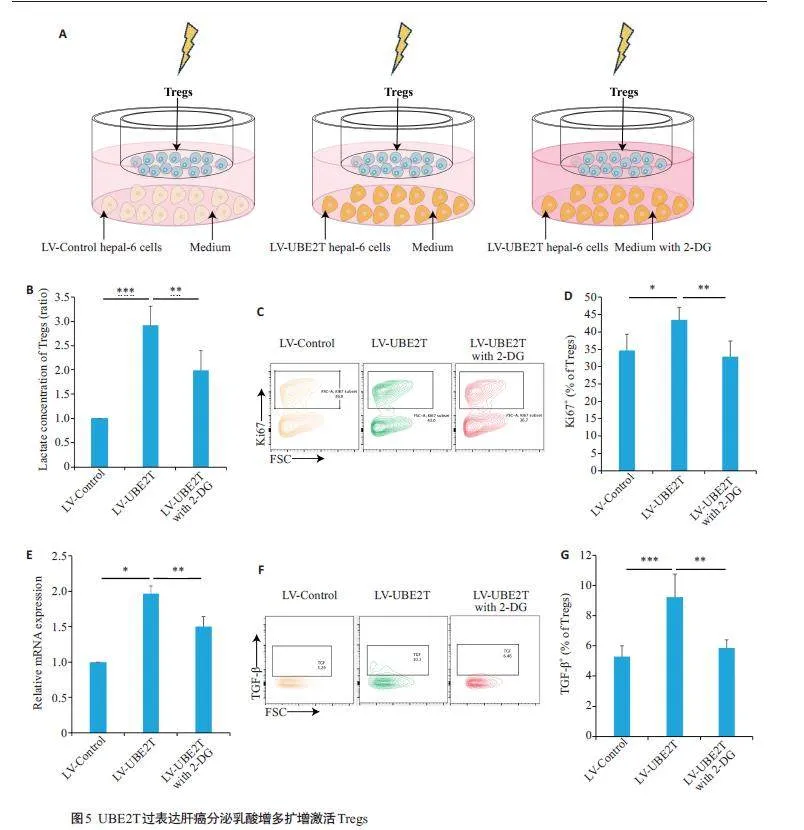
2.5 过表达UBE2T肝癌扩增激活Tregs
将Tregs 与LV-Control 或LV-UBE2T 肝癌细胞进行共培养并接受IR处理,同时加入或不加入糖酵解抑制剂2-DG(图5A)。结果显示,与LV-Control肝癌细胞共培养的Tregs相比,与LV-UBE2T肝癌细胞共培养的Tregs 细胞内乳酸含量显著升高(Plt;0.0001),而加入2-DG则会使其含量下降(Plt;0.01,图5B)。同时,与LVControl共培养组相比,与LV-UBE2T肝癌细胞共培养的Tregs增殖能力显著上调(Plt;0.05),而同时加入2-DG时Tregs增殖能力则被抑制(Plt;0.01,图5C~D)。qPCR以及流式细胞术结果显示,与LV-Control 共培养组相比,LV-UBE2T 共培养组中Tregs Il-10 表达水平以及TGF-β含量显著上调(Il-10,Plt;0.05;TGF-β,Plt;0.001),而在LV-UBE2T肝癌细胞共培养同时加入2-DG组中的Tregs Il-10表达水平以及TGF-β含量相较于LV-UBE2T共培养组则显著下调(Il-10,Plt;0.01;TGF-β,Plt;0.01,图5E~G)。
3 讨论
根据一项全球分析,肝癌新病例和相关死亡率预计将急剧上升,据预测,到2040年预计有130万人死于肝癌[19]。面对如此严峻的患病形势,对肝癌进行深度探究以寻求提高肝癌患者预后的突破口尤为重要。多项研究表明,在卵巢癌、肺癌、乳腺癌和肝癌等恶性肿瘤中观察到UBE2T的异常表达情况[16, 20-23]。本课题组前期研究发现UBE2T在肝癌组织中的表达显著高于癌旁组织,且与肝癌患者预后不良显著相关,提示UBE2T在肝癌的发生和发展过程中可能扮演着癌基因的角色[16]。本研究运用克隆形成实验、小鼠皮下瘤模型、CIBERSORT免疫浸润分析、体外细胞学实验验证以及GSEA富集分析,分析了肝癌细胞中UBE2T的异常表达对肝癌放疗敏感性的调控作用和分子机制,结果显示UBE2T在肝癌中高表达会导致肝癌放疗抵抗。
放疗是一种常见的癌症治疗方法,利用高能量的电离辐射(如X射线、γ射线或质子束)照射肿瘤组织,通过造成肿瘤细胞DNA损伤、引起肿瘤细胞凋亡、细胞周期阻滞、微血管损伤等机制阻止肿瘤增殖[24-26]。然而,肝癌的形成和进展涉及众多因素的错综复杂过程,因此放疗的成效亦受多方面因素的影响[27]。Fang等[28]研究报道葡萄糖和心磷脂合成代谢的整合可通过调节肝癌细胞中细胞色素c的分泌来介导放疗抵抗。Hong等[29]研究报道人解螺旋酶蛋白(RECQL4)修复放疗过程中肿瘤细胞释放的双链DNA,抑制树突状细胞(DC)的cGASSTING信号通路,阻止放疗诱导的抗肿瘤免疫反应有效激活,导致肝癌放疗抵抗。在本研究中,我们发现,在免疫系统正常的C57BL/6小鼠以及缺乏成熟T淋巴细胞的裸鼠中UBE2T高表达均能导致肝癌放疗抵抗,且该放疗抵抗特性在免疫系统正常的C57BL/6小鼠中更为显著。UBE2T在裸鼠中能导致放疗抵抗的现象与本课题组前期研究发现以及Yin 等在非小细胞肺癌上的研究结果一致[17, 30]。而在本次研究中UBE2T高表达肝癌的放疗抵抗特性在免疫系统正常小鼠上更显著的新发现提示了UBE2T所介导的肝癌放疗抵抗与肿瘤免疫微环境(TIME)关系密切。
在本研究设计中,我们选择了2个关键的终点。第一个是观察小鼠皮下瘤生长体积变化的终点。根据我们课题组之前使用UBE2T肝癌细胞系构建小鼠皮下瘤的经验,以及在研究设计过程中对观察终点的预实验探索,我们发现在开始放疗后的第18天,各组皮下瘤体积之间已经出现显著差异,并且符合实验动物伦理标准。因此,我们将小鼠皮下瘤生长体积的观察终点定为开始放疗后的第18天。另一个是检测免疫细胞在肿瘤组织内的浸润情况的终点。Zhang 等[31]通过多时间点的单细胞测序发现,在小鼠结束放疗后的第4天,TIME处于相对稳定的免疫反应阶段。结束放疗后4 d再进行检测可允许足够的时间让免疫细胞对放疗引起的肿瘤抗原释放做出反应。因此,综合考虑以上因素,我们将检测终点定于开始放疗后的第9 天(即结束放疗后的第4天),以准确评估Tregs对UBE2T高表达肝癌放疗抵抗性的调控作用。
TIME是指存在于肿瘤组织周围的免疫细胞、间质细胞、血管及其相关因子等组成的复杂生态系统,与肿瘤的进展与治疗抵抗息息相关[32]。Song等[33]研究报道泛素连接酶UBR5 可通过CCL2/CSF-1 的旁分泌途径募集肿瘤相关巨噬细胞,增强免疫抑制从而导致卵巢癌发展。de Galarreta等[34]研究报道肝癌细胞CTNNB1突变可下调CCL5的表达并影响DC募集,从而促进肝癌的免疫逃逸以及免疫治疗抵抗。目前尚未有关于UBE2T在肝癌中调控免疫细胞的报道。本研究中,在不接受放疗的情况下,相比起LV-Control组,我们发现LV-UBE2T组肝癌细胞所处的TIME中,CD4+T细胞的比例无显著差异,但浸润的Tregs 实际数量显著增加。Tregs是一群以CD4+CD25+Foxp3+为典型标志物的免疫抑制细胞亚群,在调节机体免疫平衡和防止免疫系统过度活化中发挥重要的作用[35-37]。在TIME 中累积的Tregs不仅可以通过分泌TGF-β、IL-10等抑制性细胞因子阻碍有效的抗肿瘤免疫,还可以通过调节细胞因子表达来抑制CD8+T细胞迁移至TIME,抑制细胞毒性T细胞的功能,导致免疫逃逸[38-40]。本研究中,在接受放疗后,LV-UBE2T 组瘤内浸润的CD4+T 细胞的比例以及Tregs的实际数量均高于LV-Control组。早期有研究表明,由于Tregs对射线的敏感性低于其他淋巴细胞类型,射线在杀死癌细胞以外可以杀死其余淋巴细胞,而Tregs在TIME中仍持续存在[41]。这提示了UBE2T高表达的肝癌在接受放疗后,会形成抑制性更强的TIME。因此我们推测,UBE2T 高表达的肝癌会引起Tregs 富集,在接受放疗后,非但没有激活肿瘤免疫微环境,而是加剧了Tregs富集程度,阻碍了抗肿瘤免疫反应的有效激活,最终导致肝癌进展。
目前仅有少数文献报道肿瘤中UBE2T的表达与免疫细胞浸润的关系。郭康等[42]研究报道在乳腺癌中UBE2T 表达与常见的体液免疫B细胞的浸润呈正相关,与肿瘤微环境中的巨噬细胞浸润呈负相关。而于运亮等[43]研究报道在胰腺癌患者中UBE2T与巨噬细胞浸润亦呈负相关。本研究分析结果提示在肝癌中UBE2T表达与DC、滤泡辅助性T 细胞、M2 型巨噬细胞以及Tregs浸润呈正相关。由此可见,UBE2T在不同的癌症类型中与免疫细胞浸润相关关系存在差异,提示UBE2T在不同癌症类型中发挥作用的机制不相同。
Tregs在肿瘤中富集的原因是多方面的,例如肿瘤细胞释放趋化因子CCL22和CCL17吸引Tregs迁移到肿瘤部位;肿瘤细胞分泌的生长因子如TGF-β能够促进Tregs的生存、增殖和活化;肿瘤微环境的缺氧和代谢产物,如乳酸和酸化微环境,也能够促进Tregs的增殖和功能[40]。在有氧状态下,肿瘤细胞仍会优先选择糖酵解,而不是选择能够高效产能的氧化磷酸化以提供肿瘤细胞所需能量,这种现象称之为“Warburg效应”,即有氧糖酵解[44-46]。在本研究中我们发现过表达UBE2T的肝癌细胞上清液中葡萄糖含量下降,乳酸含量升高,即肝癌细胞糖酵解水平提高。并且GSEA 富集分析提示UBE2T高表达肝癌与糖酵解相关基因集以及Tregs相关表达基因集高度正相关。已有研究报道显示,低葡萄糖、高乳酸、低氧的环境不适合效应T 细胞的生存,CD8+T 细胞难以发挥功能,导致抗肿瘤免疫反应下降[47-49]。但是Tregs却可以在如此苛刻的TIME中大量浸润并实现免疫抑制功能,其原因在于Tregs能够摄取乳酸维持三羧酸循环,为Tregs的增殖提供能量以及维持免疫抑制活性[50-52]。因此,UBE2T高表达肝癌细胞糖酵解水平提高,TIME中乳酸含量上升,塑造了一个适合Tregs生存的环境。
综上所述,UBE2T高表达可导致肝癌免疫微环境中Tregs富集以及肝癌细胞产生放疗抵抗,其放疗抵抗特性可能是由于UBE2T通过提高肝癌细胞糖酵解水平,使肿瘤免疫微环境中乳酸增加,有利于Tregs的增殖以及维持其免疫抑制功能,使放疗不能有效激活抗肿瘤免疫,但其具体分子机制仍有待更深入的探索。
参考文献:
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2] Llovet JM, Kelley RK, Villanueva A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021, 7: 6.
[3] Chen LC, Lin HY, Hung SK, et al. Role of modern radiotherapy inmanaging patients with hepatocellular carcinoma[J]. World JGastroenterol, 2021, 27(20): 2434-57.
[4] Kim TH, Koh YH, Kim BH, et al. Proton beam radiotherapy vs.radiofrequency ablation for recurrent hepatocellular carcinoma: arandomized phase III trial[J]. J Hepatol, 2021, 74(3): 603-12.
[5] Shi CY, Li Y, Geng L, et al. Adjuvant stereotactic body radiotherapyafter marginal resection for hepatocellular carcinoma withmicrovascular invasion: a randomised controlled trial[J]. Eur JCancer, 2022, 166: 176-84.
[6] Byun HK, Kim HJ, Im YR, et al. Dose escalation by intensitymodulated radiotherapy in liver-directed concurrentchemoradiotherapy for locally advanced BCLC stage Chepatocellular carcinoma[J]. Radiother Oncol, 2019, 133: 1-8.
[7] Bang A, Dawson LA. Radiotherapy for HCC: ready for prime time?[J]. JHEP Rep, 2019, 1(2): 131-7.
[8] Schaue D, McBride WH. Opportunities and challenges ofradiotherapy for treating cancer[J]. Nat Rev Clin Oncol, 2015, 12(9): 527-40.
[9] Pointer KB, Pitroda SP, Weichselbaum RR. Radiotherapy andimmunotherapy: open questions and future strategies[J]. TrendsCancer, 2022, 8(1): 9-20.
[10]Koukourakis MI, Giatromanolaki A. Tumor draining lymph nodes,immune response, and radiotherapy: towards a revisal of therapeuticprinciples[J]. Biochim Biophys Acta Rev Cancer, 2022, 1877(3):188704.
[11]McLaughlin M, Patin EC, Pedersen M, et al. Inflammatorymicroenvironment remodelling by tumour cells after radiotherapy[J]. Nat Rev Cancer, 2020, 20(4): 203-17.
[12]Yum S, Li MH, Chen ZJ. Old dogs, new trick: classic cancertherapies activate cGAS[J]. Cell Res, 2020, 30(8): 639-48.
[13]Li JY, Zhao Y, Gong S, et al. TRIM21 inhibits irradiation-inducedmitochondrial DNA release and impairs antitumour immunity innasopharyngeal carcinoma tumour models[J]. Nat Commun, 2023,14(1): 865.
[14] Jiang XY, Ma Y, Wang T, et al. Targeting UBE2T potentiatesgemcitabine efficacy in PancreaticCancer by regulating pyrimidinemetabolism and replication stress[J]. Gastroenterology, 2023, 164(7): 1232-47.
[15]Yu ZY, Jiang XY, Qin L, et al. A novel UBE2T inhibitor suppressesWnt/β‑catenin signaling hyperactivation and gastric cancerprogression by blocking RACK1 ubiquitination[J]. Oncogene,2021, 40(5): 1027-42.
[16]Zhu ZR, Cao CH, Zhang DY, et al. UBE2T-mediated Aktubiquitination and Akt/β-catenin activation promotes hepatocellularcarcinoma development by increasing pyrimidine metabolism[J].Cell Death Dis, 2022, 13(2): 154.
[17]Sun JY, Zhu ZR, Li WW, et al. UBE2T-regulated H2AXmonoubiquitination induces hepatocellular carcinomaradioresistance by facilitating CHK1 activation[J]. J Exp ClinCancer Res, 2020, 39(1): 222.
[18]Newman AM, Liu CL, Green MR, et al. Robust enumeration of cellsubsets from tissue expression profiles[J]. Nat Methods, 2015, 12(5): 453-7.
[19]Rumgay H, Arnold M, Ferlay J, et al. Global burden of primary livercancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77(6):1598-606.
[20]Qiao L, Dong C, Ma BL. UBE2T promotes proliferation, invasionand glycolysis of breast cancer cells by regualting the PI3K/AKTsignaling pathway[J]. J Recept Signal Transduct Res, 2022, 42(2):151-9.
[21]Wang Y, Leng H, Chen H, et al. Knockdown of UBE2T inhibitsosteosarcoma cell proliferation, migration, and invasion bysuppressing the PI3K/akt signaling pathway[J]. Oncol Res, 2016, 24(5): 361-9.
[22]Cao K, Ling XD, Jiang XY, et al. Pan-canceranalysis of UBE2T witha focus on prognostic and immunological roles in lungadenocarcinoma[J]. Respir Res, 2022, 23(1): 306.
[23]Huang W, Huang HY, Xiao YZ, et al. UBE2T is upregulated,predicts poor prognosis, and promotes cell proliferation and invasionby promoting epithelial-mesenchymal transition via inhibitingautophagy in an AKT/mTOR dependent manner in ovarian cancer[J]. Cell Cycle, 2022, 21(8): 780-91.
[24]Allen C, Her S, Jaffray DA. Radiotherapy for cancer: present andfuture[J]. Adv Drug Deliv Rev, 2017, 109: 1-2.
[25]Citrin DE. Recent developments in radiotherapy[J]. N Engl J Med,2017, 377(22): 2200-1.
[26]Ahmad SS, Duke S, Jena R, et al. Advances in radiotherapy[J].BMJ, 2012, 345(dec04 1): e7765.
[27]Ohri N, Dawson LA, Krishnan S, et al. Radiotherapy forhepatocellular carcinoma: new indications and directions for futurestudy[J]. J Natl Cancer Inst, 2016, 108(9): djw133.
[28]Fang Y, Zhan YZ, Xie YW, et al. Integration of glucose andcardiolipin anabolism confers radiation resistance of HCC[J].Hepatology, 2022, 75(6): 1386-401.
[29]Hong WF, Zhang Y, Wang SW, et al. RECQL4 inhibits radiationinducedtumor immune awakening via suppressing the cGASSTINGpathway in hepatocellular carcinoma[J]. Adv Sci, 2024, 11(16): e2308009.
[30]Yin H, Wang XY, Zhang X, et al. UBE2T promotes radiationresistance in non-small cell lung cancer via inducing epithelialmesenchymaltransition and the ubiquitination-mediated FOXO1degradation[J]. Cancer Lett, 2020, 494: 121-31.
[31]Zhang YH, Hu JY, Ji K, et al. CD39 inhibition and VISTA blockademay overcome radiotherapy resistance by targeting exhausted CD8+T cells and immunosuppressive myeloid cells[J]. Cell Rep Med,2023, 4(8): 101151.
[32]Gajewski TF, Schreiber H, Fu YX. Innate and adaptive immune cellsin the tumor microenvironment[J]. Nat Immunol, 2013, 14(10):1014-22.
[33]Song M, Yeku OO, Rafiq S, et al. Tumor derived UBR5 promotesovarian cancer growth and metastasis through inducingimmunosuppressive macrophages[J]. Nat Commun, 2020, 11(1):6298.
[34]Ruiz de Galarreta M, Bresnahan E, Molina-Sánchez P, et al. β-catenin activation promotes immune escape and resistance to anti-PD-1 therapy in hepatocellular carcinoma[J]. Cancer Discov, 2019,9(8): 1124-41.
[35]Dikiy S, Rudensky AY. Principles of regulatory Tcell function[J].Immunity, 2023, 56(2): 240-55.
[36]Savage PA, Klawon DEJ, Miller CH. Regulatory T cell development[J]. Annu Rev Immunol, 2020, 38: 421-53.
[37]Wing JB, Tanaka A, Sakaguchi S. Human FOXP3+ regulatory T cellheterogeneity and function in autoimmunity and cancer[J].Immunity, 2019, 50(2): 302-16.
[38]Kang JH, Zappasodi R. Modulating Treg stability to improve cancerimmunotherapy[J]. Trends Cancer, 2023, 9(11): 911-27.
[39]Shan F, Somasundaram A, Bruno TC, et al. Therapeutic targeting ofregulatory T cells in cancer[J]. Trends Cancer, 2022, 8(11): 944-61.
[40]Togashi Y, Shitara K, Nishikawa H. Regulatory T cells in cancerimmunosuppression-implications for anticancer therapy[J]. NatRev Clin Oncol, 2019, 16(6): 356-71.
[41]Persa E, Balogh A, Sáfrány G, et al. The effect of ionizing radiationon regulatory T cells in health and disease[J]. Cancer Lett, 2015, 368(2): 252-61.
[42]郭 康, 刘晓敏, 戴 聪, 等. UBE2T基因在乳腺癌中的差异表达及其与免疫细胞浸润之间的相关性研究: 基于生物信息学分析的结果[J]. 临床医学研究与实践, 2020, 5(34): 5-7, 15.
[43]于运亮, 李 婷, 王莉莉, 等. UBE2C和UBE2T与胰腺癌患者预后及免疫细胞浸润的关系[J]. 山东医药, 2021, 61(28): 13-8.
[44]Pouysségur J, Marchiq I, Parks SK, et al. 'Warburg effect' controlstumor growth, bacterial, viral infections and immunity-Geneticdeconstruction and therapeutic perspectives[J]. Semin Cancer Biol,2022, 86(Pt 2): 334-46.
[45]Kang H, Kim B, Park J, et al. The Warburg effect on radioresistance:survival beyond growth[J]. Biochim Biophys Acta Rev Cancer,2023, 1878(6): 188988.
[46]Gogvadze V, Zhivotovsky B, Orrenius S. The Warburg effect andmitochondrial stability in cancer cells[J]. Mol Aspects Med, 2010,31(1): 60-74.
[47]Apostolova P, Pearce EL. Lactic acid and lactate: revisiting thephysiological roles in the tumor microenvironment[J]. TrendsImmunol, 2022, 43(12): 969-77.
[48] Joyce JA, Fearon DT. T cell exclusion, immune privilege, and thetumor microenvironment[J]. Science, 2015, 348(6230): 74-80.
[49]Park J, Hsueh PC, Li ZY, et al. Microenvironment-driven metabolicadaptations guiding CD8+ T cell anti-tumor immunity[J]. Immunity,2023, 56(1): 32-42.
[50]Watson MJ, Vignali PDA, Mullett SJ, et al. Metabolic support oftumour-infiltrating regulatory T cells by lactic acid[J]. Nature,2021, 591(7851): 645-51.
[51]Angelin A, Gil-de-Gómez L, Dahiya S, et al. Foxp3 reprograms Tcell metabolism to function in low-glucose, high-lactateenvironments[J]. Cell Metab, 2017, 25(6): 1282-93.e7.
[52]Li N, Kang YQ, Wang LL, et al. ALKBH5 regulates anti-PD-1therapy response by modulating lactate and suppressive immune cellaccumulation in tumor microenvironment[J]. Proc Natl Acad Sci US A, 2020, 117(33): 20159-70.
(编辑:经 媛)
基金项目:国家自然科学基金(82373318,82073343) ;广东省自然科学基金(2023A1515010608)

