干性相关分子Nanog 在食管鳞状细胞癌组织中高表达并促进食管鳞癌细胞的侵袭转移:基于激活TGF-β信号通路

摘要:目的 探讨食管鳞状细胞癌(鳞癌)中干性相关分子胚胎干细胞关键因子(Nanog)和侵袭迁移相关分子基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)蛋白的表达及其之间的调控关系。方法 运用免疫组织化学技术检测127例食管鳞癌组织和82 例癌旁正常组织中Nanog 和MMP-2/MMP-9 蛋白的表达情况,分析Nanog 和MMP-2/MMP-9 蛋白的表达水平、相关性及与食管鳞癌患者的临床病理参数和预后之间的关系;采用GEO数据库分析Nanog 等干性相关分子主要富集通路;应用TIMER在线网站分析食管癌中TβR1和MMP-2及MMP-9的相关性。在体外运用siRNA转染的方式将食管鳞癌细胞株分为正常对照组、Nanog 低表达组,采用划痕实验分析其对食管鳞癌细胞迁移的影响,qRT-PCR 及Western blotting 检测两组之间TβR1、p-Smad2/3、MMP-2/MMP-9 的表达情况。结果 Nanog 和MMP-2/MMP-9 蛋白在食管鳞癌组织中表达均上调(χ2=70.475,Plt;0.01;χ2=34.415,Plt;0.01;χ2=46.605,Plt;0.01),且呈正相关(r=0.205,P=0.045;r=0.307,Plt;0.001)。Nanog 和MMP-2/MMP-9蛋白表达水平与食管鳞癌的浸润深度相关(χ2=23.9,Plt;0.01;χ2=6.029,Plt;0.05;χ2=11.89,Plt;0.05),有淋巴结转移的样本中,MMP-2/MMP-9蛋白表达水平高于无淋巴结转移的样本(χ2=10.08,Plt;0.01;χ2=5.731,Plt;0.05)。MMP-2/MMP-9 蛋白表达与食管鳞癌患者的年龄、性别和肿瘤分化程度无相关性(Pgt;0.05)。Kaplan-Meier生存分析显示,Nanog和MMP-2/MMP-9蛋白高表达组的食管鳞癌患者生存时间短于低表达组(Plt;0.001;P=0.004;P=0.017);生物信息学分析显示,Nanog等干性相关分子主要富集在转化生长因子-β(TGF-β)信号通路,MMP-2/MMP-9与TβR1表达在食管癌中呈正相关关系。体外划痕实验结果显示,Nanog促进食管鳞癌细胞系的迁移;qRT-PCR及Western blotting结果显示,敲低Nanog后,TβR1、p-Smad2/3、MMP-2/MMP-9的表达水平明显降低。结论 Nanog和MMP-2/MMP-9蛋白在食管鳞癌患者组织中高表达且呈正相关,其与食管鳞癌患者的肿瘤浸润深度、淋巴结转移及预后密切相关,且Nanog通过TGF-β信号通路影响MMP-2/MMP-9蛋白的表达。
关键词:食管鳞状细胞癌;胚胎干细胞关键因子;基质金属蛋白酶-2/基质金属蛋白酶-9;浸润转移;生存分析
食管癌是最常见的恶性肿瘤之一,我国2020年食管癌发病率居恶性肿瘤排名第7位,死亡率居第5位[1]。食管癌患者预后较差,5年生存率为30.3%[2],患者常死于癌症的转移复发[3]。研究表明,肿瘤干细胞是肿瘤发生发展、转移和复发的关键因素[4, 5]。
胚胎干细胞关键因子(Nanog)在食管癌等恶性肿瘤中常存在异常表达[6],是食管癌的干性标志物之一。研究表明,在肿瘤中Nanog 可维持肿瘤干细胞干性特征,促进肿瘤细胞的侵袭、转移过程[7-9]。有研究显示,在胃癌细胞中敲低Nanog 会导致基质金属蛋白酶-2(MMP-2)mRNA和蛋白表达水平下调从而抑制胃癌细胞MKN-45 的迁移能力[10]。有文献报道食管癌中MMP-2和MMP-9表达明显增高,其表达与食管癌的浸润深度、淋巴结转移和血管浸润密切相关[11]。另有研究表明,在骨肉瘤干细胞中敲低转化生长因子-β(TGF-β)后MMP-2的水平明显降低[12]。但目前Nanog蛋白在食管鳞癌组织中的异常表达的调控机制尚不清楚。
为探讨食管鳞癌组织中干性分子Nanog的表达及其与侵袭转移分子MMP-2/9 的相关性,本研究采用免疫组化技术联合检测Nanog和MMP-2/9蛋白在食管鳞状细胞癌(ESCC)组织中的表达情况,初步探讨Nanog和MMP-2/9 蛋白表达水平与食管鳞癌浸润深度、淋巴结转移及患者生存的关系,并通过生物信息学分析它们可能存在的调控信号通路,进而从细胞层面验证Nanog可能通过TGF-β信号通路调控MMP-2、MMP-9的表达从而影响食管癌的侵袭迁移,为进一步寻找食管鳞癌的发生发展及预后分子靶标提供参考依据。
1 资料和方法
1.1 临床资料
收集2009年1月~2015年12月伊犁友谊医院和新华医院的127例食管鳞癌组织样本及82例癌旁正常组织标本。纳入标准:经术后病理检查结果确定为食管鳞癌;术前未进行放化疗或新辅助免疫治疗;具有福尔马林固定后石蜡包埋组织;具有相关临床病理资料。排除标准:经术后病理检查结果食管腺癌或食管鳞癌合并腺癌;合并其他恶性肿瘤或有恶性肿瘤个人史;合并心、肝、肾等脏器功能不全;临床病理信息不完整。对127例食管癌根治手术患者进行随访,随访终点为患者死亡时间或最后随访时间(2022年12月)。本研究获石河子大学第一附属医院伦理委员会批准(伦理批号:2018-023-01)。
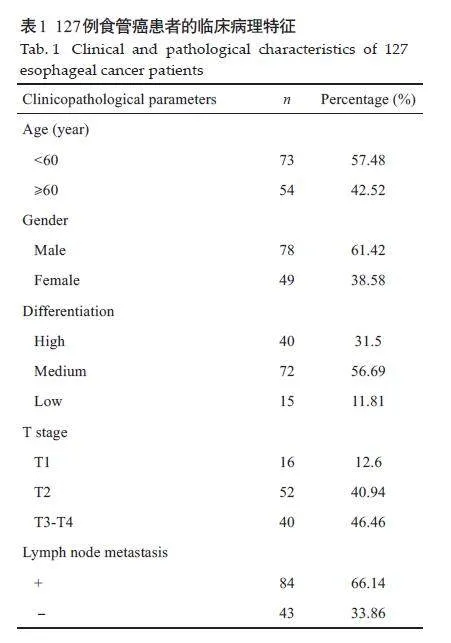
食管鳞状细胞癌组织样本127 例,病理诊断年龄23~76 岁,其中男性78 例、女性49 例;食管癌旁正常组织样本共82例,年龄23~74岁,其中男性54例、女性28例(表1)。对食管癌旁正常组织和和食管鳞癌组织样本进行HE染色,在两位病理专家独立阅片后,将其分为正常食管组织、食管高分化鳞癌、食管中分化鳞癌及食管低分化鳞癌。
1.2 免疫组织化学染色
ESCC样本及配对正常组织样本制备组织芯片,将包埋好的组织芯片蜡块连续切片,石蜡切片经二甲苯脱蜡后,梯度乙醇进行脱水,切片加枸橼酸缓液进行微波抗原修复;切片加Nanog 抗体(Cell SignalingTechnology,1∶600)、MMP-2抗体(Proteintech,1∶250)、MMP-9抗体(Santa Cruz,1∶100),4 ℃孵育过夜;加二抗孵育后用DAB显色,苏木素复染。检测122 例(127 例中5例脱片或无法判读)食管鳞癌组织和79例(82例中3例脱片或无法判读)癌旁正常组织中Nanog蛋白表达情况,99例(127例中28例脱片或无法判读)食管鳞癌组织和73 例(82 例中9 例脱片)癌旁正常组织中MMP-2的蛋白表达状况,及119例(127例中8例脱片或无法判读)食管鳞癌组织和81例(82例中1例脱片)癌旁正常组织中MMP-9的蛋白表达状况。免疫组化染色结果由两位病理学专家阅片,结果判定根据阳性细胞比例及染色程度进行评分。
1.3 生物信息学分析
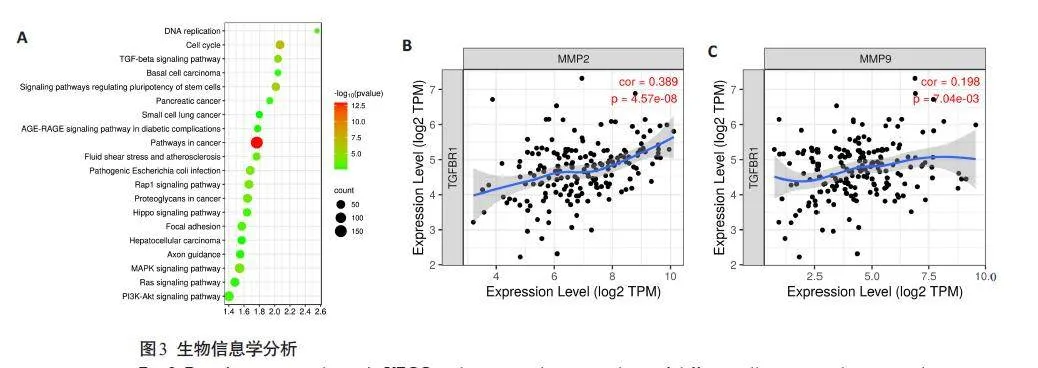
在GEO(http://www.ncbi.nlm.nih.gov/geo/)数据库中筛选胚胎干性相关实验数据,排除敲低或过表达基因等实验干扰数据集后选择GSE13834 数据集进行分析。利用GEO2R在线分析工具分析GSE13834数据集中具有差异的mRNA;利用DAVID(https://david.ncifcrf.gov/)网站分析差异表达的mRNA主要富集的通路。TIMER网站(https://cistrome.shinyapps.io/timer/)分析TβR1和MMP-2及MMP-9的相关性。
1.4 细胞培养及转染
食管癌细胞株TE-1细胞购自上海复祥生物科技有限公司。将对数生长期的TE-1细胞按照1.5×105/孔接种于六孔板(含有10%胎牛血清的RPMI1640),细胞融合达到60%~70%时加入siRNA与Lip2000的混合物到无血清培养基,孵育6 h后更换为完全培养基,48 h后进行后续实验操作。siRNA由上海吉玛公司合成,Nanog的靶序列如下:正向5'-GGAGGUCCUAUUUCUCUAA-3'和反向5'-UUAGAGAAAUAGGACCUCC-3'。
1.5 划痕实验
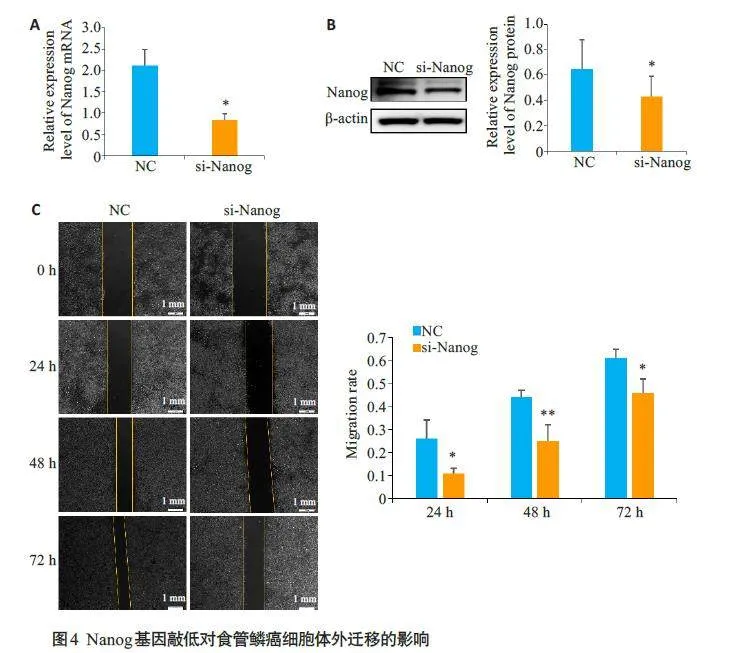
将细胞以2×105/孔的密度接种于六孔板,培养至90%融合。用200 μL无菌移液管尖端垂直在单层细胞上划一条线,在无血清培养基中培养。在0、12、24、48 h时拍照,使用Image J测量划痕面积并计算迁移率,迁移率计算公式为:(0 h划痕面积-12、24、48 h划痕面积)/0 h划痕面积×100%。
1.6 Western blotting实验
将转染48 h后的细胞提取蛋白后,用10%的SDSPAGE凝胶分离蛋白质,然后转移到PVDF 膜上,用5%BSA 封闭,并与所指示的一抗孵育,包括Nanog、TβR1、p-Smad2/3、MMP-2、MMP-9及β-actin,然后在室温下与二抗孵育2 h。TBST洗膜5 min共6次后加入显影液进行曝光显影。
1.7 qRT-PCR实验
使用RNA提取试剂盒提取总RNA,利用反转录试剂盒(Thermo Fisher Scientific)和荧光定量PCR试剂盒(康为)分别进行反转录和定量分析,通过2–ΔΔCt法计算目的基因mRNA相对表达量。使用引物均由上海生工公司合成,引物序列:Nanog上游:5'-AATGGTGTGACGCAGGGATG-3',下游:5'-TGCACCAGGTCTGAGTGTTC-3';TGFβR1 上游:5'-CCTCGAGATAGGCCGTTTGT-3',下游:5'-GCAATGGTAAACCAGTAGTTGGA-3'。Smad-2上游5'TGGGGACTGAGTACACCAAA-3',下游5'-ACTGTGAAGATCAGGCCAGC-3';MMP-2上游5'-TGCTGAAGGACACACTAAAGAAGATG-3',下游5'-GCTTGCGAGGGAAGAAGTTGTAG-3';MMP-9 上游5'-CGAACTTTGACAGCGACAAGAAG-3',下游5'-CGGCACTGAGGAATGATCTAAGC-3';βactin 上游5'-AACCGCGAGAAGATGACCCAG-3',下游5'-GGATAGCACAGCCTGGATAGCAA-3'。
1.8 统计学方法
临床样本量根据成组设计两样本率比较公式n=[(zα+zβ)2×2πc (1-πc)]/(π1-π2)2计算,根据预实验得出Nanog 食管鳞癌样本量阳性率π1=65%,Nanog 食管鳞癌癌旁组织样本量阳性率π2=5%,设α=0.05,β=0.10,计算得出最小样本量为11例/组,本实验在最小样本量的基础上随机收集所得。
使用统计学软件SPSS26.0进行数据分析。食管鳞癌及癌旁正常组织中的蛋白表达水平及其与食管癌患者临床病理参数的关系采用χ2分析;使用Spearman 秩相关分析Nanog和MMP-2/MMP-9蛋白在在食管鳞癌中表达的相关性;采用Kaplan-Meier分析比较Nanog和MMP-2/MMP-9蛋白低表达和高表达患者之间总体生存的差异;两组间比较采用t检验。以Plt;0.05为差异具有统计学意义。
2 结果
2.1 Nanog、MMP-2/MMP-9 蛋白在食管鳞癌组织中表达上调
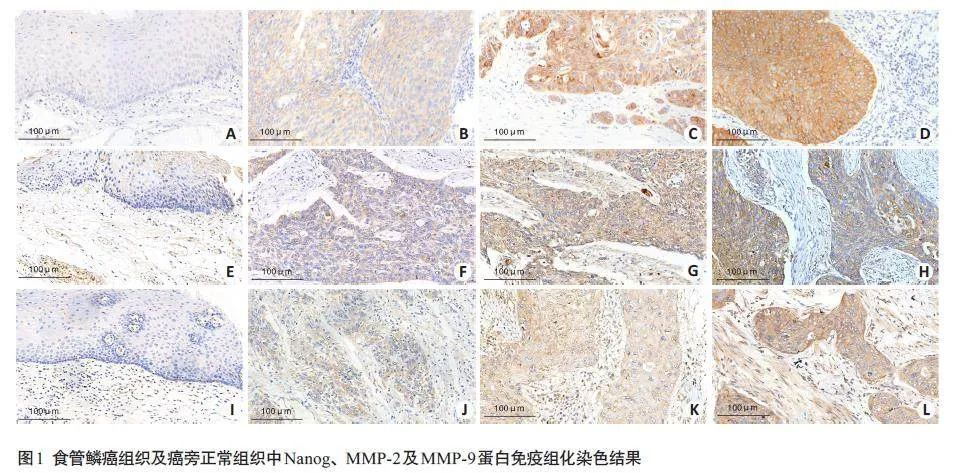
免疫组化结果显示,Nanog、MMP-2 及MMP-9 蛋白表达均主要定位于细胞浆中,其在食管鳞癌组织中的表达均明显高于癌旁正常组织(图1,表2,Plt;0.01)。
2.2 Nanog、MMP-2/MMP-9 蛋白表达与食管鳞癌患者临床病理参数的关系
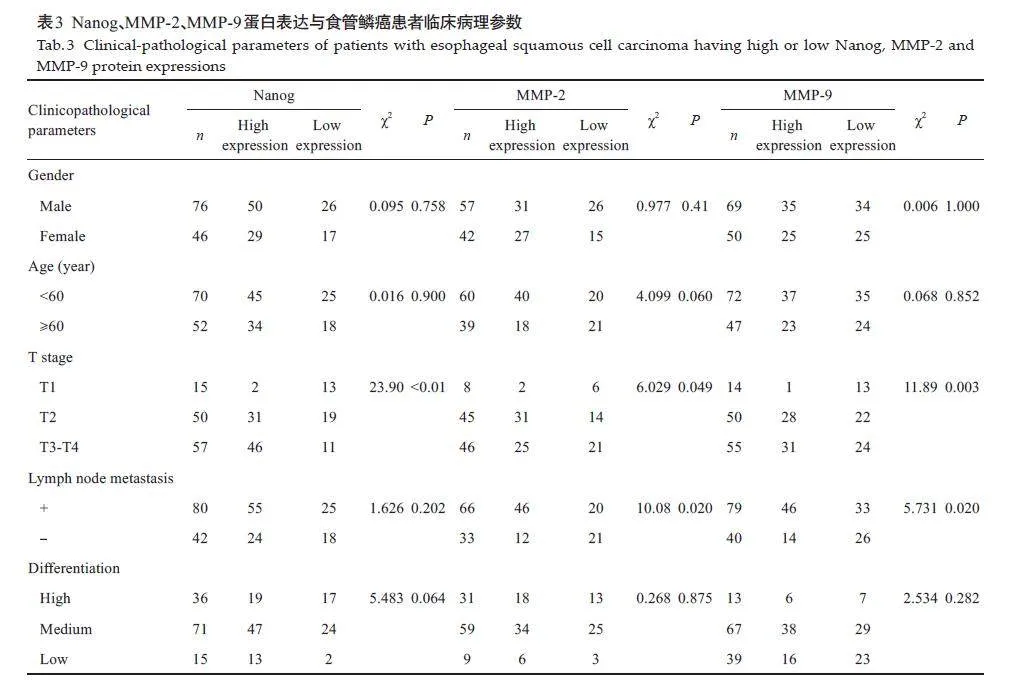
食管鳞癌样本组织中Nanog、MMP-2/MMP-9蛋白表达与肿瘤浸润深度密切相关(χ2=23.9,Plt;0.01;χ2=6.029,Plt;0.05;χ2=11.89,Plt;0.05),有淋巴结转移的样本中MMP-2/MMP-9 蛋白表达高于无淋巴结转移样本(χ2=10,08,Plt;0.01;χ2=5.731,Plt;0.05),而Nanog蛋白表达在有淋巴结转移和无淋巴结转移的样本中差异没有统计学意义(Pgt;0.05)。食管鳞癌组织中Nanog、MMP-2/MMP-9蛋白表达与年龄、性别和肿瘤分化程度相关性不显著(Pgt;0.05,表3)。
2.3 Nanog、MMP-2 和MMP-9 蛋白表达水平与食管鳞癌患者预后的关系
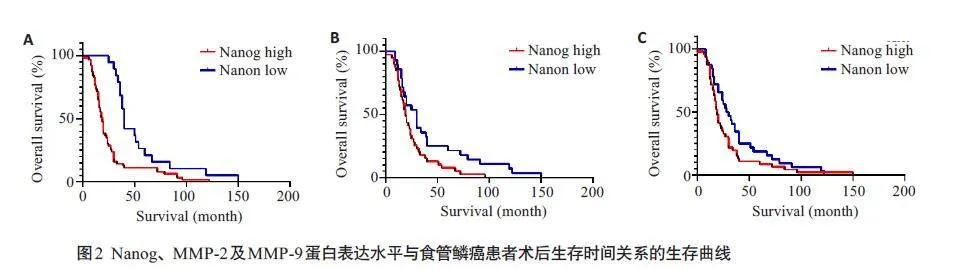
Kaplan-Meier生存分析显示,在食管鳞癌患者组织样本中Nanog、MMP-2及MMP-9低表达组的术后中位生存时间分别为40、30、32月,Nanog、MMP-2及MMP-9蛋白高表达组患者的术后中位生存时间均为19 月。Nanog、MMP-2及MMP-9蛋白高表达组患者生存时间短于低表达患者(Plt;0.001,P=0.004,P=0.017,图2)。
2.4 Nanog 和MMP-2/MMP-9 蛋白表达在食管鳞癌中呈正相关
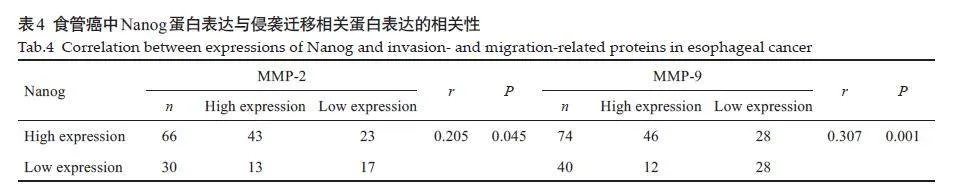
相关分析结果显示,Nanog、MMP-2/MMP-9 蛋白在食管鳞癌中表达均上调且呈正相关(r=0.205,P=0.045;r=0.307,Plt;0.001,表4)。
2.5 Nanog 可能通过TGF- β 信号通路影响 MMP-2/MMP-9蛋白的表达
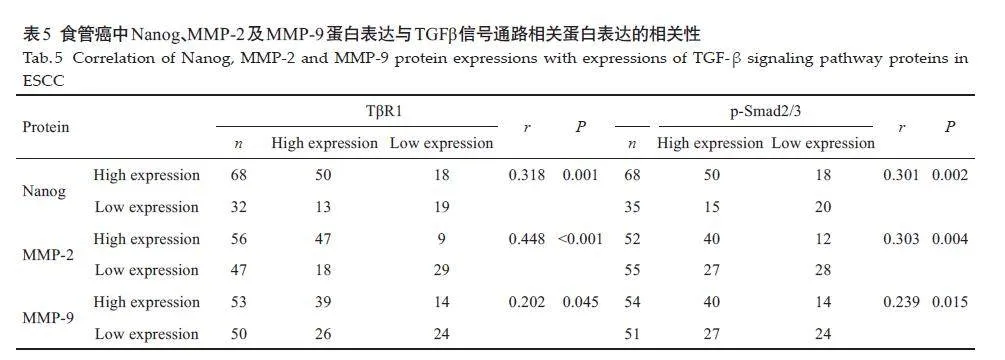
生物信息学分析显示,Nanog等干性相关基因主要富集在TGF-β信号通路;TIMER网站的相关性分析显示,食管癌中TβR1与MMP-2/9呈正相关(图3)。Nanog与TβR1、p-Smad2/3蛋白的表达水平呈正相关(r=0.318,P=0.001;r=0.301,P=0.002),且MMP-2/MMP-9 与TβR1、p-Smad2/3蛋白的表达水平也呈正相关(r=0.448,Plt;0.001,r=0.303,P=0.004;r=0.202,P=0.045,r=0.239,P=0.015,表5)[13]。
2.6 体外细胞学实验分析探讨Nanog 对食管鳞癌细胞迁移能力的影响
qRT-PCR和Western blot 检测结果显示,si-Nanog组Nanog 的mRNA及蛋白表达水平明显低于对照组(Plt;0.05,图4A、B)。划痕实验结果显示,与对照组相比,敲低Nanog 后食管鳞癌细胞的迁移率明显降低(Plt;0.05,图4C)。
2.7 Nanog 通过TGF-β 信号通路促进食管鳞癌细胞的侵袭转移
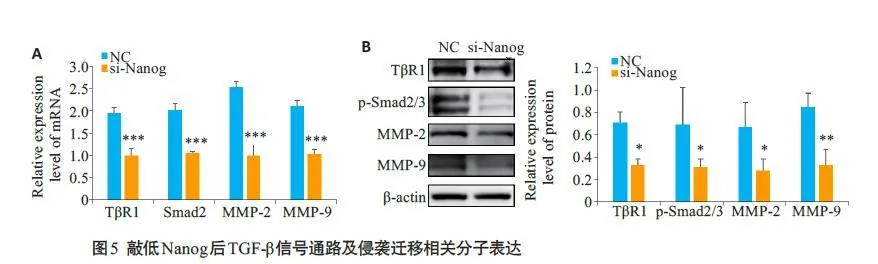
qRT-PCR 和Western blotting 结果显示,与对照组相比,敲低Nanog 后TGF-β信号通路及侵袭迁移相关分子的mRNA水平及蛋白水平均明显下降(图5,Plt;0.05)。
3 讨论
食管癌是我国高发的胃肠道恶性肿瘤之一,其发病率和死亡率高于全球平均水平[14]。多数食管癌患者出现症状时已是中晚期,易发生转移导致生存预后不佳。因此,探究食管癌侵袭转移机制,寻找新的治疗及评估预后标志物是改善患者预后、提高生存率的重要手段。
有研究表明肿瘤侵袭转移的发生是由于肿瘤干细胞的存在[15],而Nanog是一种参与胚胎干细胞自我更新的转录因子[16],参与维持肿瘤干细胞的干性特征,同时,它还可作为致癌基因,Nanog异常表达与多种癌症进展有关。本实验免疫组化结果显示,Nanog蛋白在食管鳞癌组织中高表达,且Nanog高表达的食管鳞癌患者浸润深度高于低表达患者,进一步Kaplan-Meier法分析显示Nanog高表达组患者术后生存时间短于低表达组。这说明Nanog蛋白在食管鳞癌组织中高表达,其蛋白表达是影响食管鳞癌浸润及影响患者术后生存的重要因素。此外,有研究发现在上皮源性恶性肿瘤舌鳞状细胞癌和尿路上皮癌中Nanog蛋白在癌组织中均呈高表达,且其蛋白高表达与患者不良预后密切相关[17, 18]。有研究表明,Nanog在食管鳞癌组织中高表达,其蛋白表达除与浸润深度相关外还与肿瘤分化程度、淋巴结转移相关[19]。这与本研究结果一致。
MMPs是生长性肿瘤发生侵袭转移常见的病理因素之一[20],有研究表明在口腔鳞状细胞癌中抑制Nanog基因会降低MMP-2/9蛋白的表达从而减弱口腔鳞状细胞癌的侵袭迁移能力[21],MMP家族蛋白酶在生理和病理环境中对细胞外基质(ECM)的降解和重塑起着至关重要的作用[22],这些蛋白在炎症、肿瘤发生和血管生成中发挥着充分作用[23]。本实验结果表明,MMP-2/9蛋白在食管鳞癌中高表达且与浸润深度、淋巴结转移密切相关,生存分析提示MMP-2/9 是影响食管鳞癌患者术后生存的重要因素。已有研究表明,MMP-2/9在包括膀胱癌、乳腺癌、食管癌及头颈癌等多种肿瘤中表达均上调[24]。
本研究Spearman 秩相关分析显示,Nanog 与MMP-2/9蛋白表达呈正相关。我们通过GEO数据库筛选干性分子并对差异基因进行通路富集分析发现,Nanog等干性分子主要富集在TGF-β等信号通路;同时在线网站TIMER 分析发现TβR1 与MMP-2/9 呈正相关,提示Nanog可能通过TGF-β信号通路影响MMP-2/MMP-9的表达。本课题组前期在同一批食管鳞癌芯片组织中的研究表明,TβR1、p-Smad2/3蛋白在食管鳞癌中高表达且TGF-β/Smad 信号通路与食管鳞癌的发生发展及预后密切相关[13]。因此,进一步分析Nanog、MMP-2/9蛋白与TβR1、p-Smad2/3蛋白表达的相关性,结果显示Nanog 与MMP-2/9 蛋白表达均与TGF- β/Smad信号通路蛋白表达成正相关,这与本研究生信结果一致。此外,体外实验结果表明敲低Nanog后TGF-β且食管鳞癌细胞的迁移率降低,由此得出结论:Nanog通过TGF-β/Smad 信号通路影响食管癌的侵袭转移。有研究发现在食管癌中敲低Nanog 后MMP-9 mRNA水平降低[8];在前列腺癌中沉默Nanog 会降低TGF-β1的表达,并降低Smad2的磷酸化[25];另有研究表明TGF-β1 通过NF-κB 依赖性途径增强神经元施万细胞中MMP-9的表达[26]。这些研究为本文观点提供了有利的证据。
综上所述,本研究通过免疫组织化学染色发现食管癌组织中Nanog、MMP-2、MMP-9蛋白均高表达且呈正相关,它们与食管癌浸润深度、淋巴结转移及不良预后密切相关;体外实验表明Nanog 通过TGF-β信号通路调控MMP-2、MMP-9的表达从而影响食管癌的侵袭迁移。这为进一步研究Nanog影响食管鳞癌浸润转移的分子机制奠定了基础,并有望为食管鳞癌的治疗及预后提供新的参考和方向。
参考文献:
[1] 郑荣寿, 陈 茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志, 2024, 46(3): 221-31.
[2] Zeng HM, Chen WQ, Zheng RS, et al. Changing cancer survival inChina during 2003-15: a pooled analysis of 17 population-basedcancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-67.
[3] Nafteux PR, Lerut AM, Moons J, et al. International multicenterstudy on the impact of extracapsular lymph node involvement inprimary surgery adenocarcinoma of the esophagus on overallsurvival and staging systems[J]. Ann Surg, 2015, 262(5): 809-15.
[4] Zhu ZP, Xu JH, Li LL, et al. Effect of gastric cancer stem cell ongastric cancer invasion, migration and angiogenesis[J]. Int J MedSci, 2020, 17(13): 2040-51.
[5] Li D, Peng XQ, He GP, et al. Crosstalk between autophagy andCSCs: molecular mechanisms and translational implications[J].Cell Death Dis, 2023, 14(7): 409-13.
[6] Pádua D, Figueira P, Ribeiro I, et al. The relevance of transcriptionfactors in gastric and colorectal cancer stem cells identification anderadication[J]. Front Cell Dev Biol, 2020, 8: 442-9.
[7] Vasefifar P, Motafakkerazad R, Maleki LA, et al. Nanog, as a keycancer stem cell marker in tumor progression[J]. Gene, 2022, 827:146448-57.
[8] Deng L, Zhang XP, Xiang XC, et al. NANOG promotes cellproliferation, invasion, and stemness via IL-6/STAT3 signaling inesophageal squamous carcinoma[J]. Technol Cancer Res Treat,2021, 20: 11038492-56.
[9] Serej ZA, Ebrahimi A, Kazemi T, et al. NANOG gene suppressionand replacement of let-7 modulate the stemness, invasion, andapoptosis in breast cancer[J]. Gene, 2021, 801: 145844-53.
[10]Vasefifar P, Najafi S, Motafakkerazad R, et al. Targeting Nanogexpression increased Cisplatin chemosensitivity and inhibited cellmigration in Gastric cancer cells[J]. Exp Cell Res, 2023, 429(2):113681-8.
[11] Samantaray S, Sharma R, Chattopadhyaya TK, et al. Increasedexpression of MMP-2 and MMP-9 in esophageal squamous cellcarcinoma[J]. J Cancer Res Clin Oncol, 2004, 130(1): 37-44.
[12]Ma K, Zhang C, Li WY. Gamabufotalin suppressed osteosarcomastem cells through the TGF‑β/periostin/PI3K/AKT pathway[J].Chem Biol Interact, 2020, 331: 109275-83.
[13]杨 铭, 李 梅, 孙 畅, 等. TβR1 和p-Smad2/3 蛋白在哈萨克族食管鳞状细胞癌中的表达及临床意义[J]. 华中科技大学学报: 医学版,2023, 52(2): 239-44.
[14]Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[15]Nimmakayala RK, Leon F, Rachagani S, et al. Metabolicprogramming of distinct cancer stem cells promotes metastasis ofpancreatic ductal adenocarcinoma[J]. Oncogene, 2021, 40(1):215-31.
[16]Giri A, Kar S. Interlinked bi-stable switches govern the cell fatecommitment of embryonic stem cells[J]. FEBS Lett, 2024, 598(8):915-34.
[17]Rodrigues MFSD, Xavier FCA, Andrade NP, et al. Prognosticimplications of CD44, NANOG, OCT4, and BMI1 expression intongue squamous cell carcinoma[J]. Head Neck, 2018, 40(8):1759-73.
[18]Abdelbary AM, Atwa HA, Elfarargy OM, et al. Prognosticimplications of CD24, SOX2, and nanog expression in invasiveurothelial carcinoma[J]. Appl Immunohistochem Mol Morphol,2023, 31(6): 421-8.
[19]李秀娟, 赵轶峰, 李明霞, 等. 食管鳞癌组织Nanog表达临床意义分析[J]. 中华肿瘤防治杂志, 2014, 21(24): 1962-5.
[20]Stillebroer AB, Mulders PF, Boerman OC, et al. Carbonic anhydraseIX in renal cell carcinoma: implications for prognosis, diagnosis,and therapy[J]. Eur Urol, 2010, 58(1): 75-83.
[21]Kashyap T, Nath N, Mishra P, et al. Pluripotency transcription factorNanog and its association with overall oral squamous cell carcinomaprogression, cisplatin-resistance, invasion and stemness acquisition[J]. Head Neck, 2020, 42(11): 3282-94.
[22]Alaseem A, Alhazzani K, Dondapati P, et al. Matrix Metalloproteinases:a challenging paradigm of cancer management[J].Semin Cancer Biol, 2019, 56: 100-15.
[23]Knapinska AM, Fields GB. The expanding role of MT1-MMP incancer progression[J]. Pharmaceuticals, 2019, 12(2): 77-85.
[24]Gobin E, Bagwell K, Wagner J, et al. A pan-cancer perspective ofmatrix metalloproteases (MMP) gene expression profile and theirdiagnostic/prognostic potential[J]. BMC Cancer, 2019, 19(1):581-7.
[25]Liu CM, Sheng MX, Lin LH, et al. NANOG regulates theproliferation of PCSCs via the TGF‑β1/SMAD pathway[J]. OpenMed, 2020, 15(1): 841-9.
[26]Muscella A, Vetrugno C, Cossa LG, et al. TGF-β1 activates RSC96Schwann cells migration and invasion through MMP-2 and MMP-9activities[J]. J Neurochem, 2020, 153(4): 525-38.
(编辑:林 萍)
基金项目:国家自然科学基金(81860518);石河子大学国际科技合作推进计划项目(GJHZ202105);兵团重点癌症早诊早治项目(CZ002907)

