心脏磁共振成像整体纵向应变对急性ST段抬高型心肌梗死后左心室重构的预测价值:403例前瞻性研究
摘要:目的 分析心脏磁共振成像(CMR)特征追踪技术测量的整体纵向应变(GLS)对急性ST段抬高型心肌梗死(STEMI)患者接受经皮冠状动脉介入治疗后(PCI)左心室重构(LVR)的预测价值。方法 前瞻性纳入来自国内多中心的经PCI术后的STEMI患者共403例,分别于心肌梗死后1周(7±2 d)和6月进行CMR检查,获得GLS、整体径向应变(GRS)、整体周向应变(GCS)、射血分数(LVEF)和心肌梗死面积(IS)。主要终点为LVR,其定义是随访中通过CMR检查左心室舒张末期容积从基线到6 月增加≥20%或左心室收缩末期容积增加≥15%,根据LVR 的发生情况将患者分为LVR 组(n=101)和无LVR 组(n=302)。采用Logistic 回归分析CMR参数对LVR的预测价值。结果 与无LVR组相比,LVR组的GLS、GCS更大(Plt;0.001),GRS、LVEF更小(Plt;0.001)。Logistic 回归分析显示,GLS(OR:1.387,95%CI:1.223~1.573,Plt;0.001)和LVEF(OR:0.951,95%CI:0.914~0.990,P=0.015)是LVR的独立预测因子。ROC曲线分析显示,GLS预测LVR的最佳临界值为-10.6%,灵敏度为74.3%,特异度为71.9%。GLS 预测LVR 的AUC 与LVEF 的差异无统计学意义(P=0.146),但优于GCS、GRS 和IS 等其他参数(Plt;0.05)。LVEF与其他参数的AUC差异无统计学意义(Pgt;0.05)。结论 基于CMR测定的GLS是STEMI患者PCI术后LVR的重要预测因子,与GRS、GCS、IS和LVEF相比具有明显的优势。
关键词:急性ST段抬高型心肌梗死;心脏磁共振成像特征追踪;心肌应变;左心室重构
近年来,随着经皮冠状动脉介入治疗(PCI)的广泛应用,急性心肌梗死后的死亡率趋于稳定,而心肌梗死后的心力衰竭发生率在不断升高[1-3]。急性心肌梗死后的左心室重构(LVR)会促进心力衰竭的发生,显著降低患者生存率[4, 5]。因此,及早识别和干预高危LVR患者具有重要的临床意义。心肌应变是评价心肌运动的定量指标,反映了心肌纤维组织受力后变形的程度,比左心室射血分数(LVEF)对心肌功能的变化更敏感[6, 7]。其中,整体纵向应变(GLS)在急性ST段抬高型心肌梗死(STEMI)的心肌收缩功能受损的早期就可以出现异常。相比LVEF 有更高的预测价值[8]。心脏磁共振成像(CMR)是评估心脏解剖和功能的金标准[9],可以通过后处理分析重复测量,可用于评估STEMI急性期心脏组织和功能的早期变化,确定梗死位置、大小和严重程度[10]。CMR特征追踪技术不需要额外特殊标记的成像序列,从标准的CMR成像序列中(平衡稳态自由进动序列)准确获得心肌应变参数[11, 12],对确定LVR和预后有重要预测价值[4, 10, 13-15]。目前国内关于CMR测量的心肌应变对LVR预测价值的相关研究较少,且为单中心研究,样本量较小[16, 17],尚无基于多中心建立及验证预测LVR模型的相关研究。GLS作为预测预后的指标能否用于评估STEMI后患者LVR的风险分层,仍有待进一步探索。本研究分析了CMR 特征追踪技术测量的GLS对STEMI 患者PCI 术后发生LVR的预测价值。
1 资料和方法
1.1 一般资料
本研究从国内多中心前瞻性纳入468例急性心肌梗死患者,排除既往心肌梗死、心肌病、心脏瓣膜病、行PCI、冠脉搭桥、冠脉旁路移植等不符合入组标准患者32例,排除心源性休克、心功能Ⅳ级和因失访等无法完成CMR的患者33 例,最终纳入403 例,其中男性349例,女性54 例,年龄26~82(56.8±10.7)岁,发生LVR患者101 例(LVR 组),未发生LVR 患者302 例(无LVR组)。所有患者均安排在PCI术后1周(7±2 d)和6月行2次CMR检查。
纳入标准:年龄≥18岁,依据标准诊断为STEMI[18];首次发作心肌梗死,成功行PCI治疗;同意接受CMR检查和随访复查。排除标准:CMR的禁忌证(造影剂过敏、幽闭恐惧症等);PCI前心源性休克、Killip IV级;瓣膜性心脏病、先天性心脏病、重度肺动脉高压、心肌病病史;既往心肌梗死、PCI、冠状动脉旁路移植术、心脏搭桥术等;恶性肿瘤、肝肾衰竭等不适合临床研究的严重疾病。主要终点为LVR:目前最常见的标准定义为基线检查和随访6 个月的CMR成像之间舒张末期容积增加20%或收缩末期容积增加15%以上[19]。本研究所有患者签署知情同意书,并得到中心伦理委员会的批准(审批号:S2021-126-02)。本研究在Clinicaltrial.gov 上完成注册(编号:NCT04789564)。
1.2 CMR技术及参数分析
本研究数据来自多中心,大部分采用3.0T CMR扫描仪,部分采用1.5T CMR扫描仪(西门子、飞利浦等)。在STEMI 后1 周(7±2 d)和6 月进行2 次CMR数据采集,通过连续短轴切面和左室长轴的两腔、三腔和四腔图像,静脉注射钆造影剂10 min 后获得延迟强化图像。基于CVI42 5.11.2 软件进行全自动特征追踪分析和延迟强化图像分析。全自动特征追踪分析是通过CMR成像中的心肌组织内部区域的运动变化评估心肌的运动和形变,在整个心脏周期内自动跟踪勾画出心肌边界进行三维重建,以二尖瓣环和左室心尖为左室长轴切面参考点,以右心室前插入点为左室短轴切面参考点,在舒张期自动勾画左室内膜和外膜的图像,长轴图像用于获得GLS,短轴图像用于获得整体周向应变(GCS)和整体径向应变(GRS)。从延迟强化图像分析中获得心肌梗死面积(IS)。随机选择20 例患者测试观察者之间和观察者内部的差异来评估测量的稳定性。
1.3 统计学分析
采用SPSS26.0统计软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数(上下四分位数)表示,组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,采用卡方检验或Fisher 精确检验。采用SPSS的诊断方程勾画ROC曲线,以ROC曲线获得预测重构事件的最佳临界值,Z检验比较各参数ROC曲线下面积(AUC)的差异,采用单因素和多因素Logistic回归分析LVR发生的预测因素。以Plt;0.05为差异有统计学意义。
2 结果
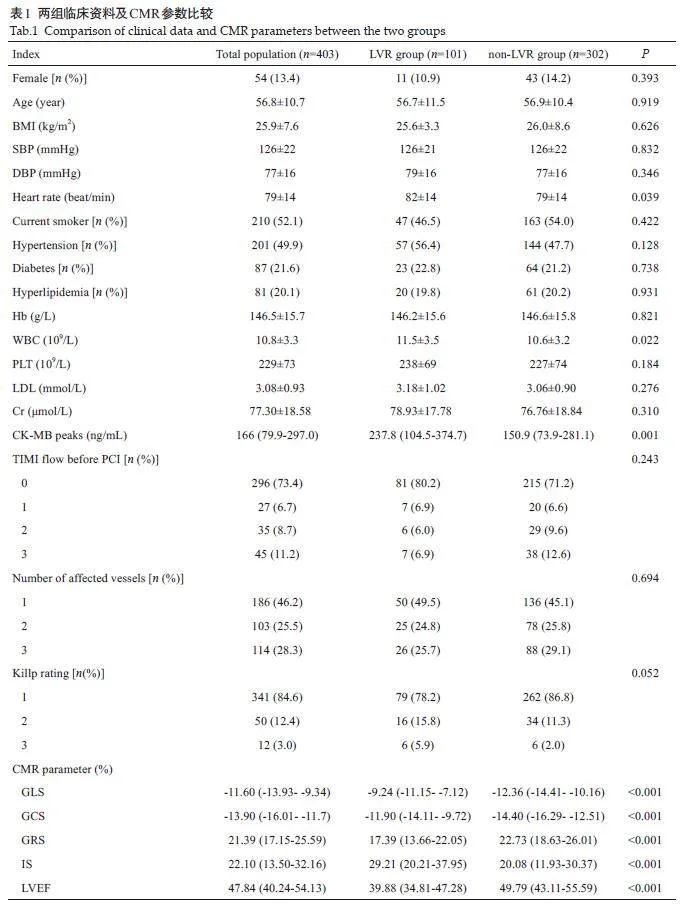
2.1 两组临床资料及CMR参数比较
LVR 组患者的IS 更大,LVEF 更低,应变参数(GLS、GCS、GRS)绝对值更小(Plt;0.001,表1)。
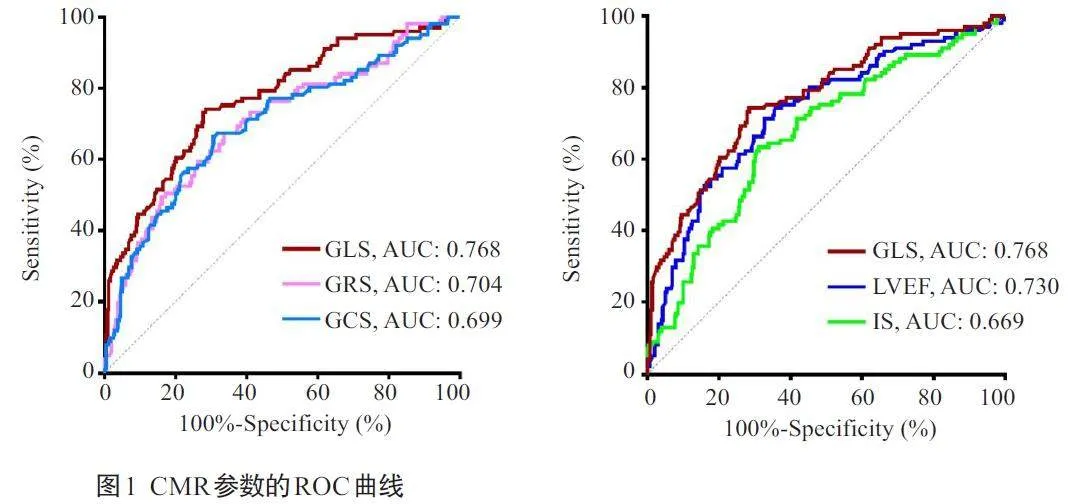
2.2 CMR参数预测LVR的ROC曲线分析
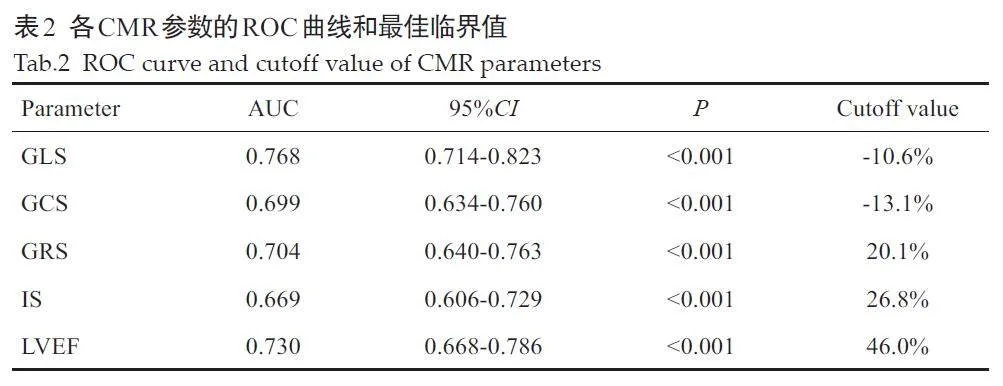
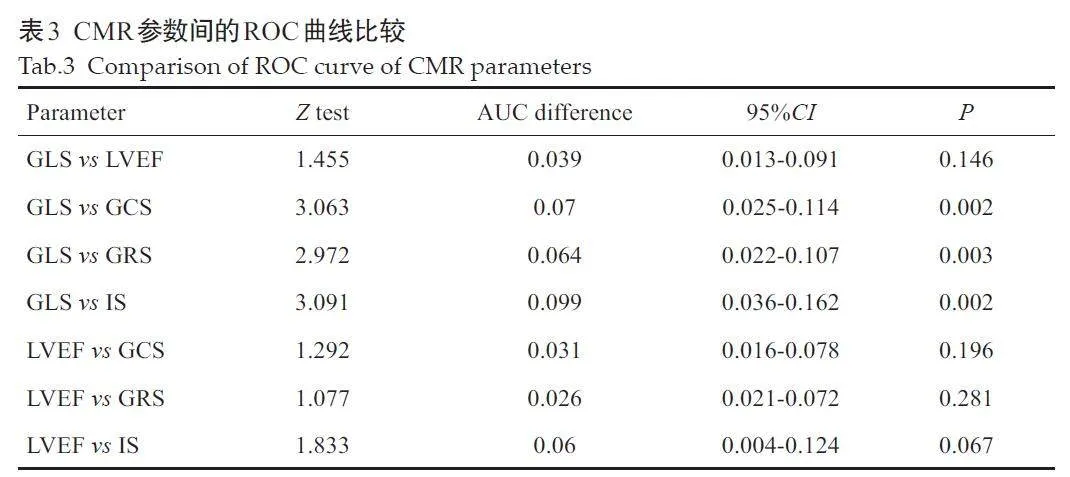
结果显示,GLS预测LVR的最佳临界值为-10.6%;GLS 的AUC大于其他CMR参数的AUC(Plt;0.05,表2、图1)。
GLS与LVEF的AUC差异无统计学意义(P=0.146),GLS与GCS、GRS、IS间的差异有统计学意义(Plt;0.05),LVEF 与GCS、GRS、IS 的AUC 差异无统计学意义(Pgt;0.05,表3)。
2.3 CMR参数预测LVR的Logistic回归分析
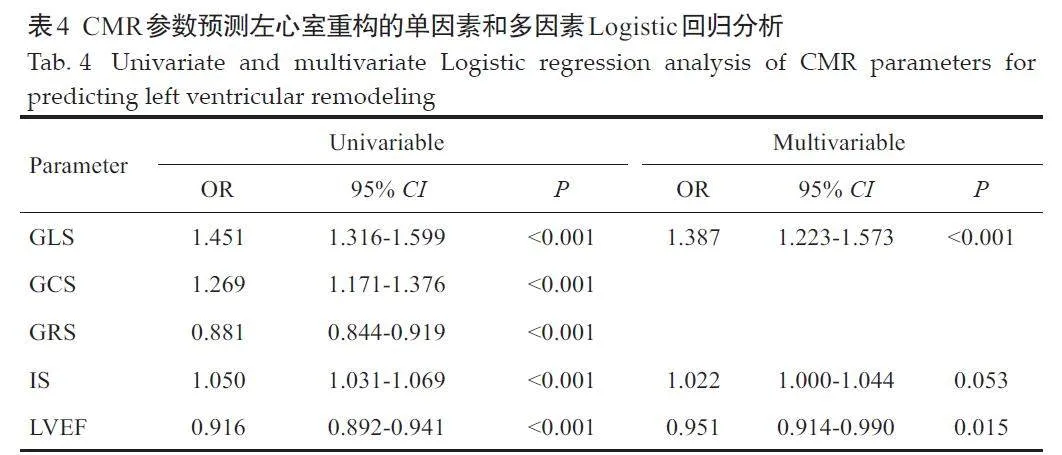
在单因素分析中,GLS、GRS、GCS、IS 和LVEF 均与LVR的发生相关(Plt;0.001)。经多因素回归分析后,仅GLS(Plt;0.001)和LVEF(P=0.015)能够独立预测LVR(表4)。
在LVEFgt;40%的亚组患者中,调整IS等因素后,仅GLS能够独立预测LVR(P=0.001)矫正核磁其它变量,GLS 和LVR 间仍具有相关性(P=0.001),而LVEF 与LVR间无相关性(P=0.429)。
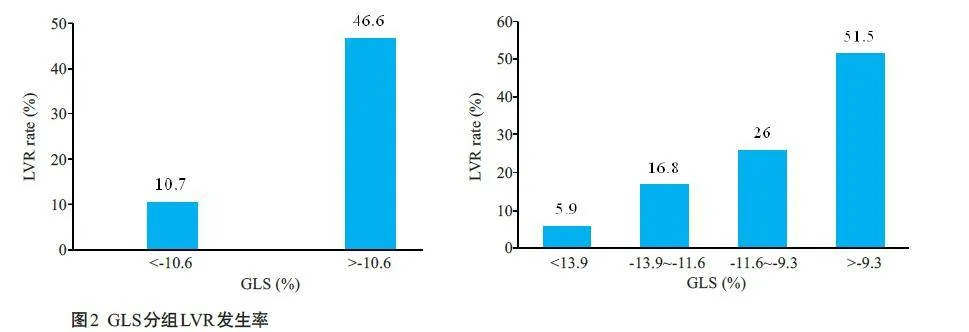
2.4 GLS分组预测LVR的发生率
以GLS最佳临界值为界分为2组:GLSlt;-10.6%时,LVR占比10.7%;GLSgt;-10.6%时,LVR占比46.6%。
以GLS四分位间距数分为4组(P25为-13.9%、P50为-11.6%、P75为-9.3%)。随着GLS绝对值降低,LVR发生率增高。其中组1(GLSlt;-13.9%)LVR 为5.9%,组2(-13.9%-9.3%)LVR 为51.5%(Plt;0.01,图2)。
2.5 联合GLS和LVEF预测LVR的发生率
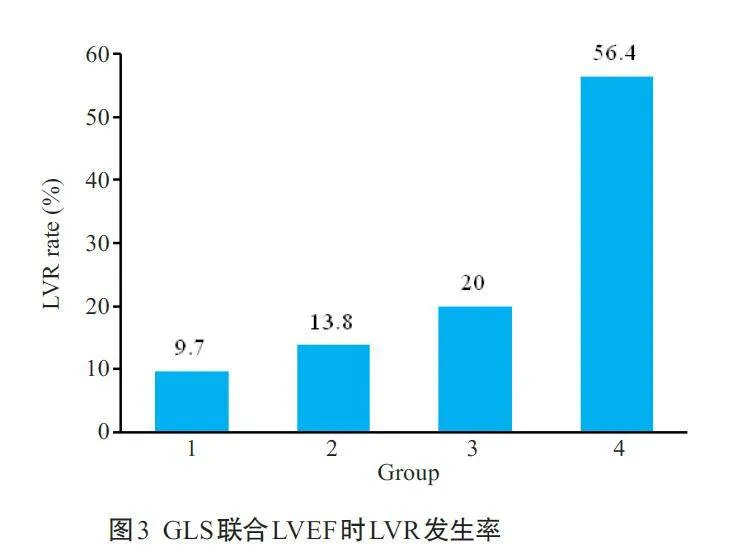
组1 GLSlt;-10.6%且LVEFgt;46%时LVR发生率为9.7%,组2 GLSlt;-10.6%且LVEFlt;46%时LVR 发生率为13.8%,组3 GLSgt;-10.6%且LVEFgt;46%时LVR发生率为20.0%,组4 GLSgt;-10.6%且LVEFlt;46%时LVR发生率为56.4%(Plt;0.01,图3)。
3 讨论
心脏重构是影响STEMI患者预后的关键因素。急性STEMI后,心脏组织遭受压力、炎症、代谢和纤维化等机制作用,导致LVR风险增加[4]。严重的心肌功能损伤与LVR风险的增加及临床预后的恶化密切相关[13]。因此,早期识别高危人群并及时采取药物治疗干预LVR的发生,对预防心力衰竭等不良预后、改善患者的生存质量具有重要意义。本研究纳入多中心的403例患者,同时考虑应变参数、IS和LVEF,通过CMR的高级后处理技术全面评估了CMR参数对LVR的预测能力。本研究显示,经PCI治疗的STEMI患者中,约25.1%发生了LVR。与未出现LVR的患者相比,经历LVR的患者IS更大,LVEF更低,心肌应变参数(GLS、GCS、CRS)的绝对值更小,这提示以上指标对PCI 术后的STEMI 患者发生LVR均有预测价值;ROC曲线分析进一步证明了CMR指标在预测LVR方面的有效性,各指标AUC值均达到了显著水平,其中GLS的AUC值最大(0.768),LVEF次之(0.730)。通过比较不同指标的AUC值,发现GLS 与LVEF 之间的差异无统计学意义,与其他CMR参数的差异有统计学意义;而LVEF与其他CMR参数之间的差异无统计学意义。这表明GLS 在预测LVR方面可能优于其他指标,在某些情况下,GLS可能比LVEF具有更加敏感和特异的预测价值。值得注意的是,即使在LVEFgt;40%或处于正常范围的情况下,GLS仍然能够独立预测LVR的发生,而此时LVEF的独立预测作用消失,进一步证实了GLS在预测心脏重构方面的优势。这一发现与既往研究[20]一致,GLS能够有效识别LVEFgt;40%的心肌梗死患者中的高危人群。现代化心肌梗死管理使得LVEF正常或轻度降低的患者比例有所增加,针对此类患者的临床管理显得尤为重要。虽然目前指南推荐将LVEF作为心血管风险分层的工具[21, 22],但是仅以LVEF可能无法全面评估心脏收缩功能和LVR 的风险。多项研究表明,相比LVEF,GLS能够捕捉心脏局部和整体的功能变化,对急性心肌梗死后患者的远期预后(全因死亡、心力衰竭等)具有更高的独立预测能力,尤其是在识别LVEF 保留的急性STEMI患者的心血管事件风险方面[11, 23, 24],这可能是由于STEMI发生后心内膜下的纵向心肌纤维最先受到影响,影响到代表心肌纵向收缩的GLS[25],此时心肌的损失还不足以使LVEF下降到异常水平,而GLS已经出现异常[26],提示GLS可能比LVEF更早地反映出心肌的功能损伤,预示LVR的发生风险。在心梗急性期,存活心肌的功能通过代偿弥补了部分梗死的心肌的损失,使得LVEF 总体上得以保留,而GLS 的下降则先于LVEF。因此,GLS作为一种更敏感的心肌损伤指标,在LVEF尚未显著下降的早期阶段,其异常更早地揭示了LVR的风险,提供了超越LVEF的预测价值。相反,有研究通过单因素分析筛选LVR的CMR高危特征指标,发现GCS差异显著(P=0.020)而GLS 差异临界(P=0.051)[17],对LVR的发生多考虑到心室短轴的变化,未将GLS纳入风险分层模型。
本研究通过分组比较GLS 值与LVR发生率的关系,直观展示了GLS 与LVR 之间的正相关性。当GLSgt;-10.6%时,LVR的发生率达到了46.6%,显著高于GLSlt;-10.6%时的10.7%。揭示了GLS超过-10.6%时,应考虑患者发生LVR的风险为高风险。相较于既往研究[27,28],本研究中GLS的最佳临界值更大(-10.6%),即GLS需要上升到更高的水平,才能预测出LVR的发生,这可能是由于本研究人群的IS基线较大(26.8%),导致心肌功能的下降更严重,部分早期已经出现了LVR的表现(左心室舒张末容积增加),进而发生LVR 需要更高的GLS 值。本研究按照GLS 的四分位间距数分为四组,随着GLS 绝对值的降低,LVR的发生率显著增高,GLSgt;-9.3%时,LVR的发生率达到了51.5%。这说明GLS 的降低与心脏重构的风险增加密切相关,有助于临床中根据患者的GLS 值来采取个体化的治疗策略。此外,本研究多因素分析显示GLS 和LVEF 是LVR的独立预测因素,在此基础上提出了新的风险分层,当GLSgt;-10.6%且LVEFlt;46 时,LVR 发生率为56.4%,显著高于其他组。GLS 联合LVEF 的预测效果进一步提高,对预测急性STEMI 幸存者的LVR 风险具有重要的临床价值,充分说明了GLS 和LVEF 作为LVR 的独立预测因素的有效性。在临床实践中,联合GLS 和LVEF 进行风险评估、监测STEMI 患者的心脏功能,可能有助于更早地识别出高风险患者并进行相应的治疗干预,然而不同研究的最佳临界值差异较大,应用于实践仍需进一步更大规模的研究来验证。
总的来说,本研究进一步证明了心肌应变参数GLS对预测LVR的价值,提供了心脏重构的预测模型,强调了进一步研究GLS 在急性STEMI 幸存者中的应用,以优化STEMI患者的风险评估和临床管理。随着CMR技术的发展和应变分析软件的标准化,心肌应变成像可能成为日常临床评估中不可或缺的一部分。在未来的临床指南中,应更多地考虑到GLS 在预测STEMI 后LVR和MACE事件风险中的应用。但本研究也存在一定局限:首先,本研究人群IS较大,可能导致GLS阈值与其他研究和实际有所不同,需要在更广泛的人群中研究心肌应变参数的测量、分析和应用,以确定在临床实践中的最佳阈值;其次,GRS、GCS和IS在单因素分析中显示出差异有统计学意义,这表明它们可能也在预测LVR中起到作用,因此需要进行深入研究探索这些参数的潜力和价值;最后,本研究数据来自多中心,不同的心脏磁共振机器存在一些差异,可能对结果有一定影响。
参考文献:
[1] GBD Causes of Death Collaborators. Global, regional, and nationalage-sex-specific mortality for 282 causes of death in 195 countriesand territories, 1980-2017: a systematic analysis for the GlobalBurden of Disease Study 2017[J]. Lancet, 2018, 392(10159):1736-88.
[2] GBD Diseases and Injuries Collaborators. Global burden of 369diseases and injuries in 204 countries and territories, 1990-2019: asystematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2020, 396(10258): 1204-22.
[3] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2022概要[J]. 中国循环杂志, 2023, 38(6): 583-612.
[4] Frantz S, Hundertmark MJ, Schulz-Menger J, et al. Left ventricularremodelling post-myocardial infarction: pathophysiology, imaging,and novel therapies[J]. Eur Heart J, 2022, 43(27): 2549-61.
[5] Cohn JN, Ferrari R, Sharpe N. Cardiac remodeling-concepts andclinical implications: a consensus paper from an international forumon cardiac remodeling. Behalf of an International Forum on CardiacRemodeling [J]. J Am Coll Cardiol, 2000, 35(3): 569-582.
[6] Kalam K, Otahal P, Marwick TH. Prognostic implications of globalLV dysfunction: a systematic review and meta-analysis of globallongitudinal strain and ejection fraction[J]. Heart, 2014, 100(21):1673-80.
[7] Biering-Sørensen T, Hoffmann S, Mogelvang R, et al. Myocardialstrain analysis by 2-dimensional speckle tracking echocardiographyimproves diagnostics of coronary artery stenosis in stable anginapectoris[J]. Circ Cardiovasc Imaging, 2014, 7(1): 58-65.
[8] Voigt JU, Cvijic M. 2- and 3-dimensional myocardial strain incardiac health and disease[J]. JACC Cardiovasc Imaging, 2019, 12(9): 1849-63.
[9] Friedrich MG. The future of cardiovascular magnetic resonanceimaging[J]. Eur Heart J, 2017, 38(22): 1698-1701.
[10]Rajiah PS, François CJ, Leiner T. Cardiac MRI: state of the art[J].Radiology, 2023, 307(3): e223008.
[11] Reindl M, Tiller C, Holzknecht M, et al. Prognostic implications ofglobal longitudinal strain by feature-tracking cardiac magneticresonance in ST-elevation myocardial infarction[J]. CircCardiovasc Imaging, 2019, 12(11): e009404.
[12]Morais P, Marchi A, Bogaert JA, et al. Cardiovascular magneticresonance myocardial feature tracking using a non-rigid, elasticimage registration algorithm: assessment of variability in a real-lifeclinical setting[J]. J Cardiovasc Magn Reson, 2017, 19(1): 24.
[13]Bulluck H, Dharmakumar R, Arai AE, et al. Cardiovascularmagnetic resonance in acute ST-segment-elevation myocardialinfarction: recent advances, controversies, and future directions[J].Circulation, 2018, 137(18): 1949-64.
[14]Rodriguez-Palomares JF, Gavara J, Ferreira-González I, et al.Prognostic value of initial Left ventricular remodeling in patientswith reperfused STEMI[J]. JACC Cardiovasc Imaging, 2019, 12(12): 2445-56.
[15]Khan JN, Nazir SA, Singh A, et al. Relationship of myocardial strainand markers of myocardial injury to predict segmental recovery afteracute ST-segment-elevation myocardial infarction[J]. CircCardiovasc Imaging, 2016, 9(6): e003457.
[16]马文坤, 李歆旎, 高程洁, 等. 心肌应变参数对急性ST段抬高型心肌梗死患者左心室重构的预测价值[J]. 海军军医大学学报, 2022, 43(5): 519-25.
[17]郭 倩, 王 晓, 郭芮丰, 等. CMR高危特征对LVEF轻度降低或保留的STEMI患者心室重构的预测价值[J]. 中华心血管病杂志, 2022,50(9): 864-72.
[18]中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 急性ST段抬高型心肌梗死诊断和治疗指南(2019)[J]. 中华心血管病杂志, 2019, 47(10): 766-83.
[19]中国医师协会胸痛专业委员会, 中华心血管病杂志(网络版)编辑委员会, 急性心肌梗死后心室重构防治专家共识起草组. 急性心肌梗死后心室重构防治专家共识[J]. 中华心血管病杂志: 网络版, 2020,3(1): 1-7.
[20]Ersbøll M, Valeur N, Mogensen UM, et al. Prediction of all-causemortality and heart failure admissions from global left ventricularlongitudinal strain in patients with acute myocardial infarction andpreserved left ventricular ejection fraction[J]. J Am Coll Cardiol,2013, 61(23): 2365-73.
[21]O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHAguideline for the management of ST-elevation myocardial infarction:executive summary: a report of the American College of CardiologyFoundation/American Heart Association Task Force on PracticeGuidelines[J]. Circulation, 2013, 127(4): 529-55.
[22] Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for themanagement of acute myocardial infarction in patients presentingwith ST-segment elevation: the Task Force for the management ofacute myocardial infarction in patients presenting with ST-segmentelevation of the European Society of Cardiology (ESC) [J]. EurHeart J, 2018, 39(2): 119-77.
[23] Joyce E, Hoogslag GE, Leong DP, et al. Association between leftventricular global longitudinal strain and adverse left ventriculardilatation after ST-segment-elevation myocardial infarction[J]. CircCardiovasc Imaging, 2014, 7(1): 74-81.
[24]Eitel I, Stiermaier T, Lange T, et al. Cardiac magnetic resonancemyocardial feature tracking for optimized prediction ofcardiovascular events following myocardial infarction[J]. JACCCardiovasc Imaging, 2018, 11(10): 1433-44.
[25]Claus P, Omar AMS, Pedrizzetti G, et al. Tissue tracking technologyfor assessing cardiac mechanics: Principles, Normal Values, andClinical Applications [J]. JACC Cardiovasc Imaging, 2015, 8(12):1444-1460.
[26]Rost C, Rost MC, Breithardt OA, et al. Relation of functionalechocardiographic parameters to infarct scar transmurality bymagnetic resonance imaging [J]. J Am Soc Echocardiogr, 2014, 27(7): 767-774..
[27]Cha MJ, Lee JH, Jung HN, et al. Cardiac magnetic resonance-tissuetracking for the early prediction of adverse left ventricularremodeling after ST-segment elevation myocardial infarction[J]. IntJ Cardiovasc Imaging, 2019, 35(11): 2095-102.
[28]Reindl M, Tiller C, Holzknecht M, et al. Global longitudinal strainby feature tracking for optimized prediction of adverse remodelingafter ST-elevation myocardial infarction[J]. Clin Res Cardiol, 2021,110(1): 61-71.
(编辑:郎 朗)
基金项目:中华心血管病发展专项基金心脏健康科研基金项目(Z-2017-26-2202-2);首都卫生发展科研专项项目(SF2020-2-5012)

