尿石素A通过活化miR-136 介导的Sirt1 信号通路减轻呼吸道合胞病毒诱导的新生小鼠肺部感染

摘要:目的 探讨尿石素A(UA)治疗呼吸道合胞病毒(RSV)引起的新生小鼠肺部感染的疗效及作用机制。方法 将Babl/c小鼠(5~7 d)随机分为5 组(n=10):正常对照(Control)组、RSV感染(RSV)组、低剂量UA(UA-L)组、中剂量UA(UA-M)组、高剂量UA(UA-H)组。BEAS-2B细胞同样分为Control组、RSV组、UA-L组、UA-M组和UA-H组。除正常对照组外,其余4组小鼠或细胞均给予RSV感染。RSV感染2 h后,UA-L组、UA-M组和UA-H组小鼠分别腹腔注射2.5、5和10 mg/kg的UA,1次/d,连续注射2 周;UA-L组、UA-M组和UA-H组细胞分别用2.5、5 和10 μmol/L的UA处理48 h。HE染色评价肺组织病理学改变。收集支气管肺泡灌洗液用于炎症细胞计数和炎症因子检测。炎症、细胞活力、凋亡和自噬分别采用酶联免疫吸附实验、CCK-8实验、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记实验、流式细胞术、Western blotting 和免疫荧光染色检测。qRT-PCR检测miR-136 和Sirt1 mRNA的表达,双荧光素酶报告基因系统验证miR-136 和Sirt1 的相互关系。结果 与Control组相比,RSV感染组小鼠肺组织病理评分、病毒荷载量、TUNEL阳性细胞数、LC3-II/I、Beclin-1和miR-136表达及BALF中总细胞数、炎症细胞数和炎症因子含量显著升高(Plt;0.0001),而p62 和Sirt1 表达显著减少(Plt;0.0001);与RSV组相比,UA处理则呈剂量依赖性逆转上述检测指标值(Plt;0.05)。与Control组相比,RSV组BEAS-2B凋亡细胞数、LC3B阳性细胞数及miR-136表达明显增多,Sirt1表达减少(Plt;0.01);与RSV组相比,UA处理剂量依赖性地减弱上述指标的改变(Plt;0.01)。与miR-NC组相比,miR-136组Sirt1-WT的荧光素酶活性显著降低,Sirt1表达减少(Plt;0.001),Sirt1-MUT的荧光素酶活性不变(Pgt;0.05)。与RSV+UA组相比,RSV+UA+miR-136组和RSV+UA+Ex527组炎症因子含量和凋亡细胞数明显增加(Plt;0.05),LC3B表达显著减少(Plt;0.0001);miR-136 与Ex527 共处理进一步改变上述指标值(Plt;0.05)。结论 UA通过活化miR-136 介导的Sirt1 信号通路减轻RSV诱导的新生小鼠肺部感染。
关键词:尿石素A;呼吸道合胞病毒;miR-136;Sirt1
呼吸道合胞病毒(RSV)是严重肺炎和毛细支气管炎的主要病因,可导致婴幼儿反复的下呼吸道感染[1, 2]。流行病学研究发现,50%~70%的婴幼儿感染RSV后引起的毛细支气管炎伴随反复喘息和哮喘[3, 4],当RSV感染合并病毒性肺炎时甚至可危及生命[5]。呼吸道支气管上皮细胞是RSV感染的主要靶细胞,近年来,尽管对RSV感染的病理生理学研究取得很大进展,但其治疗方案仍然有限[6, 7]。除常规抗病毒药物(利巴韦林)和支气管扩张剂外,尚无有效的药物用于治疗RSV感染性毛细支气管炎[8]。因此,探究RSV感染的发病机制及寻找新的用于治疗RSV感染的药物极为重要。
尿石素A(UA)是由含鞣花丹宁的食物(如石榴、浆果和坚果等)产生的一种天然代谢物[9]。UA具有多种药理学功能,包含抗炎、抗氧化、神经保护、改善肌肉功能等,在多种疾病中发挥有益作用[10]。研究发现[11, 12],UA具有肺损伤保护功能。UA可减轻脂多糖(LPS)诱导的小鼠急性肺损伤[11]。此外,UA通过诱导保护性自噬减轻LPS 诱导的新生小鼠肺炎[12]。在抗病毒方面,UA通过促进肠道病毒71(EV71)病毒感染细胞的自噬和凋亡而抑制EV71 病毒的增殖[13]。然而,目前尚无UA治疗RSV引起的肺部感染的相关研究。
MicroRNAs(miRNAs)是一类长度约为18~25 个核苷酸的非编码RNA,在mRNA稳定性和基因表达的调控中起关键作用[14]。微阵列和高通量测序显示,RSV感染的儿童miRNAs 表达与健康对照有明显差异[15]。越来越多的证据表明,miRNA表达的改变可能参与RSV 感染的发病机制[16-18]。Zhuang 等[19]报道,miR-136 的表达在RSV感染的小鼠肺组织中显著升高。然而,miR-136 在RSV引起的肺部感染中的作用尚不明确。
Sirt1是一种高度保守的NAD+依赖性去乙酰化酶,通过去乙酰化多种蛋白质影响多种生物过程[20]。据报道,激活Sirt1 可通过多个信号通路抑制人鼻病毒诱导的哮喘加重[21]。RSV感染时,Sirt1 可激活与自噬相关的树突细胞,从而指导有效的抗病毒免疫反应[22]。Sirt1还可调节RSV感染的树突细胞的线粒体功能和免疫稳态[23]。既往研究发现,Sirt1是miR-136的靶基因[24]。因此,本研究以miR-136/Sirt1 信号通路为切入点,研究UA对RSV诱导的新生小鼠肺部感染的影响。
1 材料和方法
1.1 试剂与抗体
RSVA2(ATCC),UA(纯度≥97%)和Ex527(Sigma-Aldrich)。抗体LC3B(1∶2000)、Beclin-1(1∶1000)、p62(1∶1000)、Sirt1(1∶1000)、Alexa Fluor®488-标记的IgG(H+L)(1∶1000)(Abcam)。
1.2 细胞培养
人喉表皮样癌细胞HEp-2 和人支气管上皮细胞BEAS-2B由武汉普诺赛生命科技有限公司(武汉,中国)提供。HEp-2 和BEAS-2B细胞中加入含10%胎牛血清(Hyclone)和1%青霉素/链霉素(Sigma-Aldrich)的DMEM培养基(Hyclone),在37 ℃含5% CO2的培养箱中进行培养。
1.3 RSV感染新生小鼠模型的构建与分组
50只SPF级Babl/c小鼠(5~7 d)购自内蒙古民族大学实验动物中心(内蒙古,中国)。依据先前的研究[19]确定样本量。饲养于20~25℃,相对湿度为50%~70%,12 h明暗周期的环境中,给予自由饮食和饮水。所有动物实验严格按实验动物操作指南进行,并经内蒙古民族大学附属医院伦理委员会批准(伦理批号:NM-LL-2023-03-05-11)。小鼠随机分为5 组(n=10):正常对照组(Control)、RSV感染组(RSV)、低剂量UA组(UA-L)、中剂量UA组(UA-M)、高剂量UA组(UA-H)。除正常对照组外,其余小鼠均给予RSV感染。RSVA2在HEp-2细胞中繁殖[25],制备浓度为5×106半数组织培养感染剂量(TCID50)/0.035 mL的RSV原液。用氯胺酮/噻嗪溶液(Sigma Aldrich, 2 μL/g)麻醉小鼠,用100 μL移液管将35 μL病毒稀释液注入小鼠鼻孔内[26]。病毒感染2 h后,UA组分别按2.5 mg/kg(低剂量)、5 mg/kg(中剂量)和10 mg/kg(高剂量)腹腔注射小鼠体内,1次/d,连续注射2周。正常对照组和RSV组小鼠腹腔注射相同剂量的生理盐水。末次注射后,麻醉小鼠,收集支气管肺泡灌洗液(BALF)用于炎症细胞计数和炎症因子检测,分离肺组织用于HE 染色、TUNEL 染色和Westernblotting 实验。参照Sun 等[26]方法,RSV复制进行PCR检测。
1.4 HE染色
肺组织经10%福尔马林固定后用石蜡包埋,进行5 μm厚度切片。使用HE染色试剂盒(碧云天)进行染色。采用双盲法对组织炎症反应进行评分:0分:无炎症细胞渗出;1分:少量炎症细胞渗出;2分:渗出细胞形成单层细胞环;3分:渗出细胞形成2~4层细胞环;4分:渗出细胞形成多于4层细胞环。每个切片至少取3个不同的视野进行评分。
1.5 ELISA实验
BALF 及BEAS-2B 细胞中的炎症因子TNF- α、IL-1β、IL-4、IL-5、IL-6、IL-13、IFN- γ 和CXCL1 采用ELISAs试剂盒(南京建成生物工程研究所)进行检测。所有操作按说明书进行。
1.6 BALF中细胞计数
BALF在1200 r/min,4 ℃条件下离心10 min,收集细胞沉淀物进行重悬。与100 μL预冷PBS混合后,取10 μL细胞悬液加入细胞计数板。在光学显微镜下进行总细胞计数。另取细胞悬液20 μL滴于载玻片上,涂片,自然干燥后用Wright's-giemsa染色,计算细胞总数、淋巴细胞数、巨噬细胞数和中性粒细胞数。
1.7 TUNEL实验
小鼠肺组织凋亡使用TUNEL 凋亡试剂盒(碧云天)进行检测。小鼠肺组织切片经二甲苯脱蜡、梯度酒精复水后,加入蛋白酶K工作液在37 ℃孵育15 min。然后按照使用说明书,加入试剂盒中的TDT 和dUTP(1∶9)孵育60 min,DAPI 孵育5 min。在荧光显微镜(Carl Zeiss)下观察。
1.8 细胞活性检测
BEAS-2B细胞以5×103/孔培养在96 孔板中,用于检测UA的细胞毒性。细胞中加入不同浓度的UA(0、2.5、5、10、20和40 μmol/L),每孔加入10 μL CCK8试剂(碧云天),分别培养24 h和48 h。使用酶标仪(SynergyHT)检测吸光值A450 nm。
1.9 RSV感染BEAS-2B细胞及UA处理
BEAS-2B细胞以1×104/孔接种于96孔板中,37 ℃培养,生长成单层细胞。设正常对照组(Control)、RSV感染组(RSV)、低剂量UA 组(UA-L)、中剂量UA 组(UA-M)、高剂量UA组(UA-H)。除正常对照组外,其余各组均用20 μL 100TCID50 RSV(10-2.5/mL)感染BEAS-2B细胞,RSV感染2 h后,UA组分别加入2.5(低剂量)、5(中剂量)、10 μmol/L(高剂量)UA在37 ℃孵育48 h。
1.10 细胞转染及处理
使用Lipofectamine 2000(Invitrogen)将miR-136mimic(miR-136)及其阴性对照(miR-NC;锐博生物)转染BEAS-2B细胞,收集细胞用于RT-qPCR检测。为了抑制Sirt1 的表达,细胞中加入10 μmol/L的Sirt1 抑制剂(Ex527)。
1.11 流式细胞术检测细胞凋亡
收集经不同处理的BEAS-2B细胞,用Annexin VFITC凋亡试剂盒(碧云天)检测细胞凋亡情况。加入195 μL Annexin V-FITC 结合液重悬细胞,用5 μLAnnexin V-FITC和10 μL PI 的室温避光孵育20 min。流式细胞仪(BD Biosciences)分析细胞凋亡情况。
1.12 免疫荧光染色
BEAS-2B(2×104/mL)接种于含有盖玻片的6孔培养板中。细胞经不同处理后,4%多聚甲醛固定20 min。用1% 牛血清白蛋白(Sigma-Aldrich)封闭10 min,Triton X-100破膜10 min。加入LC3B抗体4 ℃孵育过夜,加入Alexa Fluor®488-标记的IgG在37 ℃孵育1 h。用DAPI(10 mg/mL,碧云天)室温孵育5 min。在激光共聚焦显微镜(Zeiss)下观察,计算LC3B阳性细胞百分数。
1.13 Western blotting实验
细胞或组织中的蛋白用RIPA裂解缓冲液(碧云天)提取,蛋白浓度用BCA蛋白测定试剂盒(碧云天)测定。等量蛋白质(30 μg)进行SDS聚丙烯酰胺凝胶电泳并转移至PVDF膜(GE Healthcare)上,用5%脱脂牛奶封闭1 h后,加入抗LC3 I/II、p62、Beclin-1、Sirt1和β-actin的抗体,在4 ℃条件下孵育过夜,再用二抗(Abcam)在37 ℃孵育1 h。用增强化学发光试剂(Pierce)显示免疫信号。ImageJ软件(NIH)进行条带的灰度分析。
1.14 实时荧光定量PCR(qRT-PCR)
使用RNeasy Mini Kit(Qiagen)提取细胞或组织中的总RNA。逆转录用ExScript RT Reagent Kit(Takara)进行。采用SYBR Premix Ex Taq 试剂盒(Takara)在RT-qPCR 仪(ABI StepOne)上进行qPCR 分析。miRNA 和mRNA 的表达用2−ΔΔCt 法进行计算,U6 和GAPDH分别作为内参。引物序列见表1。
1.15 双荧光素酶报告基因系统实验
通过生物信息学数据库miRanda、targetScan(http://www. targetscan. org/vert_80/) 和RNAInter(http://www. rnainter. org)预测Sirt1 为miR-136 的靶点。用qRT-PCR 扩增野生型(WT)或突变型(MUT)Sirt1 mRNA 3'-UTR 序列,并插入psiCHECK-2 载体(Promega, Madison)中,生成Sirt1-WT 和Sirt1-MUT3'-UTR荧光素酶质粒。BEAS-2B以1×104/孔接种于24孔板中培养24 h,将miR-136或miR-NC与Sirt1-WT或Sirt1-MUT 使用Lipofectamine 2000 共转染BEAS-2B细胞48 h,双荧光素酶报告基因系统(Promega)评估荧光素酶活性,以Renilla荧光素酶活性作为对照。
1.16 统计学分析
所有数据以均数±标准差表示,采用Graphpadprism 8 软件进行统计分析。非配对t检验进行两组间差异比较;方差分析进行多组间差异比较,并采用Tukey's检验进行多重比较。Plt;0.05时认为差异有统计学意义。
2 结果
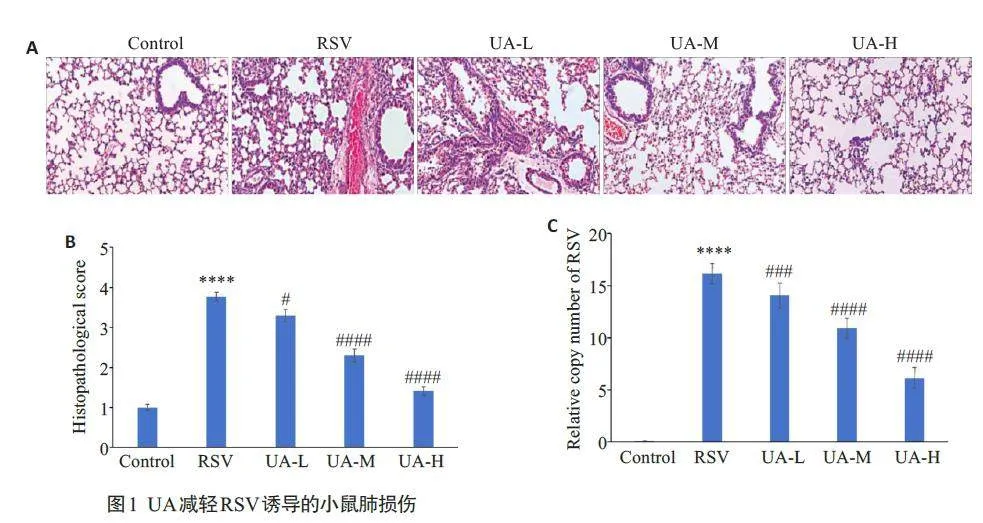
2.1 UA减轻RSV诱导的小鼠肺损伤
HE染色结果显示,对照组小鼠肺组织结构正常,RSV感染组小鼠肺组织中血管和支气管周围有大量红细胞和中性粒细胞浸润,肺泡间隙有明显组织液浸润,提示存在肺泡毛细血管屏障功能障碍。3个UA处理组小鼠肺组织中红细胞、中性粒细胞及组织液浸润明显减少,且呈浓度依赖性(图1A)。随后对HE染色结果进行评分,结果显示,RSV感染组小鼠病理评分显著高于对照组(Plt;0.0001);与RSV感染组相比,3 个UA处理组病理学评分呈浓度依赖性降低(Plt;0.05,Plt;0.0001,Plt;0.0001,图1B)。与对照组相比,RSV感染组小鼠肺组织中病毒荷载量大量增加(Plt;0.0001),UA处理组小鼠肺组织中RSV拷贝数相较于RSV感染组呈剂量依赖性减少(Plt;0.001,Plt;0.0001,Plt;0.0001,图1C)。
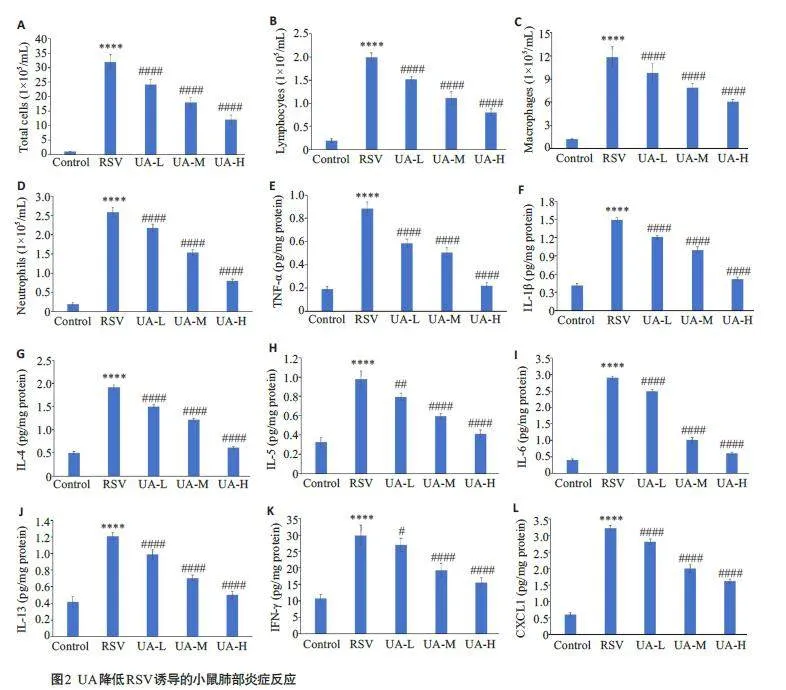
2.2 UA降低RSV诱导的小鼠肺部炎症反应
与对照组相比,感染RSV的小鼠BALF中总细胞数和炎症细胞数(包括淋巴细胞、巨噬细胞和中性粒细胞)显著增加(Plt;0.0001);与RSV感染组相比,3个UA处理组小鼠BALF 中总细胞数、淋巴细胞数、巨噬细胞数和中性粒细胞数呈剂量依赖性减少(Plt;0.0001,图2A~D)。此外,与对照组相比,RSV感染组小鼠肺组织中炎症因子TNF-α(Plt;0.0001,图2E)、IL-1β(Plt;0.0001,图2F)、IL-4(Plt;0.0001,图2G)、IL-5(Plt;0.0001,图2H)、IL-6(Plt;0.0001,图2I)、IL-13(Plt;0.0001,图2J)、IFN-γ(Plt;0.0001,图2K)和CXCL1(Plt;0.0001,图2L)水平均显著升高;3个UA处理组小鼠肺组织中上述炎症因子的含量相较RSV感染组则剂量依赖性下降(Plt;0.0001,图2E~L)。
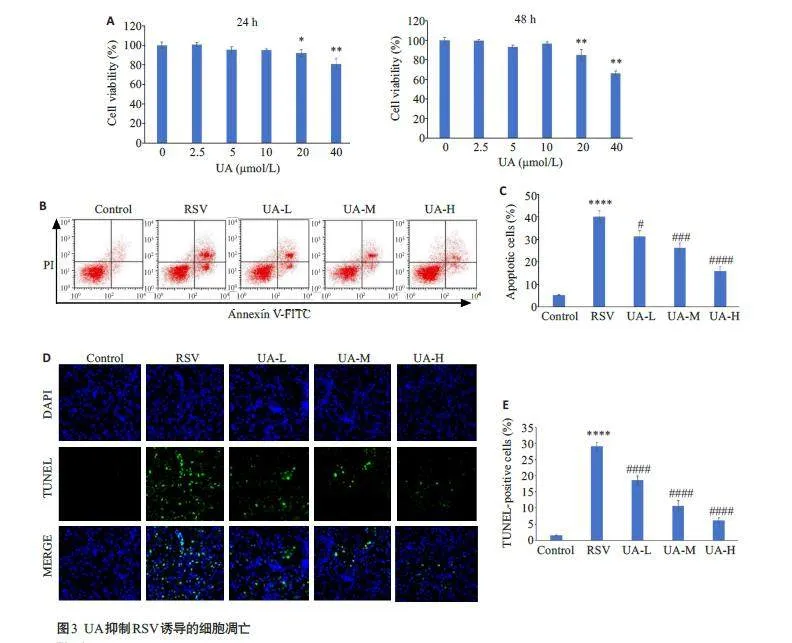
2.3 UA抑制RSV诱导的细胞凋亡
BEAS-2B 细胞中分别加入UA(2.5、5、10、20 和40 μmol/L)处理24 和48 h,然后用CCK-8 法测定细胞活力。与UA未处理组相比,20(Plt;0.05)和40 μmol/L(Plt;0.01)UA处理可明显降低细胞活力,2.5、5和10 μmol/LUA 对细胞无明显毒性(图3A),因此,选取2.5、5 和10 μmol/L UA处理BEAS-2B细胞用于后续实验。随后,检测了UA对RSV感染的BEAS-2B细胞凋亡的影响。与对照组相比,RSV诱导BEAS-2B细胞大量凋亡(Plt;0.0001);与RSV感染组相比,3个UA处理组凋亡的BEAS-2B细胞数呈剂量依赖地减少(Plt;0.05,Plt;0.001,Plt;0.0001,图3B、C)。此外,TUNEL 实验结果表明,RSV感染的小鼠肺组织中凋亡细胞数量显著多于对照组(Plt;0.0001),而3个UA处理组凋亡细胞数相较RSV感染组则剂量依赖减少(Plt;0.0001,图3D、E)。
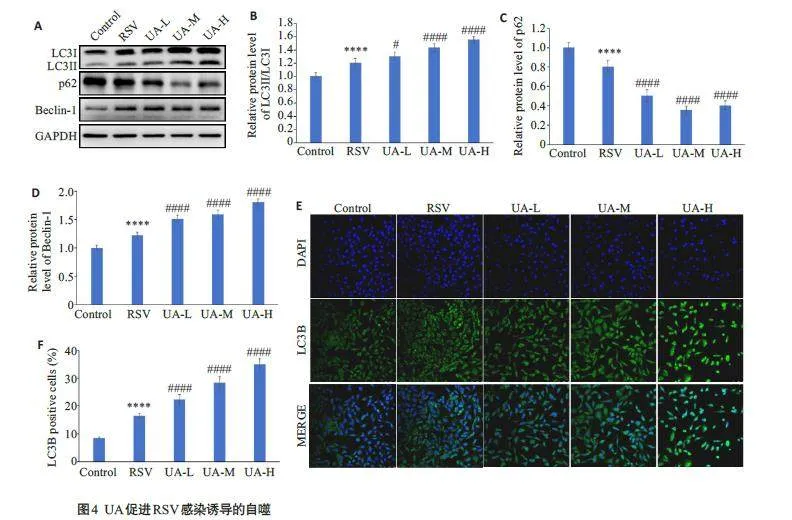
2.4 UA促进RSV感染诱导的自噬
Western blotting检测自噬相关蛋白的表达,与对照组相比,RSV感染组小鼠肺组织中LC3-II/I和Beclin-1蛋白表达显著升高(Plt;0.0001),p62 表达显著减少(Plt;0.0001);与RSV感染组相比,UA处理剂量依赖性地提高了肺组织中LC3-II/I(Plt;0.05,Plt;0.0001,Plt;0.0001)和Beclin-1的表达(Plt;0.0001),降低了p62的表达(Plt;0.0001)(图4A~D)。免疫荧光实验结果显示,与对照组相比,RSV感染的BEAS-2B细胞中LC3B表达升高(Plt;0.01),3个UA处理组BEAS-2B细胞中LC3B的表达相较RSV感染组剂量依赖性升高(Plt;0.0001,图4E、F)。
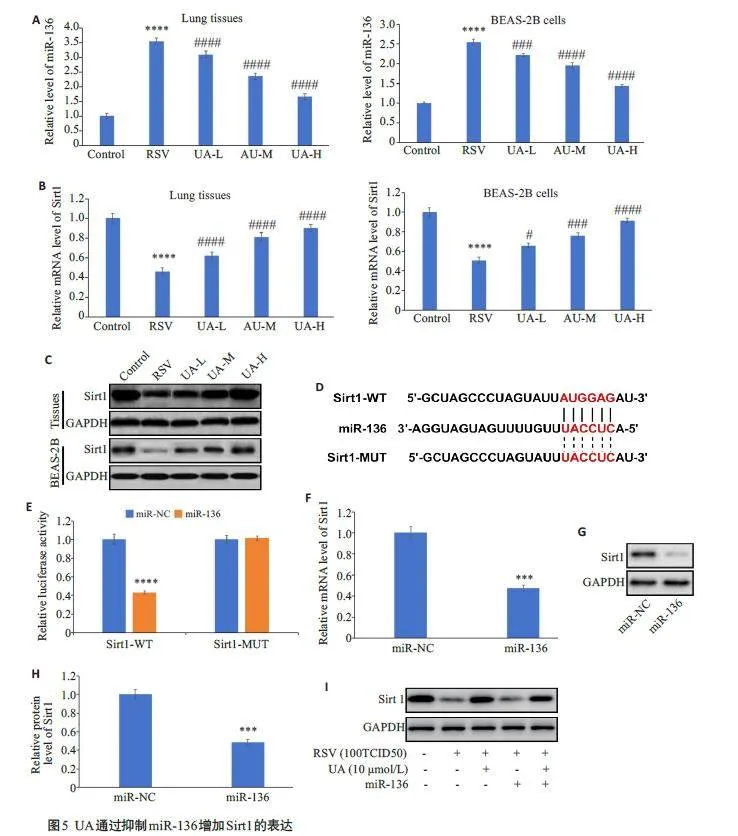
2.5 UA通过抑制miR-136促进Sirt1的表达
与对照组相比,RSV感染组小鼠肺组织和BEAS-2B细胞中miR-136 表达显著升高(Plt;0.0001);与RSV感染组相比,3 个UA处理组剂量依赖性降低miR-136的表达(Plt;0.001)(图5A)。此外,在RSV感染组小鼠肺组织和BEAS-2B细胞中Sirt1 的mRNA和蛋白表达明显低于对照组(Plt;0.0001);与RSV感染组相比,3个UA处理组Sirt1 的表达水平呈剂量依赖性增加(Plt;0.05,图5B、C)。根据生物信息预测结果,Sirt1 的mRNA 3'-UTR上存在miR-136 的结合位点(图5D)。双荧光素酶报告基因系统检测结果显示,与miR-NC 组相比,miR-136 转染降低了Sirt1-WT 的荧光素酶活性(Plt;0.0001),而对Sirt1-MUT的荧光素酶活性无显著影响(Pgt;0.05,图5E)。与miR-NC组相比,miR-136 转染显著降低BEAS-2B 细胞中Sirt1 的mRNA(Plt;0.001,图5F)和蛋白(Plt;0.001,图5G、H)水平。Western blotting结果显示,与对照组相比,RSV感染组BEAS-2B细胞中Sirt1 蛋白表达减少;与RSV感染组相比,UA+RSV组Sirt1 蛋白表达增加;与UA+RSV 组相比,UA+RSV+miR-136组Sirt1蛋白表达减少(图5I)。
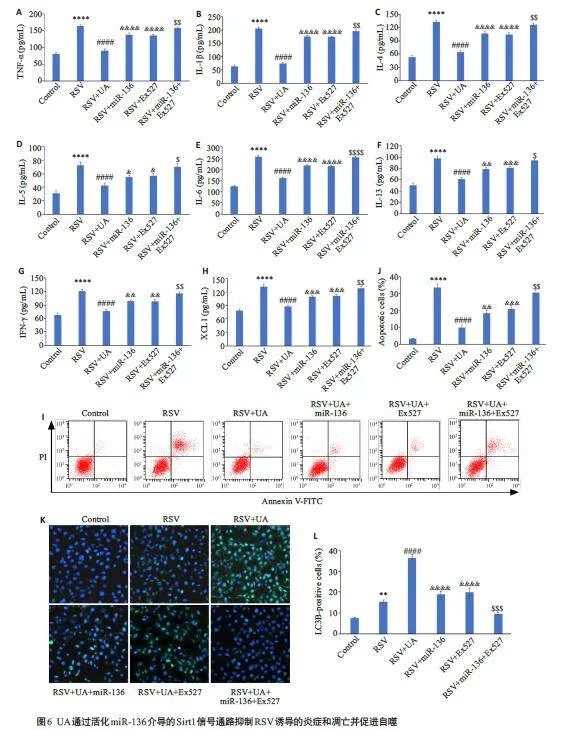
2.6 UA通过活化miR-136 介导的Sirt1 信号通路抑制RSV诱导的炎症和凋亡并促进自噬
与对照组相比,RSV感染组BEAS-2B细胞中炎症因子TNF- α、IL-1β、IL-4、IL-5、IL-6、IL-13、IFN- γ 和CXCL1的水平明显升高(Plt;0.0001);与RSV感染组相比,RSV+UA组BEAS-2B细胞中上述炎症因子的含量降低(Plt;0.0001);与RSV+UA组相比,RSV+UA+miR-136组和RSV+UA+Ex527组上述炎症因子含量明显增加(Plt;0.05);与RSV+UA+miR-136 组和RSV+UA+Ex527 组相比,RSV+UA+miR-136+Ex527 组上述炎症因子含量进一步增加(Plt;0.05,图6A~H)。RSV感染组凋亡细胞数相较对照组明显增多(Plt;0.0001);RSV+UA组凋亡细胞数相较RSV感染组显著减少(Plt;0.0001);RSV+UA+miR-136 组和RSV+UA+Ex527 组凋亡细胞数相较RSV+UA 组明显增加(Plt;0.01);RSV+UA+miR-136+Ex527 组凋亡细胞数相较RSV+UA+miR-136 组和RSV+UA+Ex527 组进一步增加(Plt;0.01,图6I、J)。此外,与对照组相比,RSV感染组BEAS-2B细胞中LC3B表达明显增加(Plt;0.01);与RSV感染组相比,RSV+UA组细胞中LC3B表达进一步增加(Plt;0.0001);与RSV+UA 组相比,RSV+UA+miR-136 组和RSV+UA+Ex527组细胞中LC3B表达显著减少(Plt;0.0001);与RSV+UA+miR-136 组和RSV+UA+Ex527 组相比,RSV+UA+miR-136+Ex527 组细胞中LC3B 表达进一步减少(Plt;0.001,图6K、L)。
3 讨论
RSV是副粘病毒科的一种单链负译RNA病毒。RSV是婴幼儿感染的最常见病毒之一,并且越来越多证据表明,RSV也是成人特别是老年人和免疫功能低下者易感染的重要病原体[27]。据统计,全球每年约3300 万例下呼吸道感染、300万例住院病例、超过10万例5岁以下儿童死亡与RSV感染有关,并且随着时间的推移,其发病率、住院率和死亡率未见下降[28]。此外,RSV感染引起的严重呼吸系统疾病可增加长期喘息和后期哮喘的风险[29]。《关于儿童呼吸道合胞病毒感染的诊断、治疗和预防的专家共识》中指出,虽然支持性护理仍然是管理呼吸道合胞病毒感染的基石,但新的单克隆抗体、疫苗、药物治疗和病毒监测技术正在推广[30]。尽管多个抗逆转录病毒剂的研发取得很大的进展,但由于存在副作用大、成本高昂等问题使其广泛使用受限[31]。此外,RSV疫苗虽已经研发了50多年,目前仅有1款RSV疫苗Arexvy(RSVPreF3 OA/GSK3844766A)于2023 年5月3 日获FDA批准上市,用于老年人群体预防RSV感染导致的下呼吸道疾病[32],但由于对于儿童及60 岁以下免疫功能低下者尚无疫苗可用,且部分人群对疫苗反应效果不佳。因此,探寻有效的用于预防或治疗RSV感染的药物仍是目前亟需解决的问题。
鞣花单宁和鞣花酸在石榴、浆果和坚果等中含量丰富[9]。这些天然物质可以在人体肠道中进一步代谢为尿石素[33-35]。在尿石素中,UA是肠道微生物群产生的主要化合物[36]。研究表明,UA具有抗衰老和抗多种疾病的药理作用[10]。多项研究证实了UA具有肺损伤保护作用。Lou等[11]发现,UA通过活化Keap1-Nrf2/HO-1信号通路减轻LPS诱导的小鼠肺部炎症反应、氧化应激和铁死亡。UA通过诱导保护性自噬而缓解小儿肺炎的炎症、氧化应激和内质网应激[12]。UA 通过靶向HMGB1抑制MAPK/NF-κB信号通路减少了LPS诱导的小鼠肺部和Beas-2B 细胞中炎症、氧化应激和凋亡[37]。在IL-1β刺激的A549细胞中,UA可降低炎症细胞因子和趋化因子水平和MMP-9 的表达,且抑制了PMA刺激的HL-60细胞中的活性氧水平和中性粒细胞胞外陷阱的形成[38]。此外,UA可抑制EV71 的复制并可在体外诱导EV71感染的细胞自噬和凋亡[13]。本研究发现,UA可抑制RSV在新生小鼠肺部的复制,并可明显减轻RSV感染引起的肺部组织病理学改变。表明UA具有抗RSV肺部感染的作用。
在RSV感染过程中,病毒ssRNA可刺激宿主免疫应答,呼吸道上皮细胞是RSV感染时宿主的第一道防线,可分泌多种促炎因子,包括TNF-α、IL-1β、IL-4、IL-5、IL-6、IL-13、TNF-α、IFN-γ和CXCL1等,这些炎症因子已被证实参与了RSV诱导的肺损伤[39-41]。同时,分泌的趋化因子可引起中性粒细胞、单核细胞、嗜酸性粒细胞向呼吸道上皮趋化,加重肺部炎症反应。本研究表明,RSV诱导的小鼠肺组织中存在大量的炎症细胞浸润并产生大量的炎症因子,UA则减少了肺组织中炎症细胞和炎症因子的水平和BEAS-2B细胞中炎症因子的释放。RSV感染还可导致呼吸道上皮细胞的凋亡,引起上皮功能紊乱,加剧肺损伤[42]。我们发现,RSV诱导的小鼠肺组织和BEAS-2B细胞凋亡明显增加,UA处理则减少了细胞凋亡。此外,自噬在肺炎中发挥重要的保护作用。当细胞受到生理、病理、化学等因素损伤时,自噬小体与溶酶体融合产生大量的自噬体,诱导自噬的启动,从而保护细胞免受损伤[43]。诱导保护性自噬可抑制LPS引起的新生小鼠肺损伤[12]。本研究发现,RSV可诱导小鼠肺组织和BEAS-2B细胞自噬,UA进一步增加了细胞自噬。以上结果提示,UA可能通过减少炎症和凋亡并促进自噬发挥其对RSV引起的肺部感染的抑制作用。
研究发现,RSV感染可引起miRNA表达谱的改变[15-18]。Li等[44]在RSV感染的HEp-2 细胞中发现有19个差异表达的miRNAs。microRNA-140-5p 在RSV感染的病人鼻咽腔气管组织和BEAS-2B细胞中低表达,且可通过靶向TLR4促进炎症因子TNF-α、IL-1β、IL-6和IL-8 的表达[45]。过表达miR-146a 可通过靶向TRAF-6 改善RSV感染对A549 和HEp-2 细胞生长的抑制作用,抑制IL-1β、IL-6、IL-18 和TNF-α炎症因子的释放以及JNK/ERK/MAPK信号通路的活化[46]。木犀草素通过miR-155 下调SOCS1 的表达促进STAT1的磷酸化而减少RSV病毒的复制及RSV感染引起的肺损伤[47]。此外,桔梗多糖可抑制RSV 感染上调的miR-181a 表达而活化Hippo 和Sirt1 通路,进而抑制RSV诱导的炎症细胞浸润和炎症因子的释放以及上皮细胞的凋亡[44]。Zhuang 等[19]研究结果表明,miR-30b、miR-136 和let-7i 在RSV感染的小鼠肺组织中上调,并且促炎细胞因子IL-5、IL-6、IFN- γ、IL-13 和CXCL1 的表达增加,而比伐卢定可减少上述miRNAs的表达及炎症因子的生成。Li等[24]报道了miR-136在急性肺损伤中肺泡上皮细胞凋亡中的作用。本研究发现,miR-136在RSV感染的小鼠肺组织和BEAS-2B细胞中高表达增加,而UA可降低miR-136 的表达,且过表达miR-136 可逆转UA抑制的炎症反应和凋亡及其诱导的自噬。这些结果提示,UA可通过抑制miR-136发挥其抗RSV感染作用。
Sirt1是Sirtuins家族中依赖于NAD+的组蛋白去乙酰化酶,具有抗炎、抗氧化和抗衰老的功能[48,49]。研究表明,多种物质通过激活Sirt1 信号通路可减轻肺损伤。比如,在NMDA诱导的急性肺损伤中,齐墩果酸刺激Sirt1激活可抑制小鼠肺泡上皮细胞的炎症、氧化应激和凋亡[50]。在LPS诱导的急性肺损伤中,Sirt1在肺泡上皮细胞中的表达被抑制,白藜芦醇诱导的Sirt1 活化减少了LPS诱导的细胞凋亡[51]。青蒿琥酯显著降低LPS处理的肺NR8383 细胞死亡,抑制肺中性粒细胞浸润,增加了急性肺损伤大鼠肺组织中Sirt1的表达。使用Sirt1拮抗剂或shRNA敲低Sirt1 的表达可显著抑制青蒿琥酯对LPS诱导的细胞损伤、肺功能障碍、中性粒细胞浸润和凋亡的保护作用,表明Sirt1 在肺损伤保护中起重要的作用[52]。此外,circHECTD1可上调Sirt1的表达而减轻急性肺损伤中肺泡上皮细胞的凋亡[24]。Sirt1 和Hippo信号通路的活化介导了桔梗多糖对RSV诱导的炎症反应和上皮细胞凋亡的抑制作用[44]。Sirt1介导的线粒体功能通过调节脂肪酸合成而导致有效的抗病毒免疫并减轻RSV引起的肺部病变[23]。Sirt1在自噬过程中同样发挥重要作用。研究表明,LPS诱导的小鼠II型肺泡上皮细胞中自噬蛋白Beclin1和LC3B水平以及炎症因子IL-6和TNF-α水平升高,并且Sirt1保护急性呼吸窘迫综合征小鼠和体外小鼠II型肺泡上皮细胞免受LPS诱导的损伤[53]。Sirt1促进了RSV感染期间与自噬过程相关的树突细胞的激活,从而指导有效的抗病毒免疫反应[22]。激活Sirt1和诱导自噬参与了UA在脑细胞中的神经保护作用[54]。UA可诱导保护性自噬而减轻LPS 诱导的肺部炎症、氧化应激和内质网应激[12]。此外,Sirt1是miR-136的一个靶基因,miR-136/Sirt1信号通路介导了circHECTD1减少的肺泡上皮细胞凋亡[24]。本研究结果表明,Sirt1 在RSV 感染的小鼠肺组织和BEAS-2B细胞中低表达,双荧光素酶报告基因系统实验结果显示,Sirt1是miR-136的一个直接靶基因,与过表达miR-136结果相似,Sirt1抑制剂Ex527处理可逆转UA抑制的炎症和凋亡及其诱导的自噬,且miR-136过表达和Ex527共处理进一步减弱UA的抗炎、抗凋亡和促自噬作用。这些结果表明,UA可通过抑制miR-136激活Sirt1信号通路发挥其抗RSV感染作用。
综上所述,UA可减轻RSV诱导的新生小鼠肺损伤。本研究证实了UA对RSV诱导的肺上皮细胞凋亡、炎症和自噬的调控作用。UA通过抑制miR-136,然后激活Sirt1通路,抑制RSV复制及其诱导的凋亡和炎症,并促进自噬。因此,UA可作为候选药物用于治疗RSV引起的肺部感染。
参考文献:
[1] Jain H, Schweitzer JW, Justice NA. Respiratory syncytial virusinfection in children[M]. StatPearls, 2023.
[2] Toivonen L, Karppinen S, Schuez-Havupalo L, et al. Respiratorysyncytial virus infections in children 0-24 months of age in thecommunity[J]. J Infect, 2020, 80(1): 69-75.
[3] Jartti T, Gern JE. Role of viral infections in the development andexacerbation of asthma in children[J]. J Allergy Clin Immunol,2017, 140(4): 895-906.
[4] Jartti T, Bønnelykke K, Elenius V, et al. Role of viruses in asthma[J]. Semin Immunopathol, 2020, 42(1): 61-74.
[5] Kwon YS, Park SH, Kim MA, et al. Risk of mortality associatedwith respiratory syncytial virus and influenza infection in adults[J].BMC Infect Dis, 2017, 17(1): 785.
[6] Kuo CH, Tsai ML, Li CH, et al. Altered pattern of macrophagepolarization as a biomarker for severity of childhood asthma[J]. JInflamm Res, 2021, 14: 6011-23.
[7] Vasconcelos LHC, Ferreira SRD, Silva MDCC, et al. Uncoveringthe role of oxidative imbalance in the development and progressionof bronchial asthma[J]. Oxid Med Cell Longev, 2021, 2021:6692110.
[8] Carande EJ, Pollard AJ, Drysdale SB. Management of respiratorysyncytial virus bronchiolitis: 2015 survey of members of theEuropean society for paediatric infectious diseases[J]. J Can DesMal Infect De La Microbiol Med, 2016, 2016: 9139537.
[9] Cerdá B, Periago P, Espín JC, et al. Identification of urolithin a as ametabolite produced by human colon microflora from ellagic acidand related compounds[J]. J Agric Food Chem, 2005, 53(14):5571-6.
[10]D'Amico D, Andreux PA, Valdés P, et al. Impact of the naturalcompound urolithin A on health, disease, and aging[J]. Trends MolMed, 2021, 27(7): 687-99.
[11] Lou LJ, Wang M, He JJ, et al. Urolithin A (UA) attenuatesferroptosis in LPS-induced acute lung injury in mice by upregulatingKeap1-Nrf2/HO-1 signaling pathway[J]. Front Pharmacol, 2023,14: 1067402.
[12]Cao XL, Wan H, Wan H. Urolithin A induces protective autophagyto alleviate inflammation, oxidative stress, and endoplasmicreticulum stress in pediatric pneumonia[J]. Allergol Immunopathol,2022, 50(6): 147-53.
[13]Wang SY, Qiao JH, Chen YP, et al. Urolithin A inhibits enterovirus71 replication and promotes autophagy and apoptosis of infectedcells in vitro[J]. Arch Virol, 2022, 167(10): 1989-97.
[14]Felekkis K, Touvana E, Stefanou CH, et al. MicroRNAs: a newlydescribed class of encoded molecules that play a role in health anddisease[J]. Hippokratia, 2010, 14(4): 236-40.
[15]Liu Z, Fan PP, Chen M, et al. miRNAs and leukotrienes inrespiratory syncytial virus infection[J]. Front Pediatr, 2021, 9:602195.
[16]Zhang X, Huang F, Yang DY, et al. Identification of miRNA-mRNAcrosstalk in respiratory syncytial virus- (RSV- ) associated pediatricpneumonia through integrated miRNAome and transcriptomeanalysis[J]. Mediators Inflamm, 2020, 2020: 8919534.
[17]Atherton LJ, Jorquera PA, Bakre AA, et al. Determining immune andmiRNA biomarkers related to respiratory syncytial virus (RSV)vaccine types[J]. Front Immunol, 2019, 10: 2323.
[18]Eilam-Frenkel B, Naaman H, Brkic G, et al. MicroRNA 146-5p,miR-let-7c-5p, miR-221 and miR-345-5p are differentiallyexpressed in Respiratory Syncytial Virus (RSV) persistently infectedHEp-2 cells[J]. Virus Res, 2018, 251: 34-9.
[19]Zhuang SH, Tang QY, Chen P, et al. Bivalirudin exerts antiviralactivity against respiratory syncytial virus-induced lung infections inneonatal mice[J]. Acta Pharm, 2022, 72(3): 415-25.
[20]Yang YS, Liu Y, Wang YW, et al. Regulation of SIRT1 and its rolesin inflammation[J]. Front Immunol, 2022, 13: 831168.
[21]Fukuda Y, Akimoto K, Homma T, et al. Virus-induced asthmaexacerbations: SIRT1 targeted approach[J]. J Clin Med, 2020, 9(8):2623.
[22]Owczarczyk AB, Schaller MA, Reed M, et al. Sirtuin 1 regulatesdendritic cell activation and autophagy during respiratory syncytialvirus-induced immune responses[J]. J Immunol, 2015, 195(4):1637-46.
[23]Elesela S, Morris SB, Narayanan S, et al. Sirtuin 1 regulatesmitochondrial function and immune homeostasis in respiratorysyncytial virus infected dendritic cells[J]. PLoS Pathog, 2020, 16(2): e1008319.
[24]Li HB, Niu XX, Shi HJ, et al. circHECTD1 attenuates apoptosis ofalveolar epithelial cells in acute lung injury[J]. Lab Invest, 2022,102(9): 945-56.
[25]Martínez I, Lombardía L, Herranz C, et al. Cultures of HEp-2 cellspersistently infected by human respiratory syncytial virus differ inchemokine expression and resistance to apoptosis as compared tolytic infections of the same cell type[J]. Virology, 2009, 388(1):31-41.
[26]Sun Y, López CB. Respiratory syncytial virus infection in mice anddetection of viral genomes in the lung using RT-qPCR[J]. Bioprotocol,2016, 6(10): e1819.
[27]Ruiz-Galiana J, Cantón R, De Lucas Ramos P, et al. Respiratorysyncytial virus: a new era[J]. Rev Esp Quimioter, 2024, 37(2):134-48.
[28]Li Y, Wang X, Blau DM, et al. Global, regional, and national diseaseburden estimates of acute lower respiratory infections due torespiratory syncytial virus in children younger than 5 years in 2019:a systematic analysis[J]. Lancet, 2022, 399(10340): 2047-64.
[29]Chatterjee A, Mavunda K, Krilov LR. Current state of respiratorysyncytial virus disease and management[J]. Infect Dis Ther, 2021,10(Suppl 1): 5-16.
[30]Zhang XL, Zhang X, Hua W, et al. Expert consensus on thediagnosis, treatment, and prevention of respiratory syncytial virusinfections in children[J]. World J Pediatr, 2024, 20(1): 11-25.
[31]Zou G, Cao SS, Gao Z, et al. Current state and challenges inrespiratory syncytial virus drug discovery and development[J].Antiviral Res, 2024, 221: 105791.
[32]Papi A, Ison MG, Langley JM, et al. Respiratory syncytial virusprefusion F protein vaccine in older adults[J]. N Engl J Med, 2023,388(7): 595-608.
[33]Larrosa M, González-Sarrías A, García-Conesa MT, et al.Urolithins, ellagic acid-derived metabolites produced by humancolonic microflora, exhibit estrogenic and antiestrogenic activities[J]. J Agric Food Chem, 2006, 54(5): 1611-20.
[34]Espín JC, Larrosa M, García-Conesa MT, et al. Biologicalsignificance of urolithins, the gut microbial ellagic Acid-derivedmetabolites: the evidence so far[J]. Evid Based ComplementAlternat Med, 2013, 2013: 270418.
[35]Kujawska M, Jodynis-Liebert J. Potential of the ellagic acid-derivedgut microbiota metabolite - Urolithin A in gastrointestinal protection[J]. World J Gastroenterol, 2020, 26(23): 3170-81.
[36]Landete JM. Ellagitannins, ellagic acid and their derivedmetabolites: a review about source, metabolism, functions and health[J]. Food Res Int, 2011, 44(5): 1150-60.
[37] Jiao PF, Wang YR, Ren GF, et al. Urolithin A exerts a protectiveeffect on lipopolysaccharide-induced acute lung injury by regulatingHMGB1-mediated MAPK and NF- κB signaling pathways[J].Naunyn Schmiedebergs Arch Pharmacol, 2024, [Online ahead ofprint].
[38]Kim S, Kim J, Song Y, et al. Unripe Rubus occidentalis, ellagic acid,and urolithin A attenuate inflammatory responses in IL-1β-stimulated A549 cells and PMA-stimulated differentiated HL-60cells[J]. Nutrients, 2023, 15(15): 3364.
[39]Carvajal JJ, Avellaneda AM, Salazar-Ardiles C, et al. Hostcomponents contributing to respiratory syncytial virus pathogenesis[J]. Front Immunol, 2019, 10: 2152.
[40]Schmidt ME, Varga SM. Cytokines and CD8 T cell immunity duringrespiratory syncytial virus infection[J]. Cytokine, 2020, 133:154481.
[41]Clementi N, Ghosh S, De Santis M, et al. Viral respiratory pathogensand lung injury[J]. Clin Microbiol Rev, 2021, 34(3): e00103-20.
[42]O'Donnell DR, Milligan L, Stark JM. Induction of CD95 (Fas) andapoptosis in respiratory epithelial cell cultures following respiratorysyncytial virus infection[J]. Virology, 1999, 257(1): 198-207.
[43]Levine B, Kroemer G. Biological functions of autophagy genes: adisease perspective[J]. Cell, 2019, 176(1/2): 11-42.
[44]Li JJ, Liu ML, Lv JN, et al. Polysaccharides from PlatycodonisRadix ameliorated respiratory syncytial virus-induced epithelial cellapoptosis and inflammation through activation of miR-181amediatedHippo and SIRT1 pathways[J]. Int Immunopharmacol,2022, 104: 108510.
[45]Zhang Y, Shao LY. Decreased microRNA-140-5p contributes torespiratory syncytial virus disease through targeting Toll-likereceptor 4[J]. Exp Ther Med, 2018, 16(2): 993-9.
[46]Huang Z, Liu XX, Wu X, et al. MiR-146a alleviates lung injurycaused by RSV infection in young rats by targeting TRAF-6 andregulating JNK/ERKMAPK signaling pathways[J]. Sci Rep, 2022,12(1): 3481.
[47]Wang SS, Ling YT, Yao YY, et al. Luteolin inhibits respiratorysyncytial virus replication by regulating the miR-155/SOCS1/STAT1 signaling pathway[J]. Virol J, 2020, 17(1): 187.
[48]Singh V, Ubaid S. Role of silent information regulator 1 (SIRT1) inregulating oxidative stress and inflammation[J]. Inflammation,2020, 43(5): 1589-98.
[49]DiNicolantonio JJ, McCarty MF, O'Keefe JH. Nutraceuticalactivation of Sirt1: a review[J]. Open Heart, 2022, 9(2): e002171.
[50]Peng XP, Li XH, Li Y, et al. The protective effect of oleanolic acid onNMDA-induced MLE-12 cells apoptosis and lung injury in mice byactivating SIRT1 and reducing NF‑κB acetylation[J]. IntImmunopharmacol, 2019, 70: 520-9.
[51]Liu XL, Shao KQ, Sun TY. SIRT1 regulates the human alveolarepithelial A549 cell apoptosis induced by Pseudomonas aeruginosalipopolysaccharide[J]. Cell Physiol Biochem, 2013, 31(1): 92-101.
[52]Liu ZH, Meng YL, Miao Y, et al. Artesunate reduces sepsis-mediatedacute lung injury in a SIRT1-dependent manner[J]. Bioimpacts,2023, 13(3): 219-28.
[53]Liu JY, Lv XJ, Dong WJ, et al. The role of SIRT1 in autophagy inlipopolysaccharide-induced mouse type II alveolar epithelial cells[J]. Inflammation, 2018, 41(6): 2222-35.
[54]Velagapudi R, Lepiarz I, El-Bakoush A, et al. Induction ofautophagy and activation of SIRT-1 deacetylation mechanismsmediate neuroprotection by the pomegranate metabolite urolithin Ain BV2 microglia and differentiated 3D human neural progenitorcells[J]. Mol Nutr Food Res, 2019, 63(10): e1801237.
(编辑:经 媛)
基金项目:内蒙古自治区高等学校科学研究项目(NJZY19151)

