痛痒消洗剂可促进大鼠肛瘘术后的创面愈合

摘要:目的 通过网络药理学及分子对接技术预测痛痒消洗剂促进创面愈合的潜在靶点,并通过动物实验进行验证。方法 通过TCMSP、BATMAN数据库筛选痛痒消洗剂活性成分及药物靶点,通过GeneCards、OMIM数据库筛选创面愈合相关靶点,对药物及创面相关靶点取交集,进行PPI分析、GO和KEGG富集分析,25 只SD大鼠随机分为模型组(Model),对照组(PP),痛痒消洗剂低、中、高剂量组(TYX-L、TYX-M、TYX-H),n=5。每组大鼠造模后,Model、PP及TYX各组分别予生理盐水、高锰酸钾溶液及低、中、高浓度痛痒消洗剂药液(药物浓度分别为171 mg·mL-1·d-1,342 mg·mL-1·d-1及684 mg·mL-1·d-1)塌渍创面,10 min/次,1 次/d,治疗14 d。HE染色观察肉芽组织病理变化,免疫组化观察肉芽组织TNF-α蛋白表达,RT-PCR法检测肉芽组织白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6) mRNA水平,Western blotting 法检测肉芽组织中IL-1β、TNF-α 蛋白表达,ELISA法检测肉芽组织IL-6 蛋白表达。结果 网络药理学获取痛痒消洗剂与创面的共同靶点156 个,炎症因子IL-1β、TNF-α、IL-6是痛痒消洗剂促进创面愈合的潜在靶点。痛痒消洗剂6个核心成分与IL-1β、TNF-α、IL-6的结合能都小于-6.0 kcal/mol,较好地与关键蛋白结合。Model组比较,TYX各组、PP组炎细胞浸润较少、可见大量成纤维细胞且有较多胶原沉积,TYX各组大鼠肉芽组织IL-6、IL-1β、TNF-α mRNA及IL-6 蛋白表达降低(Plt;0.05),TYX-M、TYX-H组TNF-α 蛋白表达降低(Plt;0.05);与PP 组相比,TYX-M、TYX-H组TNF-α mRNA,TYX-L、TYX-H组IL-6 mRNA表达降低(Plt;0.05)。结论 痛痒消洗剂可通过下调炎症因子表达、促进炎症消退而加快组织愈合。
关键词:创面愈合;肛瘘;网络药理学;白介素;肿瘤坏死因子
肛瘘是中医肛肠科常见病,约占所有肛周疾病的7.7%[1],手术是目前治疗肛瘘的主要方法[2]。然而,由于肛瘘手术创面面积大、位置深、易受粪便污染,术后常出现创面愈合不良的问题,加重患者痛苦,延长住院时间。因此,规范管理肛瘘术后创面是临床医师关注的重点。
研究表明,具有祛腐生新作用的中药可加快创面愈合[3],对肛瘘术后的难愈性创面同样具有理想的治疗效果[4]。中药复方痛痒消洗剂方含黄柏、苦参、当归、苍术、秦艽、细辛、芒硝、明矾、防风、川椒,该方立足于祛腐生新法,一方面清热燥湿祛风,消除创面无形之余毒,起祛腐之效;同时兼顾扶正,佐以温通之药物发散阳气、活血之药充养营血,阴阳并重,促进组织新生。既往研究发现,痛痒消洗剂能修复肛垫黏膜损伤[5],改善肛瘘、肛周脓肿术后创面愈合情况[6,7],但目前尚缺乏痛痒消洗剂改善创面愈合的作用机制的研究。
网络药理学通过构建“成分-靶点-疾病”网络,借助拓扑分析、富集分析找到药物干预疾病的靶点及与相关生物过程的相关性,是一种新兴的研究方法,为中药复方的生物学作用研究提供了全新视角[8],结合体内实验验证可增加网络药理学预测结果的精确性、可靠性。因此,本研究运用网络药理学构建痛痒消洗剂“药物成分-作用靶点”网络,预测痛痒消洗剂改善创面愈合的作用靶点,结合动物实验验证痛痒消洗剂促进创面愈合的作用机制,阐释中医“祛腐生新法”的内涵,为痛痒消洗剂的临床应用提供依据。
1 材料和方法
1.1 痛痒消洗剂促进创面愈合的网络药理学研究
1.1.1 痛痒消洗剂促进创面愈合的有效成分及靶点筛选
( 1)在TCMSP平台(https://tcmsp-e.com/tcmsp.php)检索黄柏、苦参、当归、苍术、秦艽、细辛、防风、川椒的化合物成分,筛选类药性≥0.18作为活性化合物,记录活性化合物对应的基因靶点;采用BATMAN-TCM数据库(http://bionet. ncpsb. org. cn/batman-tcm/#/search)补充获取矿物药芒硝、明矾化合物和对应靶点。UniProt数据库(https://www.uniprot.org/)进行中药靶点基因注释转换;(2)在GeneCards(https://www. genecards. org)、OMIM(https://db.idrblab.org/ttd/)中以“wound”为关键词进行检索,经合并去重,得到创面相关靶基因;(3)对痛痒消洗剂药物对应基因靶点与创面对应基因靶点取交集,得出痛痒消洗剂与创面愈合共同靶点。运用Cytospace 3.9.0将痛痒消洗剂所含药物、活性化合物与交集靶点进行“药物-化合物-靶点”可视化展示。
1.1.2 蛋白质相互作用(PPI)分析
将共同靶点导入String 数据库(https://string-db.org),置信度为0.900,获得PPI网络,将结果导入Cytoscape3.9.0 软件,生成PPI网络图。
1.1.3 GO 和KEGG 富集分析
使用RStudio 4.1.1cluster Profiler 包对交集靶点进行GO富集分析;应用DAVID 平台(https://david.ncifcrf.gov/home. jsp)对痛痒消洗剂促进创面愈合的核心靶点进行KEGG分析。
1.2 痛痒消洗剂核心化合物与关键蛋白的分子对接
将“药物-化合物-靶点”分析中“degree值”最高的前六位化合物作为痛痒消洗剂核心成分,使用AutoDockVina 1.1.2软件将核心成分与筛选出的关键蛋白进行分子对接,利用PyMol 2.4完成蛋白质的前处理(删除水分子和多余配体,添加氢原子)。采用AutoDock Tools 1.5.6生成用于对接模拟的PDBQT文件,将对接结果设置为输出10个最佳对接位置,结合能最低、聚簇频率最高的对接构象被认为是配体与蛋白质之间最潜在的结合模式,使用PyMol 2.4软件对对接结果进行了可视化。
1.3 痛痒消洗剂促进创面愈合的药理学实验验证
1.3.1 实验动物
SPF 级雄性SD大鼠25 只,4~5 周龄,体质量160~180 g,购于北京维通利华实验动物技术有限公司,动物生产合格证号为SCXK(京)2021-0011。饲养于河北省中医药科学院河北省浊毒证重点实验室,控制适宜温度、适度,光照时间7∶00~19∶00,自由获取食物和水。本实验经河北中医学院伦理委员会批准(伦理批号:DWLL2021050)。
1.3.2 药物
痛痒消洗剂药物组成为:黄柏15 g、苦参30 g、当归15 g、苍术15 g、秦艽15 g、细辛6 g、芒硝30 g、明矾15 g、防风15 g、川椒15 g,选用中药配方颗粒,生产厂家为石家庄以岭药业,由河北省中医院中药房统一调配。高锰酸钾消毒片(0.2 g/片,济南清华消毒用品厂,生产批号:20230201)。
1.3.3 试剂与仪器
2%异氟烷(深圳瑞沃德)、RNA提取试剂盒(普洛麦格)、GoTaq qPCR Master Mix(普洛麦格)、DEPC(Sigma)、RIPA 裂解液(赛默飞世尔)、MicroAmp 快速反应管(赛默飞世尔)、TNFα单克隆抗体(武汉三鹰)、HRP 标记山羊抗小鼠 IgG(赛维尔)、山羊抗兔二抗(北京中杉金桥)、IL-1β(赛默飞世尔),蛋白Marker(碧云天),GAPDH Ab(北京博奥森),IL-6ELISA试剂盒(武汉云克隆)。
动物呼吸麻醉机(深圳瑞沃德)、病理扫描仪(匈牙利3DHISTECH)、基因扩增仪2720(赛默飞)、高速冷冻离心机1-15K(Sigma)、紫外可见分光光度计756MC(上海精密科学仪器有限公司)、电动匀浆机S25(IKA)、实时荧光定量PCR仪CFX96(伯乐)、酶标仪MK3(雷勃)、电泳槽及电泳仪DYY(北京六一)、分析软件Quantityone(伯乐)。
1.3.4 创面模型制备和分组干预
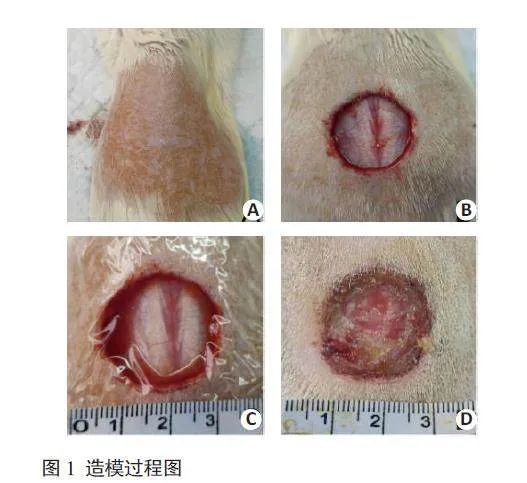
造模方法:所有大鼠经1周适应性饲养,在张雅明等[9]的造模方法基础上加以改进,采用全层皮肤缺损开放感染模型模拟肛瘘术后创面情况。造模过程(图1),具体方法为:大鼠术前禁食水8 h,异氟烷进行呼吸麻醉,麻醉成功后将大鼠俯卧位固定在实验台上,充分暴露背部皮毛,在背部正中先用电动剃毛器剃毛、脱毛膏脱毛,形成一个4 cm×7 cm的脱毛区(图1A),在脱毛区正中做1个直径2 cm圆形创面,切除皮肤全层直至肌肉(图1B),在创面喷洒分离自人粪便的大肠杆菌悬液1 mL(人新鲜粪便10 g,加0.9%氯化钠溶液5 mL,混匀,离心,取上清液,现配现用),使用医用伤口防水贴固定(图1C),48 h后除覆盖物,见创面有脓性分泌物者为造模成功(图1D)。
分组干预方法:将成功建立的25只肛瘘术后创面大鼠随机分为模型组(Model)、高锰酸钾组(PP)、痛痒消低剂量组(TYX-L)、痛痒消中剂量组(TYX-M)、痛痒消高剂量组(TYX-H),5只/组。造模后,模型组每天以生理盐水塌渍治疗,对照组给予高锰酸钾1∶5000 溶液塌渍治疗,分别由1000、500、250 mL蒸馏水溶解痛痒消洗剂(黄柏15 g、苦参30 g、当归15 g、苍术15 g、秦艽15 g、细辛6 g、芒硝30 g、明矾15 g、防风15 g、川椒15 g)依次配制成痛痒消低(171 mg·mL-1·d-1)、中(342 mg·mL-1·d-1)、高剂量(684 mg·mL-1·d-1)药液塌渍治疗,用于痛痒消低、中、高剂量组。各组大鼠每次治疗10 min,1 次/d,共治疗14 d。
取材方式:在治疗第14天,大鼠经异氟烷呼吸麻醉后,取创面肉芽组织,一部分置于4%多聚甲醛中固定,另一部分置于液氮中速冻后转移至-80 ℃冰箱备用。
1.3.5 HE染色观察肉芽组织形态
取肉芽组织经梯度脱水、透明、石蜡包埋、切片、脱蜡,行HE染色,将染色后的切片脱水透明,封片,于显微镜下观察肉芽组织病理变化。
1.3.6 免疫组化检测肉芽组织TNF-α阳性表达
肉芽组织切片经脱蜡、抗原修复、一抗(1∶400)、二抗(1∶200)依次孵育、复染返蓝、脱水、封片,于显微镜下观察肉芽组织TNF-α阳性表达变化。
1.3.7 RT-qPCR 检测肉芽组织IL-6、TNF‑α、IL-1βmRNA水平
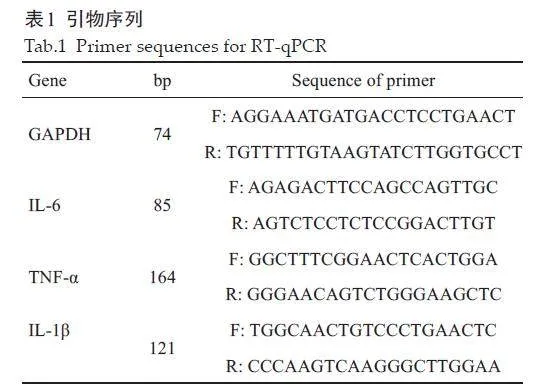
提取大鼠肉芽组织总RNA进行反转录。采用GoTaq qPCR Master Mix试剂盒进行PCR扩增反应,反应条件:预变性95 ℃ 10 min,然后44个循环反应:95 ℃ 15 s,60 ℃ 60 s;实验重复3 次。以GAPDH为内参,采用2-△△Ct法计算目的基因相对表达量。引物序列由生工上海总部合成部提供(表1)。
1.3.8 ELISA法检测肉芽组织IL-6蛋白表达
制备组织匀浆,标准品孔加入100 μL标准品,空白孔加入100 μL检测缓冲液,样本孔加入100 μL预稀释样本,覆膜孵育,加入酶标抗体,覆膜孵育;加TMB 90 μL,覆膜,孵育,加终止液;酶标仪测定的光密度值A450 nm。
1.3.9 Western blotting 法检测TNF-α、IL-1β 蛋白表达
将适量肉芽组织匀浆取上清液。配置BCA工作液,对组织进行浓度测定。配置SDS-PAGE胶、蛋白样品加样、电泳、电转、牛奶封闭、一抗TNFα(1∶1000)、IL-1β(1∶800)孵育过夜、TBST水洗、二抗(1∶5000)孵育、显色。通过Image J 软件对所测蛋白条带进行分析,用内参GAPDH的灰度值作为参照,对目的蛋白相对表达量进行分析。
1.4 统计学分析
应用 SPSS23.0 软件统计,符合正态分布的计量资料以均数±标准差表示,组间比较采用单因素方差分析(方差不齐时采用Welch检验);不符合正态分布的数据采用Kruskal-Wallis 检验进行比较。Plt;0.05 表示差异具有统计学意义。
2 结果
2.1 痛痒消洗剂促进创面愈合的网络药理学分子机制分析
2.1.1 作用靶点筛选
通过TCMSP、BATMAN数据库共获得283个有效化合物成分,去除重复后剩余272个活性成分,对应308 个基因靶点,删去无人源信息的靶点,最终保留293个痛痒消洗剂相关基因。
GeneCards 数据库检索到创面相关基因5009 个,保留基因相关性分值大于1的基因1787个;OMIM数据库得到创面相关基因16个,将两数据库基因合并去重,最终得到创面相关靶点1800个。
将痛痒消洗剂与创面基因取交集,共得到痛痒消洗剂促进创面愈合相关作用靶点156个。
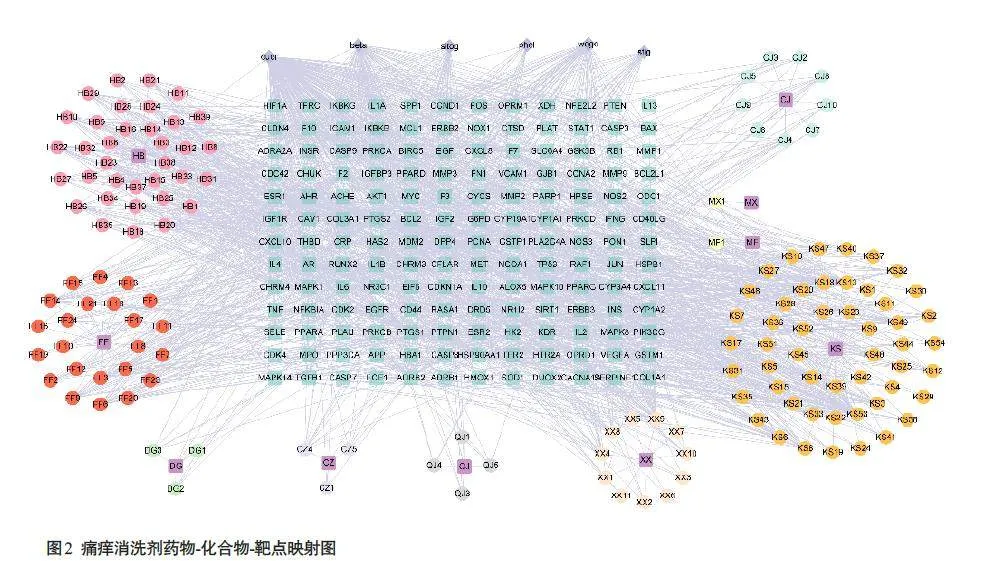
2.1.2“ 药物-化合物-靶点”可视化展示
将所有药物名称、对应化合物与关联交集靶基因导入Cytospace软件,绘制药物-化合物-靶点映射图(图2)。根据Degree值排序,前6位化合物分别为槲皮素、β-谷甾醇、汉黄芩素、芹菜素、木犀草素和山柰酚。
2.1.3 PPI 分析可视化
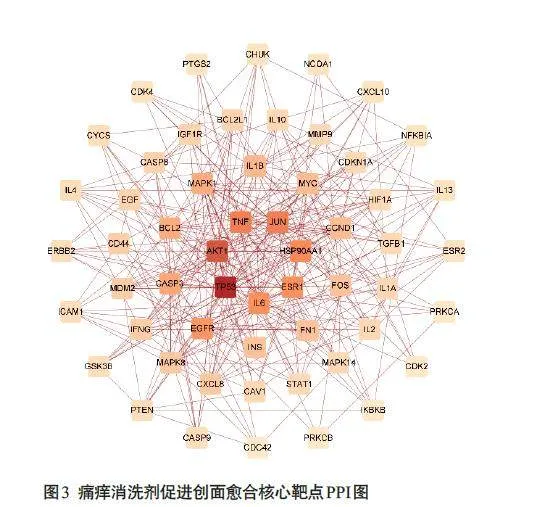
通过STRING数据库得到PPI网络数据,导入Cytospace 软件,应用“AnalyzeNetwork”功能,获得网络拓扑属性分析结果:该网络图节点141个,边550条,平均Degree值为7.8。共有56个基因Degree值大于平均值被视作痛痒消洗剂调节创面愈合的核心靶点(图3),其中每个节点代表一个核心靶点,并根据Degree 值由小到大设置节点颜色渐深。核心靶点前7位为:TP53、AKT1、JUN、TNF、HSP90AA1、ESR1和IL-6。
2.1.4 GO 和KEGG 分析
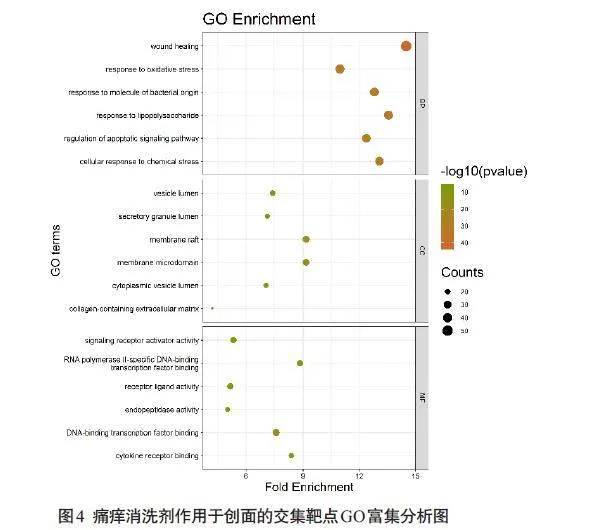
利用RStudio 4.1.1clusterProfiler包对痛痒消洗剂治疗创面的交集靶点进行GO富集分析,保留Plt;0.05数据,得到痛痒消洗剂调节创面的相关BP 2353 个,MF 175 个,CC 68 个。选取三类中各前5 名使用RStudio ggplot2 包进行气泡图绘制(图4)。图上横坐标代表富集倍数、气泡大小代表反映富集基因数、气泡颜色代表P值大小。BP前3位为创面愈合、对脂多糖的反应、对氧化应激的反应;前3位MF涉及(DNA或RNA特异性聚合酶II)转录因子结合、细胞因子受体结合。前3位CC为膜筏、膜微区、囊泡腔。
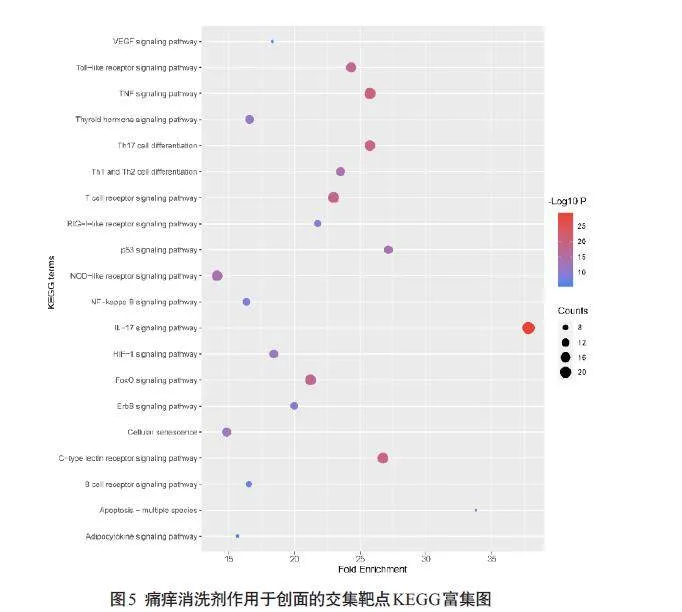
DAVID平台导出交集靶点相关信号通路118 个。除去与某些特定疾病相关的通路,将剩余通路按照富集倍数由高到低排序,痛痒消洗剂作用于创面交集靶点相关的信号通路主要为VEGF信号通路、Toll样受体信号通路、TNF信号通路等(图5)。
2.2 分子对接结果
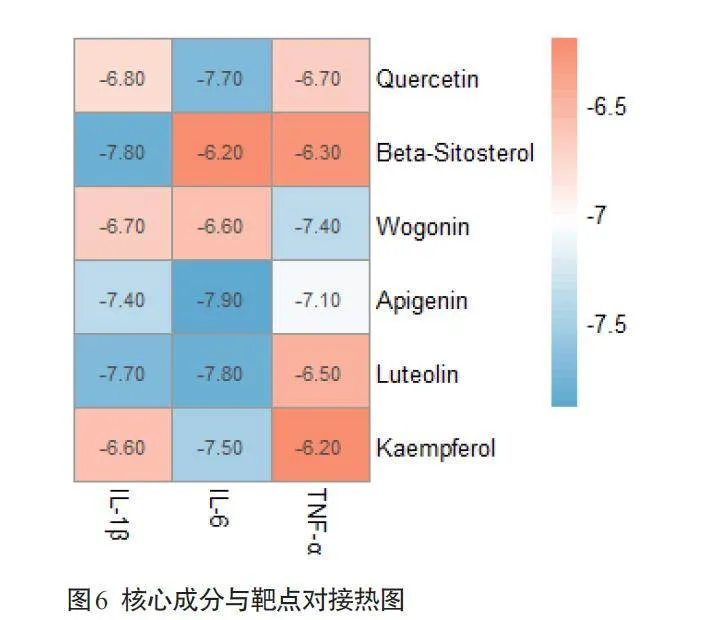
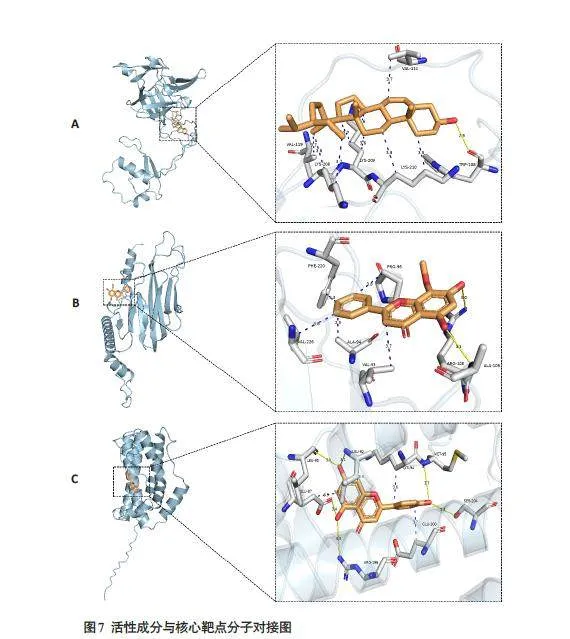
中药痛痒消洗剂的核心成分槲皮素、β-谷甾醇、汉黄芩素、芹菜素、木犀草素和山柰酚分别与关键蛋白IL-1β、TNF-α、IL-6 进行分子对接(图6)。槲皮素、β-谷甾醇、汉黄芩素、芹菜素、木犀草素和山柰酚与IL-1β、TNF-α、IL-6 的结合能都小于-6.0 kcal/mol,其中β-谷甾醇与IL-1β的结合效果最佳,芹菜素与IL-6的结合效果最佳,汉黄芩素与TNF-α的结合效果最佳,其分子对接最佳结合模式(图7)。
2.3 动物实验结果
2.3.1 创面肉芽组织HE染色
创面肉芽组织HE染色结果显示,各组均可见胶原沉积及新生血管,其中Model组胶原排列不整齐且可见大量炎细胞浸润;PP组胶原排列较为稀疏,可见成纤维细胞、中性粒细胞浸润;TYX各剂量组可见大量成纤维细胞,胶原沉积较多且排列较为整齐(图8)。
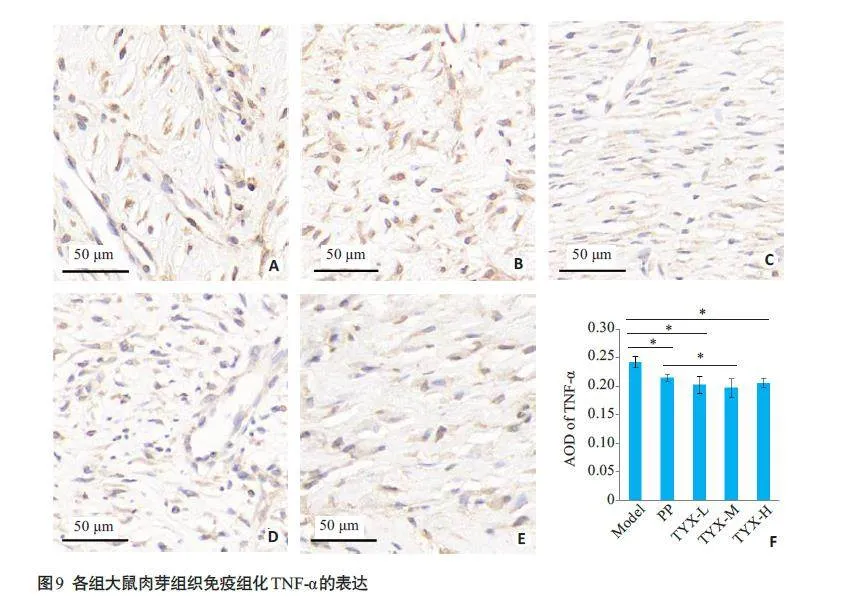
2.3.2 创面肉芽组织免疫组化TNF-α表达
各组间肉芽组织TNF-α平均光密度(AOD)值不全相等,差异具有统计学意义(Welch t=9.18,Plt;0.01)。在治疗第14天,痛痒消低、中、高剂量组TNF-α AOD值均低于模型组(P=0.01、Plt;0.01、P=0.02),痛痒消中剂量组低于高锰酸钾组(P=0.01,图9)。
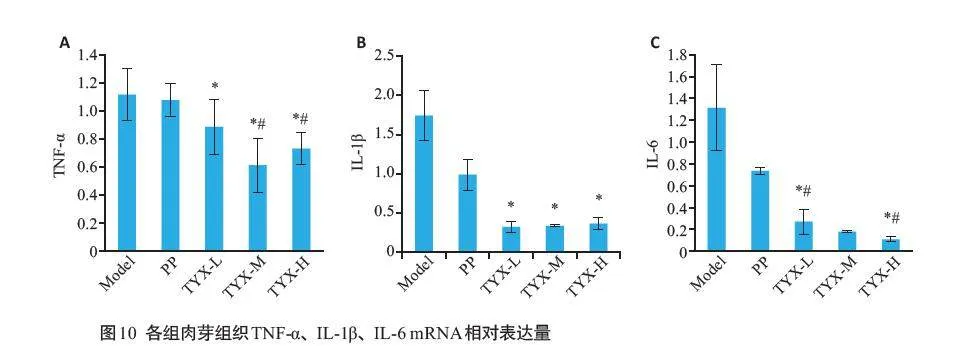
2.3.3 各组肉芽组织TNF-α、IL-1β、IL-6 mRNA 水平
各组间TNF-α mRNA相对表达量差异具有统计学意义(F=10.42,Plt;0.01,图10)。相较于模型组,痛痒消洗剂低、中、高剂量组TNF-α mRNA表达较低(P=0.02、Plt;0.01、Plt;0.01);相较于高锰酸钾组,痛痒消洗剂中、高剂量组TNF-α mRNA相对表达量偏低(Plt;0.01)。各组间IL-1β mRNA相对表达差异具有统计学意义(Welch t=6.50,P=0.01)。相较于模型组,痛痒消洗剂低、中、高剂量组IL-1β mRNA 表达减少(均P=0.03),其余组间IL-1β mRNA 表达差异无统计学意义。各组间IL-6mRNA相对表达量差异具有统计学意义(Z=21.26,Plt;0.01)。相较于模型组,痛痒消洗剂低、高剂量组IL-6mRNA 表达较低(P=0.04、P=0.01);相较于高锰酸钾组,痛痒消洗剂低、高剂量组IL-6 mRNA相对表达量偏低(P=0.04、P=0.01)。
2.3.4 ELISA法检测各组肉芽组织IL-6表达
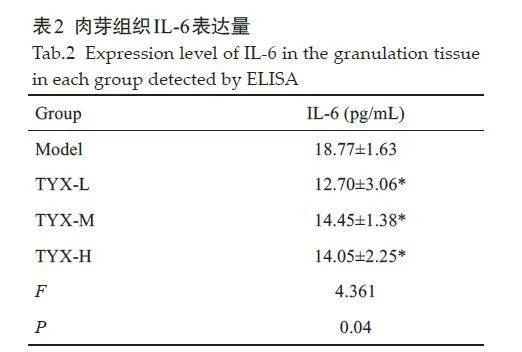
相较于模型组,痛痒消洗剂低、中、高组肉芽组织IL-6表达降低,差异具有统计学意义(P=0.01、P=0.04、P=0.03,表2)。
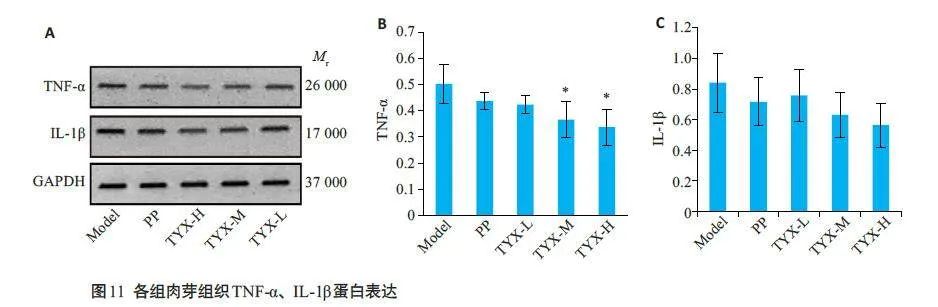
2.3.5 Western blotting 法检测各组肉芽组织TNF-α、IL-1β 表达
各组TNF-α水平不同,差异具有统计学意义(F=3.617,Plt;0.05)。相较于模型组,痛痒消中、高剂量组TNF-α蛋白表达降低(P=0.02、P=0.01),其余组间差异无统计学意义。痛痒消洗剂各组IL-1β表达低于模型组、高锰酸钾组,但组间差异无统计学意义(Pgt;0.05,图11)。
3 讨论
本研究运用网络药理学方法获得痛痒消洗剂得活性成分272个、相关靶点293个,肛瘘术后创面相关靶点1800个,取交集获得共同靶点156个。槲皮素、β-谷甾醇、汉黄芩素等是痛痒消洗剂起效得核心成分。槲皮素主要来自于黄柏和苦参,具有较强的抗炎、促愈作用。研究表明,槲皮素可以通过抑制巨噬细胞炎性表型极化,增加抗炎表型比例,来控制炎症发展[10],同时槲皮素可促进成纤维细胞增殖[11]、诱导上皮间质转化,加快创面在上皮化进程以促进创面愈合[12]。痛痒消洗剂中的β-谷甾醇来源于黄柏、当归、秦艽与防风,其对创面的调节作用主要体现在促进伤口胶原沉积上。研究表明,β-谷甾醇可修复糖尿病皮肤创面,促进伤口血管生成、增加胶原蛋白合成[13],其衍生物被发现具有诱导成纤维细胞增殖、促进胶原的合成的作用[14]。汉黄芩素源于苍术、防风,具有抗炎效应,可以介导中性粒细胞发生凋亡而减轻炎性介质的释放[15],促进创面愈合过程由炎症期向增殖期过渡,加快创面修复。
PPI分析获得痛痒消洗剂调节创面的核心靶点56个,包括TP53、AKT1、JUN、TNF、HSP90AA1、ESR1 和IL-6、IL-1β 等。其中TP53、AKT1、JUN、HSP90AA1、ESR1 参与细胞活性调节,通过调节细胞凋亡[16-19]、自噬[20,21],增加成纤维细胞增殖与迁移,促进血管生成以改善创面愈合。其他核心靶点,如TNF、IL-6 及IL-1β主要参与创面炎症的调节。结合KEGG通路富集分析结果,痛痒消洗剂可调节TNF信号通路,作为TNF信号通路中的典型的炎症因子,IL-6、TNF-α、IL-1β诱导炎症反应的发生是创面愈合过程中的必然阶段。在创面早期,炎细胞释放TNF-α,IL-1β和IL-6[22],可改善创面微环境,促进肌成纤维细胞的活化[23],有助于创面愈合[24]。然而,持久暴露于高浓度炎性因子的上皮细胞凋亡增加且迁移能力下降[25,26],影响创面肉芽生长与再上皮化的过程。因此,在创面愈合中后期,降低炎症因子IL-6、TNF-α、IL-1β的水平对创面愈合具有积极意义[27,28]。因此痛痒消洗剂可以通过对核心靶点的调节介导创面细胞增殖、减轻创面炎性浸润以促进创面愈合。
分子对接结果提示,核心成分槲皮素、β-谷甾醇、汉黄芩素、芹菜素、木犀草素与山柰酚与靶点IL-6、TNF-α、IL-1β的结合能都小于-6.0 kcal/mol,说明痛痒消洗剂的核心成分能够较好地与关键蛋白结合。其中,β谷甾醇与IL-1β的结合效果最佳,芹菜素与IL-6的结合效果最佳,汉黄芩素与TNF-α的结合效果最佳。关键靶点的结合口袋大多数为疏水性氨基酸残基,表明疏水相互作用对结合的有较大贡献。分子对接结果表明了痛痒消洗剂在改善肛瘘术后创面愈合方面的潜力,为进一步动物实验提供依据。
我们进一步采用SD大鼠全层皮损开放感染模型,验证网络药理学筛选出的核心靶点TNF-α,IL-1β和IL-6的表达情况,借以探讨痛痒消洗剂的作用机制。该模型在张雅明[10]造模方法的基础上,优化了麻醉方式,采用异氟烷吸入麻醉的方法,快速地诱导和维持麻醉状态,具有操作简便、效果安全可靠的优势。既往研究采用此种造模方法建立的SD大鼠全层皮损开放感染模型能较好地模拟肛瘘术后创面[7]。本次实验结果表明,给予痛痒消洗剂治疗后,大鼠创面肉芽组织中TNF-α、IL-1β、IL-6 mRNA表达减少,TNF-α、IL-6 蛋白下调明显,促进创面炎症的消退,使创面成纤维细胞增殖及胶原沉积增加,促进了创面愈合过程。提示祛腐生新法指导下的痛痒消洗剂可能通过抑制TNF信号通路,减少炎症因子释放,促进创面愈合。
我国中医肛肠领域国医大师陈民藩教授认为,肛瘘术后早期治疗上仍以祛邪为主[29],因为创面余邪未尽,化生腐肉,故早期创面应当祛腐。夏庭伟等[30]认为,创面的腐肉具有毒与瘀的属性,呈现出对正常组织的蔓延性及破坏性;结合梅苹苹等[31]的报道,当IL-1β高表达会导致创面周围的组织损伤,延缓愈合进程。因此,我们认为中医“腐肉”的内在含义为创面炎症异常持续。腐肉不去则新肉不生即强调了抑制炎症过度激活的重要性,当炎症因子受到抑制,生长因子释放占据主导地位[32],诱导成纤维细胞、血管内皮细胞增殖与迁移,促进组织的修复,达到腐肉去则新肉自生的效果。
综上所述,本研究应用网络药理学、分子对接技术揭示了基于祛腐生新理论的中药复方痛痒消洗剂促进创面愈合的主要活性成分、核心基因靶点和关键通路,并通过动物实验初步证实痛痒消洗剂可能通过抑制创面炎症因子的释放促进创面修复。本研究为痛痒消洗剂的推广应用及祛腐生新法的进一步研究提供了方向,下一步可结合临床试验及动物实验进一步筛选痛痒消洗剂促进创面愈合的关键细胞,以期为肛瘘术后难愈性创面提供治疗的新思路。
参考文献:
[1] 盛惠英, 马天林. 肛周疾病与行为方式的分析[J]. 中国当代医药,2009, 16(9): 44-6.
[2] 朱煜璋, 郭修田. 中医外治法在良性肛肠疾病中的运用研究进展[J]. 上海中医药杂志, 2023, 57(11): 95-100.
[3] 杜美萱, 丁 康, 谭妍妍, 等. 祛腐生肌中药外用治疗肛瘘术后的Meta分析[J]. 中医临床研究, 2021, 13(26): 123-7.
[4] 张 晓, 余先昊. 益气祛腐生肌法对2型糖尿病老年患者肛瘘术后创面的影响[J]. 中国老年学杂志, 2024, 44(2): 323-7.
[5] 田茂生, 高记华, 许建成, 等. 贻贝粘蛋白联合痛痒消洗剂治疗Ⅰ度和Ⅱ度混合痔的临床疗效研究[J]. 中国全科医学, 2023, 26(8):955-62.。
[6] 许建成, 师晨松, 张海深, 等. 痛痒消洗剂对肛周脓肿术后患者的临床疗效[J]. 中成药, 2023, 45(2): 439-43
[7] 戚文月, 高记华, 田茂生, 等. 痛痒消洗剂对肛瘘术后创伤大鼠创面愈合的影响[J]. 中华中医药杂志, 2023, 38(3): 1246-9.
[8] 谢成志, 任建勋. 中药及复方功效的网络药理学研究与思考[J]. 中国实验方剂学杂志, 2024, 30(1): 198-207.
[9] 张雅明, 叶伟成. 痔科熏洗方对大鼠术后伤口愈合的实验研究[J].中国肛肠病杂志, 2000, 447(3): 3-5.
[10]Tsai CF, Chen GW, Chen YC, et al. Regulatory effects of quercetinon M1/M2 macrophage polarization and oxidative/antioxidativebalance[J]. Nutrients, 2021, 14(1): 67.
[11] Beken B, Serttas R, Yazicioglu M, et al. Quercetin improvesinflammation, oxidative stress, and impaired wound healing inatopic dermatitis model of human keratinocytes[J]. Pediatr AllergyImmunol Pulmonol, 2020, 33(2): 69-79.
[12]Mi YH, Zhong L, Lu SJ, et al. Quercetin promotes cutaneous woundhealing in mice through Wnt/β‑catenin signaling pathway[J]. JEthnopharmacol, 2022, 290: 115066.
[13]Liu Y, Li ZN, Li WD, et al. Discovery of β-sitosterol's effects onmolecular changes in rat diabetic wounds and its impact onangiogenesis and macrophages[J]. Int Immunopharmacol, 2024,126: 111283.
[14]Cui SY, Jiang HL, Chen L, et al. Design, synthesis and evaluation ofwound healing activity for β-sitosterols derivatives as potent Na+/K+-ATPase inhibitors[J]. Bioorg Chem, 2020, 98: 103150.
[15]Bai FF, Chen Z, Xu SL, et al. Wogonin attenuates neutrophilicinflammation and airway smooth muscle proliferation throughinducing caspase-dependent apoptosis and inhibiting MAPK/Aktsignaling in allergic airways[J]. Int Immunopharmacol, 2022, 113(Pt B): 109410.
[16]孙 鹏. 辐照后皮肤伤口愈合障碍与P53相关凋亡通路的关系[D].上海: 中国人民解放军海军军医大学, 2019.
[17]叶杰阳, 庞苏滨, 张圣江, 等. 消肿生肌汤对肛瘘术后患者肉芽组织Bax、P53、Caspase-3水平的影响[J]. 长春中医药大学学报, 2021, 37(3): 567-70.
[18]李剑庆. 基于IL-17A/JNK/c-Jun通路研究补肺汤对COPD凋亡的影响[D]. 长沙: 湖南中医药大学, 2023.
[19]Zhang MY, Ma LJ, Jiang L, et al. Paeoniflorin protects againstcisplatin-induced acute kidney injury through targeting Hsp90AA1-Akt protein-protein interaction[J]. J Ethnopharmacol, 2023, 310:116422.
[20]李媛媛, 赵富生, 张可心, 等. 硫化氢对糖尿病大鼠皮肤创面自噬和血管形成的影响[J]. 中国病理生理杂志, 2023, 39(12): 2223-33.
[21]魏晓涛, 何志军, 刘 涛, 等. 消肿止痛合剂对糖尿病溃疡模型大鼠创面愈合的影响[J]. 中国病理生理杂志, 2023, 39(5): 902-9.
[22]Mei H, Yao PL, Wang SS, et al. Chronic low-dose cadmiumexposure impairs cutaneous wound healing with defective earlyinflammatory responses after skin injury[J]. Toxicol Sci, 2017, 159(2): 327-38.
[23]Wang YL, Rouabhia M, Zhang Z. Pulsed electrical stimulationbenefits wound healing by activating skin fibroblasts through theTGFβ1/ERK/NF‑κB axis[J]. Biochim Biophys Acta, 2016, 1860(7): 1551-9.
[24]杨 影, 陈东升, 赵艾艾, 等. TNF-α和VEGF协同作用小鼠胚胎干细胞衍生的血管内皮祖细胞促伤口愈合[J]. 中国生物化学与分子生物学报, 2024, 40(2): 240-50.
[25]Basso FG, Pansani TN, Turrioni AP, et al. Tumor necrosis factor-αand interleukin (IL)-1β, IL-6, and IL-8 impair in vitro migration andinduce apoptosis of gingival fibroblasts and epithelial cells, delayingwound healing[J]. J Periodontol, 2016, 87(8): 990-6.
[26]何咏磬. IL-1β通过调节stathmin/FAK通路促进人真皮成纤维细胞迁移的作用及机制[D]. 重庆: 中国人民解放军陆军军医大学, 2023.
[27]靳立强, 郭海涛, 韩书明. 复方黄柏液涂剂外敷联合泡沫硬化治疗下肢静脉曲张性溃疡疗效及其对TNF-α、IL-6、CRP水平的影响[J]. 中华中医药学刊, 2023, 41(11): 250-3.
[28]李锐阳, 董秋霖, 胡金华, 等. 成纤维细胞与间充质干细胞来源外泌体修复急性皮肤创面的比较[J]. 中山大学学报: 医学科学版, 2023,44(3): 369-78.
[29]吴许雄, 汪昭楚, 黄 娟, 等. 国医大师陈民藩教授“存体寡损-形神兼顾” 治瘘护肛理论的形成与应用[J]. 时珍国医国药, 2023, 34(11):2779-81.
[30]夏庭伟, 杨 越, 李炜弘, 等. 中医学“腐” 的语义内涵探赜[J]. 中华中医药杂志, 2023, 38(5): 2201-3.
[31]梅苹苹, 冯文哲, 石 鹏, 等. 基于NF-κB/VEGF信号通路探究加味生肌玉红膏促进湿热型肛瘘术后创面愈合的机制[J]. 浙江中医药大学学报, 2024, 48(3): 255-63, 281.
[32]杨 露, 张永萍, 彭丽华. 中药及其外用制剂调控细胞因子促创面愈合的研究进展[J]. 中国中药杂志, 2021, 46(20): 5173-84.
(编辑:吴锦雅)
基金项目:国家自然科学基金(82174381);河北中医学院研究生创新能力培养资助项目(XCXZZBS2023021)

