不同捕捉方式对白羽肉鸡品质的影响








摘 要:为探究捕捉方式对白羽肉鸡品质的影响,选取相同饲养条件下日龄42 d的白羽肉鸡1 200 只,随机分为捉腿、捉胸、捉翅膀、捉脖子4 组,通过测定白羽肉鸡宰前的应激反应、体温、淤伤率、死亡率、捕捉速率及宰后肉品质等指标,研究不同捕捉方式对其品质的影响。结果表明:捉脖子处理组的应激反应、死亡率显著高于其他组(P<0.05);4 个处理组的体温显著高于对照组(P<0.05);捉胸处理组的捕捉速率与捉腿、捉脖子处理组无显著差异(P>0.05),但显著高于捉翅膀处理组(P<0.05);捉胸、捉腿处理组的pH24 h值显著高于捉翅膀、捉脖子处理组(P<0.05),捉胸处理组的保水性显著高于捉腿、捉翅膀、捉脖子处理组(P<0.05)。综合比较,捉胸处理组的捕捉方式可以减少家禽在捕捉过程中的应激反应,有利于改善肉质和减少损伤,从而提高产品的食用价值和市场竞争力。
关键词:白羽肉鸡;捕捉方式;品质
Effects of Different Catching Methods on the Quality of White-Feathered Broilers
ZHANG Mingcheng1, CHANG Guangqiang1, FENG Miao1, DENG Xiaomin2, WAN Die2, LIU Hui1,
ZHENG Duoduo1, JIA Na1, LI Hongyu3, LIU Dengyong1,*
(1. National and Local Joint Engineering Research Center for Storage, Processing and Safety Control Technology of Fresh Agricultural Products, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China; 2. Shenyang Huamei Food Co. Ltd., Shenyang 110131, China; 3. Beijing Ershang Meat Food Group Co. Ltd., Beijing 101100, China)
Abstract: In order to study the effect of catching methods on the quality of white-feathered broilers, 1 200 forty-two-day-old white-feathered broilers, reared under the same conditions, were randomly divided into four groups, which were caught by the leg, breast, wing and neck, respectively. Premortem stress responses, body temperature, bruising rate, mortality rate, catching rate and postmortem meat quality were measured. The results showed that stress responses and mortality rate were significantly higher in the neck catching group than in the other groups (P lt; 0.05). Body temperature was significantly higher in the four treatment groups than in the control group (P lt; 0.05). There was no significant difference in catching rate between the breast catching group and the leg and neck catching groups (P gt; 0.05), but catching rate was significantly higher in these groups than in the wing catching group (P lt; 0.05). pH24 h of chicken breast meat was significantly higher in the breast and leg catching groups than in the wing and neck catching groups (P lt; 0.05), and water-holding capacity of chicken breast meat was significantly higher in the breast catching group than in the other treatment groups (P lt; 0.05). In conclusion, breast catching can reduce stress responses in broilers during the catching process, which is conducive to improving meat quality and reducing injuries, thus improving the edible value and market competitiveness of broiler products.
Keywords: white-feathered broiler; catching method; quality
DOI:10.7506/rlyj1001-8123-20240605-136
中图分类号:TS251.4" " " " " " " " " " " " " " " " " " " 文献标志码:A 文章编号:1001-8123(2024)08-0056-07
引文格式:
张明成, 常光强, 冯淼, 等. 不同捕捉方式对白羽肉鸡品质的影响[J]. 肉类研究, 2024, 38(8): 56-62. DOI:10.7506/rlyj1001-8123-20240605-136." "http://www.rlyj.net.cn
ZHANG Mingcheng, CHANG Guangqiang, FENG Miao, et al. Effects of different catching methods on the quality of white-feathered broilers[J]. Meat Research, 2024, 38(8): 56-62. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240605-136." "http://www.rlyj.net.cn
白羽肉鸡屠宰前要被捕捉并置入运输笼中,运输到屠宰场,因此捕捉是白羽肉鸡在宰前运输和管理过程中的一项必要的操作环节[1-2]。鸡的捕捉方式可分为人工捕捉与机械捕捉[3],由于我国在肉鸡屠宰设备生产、应用方面发展的不平衡,目前人工捕捉方式依然被大多数企业所采用。恰当的捕捉方式能够在捕捉过程中减少鸡只恐惧和痛苦。然而不当的捕捉操作可能会导致肉鸡应激、受伤、死亡并降低动物福利,从而影响鸡肉的品质[4]。因此科学、合理的人工捉鸡方式是十分必要的。
目前人工捕捉方式(例如捉取部位)存在差异,缺乏相关的指导标准或支撑性研究。随着人们对动物福利的关注日益增加及畜牧业可持续发展的需求,制定一套科学、统一且人性化的肉鸡捕捉标准显得尤为迫切。规范、科学的捕捉流程不仅有助于提高捕捉效率、降低操作成本,还能保障肉鸡福利和食品安全。鉴于此,本研究在调研多家大型肉鸡养殖场捉鸡方式的基础上,将捕捉方式整理并分类为捉翅膀、捉胸、捉腿、捉脖子4 种方式,通过测定不同方式捉鸡后肉鸡的宰前应激反应、体温、淤伤率、死亡率、捕捉速率及宰后肉品质等指标,探究不同捕捉方式对白羽肉鸡品质的影响,旨在为白羽肉鸡捕捉流程和宰前操作规范提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
白羽肉鸡(日龄42 d,体质量(2 700±100)g)"沈阳华美食品有限公司养殖基地。
1.2 仪器与设备
PE20型pH计 梅特勒-托利多仪器(上海)有限公司;TA.XT Plus型质构仪 英国Stable Micro Systems公司;CR-400型色差仪 柯尼卡美能达光学有限公司;GL-21M型高速冷冻离心机 湘潭湘仪仪器有限公司;ZMR-200型兽用体温温度计 郑州火火猪生物科技有限公司;PQ001型低场核磁共振分析仪 苏州纽迈分析仪器股份有限公司;T25型数显型均质机 德国IKA集团;YS-810型秒表 深圳瑞圣特电子科技有限公司;DK-8D型电热恒温水槽 上海一恒科学仪器有限公司;C-LM4型数显式肌肉嫩度仪 东北农业大学工程学院;202-0A/B型电热恒温干燥箱 上海尚仪仪器设备有限公司。
1.3 方法
1.3.1 试验设计
采用单因素试验设计,选择体质量相近和精神状态良好的42 日龄白羽肉鸡1 200 只,根据捕捉方式不同,随机分为捉翅膀、捉胸、捉腿、捉脖子4 组,每个处理组3 个重复,每组重复100 只。经过严格训练的捕捉人员在环境一致的条件下将白羽肉鸡从养殖场鸡笼捕捉到周转运输笼中。捉翅膀:捕捉人员将手指深入羽毛中,找准翅膀的根部,即位于鸡身体两侧的肩部连接处,用手握紧两侧翅膀,将肉鸡抓起;捉胸:捕捉人员用2 只手同时从肉鸡的两侧抓住肉鸡两翅之间的胸部将肉鸡抓起;捉腿:捕捉人员用手抓住肉鸡的双腿,主要是鸡腿肌肉的中间部分,将肉鸡抓起;捉脖子:用手从鸡的背后或侧面迅速伸向鸡的脖子部位,抓住脖子的根部,将肉鸡抓起。
每组随机取10 只宰后白羽肉鸡的左胸肌样品,进行肉品质的测定。
1.3.2 应激行为测定
参考黄中秋[5]的方法并稍作修改,捕捉人员采用不同捕捉方式将白羽肉鸡从养殖笼捕捉到周转运输笼中,观察和记录过程中白羽肉鸡的应激行为,包括摇头、深呼吸、慢翼扑动、发声。具体的行为参数见表1。
1.3.3 体温测定
捕捉人员通过不同的捕捉方式将白羽肉鸡轻抓轻放到周转运输笼中,待肉鸡稳定后,用兽用红外体温温度计的探头插入白羽肉鸡肛门处,准确记录体温。
1.3.4 死亡率测定
捕捉人员通过不同的捕捉方式将白羽肉鸡从养殖笼捕捉到周转运输笼后记录死亡数。死亡率为死亡的鸡只数量与总捕捉鸡只数量的比例,按式(1)计算:
(1)
1.3.5 淤伤率测定
捕捉人员通过不同捕捉方式将白羽肉鸡从养殖笼捕捉到周转运输笼,待肉鸡稳定后,检查并记录白羽肉鸡的翅膀淤伤数、腿部淤伤数和胸部淤伤数。淤伤率为每组淤伤数与每组总淤伤数的比例,按式(2)计算:
(2)
1.3.6 捕捉速率测定
选择经过严格训练的捕捉人员进行捕捉,将白羽肉鸡从养殖笼捕捉到周转运输笼,白羽肉鸡从养殖笼到周转运输笼的时间为1 个周期,记录每小时的捕捉数量。
1.3.7 胸肉pH值测定
参考Yang Xiaodong等[6]的方法并稍作修改,剥离肉鸡左侧胸肌,取5 g样品切碎后放入烧杯,加入45 mL去离子水,涡旋摇匀后离心,取上清液,校准pH计,测定胸肌宰后45 min和24 h的pH值,每个样品测定3 次,测定结果取平均值。
1.3.8 胸肉色差测定
参考Zhang Jian等[7]的方法并稍作修改,用色差仪沿胸肌长轴中线从厚到薄取3 个点,测定亮度值(L*)、红度值(a*)和黄度值(b*),取3 次测定值的平均值。
1.3.9 胸肉水分含量测定
参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。
1.3.10 胸肉蒸煮损失率测定
参考Barbanti等[8]的方法并稍作修改,将样品在70 ℃水浴中加热30 min,蒸煮前将胸肌擦干表面水分后称质量,记为m1/g,蒸煮完成后冷却至室温,擦干胸肌表面水分后称质量,记为m2/g,肉样的蒸煮损失率按式(3)计算。
(3)
1.3.11 胸肉滴水损失率测定
参考Tarczyński等[9]的方法并稍作修改,将胸肌切成大小为4 cm×2 cm×2 cm的肉块,称质量后记为m3/g,然后将肉块穿入铁钩上并挂于纸杯中用保鲜膜覆盖,在4 ℃冷藏条件下悬挂24 h后,用滤纸吸干肉块表面水分后再次称质量,记为m4/g。肉样的滴水损失率按式(4)计算。
(4)
1.3.12 胸肉离心损失率测定
参考Zhou Ying等[10]的方法并稍作修改,取5 g左右的胸肌样品称质量,记为m5/g;用滤纸包裹肉样,于4 ℃、8 000 r/min条件下离心5 min后,取出肉样,剥去滤纸后称质量,记为m6/g。肉样的离心损失率按式(5)计算。
(5)
1.3.13 胸肉质构测定
参考Wang Xuping等[11]的方法并稍作修改,将胸肉切成2 cm×2 cm×2 cm的正方体,使用带有圆柱形探头P50的质构仪进行测试。质构仪参数设定:测前、测中和测后速率分别为1、2、2 mm/s,返回速率10 mm/s,校准高度30 mm,压缩程度50%,触发力5 g。
1.3.14 胸肉水分分布测定
参考盖圣美等[12]的方法通过核磁成像对不同组胸肉内部的水分分布进行测定,成像方式为冠状面成像,脉冲序列为自旋回归脉冲序列,具体参数为:中心频率22 MHz,信号采样点数400,采样频率20 kHz,重复采样等待时间1 000 ms,回波时间6 ms,采样层数1,采样厚度2 mm,重复采样次数8。
低场核磁共振横向弛豫时间T2测定参考李素等[13]的方法,将样品切成长、宽、高约1 cm×1 cm×2 cm的肉块,置于核磁共振成像仪永磁场中心位置的射频线圈中心,进行磁共振波谱测定,共振频率18 MHz,磁体强度0.5 T,线圈直径40 mm,磁体温度(32.00±0.01)℃。采用核磁共振分析软件中的CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的T2,CPMG脉冲序列参数为:主频23 MHz,偏移频率286.781 3 kHz,90°脉冲时间17 μs,180°脉冲时间35 μs,采样点数54 996,重复时间3 000 ms,累加次数4,回波数2 000。结果取样品3 次测定的平均值。
1.4 数据处理
实验数据采用Excel 2021软件进行整理,用平均值±标准差表示,采用Origin 8.5软件作图,应用SPSS 19.0软件进行差异分析,统计学显著定义为P<0.05,每个实验重复3 次。
2 结果与分析
2.1 不同捕捉方式对白羽肉鸡应激行为的影响
应激行为是白羽肉鸡对外部环境变化或内部生理状态失衡的适应性反应,对其生长、发育、健康和肉品质均有重要影响[14]。这些反应可能源于多种因素,如捕捉、运输、环境变动、疫苗接种等[15]。如图1所示,捉胸处理组的摇头次数与捉腿处理组无显著差异(P>0.05),但显著低于捉翅膀、捉脖子处理组
(P<0.05)。捉翅膀、捉腿处理组的深呼吸、慢翼扑动次数无显著差异(P>0.05),捉脖子处理组的深呼吸、慢翼扑动次数最多,这可能是由于捉脖子阻碍了肉鸡的呼吸,导致呼吸不畅而产生强烈的翅膀扑动和深呼吸,捉脖子不仅可能引发强烈的应激反应,还可能对肉鸡的生命安全构成威胁[16]。捉胸处理组的应激行为发作次数最少,这可能是由于捉胸过程中,翅膀保持闭合状态,并且腿部保持较为自然状态,产生的应激反应较小[17]。综上所述,捉脖子处理组产生的应激行为次数最多,捉胸处理组产生的应激行为次数最少。
小写字母不同表示同一参数不同组间差异显著(P<0.05)。图2~5同。
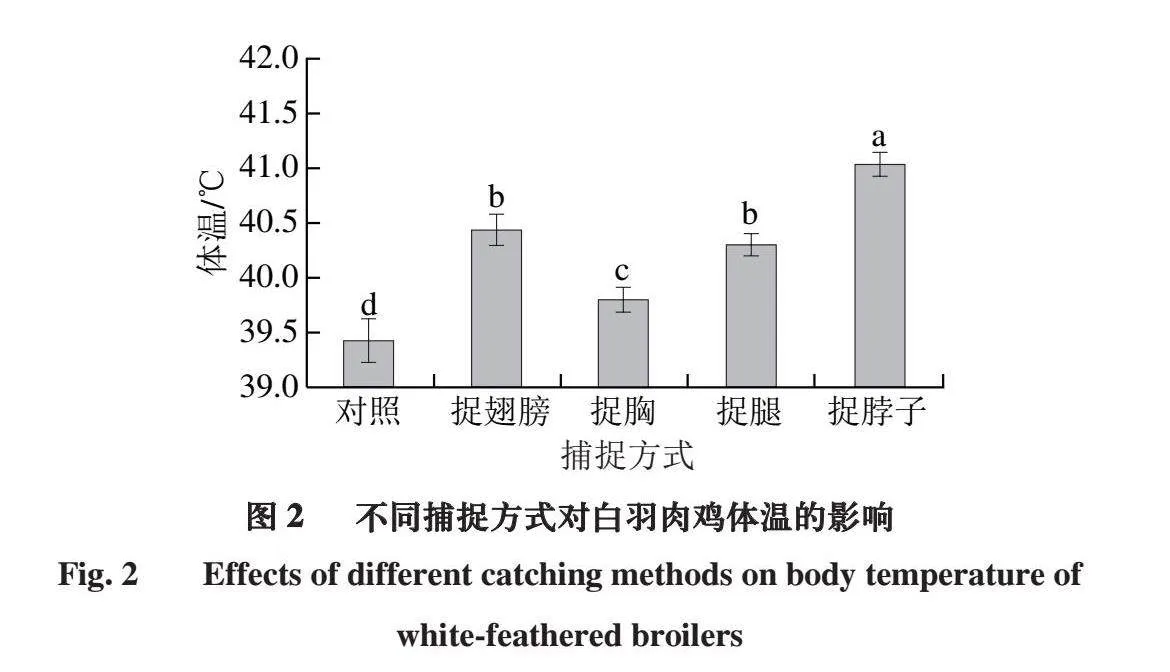
2.2 不同捕捉方式对白羽肉鸡体温的影响
白羽肉鸡在捕捉过程中体温的变化是一个重要的生理指标,体温的变化能够反映其应激程度和健康状况,体温越高,说明应激反应越大[18]。如图2所示,对照组为养殖笼中未进行捕捉的白羽肉鸡体温。与对照组相比,4 组捕捉方式的白羽肉鸡体温均显著升高(P<0.05),其中捉胸处理组的应激体温最低,说明捉胸处理组对白羽肉鸡产生较小的应激反应。捉腿、捉翅膀处理组的应激体温略高于捉胸处理组(P<0.05),这可能是由于捕捉过程中过度拉扯腿或扭曲翅膀,导致鸡只受伤或产生疼痛,从而引起体温上升[19]。4 组捕捉方式中,捉脖子处理组的应激体温最高(P<0.05),这可能是由于捕捉人员的手直接作用于鸡的颈部血管,导致鸡只产生窒息,从而引起体温急剧上升[20]。
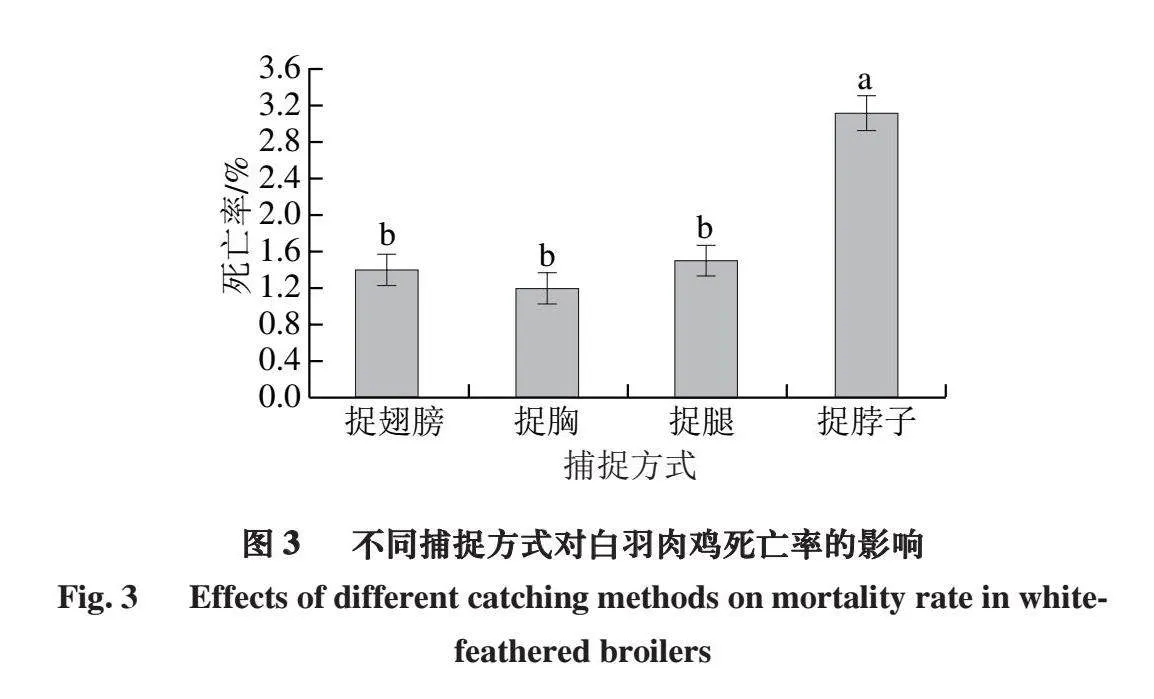
2.3 不同捕捉方式对白羽肉鸡死亡率的影响
白羽肉鸡死亡率是评估捕捉过程对畜禽生命安全影响的重要指标[21]。如图3所示,捉翅膀、捉胸、捉腿处理组的死亡率无显著差异(P>0.05),但与捉脖子处理组的死亡率具有显著差异(P<0.05)。4 组捕捉方式中,捉胸处理组的死亡率最低,捉脖子处理组的死亡率最高,这可能是由于捉脖子导致肉鸡心率加快,心脏收缩加强,血压升高,给心脏带来严重负担,导致猝死[22]。
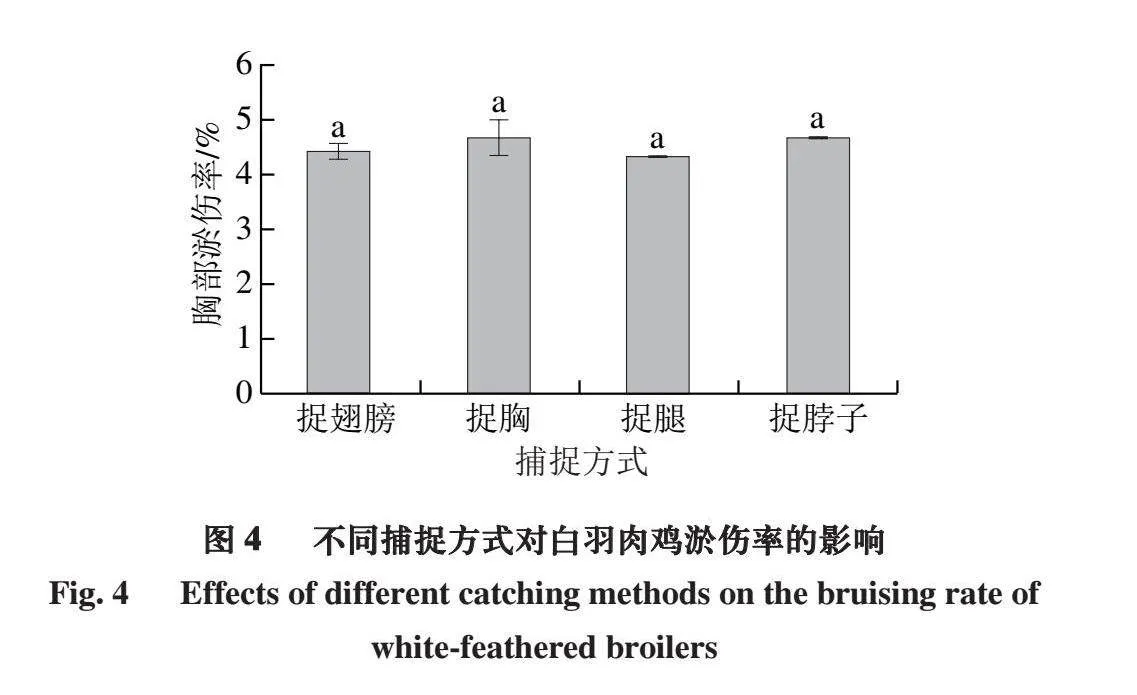
2.4 不同捕捉方式对白羽肉鸡淤伤率的影响
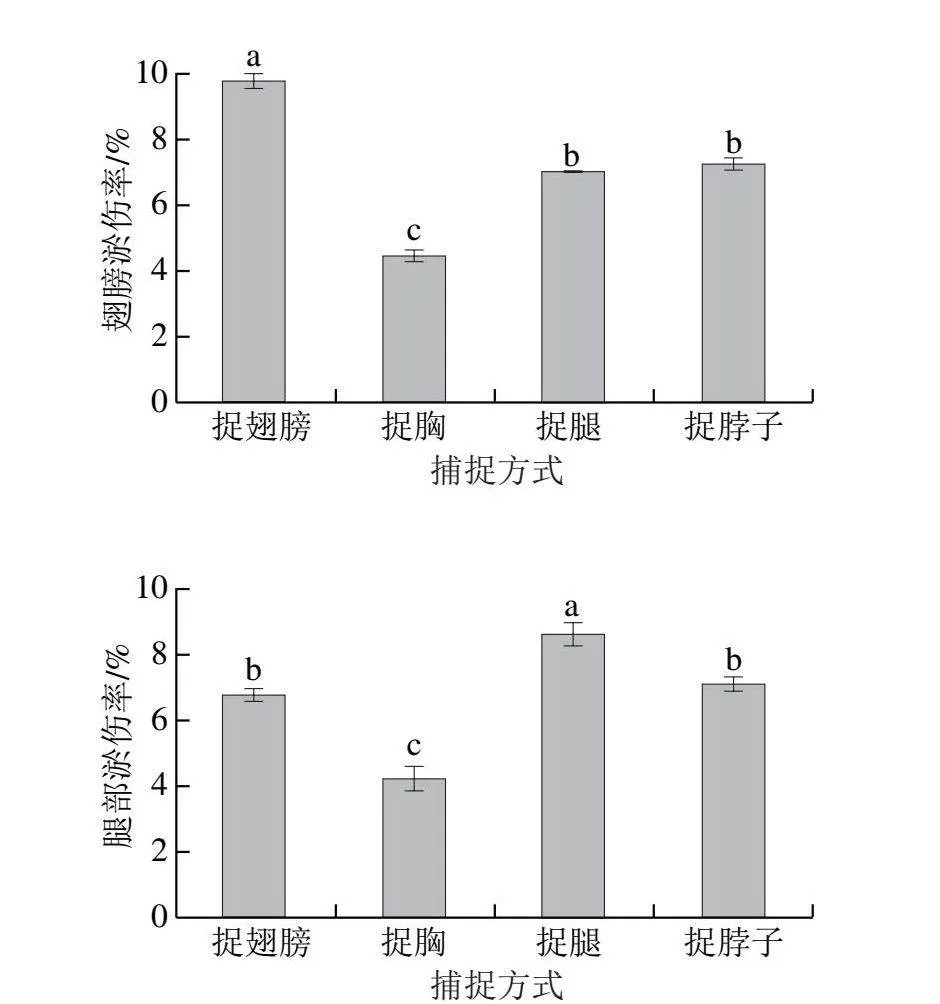
肉鸡出栏时,为了最大限度地减少外伤,捕捉过程中应小心谨慎。目前白羽肉鸡大约90%的外伤是在加工前发生的,这一时间段内的操作对肉鸡尤为关键[23]。肉鸡最容易受伤的部位为翅膀、腿及胸部,由于抓捕环节的操作不当会造成瘀伤、骨头断裂和移位,严重影响胴体品质[24]。如图4所示,捉腿、捉脖子处理组的翅膀淤伤率无显著差异(P>0.05),捉胸处理组翅膀淤伤率最低,捉翅膀处理组最高,这可能是由于白羽肉鸡在养殖过程中生长速率较快,骨骼较为脆弱,容易造成骨折[25],此外,由于捕捉人员的操作不当,也可能造成翅膀淤伤。捉翅膀、捉脖子处理组的腿部淤伤率无显著差异(P>0.05),捉腿处理组的腿部淤伤率最高(P<0.05),捉胸处理组的腿部淤伤率最低(P<0.05)。4 种捕捉方式白羽肉鸡的胸部淤伤率无显著差异(P>0.05)。
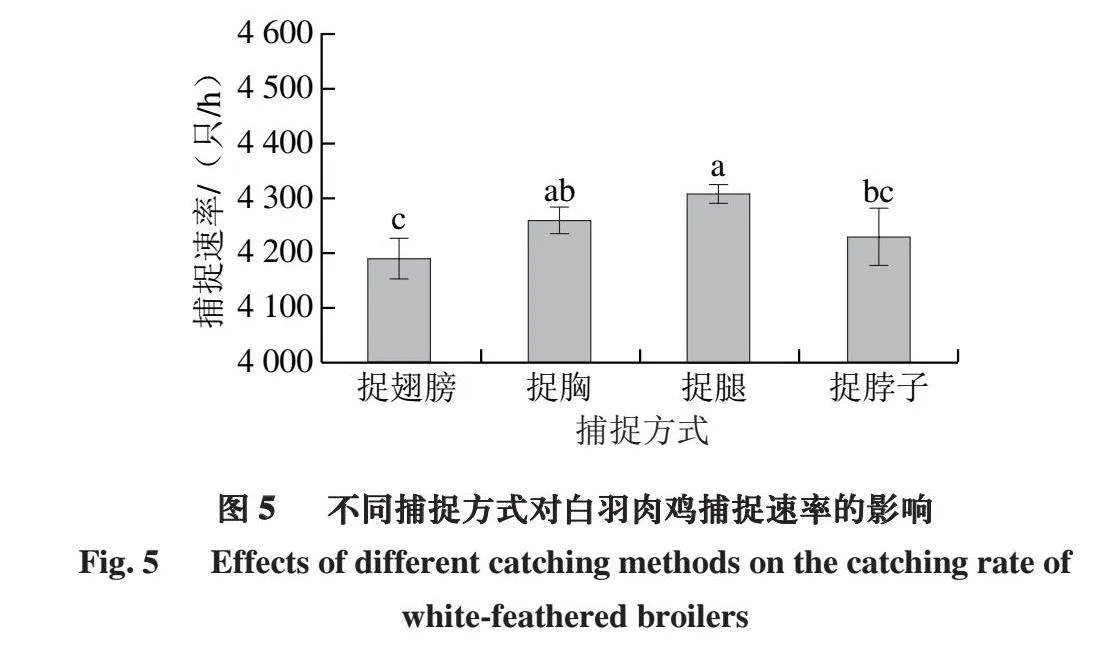
2.5 不同捕捉方式对白羽肉鸡捕捉速率的影响
白羽肉鸡捕捉速率是评估捕捉效率的重要指标,而不同的捕捉方式可能会对捕捉速率产生不同的影响。如图5所示,捉胸、捉腿处理组的捕捉速率较快,因为这2 种方式可以直接控制鸡只的行动,并且操作简单易行。捉翅膀处理组的捕捉速率较慢,因为需要花费更多时间来找到并抓住鸡的翅膀,而且在捕捉过程中可能会遇到鸡的反抗和挣扎。捉脖子处理组的速率则取决于捕捉人员的技巧和经验,如果操作得当,可以迅速控制鸡只,但如果操作不当,可能会导致捕捉失败或鸡只受伤。
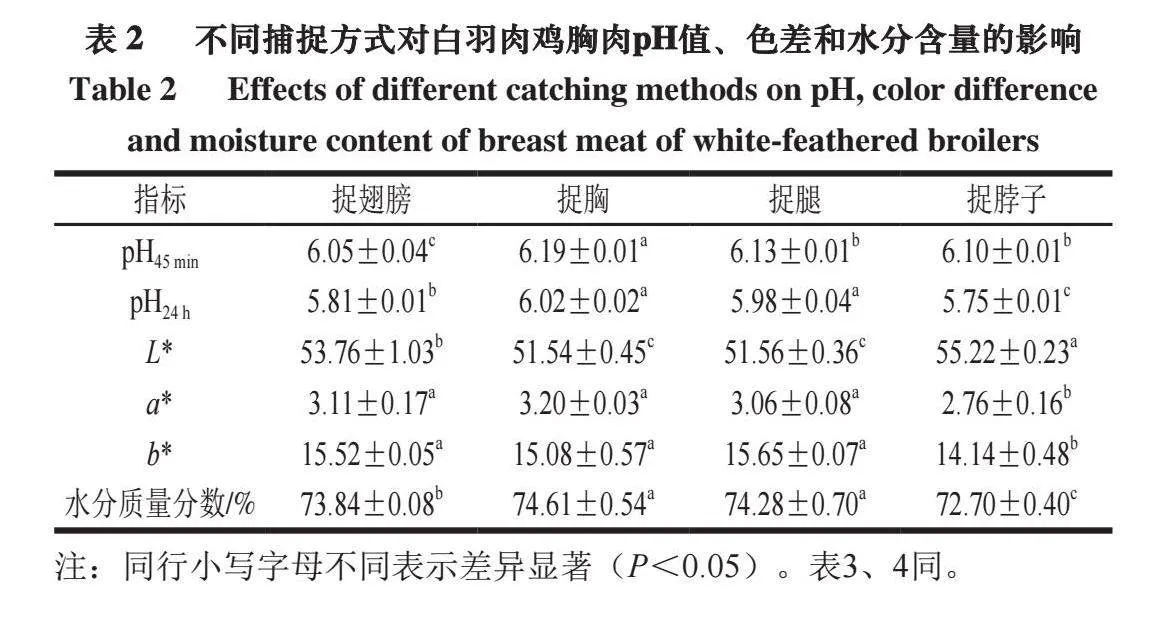
2.6 不同捕捉方式对白羽肉鸡胸肉pH值、色差和水分含量的影响
肉品pH值可以反映动物宰后体内肌糖原的酵解速率,应激时动物体内肌糖原酵解为乳酸,pH值下降[26]。如表2所示,捉腿、捉脖子处理组的pH45 min值无显著差异(P>0.05),但与其他2 组样品的pH45 min值有显著差异(P<0.05)。胸肉宰后pH24 h值迅速下降,这可能是由于家禽屠宰后,尸僵变化过程中会发生一系列的生化反应,在缺氧环境下,肌肉组织细胞内的糖原会进行无氧酵解,从而产生乳酸。乳酸的大量积累是导致肌肉pH值下降的关键因素[27]。捉脖子处理组的pH24 h值与其他3 组pH24 h值具有显著差异(P<0.05),该组胸肉pH24 h值最小,捉胸处理组的胸肉pH24 h值最大。pH值越大说明肉的保水性越好,因此在捕捉方式上,捉胸处理组对白羽肉鸡胸肉有更好的保水性。
肉色是评定肉及肉制品最重要的品质指标。肉的颜色主要受肌肉中肌红蛋白及其氧合代谢的影响[28]。
捉脖子处理组的L*与其他3 组的L*具有显著差异(P<0.05),该组的L*最大,捉胸处理组的L*最小。捉胸、捉腿处理组的L*无显著差异(P>0.05)。捉脖子处理组的a*、b*显著低于其他组(P<0.05),这可能与捕捉方式引起的强烈应激有关,通常在应激状态下,肉鸡肺呼吸功能增强,增加机体组织和细胞内氧合肌红蛋白水平,同时减少脱氧肌红蛋白和高铁肌红蛋白含量,从而使得肌肉L*升高,并在一定程度上降低a*和b*[29]。
水分含量也与肉的保水性有关,水分含量越高,说明肉的保水性越强[30]。捉胸、捉腿处理组的水分含量显著高于其他2 组(P<0.05),捉胸处理组的水分含量最高,捉脖子处理组的水分含量最低。
2.7 不同捕捉方式对白羽肉鸡胸肉蒸煮损失率、滴水损失率和离心损失率的影响
如表3所示,捉脖子处理组的蒸煮损失率与其他3 组样品的蒸煮损失率具有显著差异(P<0.05),捉脖子处理组的蒸煮损失率最大。滴水损失率是衡量肌肉系水力的重要指标,可以用来反映肉品质的稳定性[31]。肌肉的滴水损失率导致大量的肌肉水分流失,系水力变差[32]。捉胸、捉腿处理组的滴水损失率无显著差异(P>0.05),但与其他2 组样品的滴水损失率具有显著差异(P<0.05),捉脖子处理组的滴水损失率最大,捉胸处理组的滴水损失率最小。4 个处理组的离心损失率具有显著差异(P<0.05),捉脖子处理组的离心损失率最大,捉胸处理组的离心损失率最小。
2.8 不同捕捉方式对白羽肉鸡胸肉质构的影响
如表4所示,4 个处理组白羽肉鸡胸肉的硬度具有显著差异(P<0.05),捉脖子处理组的硬度最大,捉胸处理组的硬度最小。捉腿、捉脖子处理组的弹性无显著差异(P>0.05),捉胸处理组的胸肉弹性最大。4 个处理组的黏聚性之间无显著差异(P>0.05)。捉脖子处理组的胶着度与其他3 组样品具有显著差异(P<0.05),该组的胶着度最大。捉胸处理组的咀嚼性与其他3 组相比具有显著差异(P<0.05),该组的咀嚼性最小。4 个处理组的回复性无显著差异(P<0.05)。
2.9 不同捕捉方式对白羽肉鸡胸肉水分分布的影响
如图6A所示,氢质子成像图颜色深浅反映氢质子密度大小引起的磁共振信号强弱,亮度越大,说明氢质子密度越大,水分含量越高[33]。对比不同捕捉方式白羽肉鸡胸肉氢质子成像图亮度,结果发现,捉胸处理组的氢质子成像图最亮,信号最强,水分含量最高。捉脖子处理组的氢质子成像图最浅,信号最弱,水分含量最低。如图6B所示,T2b峰表示与大分子中亲水基团紧密结合的结合水,T21峰表示封闭于肌原纤维束内或粗细纤维间的不易流动水,T22峰表示存在于纤维间隙的自由水。各个样品中结合水含量变化很小。不同捕捉方式明显改变了胸肉中不易流动水和自由水的含量,与捉脖子处理组相比,捉胸处理组主要表现为T21峰面积的增加和T22峰面积的降低,这表明样品内部发生了自由水向不易流动水的迁移[34]。其中,捉胸处理组的T21弛豫时间最短,说明捉胸处理组的胸肉保水性较强。
3 结 论
本研究主要通过测定白羽肉鸡宰前的应激行为、体温、淤伤率、死亡率、捕捉速率及宰后肉品质等指标,研究不同捕捉方式对白羽肉鸡品质的影响。结果表明:在应激行为上,捉胸处理组的白羽肉鸡摇头、深呼吸、慢翼扑动、发声次数显著低于其他3 组(P<0.05),捉胸处理组的应激反应较弱;与对照组相比,4 个处理组白羽肉鸡的体温均显著升高(P<0.05),其中捉脖子处理组的体温上升最高;捉胸处理组的死亡率显著低于其他3 组(P<0.05);捉胸、捉腿处理组的捕捉速率显著高于捉翅膀处理组(P<0.05);其中捉腿处理组的捕捉速率略高于捉胸处理组;捉胸处理组的肉类品质显著高于其他3 组样品(P<0.05)。综上所述,捉胸是较优的捕捉方式。
参考文献:
[1] SAMOYLOV A V, SCHWEAN L K, CROWE T G, et al. Alternative slaughter procedures: on-farm slaughter and transport system for broilers[J]. Poultry Science, 2023, 102(12): 133-137. DOI:10.1016/j.jqsrt.2003.12.034.
[2] LACY M P, CZARICK M. Mechanical harvesting of broilers[J]. Poultry Science, 1998, 77(12): 1794-1797. DOI:10.1016/j.psj.2022.101738.
[3] NIJDAM E, DELEZIE E, LAMBOOIJ E, et al. Comparison of bruises and mortality, stress parameters, and meat quality in manually and mechanically caught broilers[J]. Poultry Science, 2005, 84(3): 467-474. DOI:10.1093/ps/84.3.467.
[4] LANGKABEL N, BAUMANN M P O, FEILER A, et al. Influence of two catching methods on the occurrence of lesions in broilers[J]. Poultry Science, 2015, 94(8): 1735-1741. DOI:10.3382/ps/pev164.
[5] 黄中秋. 宰前处理对黄羽肉鸡应激与鸡肉品质的影响[D].
广州: 华南农业大学, 2017: 10-11. DOI:10.13386/j.issn1002-0306.2017.05.007.
[6] YANG X D, ZHANG S S, LEI Y H, et al. Preservation of stewed beef chunks by using calcium propionate and tea polyphenols[J]. LWT-Food Science and Technology, 2023, 176: 114491. DOI:10.1016/j.lwt.2023.114491.
[7] ZHANG J, ZHANG R Y, ZHANG W G, et al. Effects of ultrasound-assisted cooking on quality characteristics of spiced beef during cold storage[J]. LWT-Food Science and Technology, 2021, 136: 110359. DOI:10.1016/j.lwt.2020.110359.
[8] BARBANTI D, PASQUINI M. Influence of cooking conditions on cooking loss and tenderness of raw and marinated chicken breast meat[J]. LWT-Food Science and Technology, 2005, 38(8): 895-901. DOI:10.1016/j.lwt.2004.08.017.
[9] TARCZYŃSKI K, ZYBERT A, SIECZKOWSKA H, et al. Classification accuracy of different pork quality evaluation methods in assessment of meat with lowered drip loss[J]. Ciência Rural, 2021, 51: e20200885. DOI:10.1590/0103-8478cr20200885.
[10] ZHOU Y, WANG W, MA P J, et al. High-pressure pretreatment to improve the water retention of sodium-reduced frozen chicken breast gels with two organic anion types of potassium salts[J]. Food and Bioprocess Technology, 2018, 11: 526-535. DOI:10.1007/s11947-017-2023-z.
[11] WANG X P, XU M Y, CHENG J R, et al. Effect of flammulina velutipes on the physicochemical and sensory characteristics of cantonese sausages[J]. Meat Science, 2019, 154: 22-28. DOI:10.1016/j.meatsci.2019.04.003.
[12] 盖圣美, 游佳伟, 张雪娇, 等. 利用低场核磁共振及成像技术鉴别注水肉糜[J]. 食品科学, 2020, 41(22): 289-294. DOI:10.7506/spkx1002-6630-20190709-129.
[13] 李素, 王守伟, 朱宁, 等. 加工工艺对酱牛肉蛋白质结构和水分分布的影响[J]. 食品科学, 2022, 43(7): 74-80. DOI:10.7506/spkx1002-6630-20210322-263.
[14] DICKSON T B, KICHLINE P D. Functional management of stress fractures in female athletes using a pneumatic leg brace[J]. American Journal of Sports Medicine, 1987, 15(1): 86. DOI:10.1177/036354658701500113.
[15] GOLD M S, MACDONALD N E, MCMURTRY C M, et al. Immunization stress-related response-redefining immunization anxiety-related reaction as an adverse event following immunization[J]. Vaccine, 2020, 38(14): 3015-3020. DOI:10.1016/j.vaccine.2020.02.046
[16] NIELSEN S S, ALVAREZ J. Slaughter of animals: poultry[J]. EFSA Journal, 2019, 17(11): e05849. DOI:10.2903/j.efsa.2019.5849.
[17] GERPE C, STRATMANN A, BRUCKMAIER R, et al. Examining the catching, carrying, and crating process during depopulation of end-of-lay hens[J]. Journal of Applied Poultry Research, 2021, 30(1): 100115. DOI:10.1016/j.japr.2020.100115.
[18] 谢秋菊, 刘学飞, 郑萍, 等. 畜禽体温自动监测技术及应用研究进展[J]. 农业工程学报, 2022, 38(15): 212-225. DOI:10.11975/j.issn.1002-6819.2022.15.023.
[19] BRADSHAW R H, KIRKDEN R D, BROOM D M. A review of the aetiology and pathology of leg weakness in broilers in relation to welfare[J]. Avian and Poultry Biology Reviews, 2002, 13(2): 45-104. DOI:10.3184/147020602783698421.
[20] WEEKS C A. Poultry handling and transport[M]//GRANDIN T. Livestock handling and transport. Wallingford UK: CABI, 2014: 378-398. DOI:10.1079/9781780643212.0378.
[21] MACE J L, KNIGHT A. The impacts of colony cages on the welfare of chickens farmed for meat[J]. Animals, 2022, 12(21): 2988. DOI:10.3390/ani12212988.
[22] ZHANG J, SCHMIDT C J, LAMONT S J. Transcriptome analysis reveals potential mechanisms underlying differential heart development in fast-and slow-growing broilers under heat stress[J]. BMC Genomics, 2017, 18(1): 1-15. DOI:10.1186/s12864-017-3675-9.
[23] WURTZ K E, HERSKIN M S, RIBER A B. Water deprivation in poultry in connection with transport to slaughter: a review[J]. Poultry Science, 2024, 103(5): 103-119. DOI:10.1016/j.psj.2023.103419.
[24] 许益民. 家禽加工中常见的问题和对策[J]. 中国家禽, 2003, 4(21): 30-32. DOI:10.16372/j.issn.1004-6364.2003.21.019.
[25] ARPÁŠOVÁ H, HAMADOVÁ M, KOKOSZYNSKI D. Occurrence, causes and consequences of keel bone damage of laying hens[J]. Acta Fytotechnica Et Zootechnica, 2023, 26(3): 1-8. DOI:10.15414/afz.2023.26.03.243-255.
[26] 杨玉莹, 张一敏, 董鹏程, 等. 不同品种牛肉品质特性概述[J]. 食品与发酵工业, 2018, 44(6): 271-276. DOI:10.13995/j.cnki.11-1802/ts.015719.
[27] 程业飞. β-谷甾醇对正常和热应激条件下肉鸡生长、抗氧化和线粒体功能影响的研究[D]. 南京: 南京农业大学, 2020. DOI:10.27244/d.cnki.gnjnu.2020.000094.
[28] HUANG J C, YANG J S, MA H, et al. Effect of pre-slaughter shackling and wing flapping on plasma parameters, postmortem metabolism, AMPK, and meat quality of broilers[J]. Poultry Science, 2018, 97(5): 1841-1847. DOI:10.3382/ps/pey019.
[29] IMIK H, OZLU H, GUMUS R, et al. Effects of ascorbic acid and α-lipoic acid on performance and meat quality of broilers subjected to heat stress[J]. Poultry Science, 2012, 53(6): 800-808. DOI:10.1080/00071668.2012.740615.
[30] KONDJOYAN A, OILLIC S, PORTANGUEN S, et al. Combined heat transfer and kinetic models to predict cooking loss during heat treatment of beef meat[J]. Meat Science, 2013, 95(2): 336-344. DOI:10.1016/j.meatsci.2013.04.061.
[31] LEE Y S, ZHEKOV Z G, OWENS C M, et al. Effects of partial and complete replacement of sodium chloride with potassium chloride on the texture, flavor and water-holding capacity of marinated broiler breast fillets[J]. Journal of Texture Studies, 2012, 43(2): 124-132. DOI:10.1111/j.1745-4603.2011.00322.x.
[32] WEN C, JIANG X Y, DING L R, et al. Effects of dietary methionine on growth performance, meat quality and oxidative status of breast muscle in fast-and slow-growing broilers[J]. Poultry Science, 2017, 96(6): 1707-1714. DOI:10.3382/ps/pew432.
[33] 郝丽红. 新型乳酸菌发酵饲料对猪肉品质的影响及机制研究[D]. 杭州: 浙江大学, 2020. DOI:10.27461/d.cnki.gzjdx.2020.004152.
[34] 张舒翔, 康大成, 张丽丽, 等. 运输时间对扬州鹅应激程度和肉品质的影响[J]. 食品科学技术学报, 2018, 36(6): 66-72. DOI:10.27244/d.cnki.gnjnu.2018.001061.

