基于离子对竞争性结合作用检测牛肉中16 种氨基糖苷类兽药残留


摘 要:建立同时测定牛肉中16 种氨基糖苷类兽药残留的方法。样品经磷酸盐缓冲液提取,三氯乙酸沉淀蛋白,调节pH值后,HLB固相萃取小柱净化,Hilic Plus色谱柱分离,在电喷雾电离正离子模式下采用超高效液相色谱-串联质谱检测。结果表明,16 种氨基糖苷类兽药在25~750 μg/kg内线性关系良好,相关系数均大于0.990,检出限为0.006~0.609 µg/kg,定量限为0.02~1.83 µg/kg。在牛肉中加标回收率为69.09%~115.50%,相对标准偏差为1.04%~16.58%(n=6)。本方法灵敏度、准确度高,适用于牛肉中16 种氨基糖苷类兽药的同时测定。
关键词:离子对竞争性结合;牛肉;氨基糖苷类兽药;超高效液相色谱-串联质谱
Detection of 16 Aminoglycoside Residues in Beef Based on Ion Pair Competitive Binding
LIU Huawen, LIANG Feiyan*, XIN Lina, LI Minglu
(Guangxi-Asean Food Inspection and Testing Center, Nanning 530021, China)
Abstract: A method was established for simultaneous determination of 16 aminoglycoside (AG) residues in beef. Samples were extracted with phosphate buffered solution and the proteins were precipitated using trichloroacetic acid. After adjusting the pH, the target compounds were cleaned up on an HLB solid phase extraction (SPE) column, separated on a Hilic Plus column, and detected by ultra-high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) in the positive ion electrospray ionization mode. The results showed that the calibration curves for the 16 AGs exhibited good linearity in the concentration range of 25–750 μg/kg with correlation coefficients greater than 0.990. The limits of detection (LOD) were 0.006–0.609 µg/kg and the limits of quantitation (LOQ) were 0.02–1.83 µg/kg. The average recoveries at three spiked levels were in the range of 69.09%–115.50%, with relative standard deviations (RSDs) of 1.04%–16.58%
(n = 6). The method is sensitive, accurate, and suitable for simultaneous determination of the 16 AGs in beef.
Keywords: ion pair competitive binding; beef; aminoglycosides; ultra-high performance liquid chromatography-tandem mass spectrometry
DOI:10.7506/rlyj1001-8123-20240531-130
中图分类号:TS207.3" " " " " " " " " " " " " " " " " " " "文献标志码:A 文章编号:1001-8123(2024)08-0042-06
引文格式:
刘华文, 梁飞燕, 辛丽娜, 等. 基于离子对竞争性结合作用检测牛肉中16 种氨基糖苷类兽药残留[J]. 肉类研究, 2024, 38(8): 42-47. DOI:10.7506/rlyj1001-8123-20240531-130." " http://www.rlyj.net.cn
LIU Huawen, LIANG Feiyan, XIN Lina, et al. Detection of 16 aminoglycoside residues in beef based on ion pair competitive binding[J]. Meat Research, 2024, 38(8): 42-47. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240531-130.
http://www.rlyj.net.cn
氨基糖苷类(aminoglycosides,AGs)抗生素是一类细菌蛋白质合成抑制剂,其抗菌谱较广、抗菌活性强,对需氧革兰氏阴性杆菌如大肠杆菌、沙门氏菌、巴氏杆菌变形杆菌属、肠杆菌属、志贺菌属等有强大的杀菌作用,常用于防治畜禽呼吸道、肠道、泌尿道感染及败血症、禽霍乱等疫病,是防治需氧革兰氏阴性杆菌感染的首选药物[1-2]。AGs兽药具有严重的肾毒性、耳毒性及造血系统毒性,可造成神经肌肉阻滞、过敏等不良反应[3],长期食用AGs兽药残留超标的动物源性食品会导致药物在人体内蓄积,同时引发相应的毒副作用或出现耐药性,损害人体健康。为此,监控畜禽肉中AGs兽药残留对于保障畜禽肉质量安全,以及消费者饮食安全和身体健康具有重要意义。
AGs兽药是由氨基糖苷与氨基环醇形成的苷,结构中含有氨基等碱性基团和多个羟基,故此类药物呈碱性,水溶性较强,且紫外吸收弱,进行食品中残留检测分析时存在提取难、保留弱、灵敏度低等难点问题。国内外在解决其保留弱、灵敏度低等难题方面的报道较多。例如,为解决AGs兽药在反相色谱柱上保留弱甚至无保留问题,可在样品进样溶液或流动相中加入离子对试剂[4-7],或采用亲水性色谱柱[8-12];若检测灵敏度低,可采用适宜的样品前处理净化技术,如液-液萃取法[13-15]、固相萃取法[16-21]、基质固相分散法[22]等,尽可能去除干扰杂质,降低基质效应,提高灵敏度。针对解决提取难问题的报道甚少,相关报道多采用磷酸盐缓冲液[23-24],或加入蛋白沉淀剂如三氯乙酸[25-26]、高氯酸[27]、乙腈[28-29]等溶液,提取的同时沉淀蛋白,达到净化目的。
通过查阅文献[30-31]和实验研究发现,AGs兽药可与动物源性食品中的蛋白质结合形成稳定结构,缓冲液提取或沉淀蛋白不能很好地将待测组分提取出来。基于此,本研究拟通过离子对竞争性地与AGs兽药结合,将AGs兽药从牛肉样品的蛋白质中释放出来,同时对前处理方法和仪器条件进行优化,采用超高效液相色谱-串联质谱进行检测,以期解决食品中AGs兽药残留检测提取难、保留弱、灵敏度低的难点问题。
1 材料与方法
1.1 材料与试剂
牛肉样品购自广西省内各地农贸市场,独立封装后在-20 ℃下冷冻贮藏,待测时提前取出并于室温下解冻,使用绞肉机处理为均匀肉泥以供前处理。
潮霉素B(纯度90.2%)、双氢链霉素(纯度97.7%)、硫酸巴龙霉素(纯度98.0%)、西索米星(纯度95.0%)、硫酸异帕米星(纯度98.6%) 天津阿尔塔有限公司;硫酸链霉素(纯度97.7%)、硫酸卡那霉素(纯度96.4%)、硫酸安普霉素(纯度86.3%)、硫酸庆大霉素(纯度89.2%)、妥布霉素(纯度94.3%)、硫酸新霉素(纯度80.1%)、盐酸壮观霉素(纯度99.9%)、硫酸奈替米星(纯度96.5%)、硫酸依替米星(纯度59.9%)、辛烷磺酸钠(分析纯) 上海安谱璀世标准技术服务有限公司;丁胺卡那霉素(纯度86.2%)、硫酸小诺霉素(纯度80.0%) 广州佳途科技股份有限公司;戊烷磺酸钠、十二烷基硫酸钠(均为分析纯) 上海麦克林生化科技股份有限公司;己烷磺酸钠(分析纯)"美国Sigma-Aldrich公司;庚烷磺酸钠、癸烷磺酸钠(均为色谱纯) 美国Fisher Chemical公司;十二烷基磺酸钠(分析纯) 天津市大茂化学试剂厂;乙二胺四乙酸二钠(disodium ethylenediamine tetraacetic acid,Na2EDTA)(优级纯) 天津光复科技发展有限公司;三氯乙酸、磷酸二氢钾、盐酸(均为分析纯) 国药集团化学试剂有限公司;氢氧化钠(分析纯) 广东光华科技股份有限公司;甲酸(色谱纯) 天津市科密欧化学试剂有限公司;甲醇、乙腈(均为色谱纯) 默克股份两合公司;实验用水为GB/T 6682—2008《分析实验室用水规格和试验方法》规定的一级水。
1.2 仪器与设备
Triple Quad 5500三重四极杆液相色谱-质谱联用仪"美国AB SCIEX公司;1290超高效液相色谱仪、Hilic Plus色谱柱(2.1 mm×100 mm,3.5 μm) 美国Agilent公司;MS303TS电子天平 梅特勒-托利多仪器(上海)有限公司;Milli-Q Advantage A10超纯水机 德国Millipore公司;MILTIFUGE X3R高速冷冻离心机 美国Thermo Fisher Scientific公司;Multi Reax多管式涡旋振荡器"德国Heidolph公司;Genius NM32LA氮气发生器 毕克气体仪器贸易(上海)有限公司;TurboVap LV样品自动浓缩仪 瑞典Biotage公司;Oasis HLB固相萃取小柱(6 mL,200 mg) 美国Waters公司。
1.3 方法
1.3.1 样品前处理
取样品2.0 g,加入10.0 mL提取剂(称取磷酸二氢钾1.36 g,加水980 mL使之溶解,采用1 mol/L盐酸溶液调节pH值至4.0,分别加入戊烷磺酸钠8.70 g、己烷磺酸钠9.41 g、Na2EDTA 0.15 g、三氯乙酸20 g使之溶解,以水定容至1 000 mL),涡旋5 min,超声5 min,10 000 r/min、-10 ℃离心10 min,取上清液,采用10 mol/L氢氧化钠溶液调节pH值至4~5,置于已活化HLB固相萃取小柱(6 mL,200 mg,活化:甲醇(5 mL)→水(5 mL)→提取液(5 mL)),用5 mL水淋洗,抽干,用10 mL 0.5%甲酸甲醇溶液洗脱,于40 ℃水浴氮气吹至近干,用1%甲酸水溶液-乙腈(15∶85,V/V)溶解并定容至1.0 mL,涡旋振荡5 min,过0.22 μm滤膜,上机测定。
1.3.2 标准溶液配制
标准储备溶液:精密称取16 种AGs标准物质各10.0 mg,分别置于10 mL容量瓶中,加水溶解并定容,摇匀,得到质量浓度为1 mg/mL的单标储备溶液,0~5 ℃保存。
混合标准中间液:分别精密移取各单标储备溶液0.1 mL,置于同一10 mL容量瓶中,用水稀释、定容,摇匀,各标准物质质量浓度为10 μg/mL。
混合标准工作液:精密移取混合标准中间液1.0 mL,置于10 mL容量瓶中,用水稀释、定容,各标准物质质量浓度为1.0 μg/mL,用于绘制标准曲线。
称取牛肉空白基质样品,按1.3.1节处理后,得到空白基质溶液。分别精密吸取混合标准工作液0.05、0.10、0.20、0.50、0.75 mL,混合标准中间液0.10、0.12、0.15 mL,用空白基质溶液配制成质量浓度分别为0.05、0.10、0.20、0.50、0.75、1.00、1.20、1.50 μg/mL的系列基质混合标准工作曲线所需溶液。
1.3.3 分析条件
1.3.3.1 色谱条件
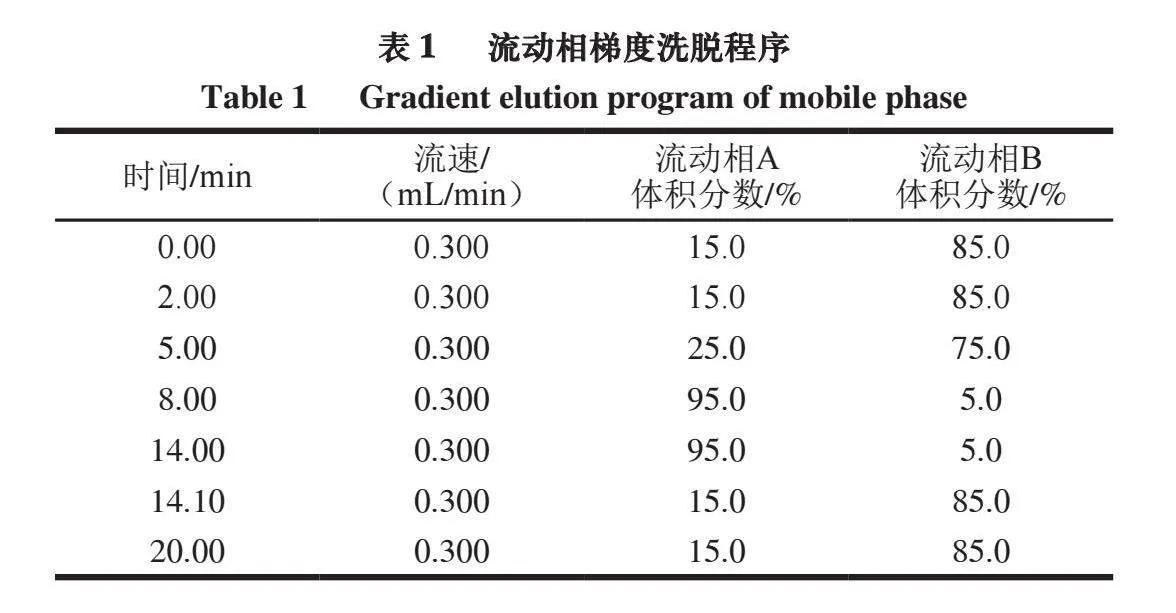
色谱柱:Hilic Plus(2.1 mm×100 mm,3.5 μm);柱温35 ℃;进样量10 μL;流动相A为1%甲酸溶液,B为乙腈;流动相梯度洗脱程序见表1。
1.3.3.2 质谱条件
电喷雾电离;多反应监测模式;正离子扫描;电喷雾电压5 500 V;碰撞室入口电压10 V;碰撞室出口电压12 V;雾化气(氮气)压力55 psi;辅助加热气压力60 psi;气帘气(氮气)压力35 psi;碰撞气压力9 psi;离子源温度550 ℃;扫描时间60 ms。
1.3.4 基质效应计算
按下式计算:
1.4 数据处理
分别利用Analyst软件和MutiQuant 3.0.2软件进行数据采集及处理,采用Excel 2010软件和Origin 2021软件进行数据汇总和分析。
2 结果与分析
2.1 色谱柱选择
由于AGs兽药含有多个氨基,电离作用强,在反相色谱分离柱中保留极弱甚至无保留。通过在流动相中添加离子对试剂,如戊烷磺酸钠、庚烷磺酸钠、七氟丁酸等,使之与待测物离子结合,形成可在反相色谱柱中保留的分子,但离子对试剂会残留在质谱系统中,损坏质谱系统,造成质谱检测器对负离子分析性能下降。通过在高纯度、具有良好机械稳定性的硅胶基质表面键合高纯度亲水性基团,可得到亲水性反相分离柱,如HILIC柱、R柱、Gold柱等,可大大增强极性化合物在反相色谱柱上的保留能力和选择性[32-35]。
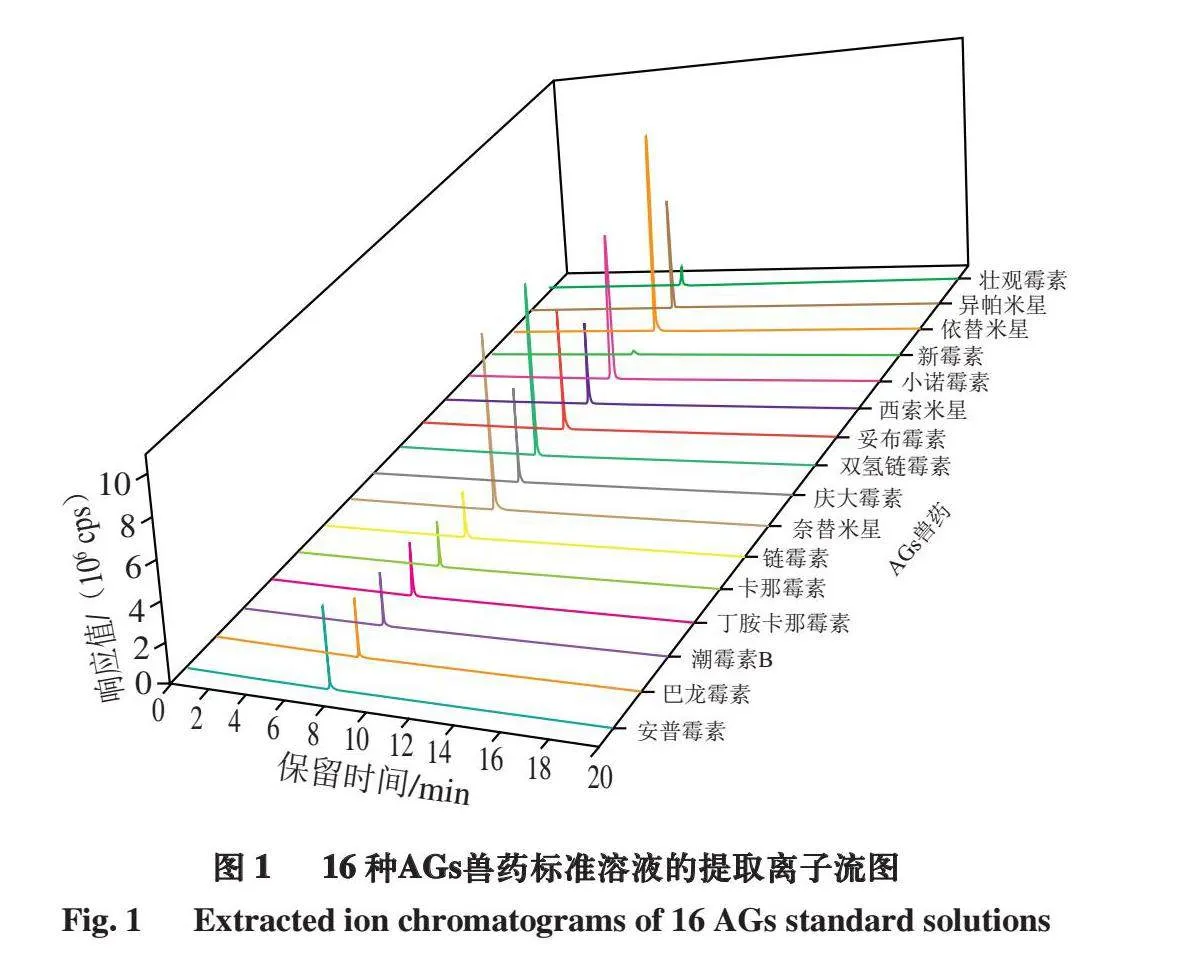
本研究对比不同厂家、不同规格、不同型号的亲水作用色谱柱(Sielc obelisk R(2.1 mm×100 mm,5 μm)、HSS T3(2.1 mm×100 mm,1.8 μm)、Hypersil Gold(2.1 mm×100 mm,1.9 μm)、Hypersil Gold AQ(2.1 mm×100 mm,1.9 μm)、Agilent Proshell 120 Hilic(4.6 mm×100 mm,2.7 μm)、Agilent Hilic Plus(2.1 mm×100 mm,3.5 μm)、Agilent RRHD Hilic Plus(2.1 mm×100 mm,1.8 μm)、Waters CORTECS UPLC Hilic(2.1 mm×100 mm,1.6 μm)、Waters ACQUITY UPL BEH Hilic(2.1 mm×100 mm,1.6 μm))。结果表明,使用Agilent Hilic Plus色谱柱时,16 种AGs兽药的保留效果较好,色谱峰峰形尖锐、对称性良好(图1)。故最终选择Agilent Hilic Plus色谱柱(2.1 mm×100 mm,3.5 μm)。
2.2 质谱条件优化
AGs兽药分子结构中含有氨基环醇、羟基和伯胺或仲胺基团等碱性基团,可与流动相中甲酸的H+结合,形成带正电荷的[M+H]+,适宜采用正离子扫描模式,通过优化锥孔电压和碰撞能量,选取响应丰度较高、易得到、出峰稳定的母离子和子离子,进而获得定量和定性离子对。具体质谱参数见表2。
2.3 提取剂优化
AGs兽药具有弱碱性、带正电,可与细胞中的金属离子螯合,同时牛肉中含有大量蛋白质,蛋白质的肽键结构含有羰基(C=O),可与AGs兽药分子结构中的N—H键形成稳定结构,给样品提取和净化带来巨大困难。现阶段去除蛋白质的方法有酸性沉淀剂盐析、有机溶剂脱水、生物酶酶解、加热等。本研究采用三氯乙酸沉淀蛋白、Na2EDTA螯合金属离子、Tris溶液-磷酸盐缓冲液提取、蛋白酶水解蛋白质等方式,通过调节提取剂的酸碱度、水解蛋白质等方式,提取液出现不同程度的浑浊,且存在提取不完全、目标物丢失等现象,均不能取得满意效果。由此可知,单纯地沉淀蛋白质并不能破坏蛋白质与AGs兽药之间的结合力,在沉淀蛋白质的同时,AGs兽药也同时沉淀而被去除。
离子对试剂具有强亲水性和结合力,可与电离能力较强的化合物结合[4-5]。而AGs兽药为阳离子化合物,电离能力强,易与阴离子离子对试剂配对[7]。为此,本研究考察阴离子离子对试剂烷基磺酸盐类(0.1 mol/L戊烷磺酸钠、己烷磺酸钠、庚烷磺酸钠、辛烷磺酸钠、癸烷磺酸钠、十二烷基磺酸钠、十二烷基硫酸钠溶液)对AGs兽药的提取效果。结果表明,在提取过程中,离子对试剂碳链越长(癸烷磺酸钠、十二烷基磺酸钠、十二烷基硫酸钠),产生的泡沫越多,难以消除,导致无法涡旋振荡提取,固相萃取净化时过柱慢,且在浓缩时有白色残渣析出,提取回收率较低(<35%);采用戊烷磺酸钠溶液提取时,所有组分均能出峰,除潮霉素B回收率(<45%)偏低外,其余组分回收率(60%~120%)良好;采用己烷磺酸钠溶液提取时,所有组分亦均能出峰,除链霉素、双氢链霉素、壮观霉素、奈替霉素和小诺霉素回收率(10%~60%)偏低外,其余组分回收率(60%~120%)良好。因此,为保证所有组分能达到更好的提取效果,本研究采用戊烷磺酸钠和己烷磺酸钠组合溶剂作为提取剂。
比较不同浓度的组合溶剂(0.02 mol/L戊烷磺酸钠-0.02 mol/L己烷磺酸钠溶液、0.05 mol/L戊烷磺酸钠-0.05 mol/L己烷磺酸钠溶液、0.1 mol/L戊烷磺酸钠-0.1 mol/L己烷磺酸钠溶液、0.2 mol/L戊烷磺酸钠-0.2 mol/L己烷磺酸钠溶液)对AGs兽药的提取效果。结果表明,随着提取剂浓度的升高,各组分的回收率也升高,提取剂浓度大于0.05 mol/L时,各组分回收率良好,提取效果较理想。因此,本研究采用组合溶剂0.05 mol/L戊烷磺酸钠-0.05 mol/L己烷磺酸钠溶液,通过离子对与蛋白质竞争性结合待测组分,将AGs兽药从蛋白质中释放出来。此外,为更好地降低基质效应,减小蛋白质对待测组分的干扰,本研究加入三氯乙酸沉淀蛋白,提供酸性环境,更有利于AGs兽药提取。
2.4 净化条件优化
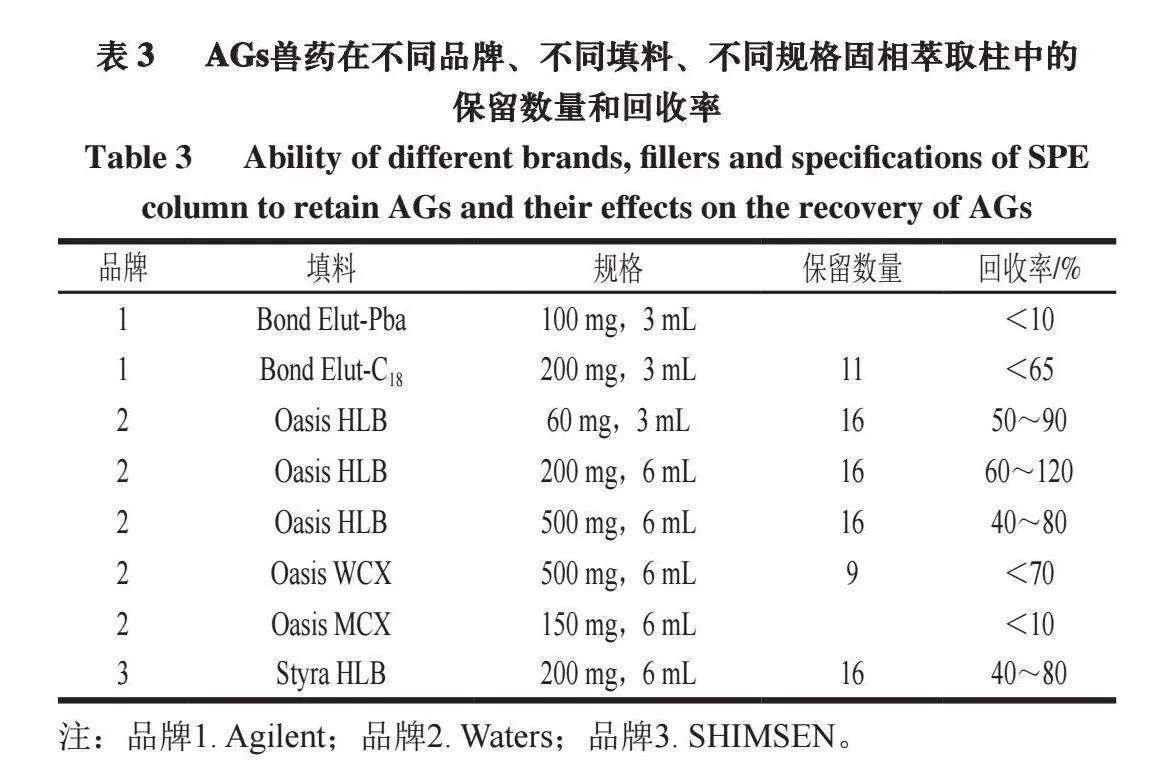
目前,最常用的兽药残留检测前处理净化方法为固相萃取法和QuEChERS方法。AGs兽药极易溶于水,宜采用水溶液进行提取,若采用QuEChERS方法净化,水溶液难以浓缩,而兽药残留检测为痕量分析,未经浓缩的样品溶液可导致方法检出限偏低,达不到检测灵敏度要求。因此,本研究拟采用固相萃取法。AGs兽药为弱碱性有机物,宜采用反相固相萃取法或阳离子交换固相萃取法。本研究以16 种AGs兽药的混合标准溶液(1 μg/mL)考察不同品牌、不同填料、不同规格固相萃取柱的净化效果。如表3所示,Oasis MCX柱(150 mg,6 mL)、Bond Elut-Pba柱(100 mg,3 mL)对所有组分均无保留,Oasis WCX柱(500 mg,6 mL)对其中9 种组分(潮霉素B、双氢链霉素、丁胺卡那霉素、卡那霉素、安普霉素、妥布霉素、壮观霉素、巴龙霉素、异帕霉素)有保留;Bond Elut-C18柱对其中11 种组分(双氢链霉素、卡那霉素、安普霉素、庆大霉素、妥布霉素、新霉素、巴龙霉素、小诺霉素、西索米星、奈替米星、依替米星)有保留;HLB填料对16 种AGs兽药均有保留,当填料规格200 mg、柱容量6 mL时,各组分回收率良好。故本研究采用Waters Oasis HLB固相萃取柱(200 mg,6 mL)作为AGs兽药净化的固相萃取柱。
2.5 基质效应分析
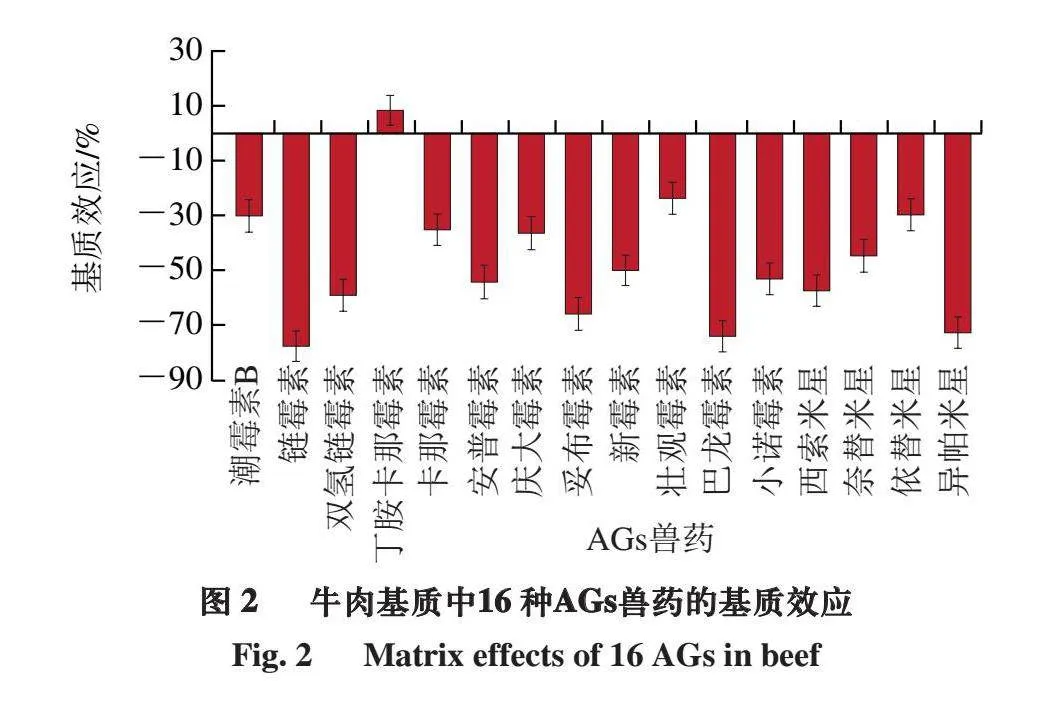
本研究通过空白基质加标法对牛肉中的基质效应进行评价。如图2所示,牛肉基质中,只有丁胺卡那霉素表现为基质增强效应,基质效应为8.5%,其他AGs兽药均表现为基质抑制效应,基质效应为-77.2%~-23.7%,其中潮霉素B、卡那霉素、庆大霉素、新霉素、壮观霉素、奈替米星和依替米星基质效应绝对值均小于50%,而链霉素、双氢链霉素、安普霉素、妥布霉素、巴龙霉素、小诺霉素、西索米星和异帕米星基质效应绝对值大于50%。因此,本研究采用空白基质溶液配制标准曲线溶液,以消除基质效应影响,提高定量分析结果的准确性。
2.6 方法学验证
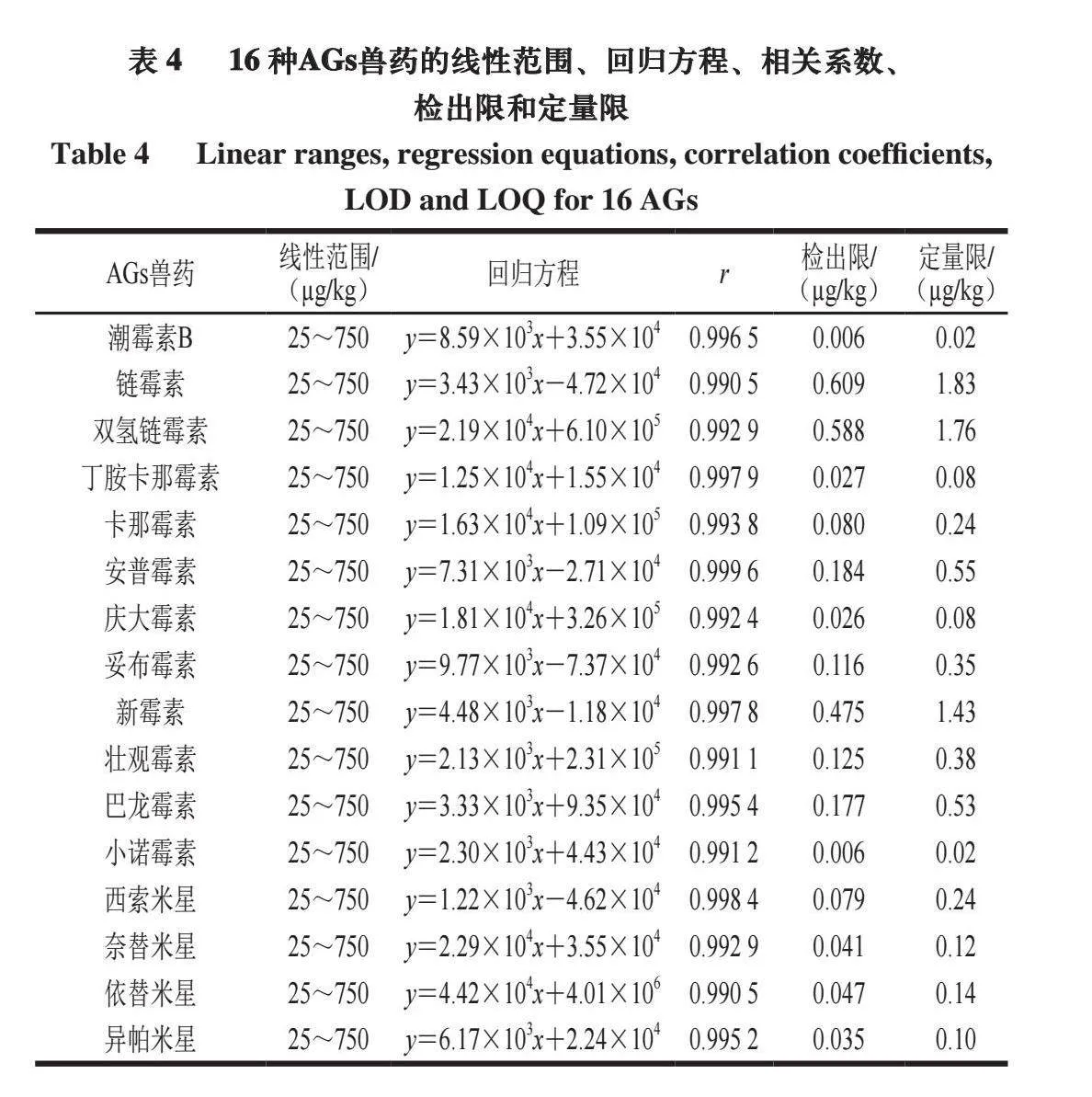
2.6.1 线性关系、检出限和定量限
采用阴性牛肉样品制备空白基质标准曲线溶液,按优化条件进行测试,以目标物定量离子的质谱图峰面积(y)为纵坐标、相应的空白基质标准工作溶液质量浓度(x,ng/mL)为横坐标,绘制标准曲线,得到16 种AGs兽药的线性回归方程和相关系数,分别以信噪比(RSN)=3和RSN=10计算检出限和定量限,如表4所示。结果表明,16 种AGs兽药在25~750 µg/kg范围内线性关系良好,相关系数r均大于0.990,检出限为0.006~0.609 µg/kg,定量限为0.02~1.83 µg/kg,满足AGs兽药的检测要求。
2.6.2 准确度和精密度
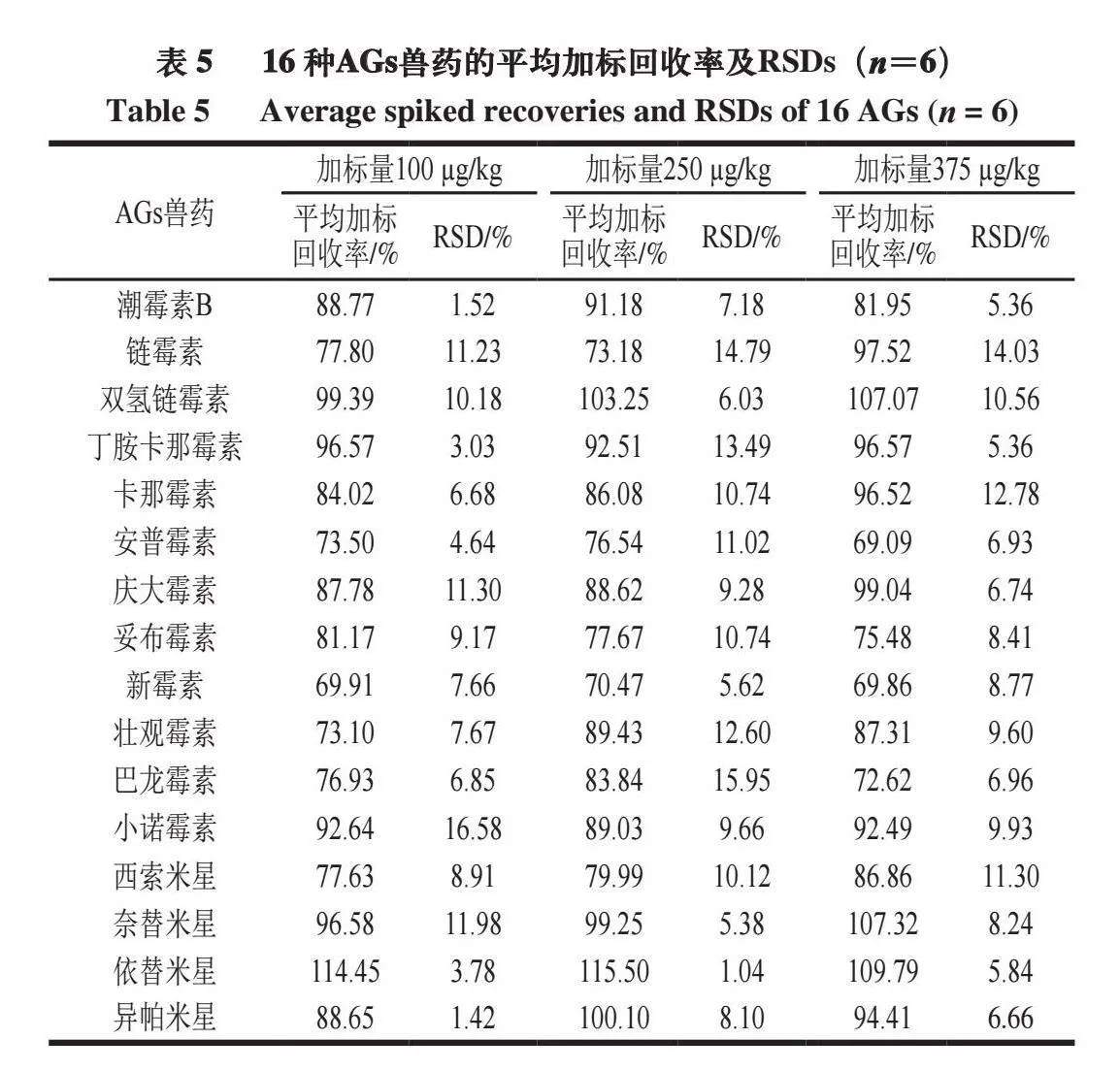
在空白牛肉基质样品中,进行3 个水平(100、250、375 µg/kg)的加标回收实验,每个加标水平平行测定6 次。如表5所示,16 种AGs兽药的平均加标回收率为69.09%~115.50%,相对标准偏差(relative standard deviation,RSD)为1.04%~16.58%(n=6),方法具有良好的准确度与精密度。
2.7 实际样品检测
在广西省内随机选取牛肉样品100 批次,采用本方法对样品中16 种AGs兽药进行检测,100 批次样品中均未检出AGs。
3 结 论
本研究基于超高效液相色谱-串联质谱建立了牛肉中16 种AGs兽药残留的测定方法。通过选择合适的色谱柱,采用三氯乙酸沉淀蛋白,以组合溶剂0.05 mol/L戊烷磺酸钠-0.05 mol/L己烷磺酸钠溶液作为提取剂,HLB固相萃取柱富集净化,实现了16 种AGs兽药的有效提取、保留和准确定量分析。本方法提取效率高、净化效果好、灵敏度高、准确度和精密度良好,适用于牛肉中16 种AGs兽药的同时测定。
参考文献:
[1] 余祖功, 董发明, 刘永旺. 兽药合理应用与联用手册[M]. 北京: 化学工业出版社, 2021: 50-58.
[2] 崔海岚. 氨基糖苷类抗生素临床应用的体会[J]. 当代畜牧, 2022(2): 48-49.
[3] 许恒, 唐春雷, 范为正. 氨基糖苷类抗生素的研究进展[J]. 中国新药杂志, 2019, 15(28): 1828-1835.
[4] ALMEIDA M P, REZENDE C P, SOUZA L F, et al. Validation of a quantitative and confirmatory method for residue analysis of aminoglycoside antibiotics in poultry, bovine, equine and swine kidney through liquid chromatography-tandem mass spectrometry[J]. Food Additives amp; Contaminants: Part A: Chemistry, Analysis, Control, Exposure amp; Risk Assessment, 2012, 29(4): 517-525. DOI:10.1080/19440049.2011.623681.
[5] ZHU Z, LIU G H, WANG F, et al. Development of a liquid chromatography tandem mass spectrometric method for simultaneous determination of 15 aminoglycoside residues in porcine tissues[J]. Food Analytical Methods, 2016, 9: 2587-2599. DOI:10.1007/s12161-016-0446-1.
[6] 湛嘉, 朱海强, 王园, 等. 猪肉中强极性-极性化学污染物快速通用筛查法的建立[J]. 中国口岸科学技术, 2020(3): 47-54. DOI:10.3969/j.issn.1002-4689.2020.03.007.
[7] TURNIPSEED S B, CLARK S B, KARBIWNYK C M, et al. Analysis of aminoglycoside residues in bovine milk by liquid chromatography electrospray ion trap mass spectrometry after derivatization with phenyl isocyanate[J]. Journal of Chromatography B, 2009, 877(14/15): 1487-1493. DOI:10.1016/j.jchromb.2009.03.025.
[8] 苏晶, 汤立忠, 陈长毅, 等. 高效液相色谱串联质谱法同时测定9 种龙虾中氨基糖苷类和四环素类抗生素残留[J]. 食品工业科技, 2016, 37(2): 60-63; 67. DOI:10.13386/j.issn1002-0306.2016.02.003.
[9] 黄原飞, 娄晓祎, 周哲, 等. 分子印迹聚合物固相萃取-超高效液-串联质谱法检测水产品中11 种氨基糖苷类药物残留[J]. 分析化学, 2018, 46(3): 454-461. DOI:10.11895/j.issn.0253-3820.171175.
[10] PERKONS I, PUGAJEVA I, BARTEVICS V. Simultaneous screening and quantification of aminoglycoside antibiotics in honey using mixed-mode liquid chromatography with quadrupole time-of-flight mass spectroscopy with heated electrospray ionization[J]. Journal of Separation Science, 2018, 41(16): 3186-3194. DOI:10.1002/jssc.201800230.
[11] SALUTI G, DIAMANTI I, GIUSEPPONI D, et al. Simultaneous determination of aminoglycosides and colistins in food[J]. Food Chemistry, 2018, 266: 9-16. DOI:10.1016/j.foodchem.2018.05.113.
[12] 吴云辉, 严丽娟, 沈鹭英, 等. 混合型离子交换液相色谱-串联质谱法测定蜂蜜中5 种氨基糖苷类抗生素残留[J]. 色谱, 2019, 37(5): 499-504. DOI:10.3724/SP.J.1123.2018.11043.
[13] CHIAOCHAN C, KOESUKWIWAT U, YUDTHAVORASIT S, et al.
Efficient hydrophilic interaction liquid chromatography-tandem mass spectrometry for the multiclass analysis of veterinary drugs in chicken muscle[J]. Analytica Chimica Acta, 2010, 682(1/2): 117-129. DOI:10.1016/j.aca.2010.09.048.
[14] 王志兵, 高杨, 刘洋, 等. 微波辅助衍生-离子液体分散液液微萃取-高效液相色谱法检测牛奶中氨基糖苷类抗生素残留[J]. 现代食品科技, 2014, 30(4): 260-267.
[15] XU X, LIU Z, ZHAO X, et al. Ionic liquid-based microwave-assisted surfactant-improved dispersive liquid-liquid microextraction and derivatization of aminoglycosides in milk samples[J]. Journal of Separation Science, 2013, 36(3): 585-592. DOI:10.1002/jssc.201200801.
[16] BOHM D A, STACHEL C S, GOWIK P. Validation of a method for the determination of aminoglycosides in different matrices and species based on an in-house concept[J]. Food Additives amp; Contaminants: Part A: Chemistry, Analysis, Control, Exposure amp; Risk Assessment, 2013, 30(6): 1037-1043. DOI:10.1080/19440049.2013.775709.
[17] ZHU W X, YANG J Z, WEI W, et al. Simultaneous determination of 13 aminoglycoside residues in foods of animal origin by liquid chromatography-electrospray ionization tandem mass spectrometry with two consecutive solid-phase extraction steps[J]. Journal of Chromatography A, 2008, 1207(1/2): 29-37. DOI:10.1016/j.chroma.2008.08.033.
[18] 刘雪红, 张秀芹, 侯颖, 等. 超高效液相色谱-串联质谱法检测牛奶中7 种氨基糖苷类药物残留[J]. 中国兽药杂志, 2015, 49(3): 48-52.
[19] 龚强, 丁利, 朱绍华, 等. 高效液相色谱-串联质谱法检测乳制品中10 种氨基糖苷类抗生素残留[J]. 色谱, 2012, 30(11): 1143-1147. DOI:10.3724/SP.J.1123.2012.06024.
[20] 孙雷, 张俪, 黄耀凌, 等. 超高效液相色谱-串联质谱法检测动物源食品中8 种氨基糖苷类药物残留[J]. 质谱学报, 2009, 30(1): 60-64.
[21] 钱疆, 余孔捷, 陈健, 等. 液相荧光法检测乳制品中9 种氨基糖苷类药物残留[J]. 福建分析测试, 2011, 20(3): 13-17. DOI:10.3969/j.issn.1009-8143.2011.03.004.
[22] 王炼, 刘少琼. 杨碧霞, 等. 基质固相分散-亲水交互作用色谱-串联质谱法测定牛奶中5 种氨基糖苷类抗生素残留量[J]. 中国食品卫生杂志, 2019, 31(3): 222-226. DOI:10.13590/j.cjfh.2019.03.006.
[23] TAO Y F, CHEN D M, YU H, et al. Simultaneous determination of 15 aminoglycoside(s) residues in animal derived foods by automated solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 135(2): 676-683. DOI:10.1016/j.foodchem.2012.04.086.
[24] 李敏青, 徐娟, 王岚, 等. 固相萃取/高效液相色谱-串联质谱法测定植物性食品中链霉素与双氢链霉素[J]. 分析测试学报, 2019, 38(7): 859-864. DOI:10.3969/j.issn.1004-4957.2019.07.016.
[25] 方秋华, 刘佩怡, 肖田安, 等. 牛奶中氨基糖苷类药物残留量的测定高效液相色谱串联质谱法[C]//2016年动物药品学分会学术年会优秀论文集. 成都: 中国畜牧兽医学会动物药品学分会, 2016: 231-237.
[26] 全德甫, 王甫, 许少坚, 等. 液相色谱串联质谱法测定猪肉中奈替米星、西索米星和小诺霉素的残留量[J]. 中国卫生检验杂志, 2014, 24(10): 1404-1406; 1421.
[27] 安冬. 水产品中氨基糖苷类药物残留检测的液-质联用分析法研究[D].
重庆: 西南大学, 2009: 18-37. DOI:10.7666/d.y1460392.
[28] KAUFMANN A, BUTCHER P, MADEN K. Determination of aminoglycoside residues by liquid chromatography and tandem mass spectrometry in a variety of matrices[J]. Analytica Chimica Acta, 2012, 711: 46-53. DOI:10.1016/j.aca.2011.10.042.
[29] 王小乔, 邱国玉, 杨志敏, 等. 液质联用高通量检测技术基质效应评价与消除[J]. 现代食品, 2020(12): 44-46. DOI:10.16736/j.cnki.cn41-1434/ts.2020.12.017.
[30] LI Z Z, LIU Y Y, CHEN X J, et al. Affinity-based analysis methods for the detection of aminoglycoside antibiotic residues in animal-derived foods: a review[J]. Foods, 2023, 12(8): 1587. DOI:10.3390/foods12081587.
[31] 王帅兵, 曲斌, 耿士伟, 等. 亲水作用色谱-高分辨质谱测定生鲜牛乳中7 种氨基糖苷类药物残留[J]. 动物医学进展, 2017, 38(9): 67-72. DOI:10.3969/j.issn.1007-5038.2017.09.014.
[32] 戴辉, 孟晶, 祖立青, 等. 基于HPLC-MS检测食品中新霉素和潮霉素B
的残留量[J]. 山西农经, 2016(18): 97-98; 101. DOI:10.16675/j.cnki.cn14-1065/f.2016.18.075.
[33] 宓捷波, 张敏, 柴铭骏, 等. 亲水作用色谱-串联质谱法测定动物源食品中10 种氨基糖苷类药物的残留量[J]. 食品研究与开发, 2019, 40(19): 197-204. DOI:10.12161/j.issn.1005-6521.2019.19.036.
[34] DÍEZ C, GUILLARME D, SPÖRRI A S, et al. Aminoglycoside analysis in food of animal origin with a zwitterionic stationary phase and liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2015, 882: 127-139. DOI:10.1016/j.aca.2015.03.050.
[35] ARSAND J B, JANK L, MARTINS M T, et al. Determination of aminoglycoside residues in milk and muscle based on a simple and fast extraction procedure followed by liquid chromatography coupled to tandem mass spectrometry and time of flight mass spectrometry[J]. Talanta, 2016, 154: 38-45. DOI:10.1016/j.talanta.2016.03.045.

