赤水乌骨鸡ADSL基因的组织表达特征及其干扰载体构建



摘要:【目的】探究赤水乌骨鸡胸肌组织中腺苷琥珀酸裂解酶基因(ADSL)表达特征及其目的基因的干扰载体构建,为深入研究畜禽组织肌肉中肌苷酸(IMP)的表达规律及ADSL基因影响畜禽风味的机制提供理论参考。【方法】以不同月龄(3、4、5和6月龄)的赤水乌骨鸡(公鸡和母鸡各半)为试验材料,运用实时荧光定量PCR检测不同月龄及不同性别赤水乌骨鸡胸肌组织中ADSL基因的表达情况;同时根据GenBank中鸡ADSL基因mRNA序列(NM_205529.2)设计4对短发夹RNA(shRNA)干扰序列(shl-ADSL、sh2-ADSL、sh3-ADSL和sh4-ADSL)和1对阴性对照序列(sh-NC)与pGPH1/GFP/Neo载体连接后进行测序,将构建成功的ADSL基因干扰载体转染至成肌细胞,检测并筛选出干扰效率最高的干扰载体。【结果】ADSL基因在不同月龄赤水乌骨鸡胸肌组织中的相对表达量排序为5月龄gt;4月龄gt;6月龄gt;3月龄,赤水乌骨母鸡3月龄母鸡的ADSL基因相对表达量极显著高于公鸡(Plt;0.01,下同),4月龄母鸡ADSL基因的相对表达量显著高于公鸡(Plt;0.05),6月龄母鸡ADSL基因的相对表达量极显著低于公鸡;ADSL基因质粒的测序结果显示干扰质粒构建成功,质粒转染后干扰组及阴性对照均可见绿色荧光,空白对照不发光,说明各重组质粒成功转染赤水乌骨鸡成肌细胞;ADSL基因沉默结果显示,sh2-ADSL沉默效果最佳,干扰效率为90.30%.【结论】赤水乌骨鸡胸肌中ADSL基因的相对表达量随着月龄增加表现为先上升后下降的变化趋势;3、4和5月龄赤水乌骨母鸡ADSL基因的相对表达量高于公鸡,随着月龄增加ADSL基因的相对表达量增加,公鸡和母鸡间的差异减小。成功分离提取赤水乌骨鸡成肌细胞,并筛选出RNA干扰效果最佳载体sh2-ADSL,为后续研究ADSL基因调控鸡肉肌苷酸及风味的分子机制提供参考。
关键词:赤水乌骨鸡;ADSL基因;组织表达;成肌细胞;干扰载体;肉质风味
中图分类号:S831.2文献标志码:A文章编号:2095-1191(2024)01-0226-09
Expression characteristics of ADSL gene in pectoral muscle tissue of Chishui black-bone chicken and the construction of ADSL gene interference vector
YU Huan',WANG Cheng-dong2,LI Hui'*,CHEN You-bo',SHI Yu-shi¹,ZHAO De-peng¹,LONG Xia¹,TAN Qi-song'
('Key Laboratory of Genetic Breeding and Reproduction of Plateau Mountain Animals,Ministry of Education,Guizhou University/Guizhou Provincial Key Laboratory of Animal Genetics and Breeding and Reproduction,Guiyang,Guizhou550025,China;2Bijie Economic Crops Workstation,Bijie,Guizhou551700,China)
Abstract:[Objective]This experiment was carried out to investigate the expression characteristics of adenylosucci-nate lyase gene(ADSL)in the pectoral muscle tissue of Chishui black-bone chicken and to construct the interference vec-tor of the target gene,.which provided atheoretical reference for an in-depth study of theexpressionpattern of inosine mo-nophosphate acid(IMP)in the muscles of livestock tissues and the mechanism by which the ADSL gene affected the fla-vour of livestock and poultry.【Method]Chishui black-bone chicken(half male and half female)of different ages(3,4,5and6months old)were used as experimental materials.The expression ofADSL gene in the pectoral muscle tissue of Chishui black-bone chicken at different ages was detected by real-time fluorescence quantitative PCR.Meanwhile,fourpairs of shorthairpinRNA(shRNA)interference sequences(sh1-ADSL,sh2-ADSL,sh3-ADSL and sh4-ADSL)and onepair of negative control sequences(sh-NC)were designed according to the mRNA sequence of chicken ADSL gene inGen-Bank(NM_205529.2).They were sequenced after ligated with pGPHI/GFP/Neo vector.The constructed ADSL gene inter-fering vectors were transfected into myoblasts,and the most efficient interference vector was detected and screened.【Result]The relative expression level of ADSL gene in the pectoral muscle tissue of Chishui black-bone chicken at diffe-rent months age was in the order of5monthsgt;4monthsgt;6monthsgt;3months.The relative expression level of ADSL genein the pectoral muscle tissue of Chishui black-bone chicken was extremely significantly higher in3-month-old femalesthan inmales(Plt;0.01,the same bellow).The relative expression level ofADSL gene was significantly higher in4-month-old females than in males(Plt;0.05).The relative expression level of ADSL gene was extremely significant lower in6-month-old females than in males.The sequencing results of the ADSL plasmid showed that the interference plasmid wassuccessfully constructed and the green fluorescewas observed in the interference group and the negative control afterplas-mid transfection,and the blank control showed no fluoresce,indicating that each recombinant plasmid successfully trans-fected the myoblasts of Chishui black-bone chicken.The ADSL gene silencing results showed that sh2-ADSL silencingeffect was the optimal,with an interference efficiency of90.30%.【Conclusion]The relative expression level of ADSLgene shows atrend of increasing and then decreasing with the increase of month age.The relative expression level of ADSL gene in the pectoral muscle tissueof females at3,4and5months old higherthan that of males.The relative expres-sion level of ADSL genes increases with increasing month age,and the differences between males and females decrease.The experiment is successful in isolating and extracting myoblast from Chishui black-bone chicken,and screening out thesh2-ADSL vector with the best RNA interference effect.This study provides areference for further research on the molecu-lar mechanism of ADSL gene regulation of meat inosinate and flavor
Key words:Chishui black-boned chicken;ADSL gene;tissue expression;myoblast;interference vectors;meat flavor
Foundation items:Guizhou Science and Technology Support Project(Key Project in Agriculture)(QKHZC〔2022〕034);Scientific Research Projectof Guizhou Department of Education(Qianjiaoji[2022]061)
0引言
【研究意义】腺苷琥珀酸裂解酶(Adenylosucci-nate lyase,ADSL)基因作为影响肌肉肌苷酸(Ino-sine monophosphate acid,IMP)含量的主效基因,在IMP合成代谢中发挥着重要调控作用。诸多研究表明,ADSL基因与畜禽IMP含量具有显著相关性(豆腾飞等,2017;Mao et al.,2018;曹少奇等,2019)。研究发现,ADSL基因在北京油鸡(刘长青等,2008)和静原鸡(虎红红等,2020)胸肌中高表达。因此,加强ADSL基因在不同畜禽组织中的表达研究,对深入研究畜禽组织IMP的表达规律,探究ADSL基因影响畜禽风味的机制及其在畜禽育种中的开发利用具有重要意义。【前人研究进展】ADSL是IMP合成酶系中唯一双功能酶,属于精氨酸琥珀酸裂解酶/富马酸酶C超家族(Tsai et al.,2007),可在同一活化位点有2个重要的生成IMP的非连续催化反应。已有研究表明,ADSL对机体的糖代谢起调节作用(Wang et al.,2021),低能量摄入状态下,发现长白猪肝脏、肌肉和脂肪等组织中ADSL基因表达量显著上调(李庆海等,2013)。季从亮(2005)在ADSL基因中发现5个分布情况与鸡种相关的单核苷酸多态位点;常山等(2008)发现ADSL基因外显子2中有2个中度多态性突变位点;Shu等(2009)发现鸡肌肉中TT基因型突变位点的ADSL基因在IMP含量中占优势;石浩等(2015)预测米易鸡ADSL基因第9外显子与IMP含量显著关联;Mao等(2018)通过检测家鸽胸肌IMP含量,发现ADSL基因的11个外显子中AA和AB基因型为优势基因型,ADSL基因与家鸽肉质和胴体性状有密切的相关性,其单核苷酸多态性可作为家鸽分子标记辅助育种的遗传标记。张梅(2018)研究表明,玫瑰冠鸡ADSL基因表达量与肌肉IMP含量呈显著正相关。此外,ADSL基因在人体和动物体内的分布及表达量有着明显差异,在人体不同组织器官中均能检测到ADSL基因的存在(Kmoch et al.,2000),而北京油鸡的胸肌为ADSL基因的优势表达组织(刘长青等,2008)。【本研究切入点】赤水乌骨鸡作为贵州省优良地方品种,具有肉质鲜美、风味独特、营养丰富等特点,但目前关于ADSL基因在赤水乌骨鸡上的研究鲜有报道。【拟解决的关键问题】利用实时荧光定量PCR检测ADSL基因在赤水乌骨鸡不同发育阶段胸肌组织中的表达情况,探究其在赤水乌骨鸡胸肌发育过程中的表达规律;同时构建ADSL基因干扰载体,验证ADSL基因的干扰效果,以期为研究畜禽组织IMP的表达规律,探究ADSL基因调控肌苷酸的分子机制及其在畜禽育种中的开发利用提供参考依据。
1材料与方法
1.1试验材料
赤水乌骨鸡由贵州省种畜禽种质测定中心提供,受精蛋购自贵州竹香鸡养殖有限公司,将受精蛋放入孵化机,在37.8℃、相对湿度60%的环境中孵化至出壳。选取同一批孵化、体质量相近、健康水平一致的赤水乌骨鸡,屠宰处于不同月龄(3、4、5和6月龄)的赤水乌骨鸡共48只(公鸡和母鸡各半)。胎牛血清(FBS)和Opti-MEMTM购自美国Gibco公司;琼脂糖、0.25%胰蛋白酶、4%多聚甲醛、青链霉素、DAPI细胞核染料、RIPA裂解液、TriX-100通透液、已过滤除菌型PBS缓冲液(pH7.2~7.4)、DMEM-F12培养基和I型胶原酶购自北京索莱宝科技有限公司;LipofectamineM3000转染试剂盒购自美国Invitro-gen生命技术公司;TRIzol试剂盒、DEPC水、TAE、异丙醇、无水乙醇和液氮购自贵州格瑞恩生物技术有限公司;T4DNA连接酶、RevertAid反转录预混液、RT-qPCR Mix和cDNA第一链合成试剂盒购自美国Thermo Fisher公司;DL2000DNAMark购自北京擎科生物有限公司;2×Taq PCR Master Mix、DNA凝胶回收试剂盒和无内毒素小提中量试剂盒购自天根生化科技(北京)有限公司;TOP10感受态细胞购自上海吉玛制药技术有限公司。动物试验由贵州大学试验动物伦理委员会批准(批准号:EAE-GZU-2020-E019)。
1.2组织RNA提取及cDNA合成
使用根据TRIzol试剂盒提取赤水乌骨鸡胸肌组织RNA,检测RNA浓度和纯度,低温保存。采用RevertAid反转录预混液将提取的总RNA逆转录合成cDNA,检测浓度和纯度后保存在-20℃冰箱。
1.3引物设计与合成
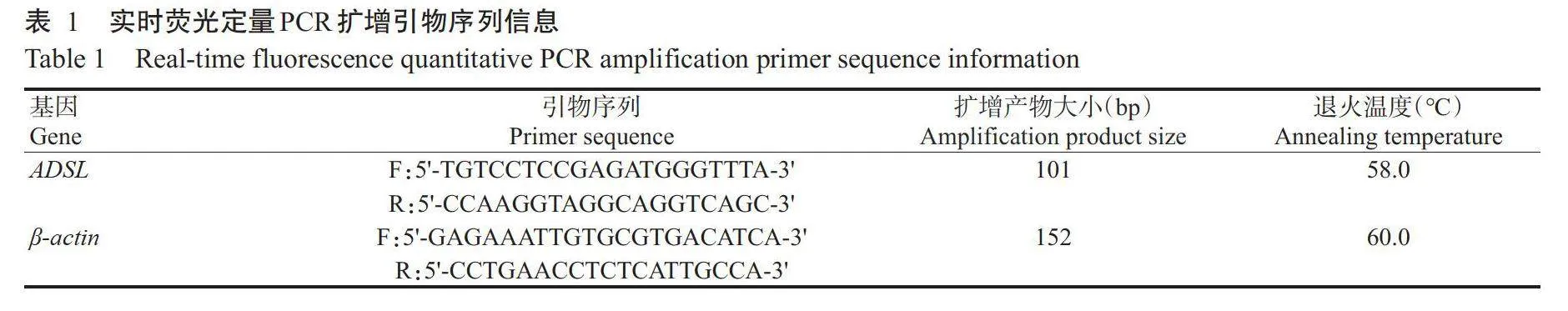
根据GenBank中鸡ADSL和β-actin基因的mRNA序列编码区(CDS),运用Primer Premier5.0设计引物(表1),送至重庆擎科生物技术有限公司合成。
1.4赤水乌骨鸡成肌细胞分离及鉴定
取1日龄生理状态良好的赤水乌骨鸡胸肌,PBS缓冲液(pH7.2~7.4)清洗后剔除脂肪,剪碎后加入大约2倍体积的1%I型胶原酶,37℃摇床消化1~2h,依次过200和400目的细胞筛,在滤液中加入15%血清浓度的DMEM-F12培养基终止消化,1200r/min离心10min弃上清液,利用差速离心法获得成肌细胞,加入完全培养基至细胞瓶和6孔板中对细胞进行培养,观察细胞形态、密度和贴壁状态等。利用成肌细胞中的肌间线蛋白(Desmin),对细胞进行间接免疫荧光鉴定,具体操作参照吴玉麟(2021)。
1.5shRNA引物设计与合成
根据鸡ADSL基因mRNA序列(NM_205529.2),结合shRNA原则,利用在线网站(https:/rnaidesigner.Thermofisher.com/rnaiexpress)设计ADSL基因效率相对较高的4个干扰靶序列与1个阴性对照序列(sh-NC)。设计4对shRNA片段并分别命名为shl-ADSL、sh2-ADSL、sh3-ADSL和sh4-ADSL。在引物正义链端添加Bbs I酶切位点,反义链端添加BamH I酶切位点,中间加入loop结构,引物委托上海吉玛制药技术有限公司合成,ADSL基因shRNA序列信息见表2。
1.6ADSL基因干扰载体构建及鉴定
取10μg pGPH1/GFP/Neo载体,37℃酶切1h,回收目的条带,采用1%琼脂糖凝胶电泳检测并估算浓度,稀释浓度至50ng/μL,酶切体系共150.0μL:10×Buffer G15.0μL、Bbs I3.0μL、BamH I3.0μL、pGPH1/GFP/Neo载体10μL,ddH₂O补足至150.0μL。随后在22℃下连接24h,载体连接体系23.0μL:10×T4连接酶缓冲液2.0μL,经Bbs I/BamHI酶切后的pGPH1/GFP/Neo载体1.0μL,shRNADNA1.0μL,T4连接酶4.0μL,ddH₂O15.0μL。将连接产物转化进TOP10感受态细胞中,涂布在含卡那霉素的LB培养基上,倒置于37℃培养箱培养16h,挑菌扩繁后提取质粒,送至上海生工生物工程股份有限公司测序。
1.7ADSL基因干扰载体转染赤水乌骨鸡成肌细胞
待6孔细胞板中细胞生长汇合度达60%~80%时,提前2h将培养基更换成新鲜的只含15%血清的DMEM-F12培养基,然后用250μLOpti-MEMTM和3.75μL P3000稀释2500ng测序成功后的无内毒素重组质粒,将转染混合液放入37℃培养箱孵育15min后加入到6孔细胞板中培养24~36h,每样品设3个重复。
1.8实时荧光定量PCR检测
使用Trizol试剂盒提取细胞RNA,通过实时荧光定量PCR检测胸肌组织及细胞ADSL基因的表达情况。反应体系10.0μL:cDNA模板0.8μL,上、下游引物各0.5μL,2×SYBRqPCR Master Mix5.0μL,ddH₂O补足至10.0μL。扩增程序:50℃激活2min;95℃预变性2min;95℃15s,58℃15s,进行40个循环;72℃延伸1min。以β-actin为内参基因,对ADSL基因进行实时荧光定量PCR扩增,每个样品重复3次,ADSL基因相对表达量以其对应的阴性对照组(NC)表达量为1,采用24-∆∆Ct法计算目的基因相对表达量。
1.9统计分析
试验数据采用SPSS25.0进行统计分析,组内比较采用单因素方差分析(One-way ANOVA),组间比较采用独立样本T检验,并使用LSD法和邓肯法进行差异显著性检验。
2结果与分析
2.1ADSL基因引物特异性检测结果
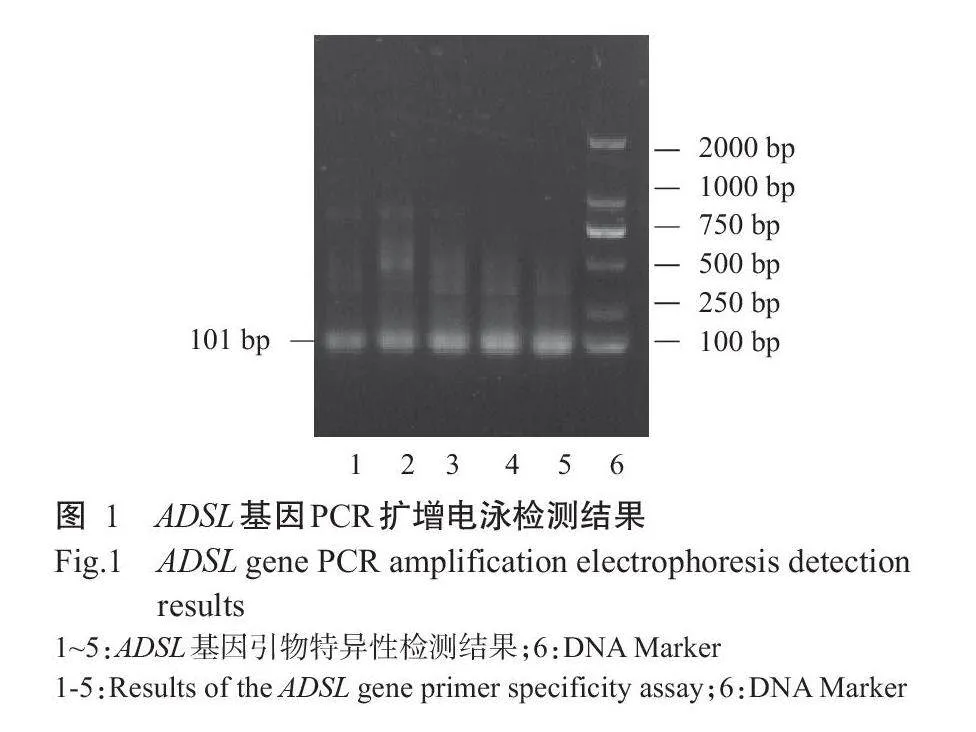
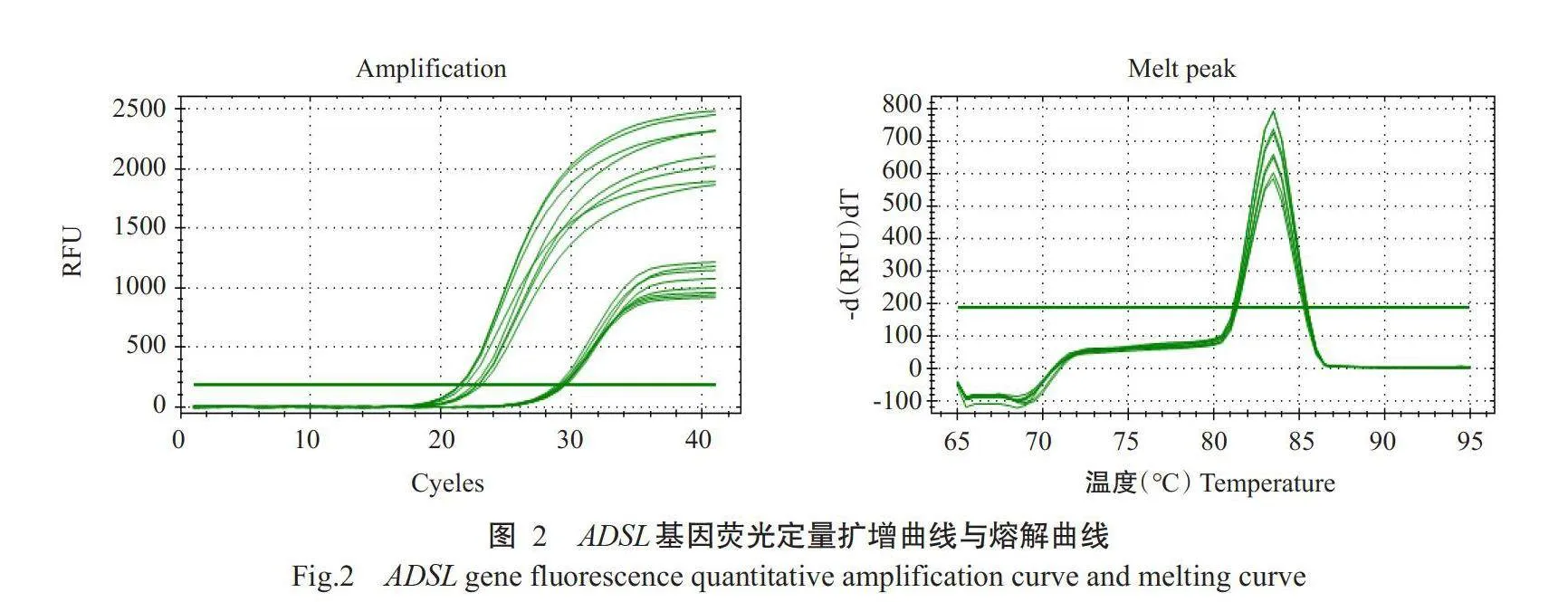
为检测ADSL引物特异性,试验采用1%琼脂糖凝胶电泳检测其扩增产物(图1)显示,目的条带清晰且单一,与预测片段大小一致,不存在非特异性扩增,可用于后续试验。对ADSL基因进行实时荧光定量PCR扩增,由图2可知,扩增曲线表现为平滑的S形,熔解曲线呈单峰,证明引物特异性良好、cDNA第一链质量良好,该引物可用于后续试验。
2.2ADSL基因在赤水乌骨鸡不同时期的表达情况
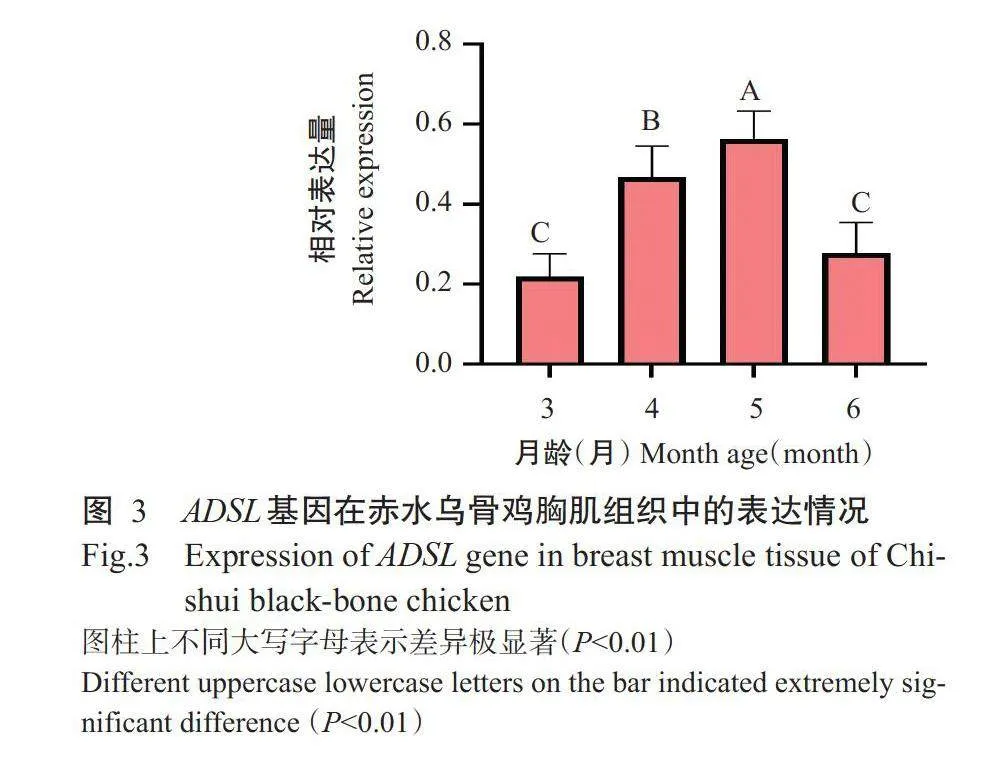
由图3可知,5月龄赤水乌骨鸡胸肌组织ADSL基因的相对表达量最高,3月龄最低,二者间差异极显著(Plt;0.01,下同);4月龄赤水乌骨鸡胸肌组织中ADSL基因的相对表达量极显著高于3月和6月龄,但3月和6月龄间无显著差异(Pgt;0.05,下同),ADSL基因的相对表达量排序为5月龄gt;4月龄gt;6月龄gt;3月龄。
2.3赤水乌骨公鸡和母鸡胸肌组织中ADSL基因表达差异分析结果
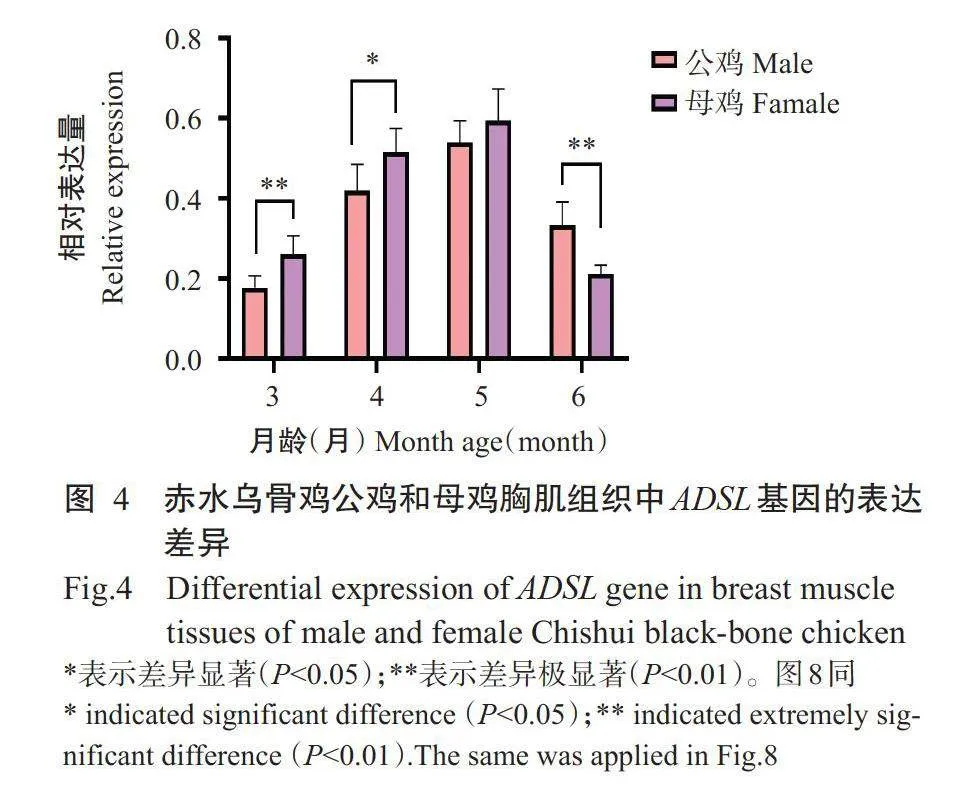
由赤水乌骨鸡公鸡和母鸡ADSL基因表达谱(图4)可知,3、4和5月龄母鸡胸肌组织中ADSL基因的相对表达量均高于公鸡,其中,二者差异在3月龄时达极显著水平,在4月龄达显著水平(Plt;0.05),5月龄差异不显著。6月龄赤水乌骨鸡母鸡ADSL基因的相对表达量极显著低于公鸡。
2.4赤水乌骨鸡成肌细胞培养鉴定结果
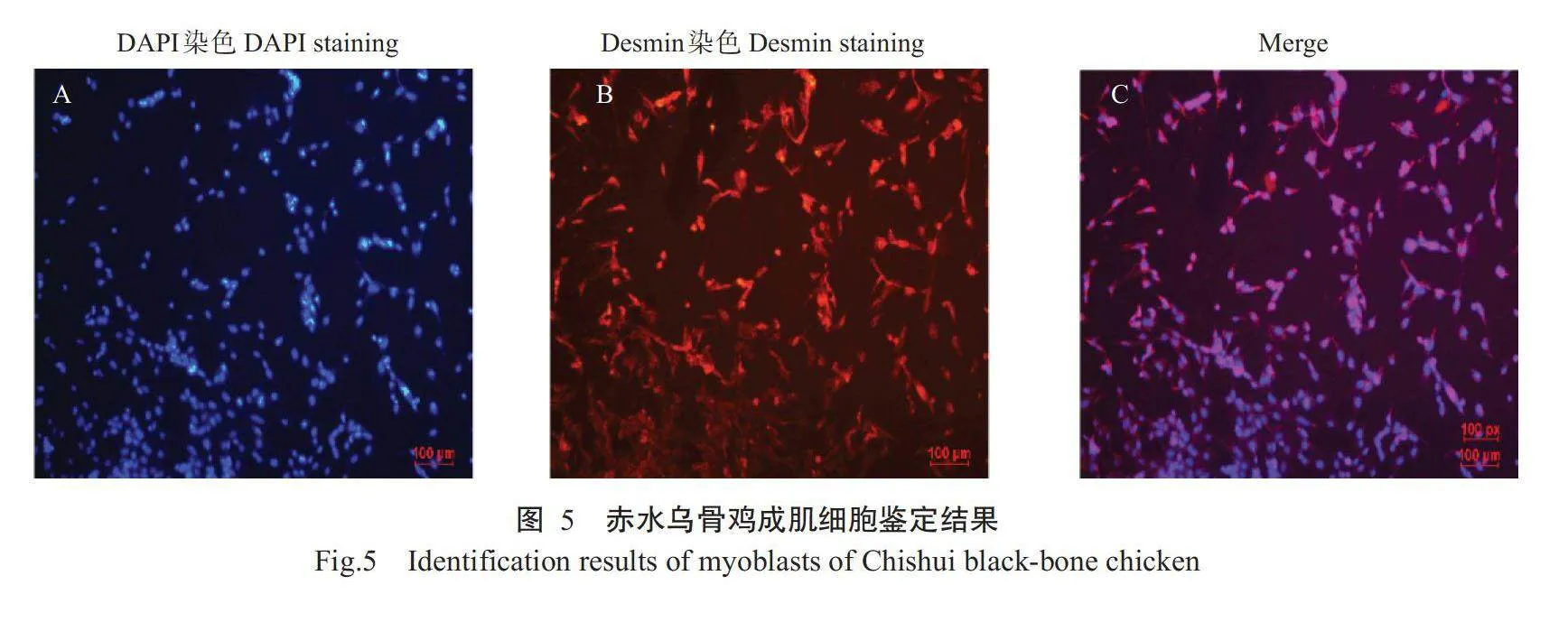
如图5所示,赤水乌骨鸡成肌细胞细胞核在DAPI核染下呈蓝色(图5-A),加入Desmin一抗孵育后的表达为红色(图5-B),细胞质与细胞核之间Merge后完全重合(图5-C),表明成功培养出赤水乌骨鸡成肌细胞,经鉴定细胞纯度在90%以上,可用于后续试验。
2.5测序鉴定ADSL基因的干扰载体结果
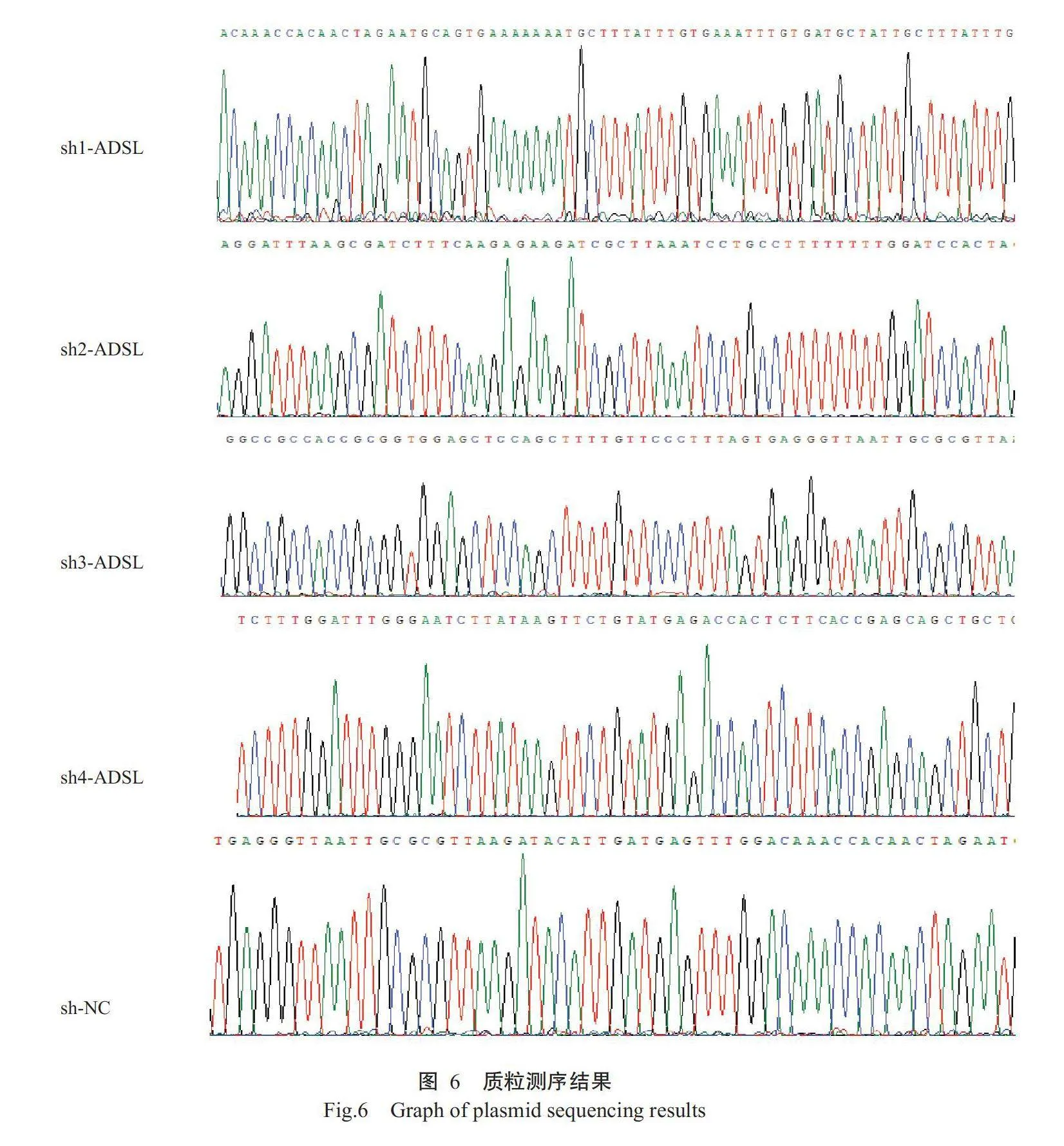
将双酶切后的pGPH1/GFP/Neo载体与目的条带在22℃水浴中连接24h,将连接产物转化进TOP10感受态细胞中,涂布在含卡那霉素的LB培养基上,倒置于37℃培养箱中,培养16h后,挑菌扩繁提取质粒测序,测序比对结果如图6,发现测序结果与预期一致,说明目的重组质粒构建成功。
2.6ADSL基因转染成肌细胞结果
待细胞生长汇合度达80%~90%时,使用Lipo-fectamineIM3000转染试剂盒进行转染,另设阴性对照(sh-NC),上述每个样品设3个生物学重复。结果如图7所示,在倒置显微镜下,干扰组(sh1-ADSL、sh2-ADSL、sh3-ADSL和sh4-ADSL)及阴性对照(sh-ADSL)均可见绿色荧光,空白对照不发光,说明各重组质粒成功转染赤水乌骨鸡成肌细胞。
2.7ADSL基因沉默效果分析结果
将4个沉默表达质粒转染成肌细胞后,以sh-NC为阴性对照,提取细胞RNA逆转录成cDNA后,采用实时荧光定量PCR检测ADSL基因的相对表达量验证干扰效率。如图8所示,发现4个沉默表达质粒均能极显著降低ADSL基因在赤水乌骨鸡成肌细胞中的表达,其中sh2-ADSL转染后ADSL基因的沉默效果最佳,干扰效率为90.30%,因此选择sh2-ADSL作为目的沉默表达质粒进行后续研究。表明ADSL基因的沉默干扰质粒构建成功,可用于后续研究。
3讨论
ADSL基因作为调控家禽IMP的重要候选基因,在鸡的肌肉组织中高表达(栾德琴,2012),对家禽肉质品质的改良有着重要参考价值(豆腾飞等,2017)。IMP作为影响畜禽肌肉风味性状的重要指标,其含量与ADSL基因存在正相关关系(张梅,2018;Mao et al.,2018;曹少奇等,2019)。地方鸡种IMP含量普遍比快大型肉鸡含量高,王珏等(2020)对3个地方鸡种和快大型肉鸡的肌苷酸含量进行比较,发现3种地方鸡更具风味优势。如皋鸡(龚琳琳,2011)和中国环颈雉(吴琼等,2012)的胸肌是ADSL基因的优势表达组织。本研究发现,赤水乌骨鸡胸肌组织中ADSL基因的相对表达量随月龄增加呈先增加后降低的变化趋势,其中3、4和5月龄胸肌中ADSL基因的相对表达量随月龄增加呈极显著上升趋势,5月龄最高。6月龄赤水乌骨鸡胸肌组织ADSL基因的相对表达量极显著低于5月龄。本研究结果与豆腾飞等(2017)的研究结果相反,豆腾飞等(2017)以90~150日龄武定鸡和大围山微型鸡为研究对象,发现胸肌组织中ADSL基因的相对表达量随日龄增加呈下降趋势。推测差异原因与试验材料的品种及生长时期不同有关(黄正洋等,2022)。本研究中,赤水乌骨鸡ADSL基因的相对表达量从3月龄至5月龄持续升高,可能与赤水乌骨鸡表现出的市场规律有关。刘基伟等(2010)研究发现通城猪背腰最长肌ADSL基因的相对表达量从刚出生至65日龄持续升高;龚琳琳(2011)的研究结果表明,如皋鸡胸肌组织中ADSL基因的相对表达量自出生到2周龄持续上升,随后逐渐下降;路宏朝等(2016)通过检测黄羽鸡和略阳乌鸡肌肉中ADSL基因在不同时间(8日胚龄和6、180日龄)的相对表达量发现,随养殖时间的增加,ADSL基因相对表达量呈先上升后下降的变化趋势,且2个鸡种的ADSL基因相对表达量均于6日龄达峰值;曹少奇等(2019)研究发现,不同周龄巨型玫瑰冠鸡与良凤花鸡胸肌的ADSL基因相对表达量均呈先升高后降低的变化趋势,且最终保持在较高水平。本研究结果与曹少奇等(2019)的研究结果相似,ADSL基因在不同日龄的相对表达量呈先升高后降低的变化趋势,推测与肌肉IMP合成变化有关,IMP合成随时间增加逐渐减少,但由于体内IMP不断积累,使其保持在较高的水平(豆腾飞等,2017)。
本研究表明,赤水乌骨鸡母鸡胸肌组织中ADSL基因(除6月龄外)的相对表达量高于公鸡,6月龄母鸡ADSL基因相对表达量低于公鸡。此外,3~5月龄ADSL基因相对表达量在公鸡和母鸡间的差异逐渐减小。该结果与如皋鸡的检测结果不一致,如皋公鸡自出生后ADSL基因相对表达量明显高于母鸡(龚琳琳,2011)。赤水乌骨鸡胸肌组织中ADSL基因相对表达量在母鸡和公鸡均呈先上升后下降的变化趋势,该结果与龚琳琳(2011)发现的如皋公鸡和隐形白羽鸡ADSL基因相对表达量均随日龄增加而增高,至峰值后下降的结果一致。潘爱銮等(2015)研究发现,地方品种洪山鸡、江汉鸡和白羽肉鸡的肌苷酸均表现为母鸡肌苷酸含量高于公鸡。连城白鸭、金陵白鸭及樱桃谷鸭中均整体上表现出母鸭ADSL基因相对表达量极显著高于公鸭(徐善金,2011)。12周龄巢湖鸭不同性别胸肌中IMP含量差异极显著(夏婷婷,2014)。本研究结果(除6月龄外)与上述结论一致,推测这种差异是由于性别不同导致的性激素和代谢情况改变造成(金睿等,2021)。
ADSL基因在家禽胸肌组织中具有高表达量的特点。成肌细胞作为研究肌肉的理想载体,研究其体外分化过程有助于了解骨骼肌的生长和发育(王红娜等,2016)。骨骼肌发育过程主要包括成肌细胞的增殖分化和发育中特异基因的激活,在胚胎形成过程中,成肌细胞就已大量存在,在发育过程中不断增殖生长,最后分化成肌纤维(王红杨,2015)。沉默表达则是由dsRNA诱导的同源性mRNA特异性降解的现象(Imaeda et al.,2019)。很多关于细胞及蛋白的研究都会通过构建目的基因的RNA干扰载体来探究目的基因在不同细胞或不同物种中的功能。本研究在成功提取赤水乌骨鸡成肌细胞的基础上,构建了ADSL基因RNA干扰载体,通过检测ADSL基因相对表达量筛选出最佳干扰载体。至今,关于ADSL基因的研究多集中于ADSL基因与IMP的相关性及ADSL基因的多态性方面,本研究构建的ADSL基因干扰载体可用于研究成肌细胞分化和肌纤维转化,进而为深入探究ADSL基因在细胞和蛋白水平影响肌肉风味的机制提供参考。
4结论
赤水乌骨鸡胸肌中ADSL基因相对表达量随着月龄增加表现为先上升后下降的变化趋势;3、4和5月龄赤水乌骨母鸡ADSL基因的相对表达量高于公鸡,随着月龄的增加ADSL基因相对表达量增加,公鸡与母鸡间的差异减少;推测5月龄的赤水乌骨鸡的风味最好,建议5月龄上市。成功分离提取赤水乌骨鸡成肌细胞,构建ADSL基因干扰细胞系,并筛选出RNA干扰效果最佳载体sh2-ADSL,为后续研究ADSL基因调控鸡肉肌苷酸及风味的分子机制提供参考依据。
参考文献:
曹少奇,张梅,张苗苗,赵宗胜,黄涛,李岩,孙杰,张金生,李坚,廖和荣.2019.巨型玫瑰冠鸡ADSL基因表达及其与IMP的相关分析[J].中国家禽,41(6):46-48.[Cao SQ,Zhang M,Zhang MM,Zhao ZS,HuangT,LiY,Sun JZhang JS,LiJ,Liao HR.2019.Expression of ADSL gene in giant rose-crowned chickens and its correlation analysis with IMP[J].China Poultry,41(6):46-48.]doi:10.16372/j.issn.1004-6364.2019.06.010.
常山,李小成,徐亚欧,杜华锐,曹特,辅宏璞,于春林,蒋小松.2008.优质肉鸡腺苷琥珀酸裂解酶基因第2和第9外显子单核苷酸多态性分析[J].四川畜牧兽医,(6):25-28.[ChangS,LiSC,XuYO,DuH R,Cao T,Fu HP,Yu CL,Jiang XS.2008.Single nucleotide polymorphism analysis of exons2and9of adenosuccinate lyase gene in"high-quality broiler chickens[J].Sichuan Animalamp;Veteri-nary Sciences,(6):25-28.]doi:10.3969/j.issn.1001-8964.2008.06.017.
豆腾飞,汪善荣,佟荟全,刘丽仙,谷大海,徐志强,李琦华,贾俊静,葛长荣.2017.武定鸡和大围山微型鸡肌苷酸含量及ADSL基因表达差异研究[J].中国家禽,39(14):7-10.[Dou TF,Wang SR,Tong QH,Liu LX,Gu DH,Xu Z"Q,LiQH,Jia JJ,Ge CR.2017.Study on inosinic acid content and ADSL gene expression in Wuding chicken and Daweishan mini chicken[J].China Poultry,39(14):7-10.]doi:10.16372/j.issn.1004-6364.2017.14.002.
龚琳琳.2011.鸡ADSL和GARS-AIRS-GART基因遗传变异、表达及其与肌苷酸的相关分析[D].扬州:扬州大学.[Gong LL.2011.Genetic variation and expression of"ADSL and GARS-AIRS-GART genes and their associations"with meat quality in chicken[D].Yangzhou:Yangzhou University.]doi:10.7666/d.Y2050127.
虎红红,黄增文,母童,蔡正云,冯小芳,马正旭,顾亚玲,辛国省,国鹏,张娟.2020.静原鸡肌苷酸沉积与ADSL基因mRNA表达量相关性分析[J].基因组学与应用生物学,39(12):5442-5448.[Hu HH,Huang ZW,Mu T,CaiZ Y,Feng XF,Ma ZX,Gu YL,Xin GS,Guo P,Zhang J.2020.Correlation analysis between inosine deposition and ADSL gene mRNA expression in Jingyuan chicken[J]Genomics and Applied Biology,39(12):5442-5448.]doi:10.13417j.gab.039.005442.
黄正洋,王钱保,黄华云,李春苗,穆春宇,黎寿丰,赵振华.2022.鸡let-7b在不同生长时期及不同组织中的表达及其生物信息学分析与靶基因预测[J].江苏农业学报,38(2):429-437.[Hang ZY,Wang QB,Hang HY,LiC M,Mu CY,LiSF,Zhao ZH.2022.Expression of let-7b in different growth stages and different tissues ochicken and its bioinformatics analysis and target gene prediction[J].Jiangsu Journal of Agricultural Sciences,38(2):429-437.]doi:10.3969/j.issn.1000-4440.2022.02.017.
季从亮.2005.鸡肉IMP含量相关候选基因SNP筛查及其用于地方鸡种群体遗传结构分析的研究[D].扬州:扬州大学.[JiC L.2005.SNP screening in the related candidate gene for IMP contents of chicken and its application in assessment of genetic structure of indigenous chicken breeds[D].Yangzhou:Yangzhou University.]doi:10.7666/d.Y747795.
金睿,曹满湖,黄泰来,温建崇.2021.鸡肉肌苷酸含量影响因素研究进展[J].中国家禽,43(10):87-93.[Jin R,Cao MH,Huang TL,Wen JC.2021.Research progress on influen-cing factors of inosinic acid content in chicken[J].China Poultry,43(10):87-93.]doi:10.16372/j.issn.1004-6364.2021.10.013.
李庆海,范京辉,楼立峰,张伟武,张雷,王欢欢,李祥,章学东.2013.饲粮能量差异对猪ADSL基因mRNA表达的影[J].养猪,(6):57-59.[LiQH,Fan JH,Lou LF,Zhang wW,ZhangL,Wang HH,LiX,Zhang XD.2013.Effect of dietary energy differences on mRNA expression of ADSL gene in pigs[J].Swine Production,(6):57-59.]doi:10.13257j.cnk0i.21-1104/s.2013.06.032.
刘基伟,徐日福,李奎,白丽景,应正宙,唐中林,杨述林.2010.猪ADSL基因克隆及其在部分组织中的mRNA定量表达[J].畜牧与兽医,42(6):22-27.[Liu JW,Xu RF,Li K,Bai LJ,Ying ZZ,Tang ZL,Yang SL.2010.Molecular cloning and mRNA expression of ADSL gene in pig tissues[J].Animal Husbandryamp;Veterinary Medicine,42(6):22-27.]
刘长青,刘帅,包阿东,陆涛峰,吴宏梅,张洪海,唐学玺,关伟军,马月辉.2008.北京油鸡ADSL基因的克隆、表达及其结构与功能分析[J].动物学研究,(4):353-362.[Liu C"Q,Liu S,Bao AD,Lu TF,Wu HM,Zhang HH,Tang X"X,Guan WJ,Ma YH.2008.Molecular clone,expression,structure and function study of Bejing fatty chicken ADSL gene[J].Zoological Research,(4):353-362.]doi:10.3321/j.issn:0254-5853.2008.04.001.
路宏朝,张涛,王令.2016.不同日龄略阳乌鸡肌肉中肌苷酸含量的变化规律[J].江苏农业科学,44(12):277-280.[Lu HZ,Zhang T,Wang L.2016.Changes of inosinic acid content in muscle of Luyang's chicken at different ages[J].Jiangsu Agricultural Science,44(12):277-280.]doi:10.15889/j.issn.1002-1302.2016.12.085.
栾德琴.2012.鸡肌肉生长相关基因的表达与肌苷酸关键酶基因网络调控的构建[D].扬州:扬州大学.[Luan DQ.2012.Analysis of gene expression profiles and construc-tion of network for key genes associated with inosine monophosphate in chicken muscles[D].Yangzhou:Yang-zhou University.]doi:10.7666/d.Y2258561.
潘爱銮,吴艳,申杰,皮劲松,杨林,蒲跃进,梁振华,孙静,张吴,杜金平.2015.不同鸡品种肉质性状比较分析[J].湖北农业科学,54(23):5966-5968.[Pan AL,WuY,Shen J,PiJS,Yang L,Pu YJ,Liang ZH,Sun J,Zhang H,Du JP.2015.Comparative analysis on musclecharacteristics of different breed chicken[J].Hubei Agricultural Sciences,54(23):5966-5968.]doi:10.14088/j.cnki.issn0439-8114.2015.23.044.
石浩,徐亚欧,梅寒,王海,刘红丽,左斌,聂晓庆,胡卫民.2015.米易鸡ADSL基因第2和第9外显子多态性与肌苷酸含量的关联[J].江苏农业科学,43(5):29-32.[Shi H,XuYO,MeiH,WangH,LiuH L,Zuo B,Nie XQ,Hu WM.2015.Association between exons2and9polymor-phisms of ADSL gene and inosinate content in Miyi chicken[J].Jiangsu Agricultural Sciences,43(5):29-32.]doi:10.15889/j.issn.1002-1302.2015.05.008.
王红娜,张英杰,刘月琴.2016.绵羊成肌细胞的纯化、培养、鉴定及其成肌诱导分化研究[J].河北农业大学学报,39(1):94-98.[Wang HN,Zhang YJ,Liu YQ.2016.A study of purification,culture,identification and differen-tiation of sheep myoblast cells[J].Jourmal of Hebei Agri-cultural University,39(1):94-98.]doi:10.13320/j.cnki jauh.2016.0016.
王红杨.2015.胚胎期至生长早期鸡肌肉发育及肌内脂肪沉积蛋白质组研究[D].北京:中国农业科学院.[Wang HY.2015.The proteomic study of muscle development and intramuscular fatdeposition of chickens at embryonic and early growth stages[D].Beijing:Chinese Academy ofAgri-cultural Sciences.]doi:10.7666/d.Y2787516.
王珏,樊艳凤,唐修君,马丽娜,葛庆联,陆俊贤,杨星星,丁红梅,高玉时,龚道清.2020.不同品种肉鸡屠宰性能及肌肉品质的比较分析[J].中国家禽,42(7):13-17.[Wang J,FanYF,TangXJ,MaLN,Ge QL,LuJX,Yang XX,Ding HM,GaoYS,Gong DQ.2020.Comparative analy-sis on slaughter characters and meat quality in different breeds ofbroilers[J].China Poultry,42(7):13-17.]doi:10.16372/j.issn.1004-6364.2020.07.003.
吴琼,杨福合,邢秀梅.2012.中国环颈雉与其它禽类肌肉肌内脂肪含量比较分析[J].特产研究,34(4):1-3.[WuQ Yang FH,Xing XM.2012.Intramuscular fat content(IMF)analysis in Chinese ring-necked pheasants and other avians species[J].Special Wild Economic Animal and Plant Research,34(4):1-3.]doi:10.16720/j.cnki.tcyj.2012.04.020.
吴玉麟.2021.和盈黑鸡PHGDH基因对肉用性状和成肌细胞增殖分化的影响[D].扬州:扬州大学.[Wu YL.2021.Effect of PHGDH gene on meat traits and prolifera-tion and differentiation of myoblastscells in Heying black chicken[D].Yangzhou:Yangzhou University.]doi:10.27441/d.cnki.gyzdu.2021.001296.
夏婷婷.2014.巢湖鸭群体遗传多样性和IMP含量与ADSL基因多态关联分析[D].合肥:安徽农业大学.[Xia TT 2014.Analysis of population genetie diversity and the association of IMP contents with ADSL gene polymor phism in Chaohu duck[D].Hefei:Anhui Agricultural Uni-versity.]
徐善金.2011.鸭ADSL与PurH基因序列特征及表达与肌肉肌苷酸(IMP)含量的相关性分析[D].南京:南京农业大学.[Xu SJ.2011.Analysing seouence characters of ADSL and PurH gene and correlation berweengenes"expression and IMP content in duck[D].Nanjing:Nan-jing Agricultural University.]
张梅.2018.玫瑰冠鸡的冠型鉴定及FABP和ADSL基因与肉品质的关联分析[D].石河子:石河子大学.[Zhang M"2018.Association analysis of FABP and ADSL genes and meat quality coronary identification of Rose crowned chickens[D].Shihezi:Shihezi University.]
Imaeda A,Tomoike F,Hayakawa M,Nakamoto K,Kimura Y,Abe N,Abe H.2019.N⁸-methyl adenosine in siRNA evades immune response without reducing RNAi activity"[J].Nucleosides,Nucleotidesamp;Nucleic Acids,38(12):972-979.doi:10.1080/15257770.2019.1641205.
Kmoch S,Hartmannová H,Stibủrková B,Krijt J,ZikánováM,Sebesta I.2000.Human adenylosuccinatelyase(ADSL),cloning and characterization of full-length cDNA and its isoform,gene structure and molecular basis for ADSL deficiency in six patients[J].Human Molecular Genetics,9(10):1501-1513.doi:10.1093/hmg/9.10.1501.
Mao HG,Cao HY,Liu HH,Dong XY,Xu NY,Yin ZZ.2018.Association of ADSL gene polymorphisms with meat quality and carcass traits in domestic pigeon(Columba livia)[J].British Poultry Science,59(5):604-607.doi:10.1080/00071668.2018.1493188.
Shu JT,Bao WB,Zhang XY,JiC J,Han W,Chen KW.2009.Combined effect of mutations in ADSL and GARS-AIRS-GART genes on IMP content in chickens[J].British"Poultry Science,50(6):680-686.doi:10.1080/00071660903391709.
Tsai M,Koo J,Yip P,Colman RF,Segall ML,Howell P.L.2007.Substrate and product complexes of Escherichia coli adenylosuccinate lyase provide new insights into the enzymatic mechanism[J].Journal of Molecular Biology370(3):541-554.doi:10.1016/j.jmb.2007.04.052.
Wang T,Wiater E,Zhang XM,Thomas JB,Montminy M.2021.Crtc modulates fasting programs associated with1-C metabolism and inhibition of insulin signaling[J].Pro-ceedings of the National Academy of Sciences of the United States of America,118(12):e2024865118.doi:10.1073/pnas.2024865118.
(责任编辑 李洪艳)

