广西H9N2亚型禽流感病毒疫苗候选株的筛选

摘要:[目的】筛选出免疫原性更优的H9N2亚型禽流感病毒(AIV)疫苗候选株用于新型疫苗研发,为加强对H9N2亚型AIV的防控提供技术支持。【方法】以2000—2020年广西地区分离获得的36株H9N2亚型AIV分离株为试验材料,依据HA基因遗传进化分析选择12株不同年份、不同地域及不同宿主来源的H9N2亚型AIV代表株,与目前使用的商品化H9亚型AIV疫苗株(SS株)进行交叉血凝抑制试验(HI)及抗原性分析,根据抗原分析结果选择其中具有不同抗原差异的代表株制备油乳剂灭活疫苗,并分别与商品化H9亚型AIV疫苗(SS株)进行交叉免疫保护试验。【结果】在36株H9N2亚型AIV广西分离株中有31株属于Y280-Like(9.4.1),其中26株属于分支I、5株属于分支I,另外5株属于G1-Like(h9.4.1),与我国常用疫苗株分属于不同进化分支。12株H9N2亚型AIV广西代表性分离株灭活后的HA效
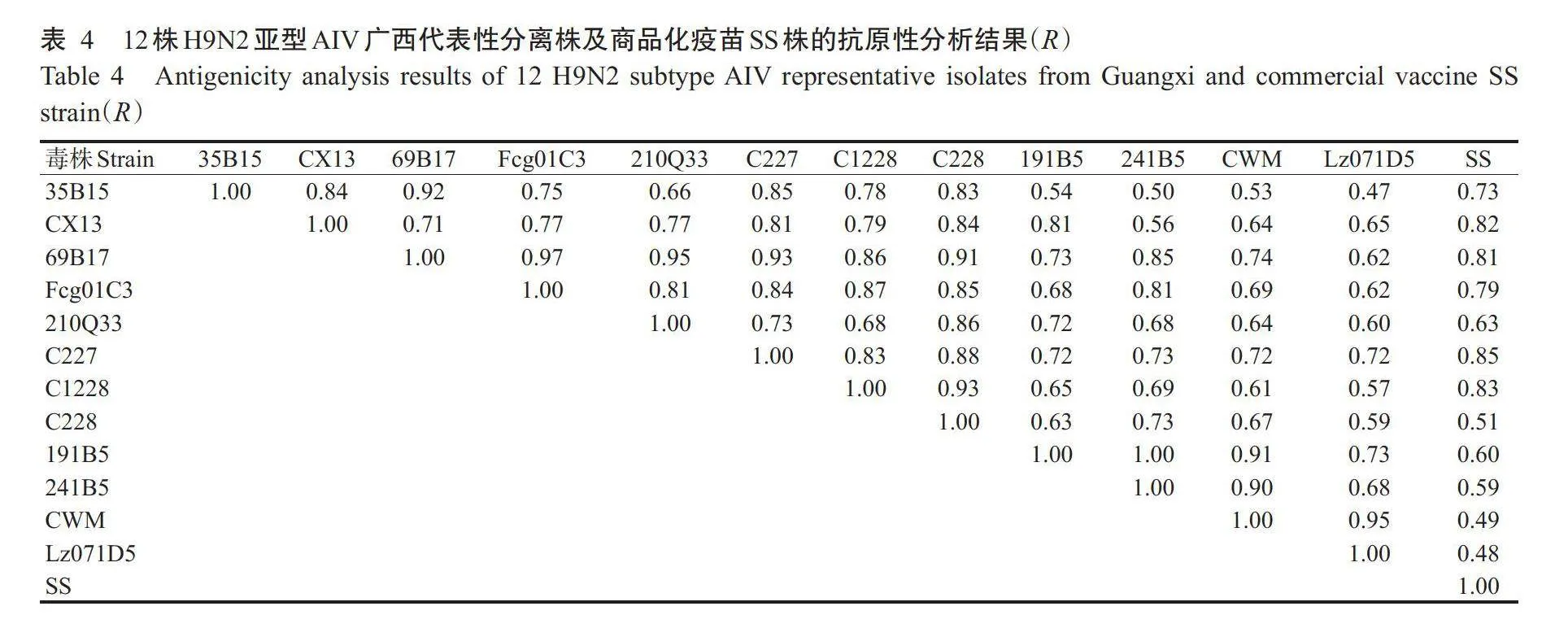
价≥7log2,病毒灭活效果良好,可用于制备油乳剂灭活疫苗,且制备的油乳剂灭活疫苗稳定性和安全性良好。根据交互HI抗体滴度计算出各毒株间的抗原相关值(R),结果发现A/chicken/Guangxi/C227/2015(H9N2)株(简称C227株)与其他毒株的抗原性无明显差异,对应的R在0.72~0.93间波动;疫苗交叉保护试验结果也表明,C227株制备的油乳剂灭活疫苗对不同毒株的免疫保护率均高于80%,且免疫保护效果优于A/chicken/Guangxi/CX/2013(H9N2)株(简称CX13株),说明C227株更适合作为H9N2亚型AIV灭活疫苗的候选株。【结论】基于抗原性分析和免疫原性测定筛选出的A/chicken/Guangxi/C227/2015(H9N2)株对广西地区绝大部分H9N2亚型AIV流行株的免疫保护效果良好,可作为疫苗候选株用于研制新型H9N2亚型AIV疫苗。
关键词:禽流感病毒(AIV);H9N2亚型;油乳灭活疫苗;抗原相关性;疫苗交叉保护
中图分类号:S852.659.5文献标志码:A文章编号:2095-1191(2024)01-0243-10
Screening of vaccine candidate strains of H9N2subtype avian influenza virus in Guangxi
LI Meng',XIEZhi-xun'°,LI Dan',XU Qian',LUO Si-si¹,ZHANG Min-xiu¹,XIE Li-ji¹,HUANG Chao2,SHEN Qian-cheng2,HUANG Jiao-ling¹
('Guangxi Veterinary Research Institute/Guangxi Key Laboratory of Veterinary Biotechnology/Key Laboratory of China (Guangxi)-ASEAN Cross-border Animal Disease Prevention and Control,Ministry of Agriculture and Rural Affairs, Nanning,Guangxi530001,China;2Guangxi Jinling Agriculture and Animal Husbandry Group Company Limited Nanning,Guangxi530049,China)
Abstract:[Objective]The vaccine candidate strains of H9N2subtype avian influenza virus(AIV)with better immu-nogenicity were screened for new vaccine research and development,which provided technical support for strengthening the prevention and control of H9N2subtype AIV.【Method]A total of36H9N2subtype AIV strains isolated in Guangxi from2000to2020were used as experimental materials.Twelve representative H9N2subtype AIV strains from different years,different regions and different host sources were selected according to the HA genetic evolution analysis.The cross hemagglutination inhibition test(HI)and antigenicity analysis were carried out with the commercial H9N2subtype AIV vaccine strain(SS strain)currently used.According to the results of antigenicity analysis,the representative strains with different antigenic differences were selected to prepare oil emulsion inactivated vaccine and tested for cross-immunoprotection with the commercial H9subtype AIV vaccine strain(SS strain),respectively.【Result]Among36strains of H9N2subtype AIV in Guangxi,31strains belonged to Y280-Like(9.4.1),of which26strains belonged to branchI,5strains belonged tobranch I,and the other5strains belonged to G1-Like(h9.4.1),which were different from theevolutionary branchof the commonly used vaccine strains in China.The HAtiter of12H9N2subtype AIV representa-tive isolates in Guangxi after inactivation was≥7log2,and the virus inactivation effect was good,which could be used to prepare inactivated oil emulsion vaccine,and the prepared inactivated oil emulsion vaccine had good stability and safety The antigen correlation value(R)of each strain was calculated acording to the titers of cross-HI antibody.The results showed that there was no obvious difference in antigenicity between A/chicken/Guangxi/C227/2015(H9N2strain)(re-ferred to as C227strain)and otherstrains,and the corresponding Rfluctuated between0.72and0.93.The results of vac-cine croSS-protection test also showed that the immune protection rate of inactivated oil emulsion vaccine prepared by C227strain was higher than80%for different strains,and the immune protection effect was better than that of A/chicken/Guangxi/CX/2013(H9N2strain)(referred to as CX13strain),which indicated that C227strain was more suitable as acandidate strain for H9N2subtype AIV inactivated vaccine.【Conclusion]A/chicken/Guangxi/C227/2015(H9N2)strain screened based on antigenicity analysis and immunogenicity determination has agood immune protection effect on most H9N2subtype AIV epidemic strains in Guangxi,and can be used as acandidate vaccine strain to develop anew H9N2subypeAIV vaccine
Keywords:avian influenzavirus(AIV);H9N2subtype;inactivated oil emulsion vaccine;antigen correlation;cross protectionof vaccine
Foundation items:Guangxi Key Research and Development Plan Project(GuikeAB21076004);Guangxi Natural Science Foundation(2022GXNSFAA035445,2021GXNSFBA196031);Guangxi Bagui Scholars Project(2019-A50)
0引言
【研究意义】禽流感病毒(Avian influenza virus,AIV)为单股负链RNA病毒,其基因组由8个独立基因片段组成(Sun and Liu,2015;王艳文等,2022)。H9N2亚型属于低致病性AIV(LPAIV)(Peacock et al.,2019),其感染后虽然不会造成禽类大量死亡,但由于传播能力极强、存在范围极广,可引起家禽产蛋性能和机体免疫力下降,继而可能与其他病原发生混合感染而造成死亡率上升,给养禽业带来巨大经济损失(李孟等,2022)。疫苗接种仍是预防禽流感(Avian influenza,AI)发生与传播的最有效措施,但H9N2亚型AIV抗原不断变异,导致原有疫苗已无法提供完全免疫保护(Cao et al.,2022;Zheng et al., 2022)。因此,从当前流行毒株中筛选新的H9N2亚型AIV疫苗候选株用于新型疫苗研发,对有效防控AI具有重要意义。【前人研究进展】H9N2亚型AIV于1966年首次在美国威斯康星州的火鸡群中分离获得(Huang et al.,2022);我国广东省于1994年首次报道分离到H9N2亚型AIV(陈伯伦等,1997),此后迅速在各地区的鸡群中传播。HA基因不断进化造成AIV抗原变异是导致原有疫苗无法提供完全免疫保护的主要原因(赵宇,2018;赵锦华,2020;王勋等,2022)。已有研究对我国2011—2021年间安徽(胡晓苗等,2015)、山东(袁小远等,2018;高斌等,2019)、江苏(孙王杨吉等,2019)、广东(宋才良等,2020)和广西(Dong et al.,2022)等多个省(区)分离鉴定的H9N2亚型AIV进行HA基因测序及系统进化分析,结果发现大部分毒株的基因序列已发生变异,与现有疫苗株分别处于不同的进化分支上。此外,宿春虎(2014)对2011—2013年华东地区H9N2亚型AIV抗原性进行分析,发现分离株与疫苗株的抗原性存在明显差异;魏延迪(2016)研究证实,2009—2013年间分离获得的H9N2亚型AIV与鸡群商业疫苗的抗体反应很差;马静(2020)从2008—2019年间分离的H9N2亚型AIV中挑选57株毒株进行抗原性分析,结果表明分离株聚类为2个不同的抗原群,且与疫苗株存在明显的抗原性差异。我国当前使用的H9N2亚型AI疫苗种类繁多,接种免疫后虽然都能促使鸡体产生较高的抗体水平,但发生免疫失败的案例也十分常见(张伟等,2015;何家辉等,2022)。【本研究切入点】在我国野鸟和家禽中流行的绝对大多数H9N2亚型AIV,其HA基因遗传进化显示分别属于不同亚系或分支(李玉磊,2020;李孟等,2022),毒株多样性给H9N2亚型AI的防控增加了难度。近年来的H9N2亚型AIV监测数据显示,当前广西流行的H9N2亚型AIV在遗传进化方面已发生显著变化,与现有疫苗株分属于不同的进化分支(李丹,2017;李云燕,2020);同时现有疫苗免疫产生的高抗体水平对鸡源H9N2亚型AIV分离株的中和作用能力减弱,而AIV在免疫鸡群体内的复制速度和传播水平逐渐增强(苏海龙等,2019;张义冉等,2019),因此亟待筛选新的H9N2亚型AIV流行株用于新型疫苗研发。【拟解决的关键问题】以2000—2020年从广西地区分离获得的36株H9N2亚型AIV分离株为试验材料,综合HA基因遗传进化分析和抗原性分析,筛选出免疫原性更优的H9N2亚型AIV疫苗候选株用于新型疫苗研发,为加强对H9N2亚型AIV的防控提供技术支持。
1材料与方法
1.1试验材料
从36株已纯化的H9N2亚型AIV广西分离株(由广西兽医生物技术重点实验室于2000—2020年分离获得)中筛选出12株代表株。H9N2亚型AIV油乳剂灭活疫苗及其对应抗原购自肇庆大华农生物药品有限公司;Tween-80和Span-80购自生工生物工程(上海)股份有限公司;β-丙内酯(β-propionolac-tone,BPL)购自德国Merck公司;SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司;4周龄SPF鸡由广西兽医生物技术重点实验室自行孵化并隔离饲养于负压SPF鸡隔离器。动物试验由广西兽医研究所动物伦理委员会批准,批准号GVRI-202203021。
1.2代表株筛选及关键氨基酸分析
对2000—2020年间分离获得的36株H9N2亚型AIV广西分离株与我国常用疫苗株[A/chicken/Guangdong/SS/94(H9N2)(SS株)、A/chicken/Guangxi/10/99(H9N2)(Re-2株)、A/chicken/Shanghai/F/98(H9N2)(F株)和A/chicken/Shandong/6/96(H9N2)(SD696株)],以及H9N2亚型AIV各分支代表株进行HA基因序列比对分析,基于推导氨基酸序列相似性构建遗传进化树,综合考虑分离株的分离时间、地点、宿主和遗传进化分析结果等因素,筛选出12株已纯化的H9N2亚型AIV代表株,同时对H9N2亚型AIV代表株的HA蛋白关键氨基酸位点进行分析。
1.3油乳剂灭活疫苗制备
将12株H9N2亚型AIV代表株以无菌PBS倍比稀释后,按0.2mL/枚的剂量接种至9~11日龄SPF鸡胚尿囊腔,35℃培养96h,收集24h后死亡及未死亡的鸡胚尿囊液,通过血凝试验(HA)测定HA效价。按0.05%的剂量混入病毒灭活剂BPL进行灭活处理,以灭活后的尿囊液原液接种SPF鸡胚进行安全性检验。然后参照谢芝勋等(2001)、韦悠等(2011)的方法制备油乳剂灭活疫苗。
1.4病毒抗原性分析
1.4.1多抗血清制备将筛选出的12株H9N2亚型AIV代表株制备成油乳灭活疫苗,然后与商品化H9亚型AIV疫苗(SS株)分别经颈部皮下免疫注射28日龄SPF鸡,免疫剂量1.0mL/羽,每组免疫5羽。免疫21d后采集血样分离血清。
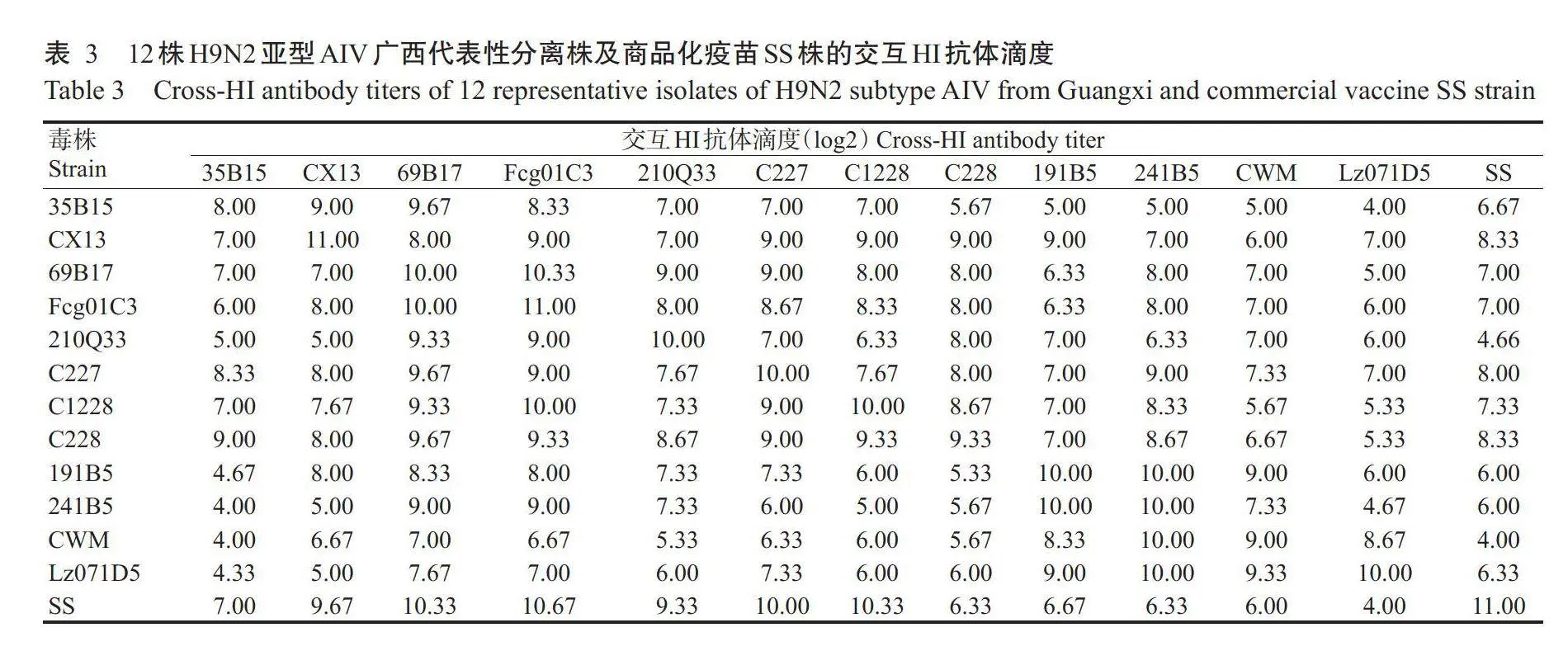
1.4.2交叉血凝抑制试验(HI)及抗原性分析以1.4.1制备的免疫血清与12株H9N2亚型AIV代表株及商品化疫苗SS株进行交叉HI试验,根据交叉HI试验结果计算各毒株间的抗原相关值(R);然后根据R排序筛选出5株代表株按常规方法制备油乳剂灭活疫苗。
1.5疫苗交叉保护试验
根据抗原性分析结果,选择5株不同抗原性差异的代表株与商品化疫苗SS株进行疫苗交叉保护试验。将5株代表株分别制备油乳剂灭活疫苗,使用制备的油乳剂灭活疫苗和商品化H9亚型AIV疫苗(SS株)分别免疫6组21日龄的SPF鸡,每组免疫5羽。免疫21d后,以筛选的5株代表株分别对各免疫组(5羽)及空白对照组(5羽)的SPF鸡进行鼻腔感染,攻毒量为10°EID₃/羽,观察攻毒后14d内各组试验鸡的临床症状,并于攻毒后第1、3、5、7、10和14d采集咽喉腔及泄殖腔棉拭子,通过鸡胚分离方法检测所样品的排毒情况。
1.6免疫后抗体维持水平监测
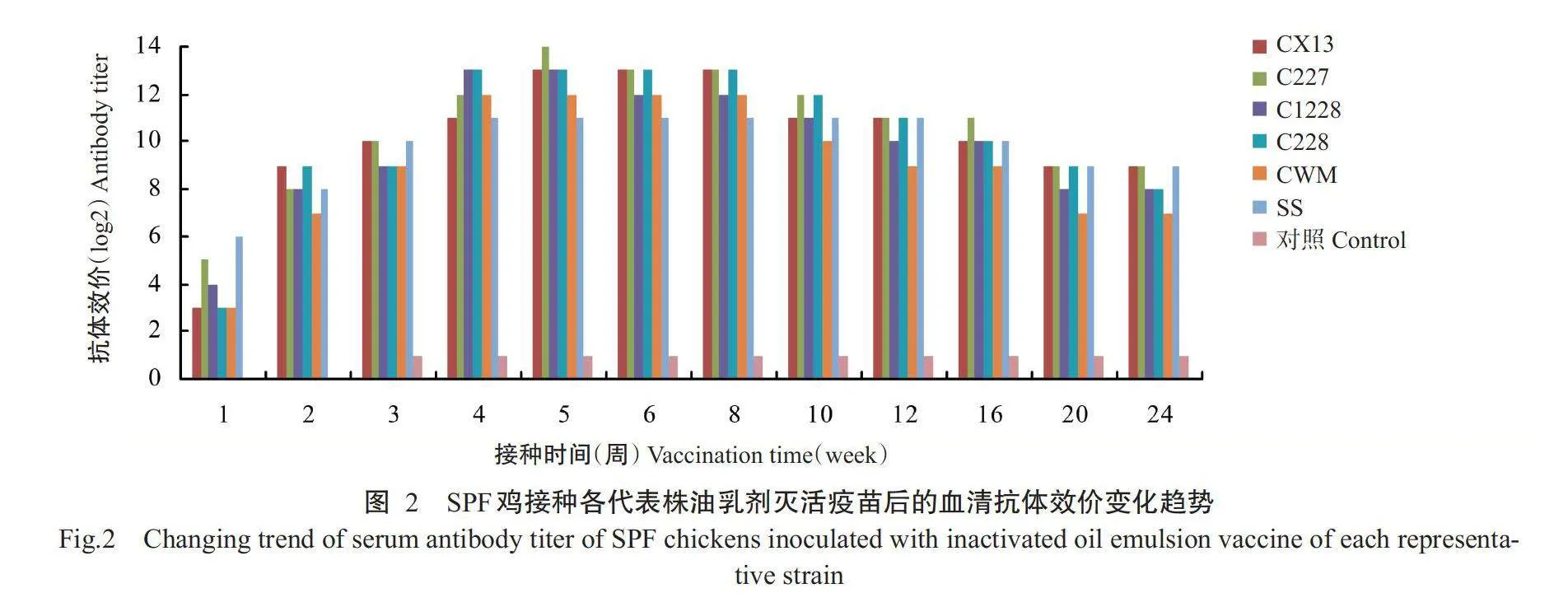
以筛选的5株H9N2亚型AIV代表株制备油乳剂灭活疫苗,与商品化H9亚型AIV疫苗(SS株)分别免疫10羽21日龄的SPF鸡,于免疫后第1、2、3、4、5、6、8、10、12、16、20和24周采集各免疫组试验鸡血样制备血清,通过对应的抗原测定血清抗体效价。
2结果与分析
2.1代表株筛选及HA蛋白关键氨基酸位点分析结果
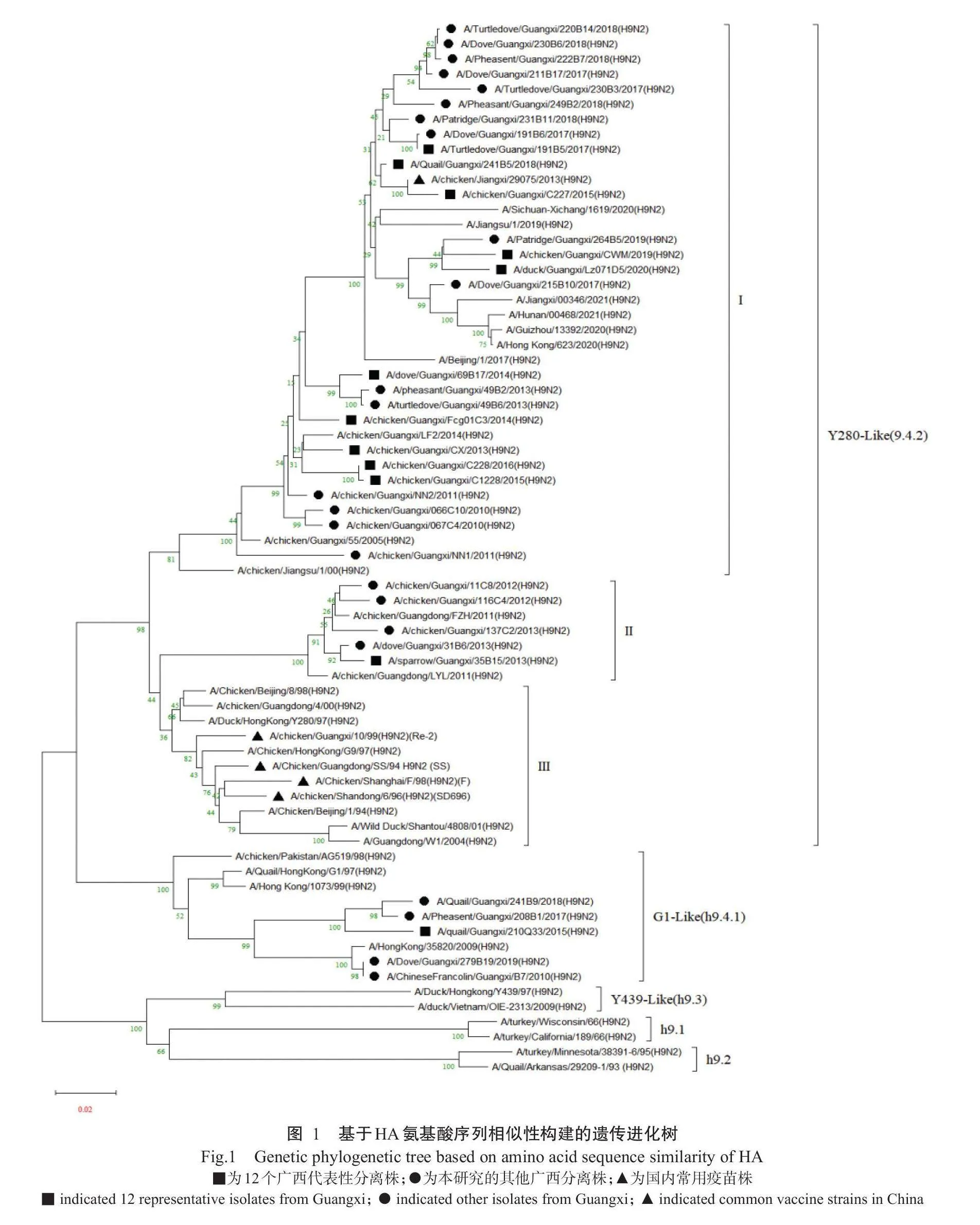
基于HA氨基酸序列相似性构建包含36株H9N2亚型AIV广西分离株、我国常用疫苗株及H9N2亚型AIV各分支代表株在内的遗传进化树,结果(图1)显示,36株H9N2亚型AIV广西分离株中有31株属于Y280-Like(9.4.1),其中26株属于分支I、5株属于分支,另外5株属于G1-Like(h9.4.1)。由于上述3个分支的毒株在广西地区普遍流行,且与疫苗株间的亲缘关系均较远,因此从3个不同分支筛选12株广西表代性分离株[A/duck/Guangxi/Lz071D5/2020(H9N2)简称Lz071D5、A/quail/Guangxi/241B5/2018(H9N2)简称241B5、A/sparrow/Guangxi/35B15/2013(H9N2)简称35B15、A/chicken/Guangxi/CWM/2019(H9N2)简称CWM、A/turtledove/Guangxi/191B5/2017(H9N2)简称191B5、A/chicken/Guangxi/CX/2013(H9N2)简称CX13、A/chicken/Guangxi/Fcg 01C3/2014(H9N2)简称Fcg01C3、A/dove/Guangi/33/2015(H9N2)简称210Q33],与广西地区应用69B17/2014(H9N2)简称69B17、A/chicken/Guangi/广的商品化疫苗株A/chicken/Guangdong/SS/94C227/2015(H9N2)简称C227、A/chicken/GuangHi/9N2)(SS株)进行HA蛋白关键氨基酸位点分C228/2016(H9N2)简称C228、A/chicken/Guangi/,结果(表1)表明,35B15和241B5株的第145位C1228/2015(H9N2)简称C1228、A/quail/Guangxi/2氨10基酸发生漂变(145S→N),C227、191B5、CWM和Lz071D5株则表现为145s→D,145S是H9N2亚型AIV HA蛋白中具有血凝抑制特性的抗原位点,其发生漂变可能会导致毒株抗原性发生改变,但具体机理尚未明确(陈陆等,2011)。在部分代表株HA蛋白中还发现第198位氨基酸发生改变,其中,35B15、CX13和69B17株表现为198T→V,Fcg01C3、C1228、C228和CWM株表现为198T→A,而CWM株表现为198T→K。
2.2油乳剂灭活疫苗制备效果
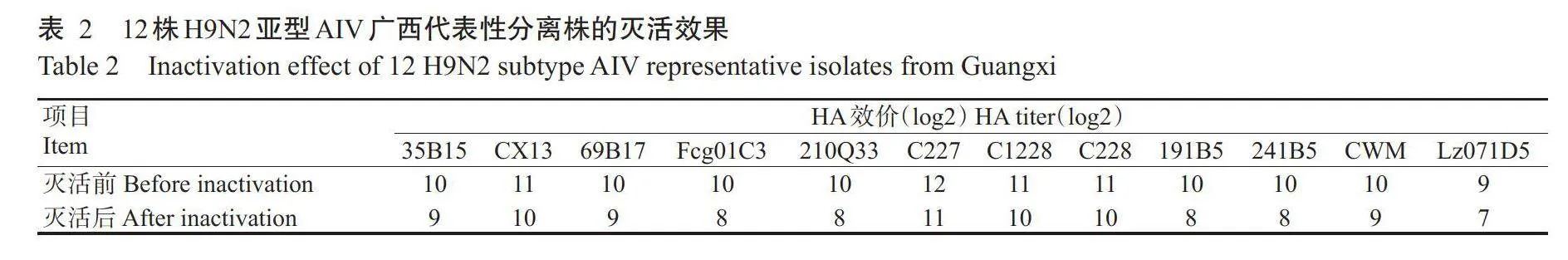
用于油乳剂灭活疫苗制备的12株H9N2亚型AIV广西代表性分离株灭活前的HA效价≥9log2,由于病毒灭活会对其高级结构造成破坏,同时使病毒失去感染活性,病毒灭活的最佳效果为灭活前后HA效价下降1log2~2log2。12株H9N2亚型AIV广西代表性分离株灭活后的HA效价≥7log2(表2),表明病毒灭活效果良好。将灭活后的鸡胚尿囊原液接种至SPF鸡胚盲传2代后,经HA试验验证病毒灭活完全,可用于制备油乳剂灭活疫苗,且制备的油乳剂灭活疫苗稳定性和安全性良好。
2.3病毒抗原性分析结果
由表3可知,12株H9N2亚型AIV广西代表性分离株及商品化疫苗SS株的交互HI抗体滴度集中在4log2~11log2。根据交互HI抗体滴度计算出各毒株间的R,结果(表4)显示,C227株与其他毒株的抗原性无明显差异,对应的R在0.72~0.93间波动,在13株毒株中其抗原性最高;Lz071D5株与其他毒株的抗原性差异较明显,R的波动范围在0.47~0.95;CWM株与商品疫苗SS株的R仅为0.49,是所有鸡源H9N2亚型AIV分离株(CWM、CX13、Fcg01C3、C227、C228和C1228)中R最低的毒株;野鸟源H9N2亚型AIV分离株(241B5、35B15、191B5、69B17和210Q33)与其他毒株间的R也存在明显差异。
2.4疫苗交叉保护试验结果
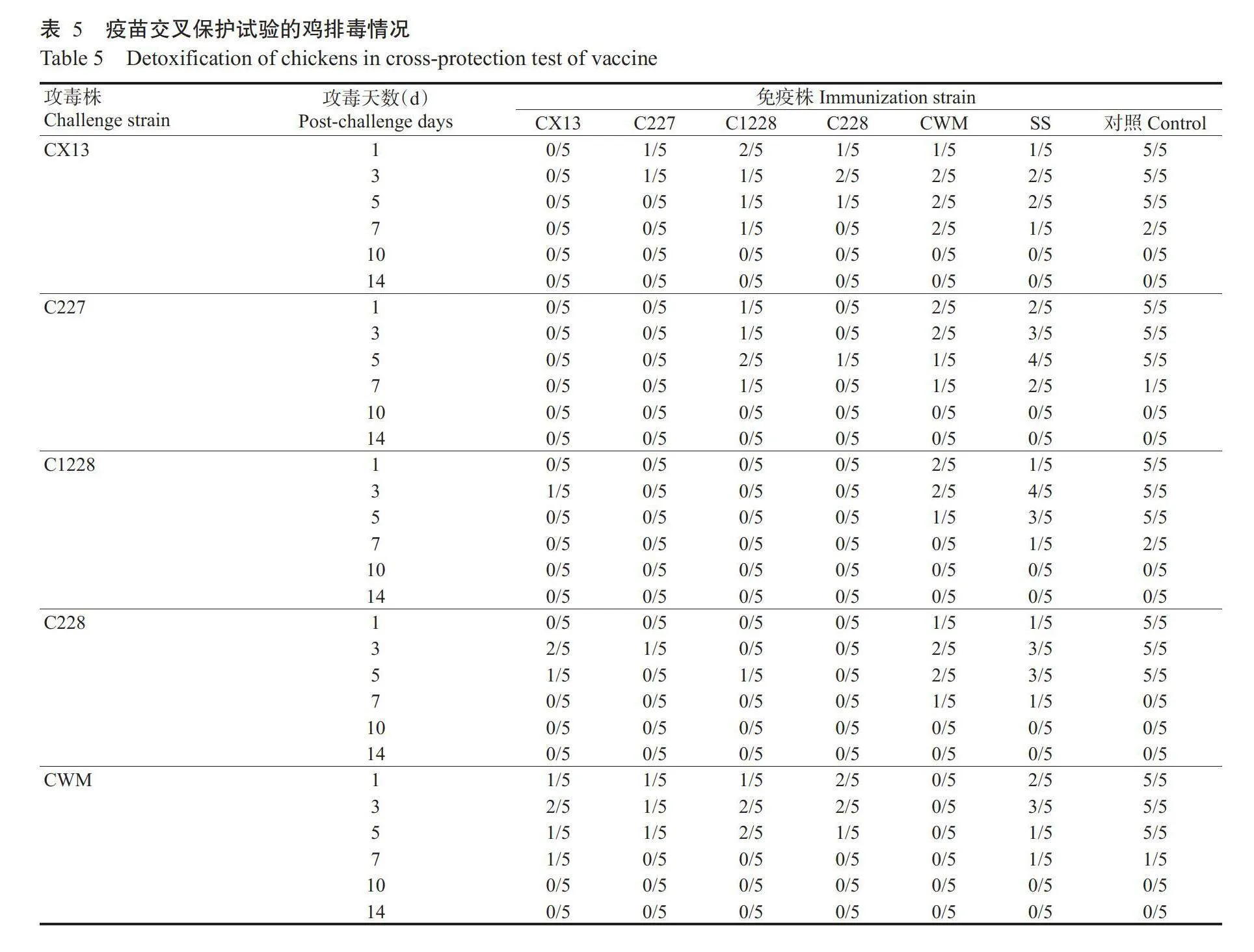
依据病毒抗原性分析结果,选择CX13、C227、C1228、C228和CWM等5株代表株与商品化疫苗SS株进行疫苗交叉保护试验。以5株代表株制备的油乳剂灭活疫苗和商品化H9亚型AIV疫苗(SS株)分别免疫SPF鸡,免疫21d后,以5株代表株的鸡胚尿囊液按10⁶EID₃/羽的剂量滴鼻感染免疫组和对照组试验鸡,其排毒情况如表5所示。对照组所有试验鸡在攻毒后第1d全部排毒,一直持续到攻毒后第5d,从攻毒后第7d起开始有所下降,且部分试验鸡开始停止排毒。商品化H9亚型AIV疫苗(SS株)免疫组试验鸡在5株代表株攻毒后7d内均存在较高的排毒水平,C227和C1228株攻毒组甚至在攻毒后第3和5d仍有60%~80%的试验鸡存在排毒现象,说明商品化疫苗(SS株)对CX13、C227、C1228、C228和CWM等5株代表株的免疫保护效果不理想。C227和CX13株免疫组对其他毒株的攻毒免疫保护率在攻毒后第1d均在80%以上,且整个疫苗交叉保护试验周期内C227株免疫组对C1228、C228和CWM株的整体免疫保护效果优于CX13株,表明C227株较CX13株更适宜作为疫苗候选株。
2.5免疫后抗体水平监测结果
以5株代表株制备的油乳剂灭活疫苗和商品化H9亚型AIV疫苗(SS株)免疫SPF鸡后的抗体水平变化趋势如图2所示。在免疫后第2周,各免疫组试验鸡的血清抗体效价均在6log2以上;至免疫后第4周,所有免疫试验鸡的血清抗体效价均达最大值,其中C227株油乳剂灭活疫苗免疫组的血清抗体效价达到12log2;从免疫后第10周开始,所有免疫试验鸡的血清抗体水平开始缓慢下降;至免疫后第24周,H9亚型AIV疫苗(SS株)及C227和CX13株油乳剂灭活疫苗免疫组试验鸡的血清抗体效价仍维持在9log2以上,其他代表株油乳剂灭活疫苗免疫组试验鸡的血清抗体效价维持在6log2以上。
3讨论
由于AIV是由8个不同的独立基因片段构成,不仅在转录复制过程中可能产生高频率错配形成变异株,不同亚型AIV基因节段相互交换(基因重排)时也极易产生新的变异株(谭伟等,2014;赵聪慧等,2019;郑丽荣等,2019)。此外,疫苗免疫压力使得AIV更易发生抗原漂移,导致H9N2亚型AIV在全世界范围内分布极广泛,且具有频繁变异的特点(张婷钰,2019)。我国于1999年首次批准并使用H9N2亚型AIV灭活苗,此后H9N2亚型AIV单苗和联苗陆续被批准生产和上市(Dong et al.,2022)。但近年来经常在已免疫H9N2亚型AIV疫苗的家禽中分离出H9N2亚型AIV,且其抗原性也发生明显变化(Li et al.,2005;邢燕茹等,2021),说明现有疫苗对当前流行株的免疫保护效力在逐渐下降,已无法满足养殖生产的需要,因此亟待筛选出新的H9N2疫苗候选株用于研制新型疫苗,以应对H9N2亚型AIV变异株的防控。
HA蛋白主要诱导保护性体液免疫应答,AIV变异与HA蛋白密切相关(黄艳艳等,2018)。疫苗株的HA基因突变及抗原性差异是影响AIV疫苗免疫效果的关键因素之一(许传田等,2012;丁芳等,2022),而使用当前流行株研发疫苗是预防和控制AIV流行的最有效途径。本研究从HA基因遗传进化分析处于不同分支的H9N2亚型AIV广西分离株中选取12株代表株,与商品化疫苗SS株进行抗原性分析及疫苗交叉保护试验,以期从遗传进化和抗原交叉保护角度入手,尽可能全面评价分离株与商品化疫苗株对不同进化分支毒株的交叉免疫保护效果,筛选出新的疫苗候选株。抗原性分析结果表明,CX13、C227株与商品化疫苗SS株的R分别为0.82和0.85,无明显差异;免疫交叉保护试验结果表明,商品化疫苗SS株对CX13、C227株的免疫保护率分别为60%和20%。由此可见,抗原性分析对于评价疫苗保护效率研究具有一定参考价值,但不能作为疫苗候选株筛选的唯一评判标准(万晓朋,2010),进一步证实评价疫苗保护效果必须经过大量动物免疫保护试验,严格根据毒株的抗原性和交叉免疫保护作用等多方面综合评价结果来筛选疫苗候选株。
本研究基于HA基因遗传进化分析结果从37株H9N2亚型AIV广西分离株中筛选出12株H9N2亚型AIV代表株,经抗原性和免疫原性分析发现C227株对其他11株代表株的R在0.72~0.93,无明显抗原性差异,且对C1228、C228和CWM株的免疫保护效果优于本课题组前期筛选出的CX13株(徐倩,2015),故推测C227株更适合作为H9N2亚型AIV灭活疫苗的候选株。此外,本研究发现野鸟源H9N2亚型AIV分离株(241B5、35B15、191B5、69B17和210Q33)与广西地区流行的禽源H9N2亚型AIV分离株存在明显的抗原性差异,提示今后应继续关注野鸟源H9N2亚型AIV的抗原性变化,及时从野鸟源H9N2亚型AIV分离株中筛选出新的疫苗候选株,与禽源H9N2亚型AIV分离株联合研制多价疫苗以提高疫苗的免疫保护效果。
4结论
基于抗原性分析和免疫原性测定筛选出的A/chicken/Guangxi/C227/2015(H9N2)株对广西地区绝大部分H9N2亚型AIV流行株的免疫保护效果良好,可作为疫苗候选株用于研制新型H9N2亚型AIV疫苗。
参考文献:
陈伯伦,张泽纪,陈伟斌.1997.鸡A型禽流感病毒的分离与血清学初步鉴定[J].中国家禽,(11):4-6.[Chen BL,Zhang ZJ,Chen WB.1997.Isolation and preliminary serological identification of avian influenza virus-type Afrom chickens[J].China Poultry,(11):4-6.]doi:10.16372/j.issn.1004-6364.1997.11.002.
陈陆,刘守川,赵军,王川庆,王泽霖.2011.不同H9N2亚型禽流感病毒分离株致病力研究及HA抗原性变异分析[J].中国农业科学,44(24):5100-5107.[Chen L,Liu SC,Zhao J,Wang CQ,Wang ZL.2011.Characteristics of pathogenic and HA antigenic variation of H9N2subtybe avian influenza viruses isolated from1998to2008in China[J].Scientia Agricultura Sinica,44(24):5100-5107.]doi:10.3864/j.issn.0578-1752.2011.24.016.
丁芳,许利军,张诚,段淇凡,陈立保,戴美丽,刘聚祥,陈立功,王学静.2022.2019—2020年河北省部分地区鸡H9N2亚型AIVHA基因和NA基因遗传进化分析[J].中国家禽,44(6):42-49.[Ding F,Xu LJ,Zhang C,Duan QF,Chen LB,Dai ML,Liu JX,Chen LG,Wang XJ.2022.Genetic evolution analysis of HA gene and NA gene of H9N2subtype AIV of chicken origin in some areas of"Hebei Province from2019to2020[J].China Poultry,44(6):42-49.]doi:10.16372/j.issn.1004-6364.2022.06.008.
高斌,张帅,魏志鹏,李旭冬,宋存鑫,曾帅,唐熠,刁有祥.2019.2017—2018年山东省H9N2亚型禽流感病毒HA基因的遗传进化分析[J].中国家禽,41(6):21-26.[Gao B,Zhang S,Wei ZP,Li XD,Song CX,Zeng S,Tang Y,Diao YX.2019.Genetic evolution analysis of HA gene of H9N2subtype avian influenzavirus in Shandong Province from2017to2018[J].China Poultry,41(6):21-26.]doi:10.16372/j.issn.1004-6364.2019.06.005.
何家辉,胡泽中,李鸿鑫,封柯宇,邵冠明,李佳成,张新珩,谢青梅.2022.免疫失败鸡群中H9N2亚型禽流感病毒的分离鉴定与分子特征分析[J].中国家禽,44(3):27-37.[He JH,Hu ZZ,LiHX,Feng KY,Shao GM,LiJC,Zhang XH,Xie QM.2022.Isolation,identification and molecu-lar characterization ofH9N2subtype avian influenzavirus from immunefailure chicken flocks[J].China Poultry,44(3):27-37.]doi:10.16372/j.issn.1004-6364.2022.03.005.
胡晓苗,胡顺林,陈鸿志,刘东,戴银,沈学怀,刘秀梵,张丹俊.2015.2011~2014年安徽省发病鸡群H9亚型禽流感病毒HA基因的遗传进化分析[J].中国动物传染病学报,23(5):21-26.[Hu XM,Hu SL,Chen HZ,Liu D,DaiY,Shen XH,Liu XF,Zhang DJ.2015.Genetic evo-lution analysis of haemagglutinin gene of H9subtype avian influenza virus isolated from diseased chicken in Anhui Province from2011to2014[J].Chinese Journal of Animal Infectious Diseases,23(5):21-26.]doi:10.3969/j.issn.1674-6422.2015.05.004.
黄艳艳,李悦,张琳,王进圣,吴福杰,吴家强,刘思当.2018.6株H9N2亚型禽流感病毒的分子演化和抗原变异分析[J].畜牧兽医学报,49(10):2205-2214.[Huang YY,Li Y,Zhang L,Wang JS,Wu FJ,Wu JQ,Liu SD.2018.
Molecular and antigenic analyses of six H9N2-subtype avian influenza viruses isolated frombroiler chicken farms of Shandong Province in2017[J].Acta Veterinaria etZoo-technica Sinica,49(10):2205-2214.]doi:10.11843/j.issn.0366-6964.2018.10.016.
李丹.2017.广西不同宿主H9亚型禽流感病毒生态进化及快速检测方法的研究[D].桂林:广西师范大学.[Li D2017.Research of ecological evolution of H9subtype avian influenza viruses origin from different hosts in Guangxi and rapid detection methods[D].Guilin:Guangxi Normal University.]doi:10.27036/d.cnki.ggxsu.2017.000099.
李孟,李丹,谢芝勋,罗思思,谢丽基,张民秀,黄娇玲,邓显文,曾婷婷,阮志华.2022.3株广西麻雀源H9N2亚型禽流感病毒对SPF鸡的致病性[J].南方农业学报,53(11):3257-3265.[LiM,LiD,Xie ZX,Luo SS,Xie LJ,Zhang MX,Huang JL,Deng XW,Zeng TT,Ruan ZH.2022.Pathogenicity of three H9N2avian influenza viruses of Guangxi sparrow origin to SPF chickens[J].Journal of Southern Agriculture,53(11):3257-3265.]doi:10.3969/j.issn.2095-1191.2022.11.027.
李玉磊.2020.近年我国野鸟源禽流感病毒生物学特性研究[D].北京:中国农业科学院.[LiYL.2020.Biological"characteristics of wild bird-derived avian influenza virus in China in recent years[D].Beijing:Chinese Academy of Agricultural Sciences.]doi:10.27630/d.cnki.gznky.2020.000688.
李云燕.2020.广西野鸟源H9亚型禽流感病毒分离鉴定和全基因组测序分析及二重RT-LAMP检测方法的建立[D].南宁:广西大学.[Li YY.2020.Isolation,identification,whole genome sequence analysis of H9subtype avian influenza virus from wild birds and establishment of duplex RT-LAMP detection method in Guangxi[D].Nan-ning:Guangxi University.]doi:10.27034/d.cnki.ggxiu.2020.000314
马静.2020.华东地区H9N2亚型禽流感病毒抗原性分析及疫苗候选株免疫效力评价[D].扬州:扬州大学.[Ma J.2020.Antigenicity analysis ofH9N2subtype avian influen-za virusandevalution of immune efficacy of vacine candi-date in Eastern China[D].Yangzhou:YangzhouUniversity.]doi:10.27441/d.cnki.gyzdu.2020.000240.
宋才良,廖志宏,沈勇,王焕,李鸿鑫,蔺文成,陈伟国,张新珩,谢青梅.2020.2018—2019年广东地区H9N2亚型禽流感病毒HA基因的遗传进化分析[J].中国兽医学报,40(10):1976-1981.[Song CL,Liao ZH,Shen Y,Wang H,Li HX,Lin WC,Chen WG,Zhang XH,Xie QM.2020.Genetic evolution analyss of HA gene of H9N2avian influenza virus in Guangdongfrom2018to2019[J].Chinese Journal of Veterinary Science,40(10):1976-1981.]doi:10.16303/j.cnki.1005-4545.2020.10.15.
苏海龙,赵宇,郑丽荣,李耀门,张辛耘,石火英.2019.鸡体内疫苗抗体选择压对H9N2亚型禽流感病毒内部基因演化的影响[J].病毒学报,35(6):919-925.[SuH L,Zhao Y,Zheng LR,LiYM,ZhangXY,Shi HY.2019.Effects of vaccine antibody selection on the internal genetic evolu-tion of H9N2subtype avian influenza virus in chickens[J].Chinese Journal of Virology,35(6):919-925.]doi:10.13242/j.cnki.bingduxuebao.003604.
孙王杨吉,朱睿,张建军,石火英.2019.2017年国内大型鸡场分离的H9N2禽流感病毒的遗传进化和分子特征分析[J].中国兽医学报,39(8):1513-1525.[Sun WYJ,Zhu R,Zhang JJ,Shi HY,2019.Genetic evolution and molecular analysis of H9N2avian influenza virus isolated"from chicken farms in China in2017[J].Chinese Journal of VeterinaryScience,39(8):1513-1525.]doi:10.16303/j.cnki.1005-4545.2019.08.16.
谭伟,谢丽基,谢芝勋.2014.禽流感病毒疫苗研究进展[J].南方农业学报,45(8):1492-1497.[Tan W,Xie LJ,Xie ZX.2014.Research updates of vaccines against avian influen-za virus[J].Journal of Southern Agriculture,45(8):1492-1497.]doi:10.3969/j:issn.2095-1191.2014.8.1492
万晓朋.2010.中国大陆H9N2亚型禽流感病毒遗传演化分析及疫苗株的选择[D].北京:中国农业科学院.[Wang XP.2010.Evolution of H9N2influenza viruses in mainland"China and selection of vaccine candidate[D].Beijing:Chi-nese Academy of Agricultural Sciences.]
王勋,李鸽,李青梅,吕镕州,孟泽锟,柴书军,杨继飞,郭军庆,张改平.2022.广谱性识别H7亚型禽流感病毒HA蛋白的单克隆抗体制备与鉴定[J].河南农业科学,51(11):119-126.[Wang X,LiG,LiQ M,LüR Z,Meng ZK,Chai SJ,Yang JF,Guo JQ,Zhang GP.2022.Prepara tion and identification of monoclonal antibody broadly reco-gnizing HA protein of H7subtype avian influenza virus[J].Journal of Henan Agricultural Sciences,51(11):119-126.]doi:10.15933/j.cnki.1004-3268.2022.11.014.
王艳文,王梦静,张虹,高鑫鑫,郭晶,李旭勇.2022.1998—2021年我国人感染H9N2亚型禽流感病毒的遗传演化规律[J].中国农业科学,55(20):4075-4090.[Wang YW Wang MJ,Zhang H,Gao XX,Guo J,LiXY.2022.Evo-lution of human H9N2avian influenza virus in China from1998to2021[J].Scientia Agricultura Sinica,55(20):4075-4090.]doi:10.3864/j.issn.0578-1752.2022.20.017.
韦悠,谢芝勋,范晴,刘加波,谢丽基,庞耀珊,邓显文,谢志勤.2011.I群禽腺病毒双价油乳剂灭活苗的研究[J].南方农业学报,42(12):1550-1554.[Wei Y,Xie ZX,Fan Q,Liu JB,Xie LJ,Pang YS,DengXW,Xie ZQ.2011.Development of bivalent inactivated oil-emulsion vaccine for fowl adenovirus group-I[J].Journal of Southern Agri-culture,42(12):1550-1554.]
魏延迪.2016.H9N2亚型禽流感病毒抗原性变异及其冷适应疫苗交互免疫机制研究[D].北京:中国农业大学.[Wei YD.2016.Antigenic evolution of H9N2chicken influenza virus and cross-protection of cold adapted vaccine[D]Beijing:Chinese Academyof Agricultural Sciences.]
谢芝勋,刘加波,庞耀珊,谢志勤,邓显文.2001.亲油亲水平衡值对鸡新城疫油苗免疫力影响的研究[J].中国预防兽医学报,23(2):127-129.[Xie ZX,Liu JB,Pang YS,Xie ZQ,Deng XW.2001.The efficacy of newcastle disease oil-emulsion vaccine effected by hydrophile-lipophile ba-lance[J].Chinese Journal of Preventive Veterinary Medi-cine,23(2):127-129.]doi:10.3969/j.issn.1008-0589.2001.02.013.
邢燕茹,范春艳,罗玉丽,汪秀会,2021.H9N2亚型禽流感病毒流行病学研究进展[J].中国家禽,43(10):80-86.[Xing YR,Fan CY,Luo YL,Wang XH.2021.Advance on epidemiology of H9N2subtype avian influenza virus[J].China Poultry,43(10):80-86.]doi:10.16372/j.issn.1004-6364.2021.10.012.
宿春虎.2014.2011—2013年华东地区禽流感病毒流行病学调查及H9N2亚型禽流感病毒的抗原性分析[D].扬州:扬州大学.[Su CH.2014.Epidemiological investigation of avian influenza viruses isolated in Eastern China from2011to2013and antigenic analysis of H9N2subtype avian influenza viruses[D].Yangzhou:Yangzhou Univer-sity.]
徐倩.2015.广西H9亚型禽流感病毒全基因组序列分析及疫苗候选株的筛选[D].南宁:广西大学.[Xu Q.2015.
Whole genome sequence analysis of H9subtype avian"influenza virus in Guangxi and the selection of vaccine candidate[D].Nanning:Guangxi University.]doi:10.7666/d.Y3086569.
许传田,鲁梅,胡北侠,杨少华,颜世敢,张琳,张秀美.2012.H9N2亚型禽流感疫苗株的筛选及其免疫效果评价[J].中国兽医报,32(7):997-1000.[Xu CT,Lu M,Hu BX,Yang SH,Yan SG,Zhang L,Zhang XM.2012.H9N2subtypes of flu vaccine strains selection and immune effect assessment[J].Chinese Journal of Veterinary Science,32(7):997-1000.]doi:10.16303/j.cnki.1005-4545.2012.07.018.
袁小远,孟凯,张玉霞,徐怀英,李莉,艾武,杨金兴,元丽红,王友令.2018.2016年~2017年山东地区商品肉鸡H9N2亚型禽流感病毒HA基因的分子特征和遗传进化分析[J].中国预防兽医学报,40(6):543-545.[Yuan XY,Meng K,Zhang YX,Xu HY,Li L,AiW,Yang JX,QiL H,Wang YL.2018.Analysis on variation and molecular characteristics of hemagglutinin genes of H9N2subtype avian influenza viruses isolated from Shandong in2016-2017[J].Chinese Journal of Preventive Veterinary Medi-cine,40(6):543-545.]doi:10.3969/j.issn.1008-0589.201708019.
张婷钰.2019.2017—2018年我国H9N2亚型禽流感流行病学调查及疫苗候选株的筛选[D].南京:南京农业大学.[Zhang TY.2019.The epidemiology subtype of H9N2avian influenza virus in China from2017to2018and H9N2vaccine virus candidate screening[D].Nanjing:Nan-jing Agricultural University.]doi:10.27244/d.cnki.gnjnu2019.000460.
张伟,徐怀英,孟芳,马秀丽,刘霞,黄迪海,秦卓明,刘金华,赵鹏.2015.1999~2013年山东H9N2亚型禽流感病毒HA基因的演化和HI抗原性差异分析[J].中国科学:生命科学,45(2):190-199.[Zhang W,XuHY,Meng F,Ma XL,Liu X,Huang DH,Qin ZM,Liu JH,Zhao P.2015.Evolution of HA gene and antigenicity of HI in H9N2sub-type avian influenza viruses in Shandong Province from1999to2013[J].Scientia Sinica(Vitae),45(2):190-199.]doi:10.1007/s11427-014-4777-0.
张义冉,王贞,孙怡朋,刘长清,刘金华.2019.2017年河北省蛋鸡养殖场H9N2亚型禽流感病毒的遗传演化和抗原性分析[J].微生物学通报,46(7):1803-1811.[Zhang YR Wang Z,Sun YP,LiuCQ,Liu JH.2019.Genetic evolu-tion and antigenic characteristics of H9N2avian influenza viruses in laying-hen farms in Hebei Province in2017[J]Microbiology,46(7):1803-1811.]doi:10.13344/j.micro-biol.china.190165.
赵聪慧,郭晶,李旭勇.2019.H9N2亚型禽流感病毒研究进展[J].黑龙江畜牧兽医,(3):35-39.[Zhao CH,Guo J,L XY.2019.Research progress on H9N2avian influenza"virus[J].Heilongjiang Animal Science and Veterinary Me-dicine,(3):35-39.]doi:10.13881/j.cnki.hljxmsy.2018.050030.
赵锦华.2020.H9N2亚型禽流感病毒流行株抗原变异特征分析及疫苗候选株的筛选[D].南京:南京农业大学.[Zhao JH.2020.Analysis of antigenic variability and screening of candidate vaccine strains for H9N2subtype avian influenza virus epidemic strains[D].Nanjing:Nan-jing Agricultural University.]doi:10.27244/d.cnki.gnjnu.2020.000642.
赵宇.2018.疫苗抗体压下分离的H9N2亚型禽流感病毒的基因分析及其免疫原性研究[D].扬州:扬州大学.[Zhao Y.2018.Gene analysis and immunogenicity study of H9N2subtype avian influenza virus isolated from chic-kens with vaccine antibodies[D].Yangzhou:Yangzhou Uni-versity.]doi:10.7666/d.Y3433553.
郑丽荣,苏海龙,张英,石火英.2019.禽流感病毒抗原变异的研究进展[J].中国家禽,41(7):47-50.[Zheng LR,SuH L,Zhang Y,Shi HY.2019.Research progress on antigenic variation of avian influenza virus[J].China Poultry,41(7):47-50.]doi:10.16372/j.issn.1004-6364.2019.07.010.
Cao Y,Liu HZ,Liu D,Liu WJ,Luo TR,LiJ.2022.Hemag-glutinin gene variation rate of H9N2avian influenza virus by vaccine intervention inChina[J].Viruses,14(5):1043.doi:10.3390/v14051043.
Dong JZ,Zhou Y,Pu J,Liu LT.2022.Status and challenges for vaccination against avian H9N2influenza virus in China[J].Life,12(9):1326.doi:10.3390/life12091326.
Huang XY,Yin GL,CaiYQ,Hu JN,HuangJW,Liu QT,Feng XL.2022.Identification of unique and conserved neutralizing epitopes of vestigial esterase domain in HA protein of the H9N2subtype of avian influenza virus[J].Viruses,14(12):2739.doi:10.3390/v14122739.
LiCJ,Yu KZ,Tian GB,Yu DD,Liu LL,JingB,Ping JH,Chen HL.2005.Evolution of H9N2influenza viruses from domestic poultry in Mainland China[J].Virology,340(1):70-83.doi:10.1016/j.virol,2005.06.025
Sun YP,Liu JH.2015.H9N2influenza virus in China:A cause of concern[J].Proteinamp;Cell,6(1):18-25.doi:10.1007/s13238-014-0111-7.
Peacock TP,James J,Sealy JE,Iqbal M.2019.A global per-spective on H9N2avian influenza[J].Viruses,11(7):620.doi:10.3390/v11070620.
Zheng YQ,Guo YN,LiYF,Liang B,Sun XY,LiSJ,Xia HZ,Ping JH.2022.The molecular determinants of anti-genic drift in anovel avian influenza A(H9N2)variant virus[J].Virology Journal,19(1):26.doi:10.1186/s12985-022-01755-9.
(责任编辑 兰宗宝)

