色瓦绵羊GPIHBP1基因克隆及其组织表达特征分析



摘要:[目的】克隆色瓦绵羊乳腺组织糖基化磷脂酰肌醇锚定高密度脂蛋白结合蛋白1基因(GPIHBP1),明确其生物信息学特性及组织表达分布特征,为揭示GPIHBP1基因影响绵羊产奶性状的作用机制提供参考依据。【方法】克隆色瓦绵羊GPIHBP1基因编码区(CDS)序列,通过ProtPara、ProtScale、SOPMA、SWISS-MODEL、TMHMM-2.0等在线软件进行生物信息学分析,并以实时荧光定量PCR检测该基因在色瓦绵羊乳腺、肌肉、心脏、肾脏、肝脏、小肠、瘤胃和卵巢等8个组织中的表达情况。【结果]色瓦绵羊GPIHBP1基因CDS序列长519bp,共编码172个氨基酸残基,与山羊GPIHBP1氨基酸序列(XM_018058666.1)比对,有4处氨基酸发生突变(2A→P、2V→A、130S→N和17M→V);色瓦绵羊GPIHBP1蛋白分子量为18063.87Da,理论等电点(pl)为4.29,不存在跨膜螺旋结构,但存在信号肽(位于第20~21位氨基酸处),是一种细胞外的酸性亲水性蛋白。色瓦绵羊GPIHBP1蛋白存在12个磷酸化位点(6个丝氨酸磷酸化位点,5个苏氨酸磷酸化位点,1个酪氨酸磷酸化位点),其二级结构以无规则卷曲状态(占55.07%)为主,其次是α-螺旋(占35.47%),延伸链、β-转角分别占5.81%和4.65%。GPIHBP7基因在色瓦绵羊乳腺、肌肉、心脏、肾脏、肝脏、小肠、瘤胃和卵巢等8个组织中均有表达,以乳腺中的相对表达量最高,其次是心脏和肝脏,均极显著高于肌肉中的相对表达量(Plt;0.01)。【结论】GPIHBP1基因在色瓦绵羊不同组织中均有表达,且以乳腺中的相对表达量最高,可能与乳脂相关基因表达的增减有关,其中,GPIHBP1基因与LPL基因共同作用而参与绵羊泌乳调控。
关键词:色瓦绵羊;GPIHBP1基因;乳腺;产奶性状;泌乳调控
中图分类号:S826.89文献标志码:A文章编号:2095-1191(2024)01-0235-08
Cloning and tissue expression characteristics analysis of GPIHBP1gene in Sewa sheep
PAN Jun-ru¹,LI Rui¹,ZHANG Xin',Ren-qing-cuo-mu2,SUN Yu2.3,YANG Jing-quan⁴
ZHANG Zhen-zhen',CHEN Hua-li¹,ZHAO Wang-sheng⁴,SONG Tian-zeng2
('School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang,Sichuan 621010,China;2Institute ofAnimal Science,XizangAcademy of Agricultural and Animal Husbandry Science,Lhasa, Xizang850009,China;³College of Animal Science and Technology,Henan Agricultural University,Zhengzhou Henan450002,China;⁴Animal Husbandry and Veterinary Institute,Xinjiang Academy of Agricultural and Reclamation Science,Shihezi,Xinjiang832000,China)
Abstract:[Objective]The glycosylated phosphatidylinositol anchored HDL-binding protein Igene(GPIHBP1)in the mammary gland tissue of Sewa sheep was cloned to clarify its bioinformatics characteristics and tissue expression dis-tribution characteristics,which provided areference for revealing the mechanismof GPIHBP1 genes affecting milk pro-duction traits in sheep.【Method]The sequence of coding region(CDS)of GPIHBP¹gene of Sewa sheep was cloned, and bioinformaticsanalysiswas carried outby online softwares such as ProtPara,ProtScale,SOPMA,SWISS-MODEL,and TMHMM-2.0,and real-time fluorescence quantitative PCR was used to detect the expression of this gene in mam-mary gland,muscle,heart,kidney,liver,small intestine,rumen and ovary in sewa sheep.[Result]The CDS sequence of Sewa sheep GPIHBP1gene was519bp long,encoding atotal of172amino acid residues,and compared with the amino acid sequence of goat GPIHBP1(XM_018058666.1),there were four amino acid changes(A→P,“V→A,130s→N and'70M→V);the molecular weight of Sewa sheep GPIHBPl protein was18063.87Da,and the theoretical isoelectric point(pI)was4.29.There was no transmembrane helical structure,but there was asignal peptide(located at amino acids20-21),which was an extracellular acidic hydrophilic protein.There were12phosphorylation sites(6serine phosphoryla-tion sites,5threonine phosphorylation sites,I tyrosine phosphorylation site)existed in the Sewa sheep GPIHBP¹pro-tein,and its secondary structure was in the state of iregularly curls(55.07%),followed by α-helix(35.47%),and the extended strand andβ-turns accounted for5.81%and4.65%,respectively.GPIHBP1gene was expressed in eight tssues including mammary gland,muscle,heart,kidney,liver,small intestine,rumen and ovary of Sewa sheep,and the highest relative expression was found in the mammary gland,followed by the heart and liver,which were both extremely signifi-cant higher than that in the muscle(Plt;0.01).【Conclusion]GPIHBP1 gene is expressed in different tissues of Sewa sheep,and the relative expression in mammary gland is the highest,which might be related to the increase or decrease in theexpressionof milk fat-related genes,among which,GPIHBP1 gene actstogether with LPL gene and participate in the regulation of lactation in sheep
Key words:Sewa sheep;GPIHBP1 gene;mammary gland;milk production traits;lactation regulation
Foundation items:National Natural Science Foundation of China(32260824);Central Government Guiding Local Science andTechnology Development Fund Prject(XZ202201YD0007C)
0引言
【研究意义】色瓦绵羊是在我国西藏地区特有的草原绵羊类群,栖息于海拔超过4800m的高原地区,具有繁殖速度快、体质强健有力、产奶量和屠宰率高、耐力强等特点,因其特殊的生理结构、优良的生产性能及优秀的肉质性状,已被列为我国重要的地方畜禽品种之一(王耀梅等,2021;邵会等,2022;符汉宇等,2023)。近年来,随着我国养羊业的快速发展,色瓦绵羊逐渐得到广大消费者青睐,其生产性能已被世界上许多国家和地区认可。色瓦绵羊体高较普通绵羊高出12~15cm,体重较普通绵羊约重10kg,产奶量较普通绵羊提高25%;且色瓦绵羊肉质中的蛋白和微量元素含量高,脂肪含量低,其蛋白含量为20.5g/100g、脂肪含量为1.5g/100g、胆固醇含量为35.4mg/100g、不饱和脂肪酸含量为51.3%、氨基酸含量为16.2g/100g(扎西次仁等,2020)。色瓦绵羊作为国家级遗传资源,其发展及品牌建设对推动西藏色瓦绵羊畜禽遗传资源的可持续开发和利用具有重要意义。【前人研究进展】糖基化磷脂酰肌醇锚定高密度脂蛋白结合蛋白1(Glycosylated phosphatidylinositol-anchored HDL-binding proteins1,GPIHBP1)是在中国仓鼠卵巢细胞上鉴定获得的一种可锚定高密度脂蛋白的小分子细胞表面蛋白,是淋巴细胞抗原6蛋白家族成员之一(Ioka et al.,2003)。牛GPIHBP1基因存在可变剪切体,具备2种翻译蛋白,分别由171和142个氨基酸组成(李永青和操礼军,2022)。典型的GPIHBP1具有4个重要结构域(Beigneux et al.,2007),分别是信号肽结构域、氨基末端富集带负电的氨基酸酸性结构域、Ly6结构域及梭基末端的糖基化磷脂酰肌醇(GPI)锚定结构域,其中Ly6结构域包含1个N-糖基化位点,且该位点的糖基化对于GPIHBP1从内质网转运到细胞非常重要(Beigneux et al.,2009b)。GPIHBP1蛋白转运至内质网后,其信号肽序列被切除,同时羧基末端的疏水序列被锚定结构所替代(Beigneux et al.,2009a),因此Ly6保守域及酸性区域对成熟的GPIHBP1蛋白具有重要意义。Ly6保守域及其酸性区域在GPIHBP1与脂蛋白脂肪酶(Lipoprotein lipase,LPL)和乳糜微粒结合时发挥重要作用(Gin et al.,2008;Weinstein et al.,2008),将Ly6结构域中的半胱氨酸替换为丙氨酸后,突变的GPIHBP1可到达细胞表面,但无法与LPL结合(Beigneux et al.,2009a,2009b),进而引起患者出现严重的高甘油三酯血症或乳糜微粒血症(Wang and Hegele,2007)。此外,Jiang等(2010)通过中国荷斯坦奶牛群体产奶性状的全基因组关联研究,证实GPIHBP1基因是一个新的乳脂含量性状候选基因;侯飞(2011)基于DNA混合池测序寻找黄牛GPIHBP1基因的SNPs,结果在南阳牛、郏县红牛、鲁西牛、秦川牛和中国荷斯坦牛的GPIHBP1基因编码区均发现存在3个SNPs,为改良地方黄牛品种提供了理论依据;邢淑华(2013)基于猪GPIHBP1基因的作用机理研究发现,GPIHBP1基因与LPL基因在mRNA水平上的组织表达模式相似,但存在性别差异;杨洁(2014)通过分析GPIHBP1基因启动子多态性与泌乳性状(产奶量、乳脂量、乳蛋白量、乳脂率及乳蛋白率)的关联程度,发现野生型的育种值极显著低于突变型;Yang等(2014)研究表明,GPIHBP1基因可能是影响奶牛乳脂含量的功能基因,且该基因启动子区的G/A突变与奶牛产奶量、乳蛋白量及乳脂率等呈极显著相关。综上所述,GPIHBP1基因可作为调控哺乳动物泌乳性状的候选基因。【本研究切入点】目前,GPIHBP1基因在人类及小鼠和牛上的研究较多(Ioka et al.,2003;Wang and Hegele,2007;Jiang et al.,2010;邢淑华,2013;李永青和操礼军,2022),但在绵羊上尚无任何文献报道。【拟解决的关键问题】克隆色瓦绵羊乳腺组织GPIHBP1基因,并在生物信息学分析的基础上比较该基因在色瓦绵羊不同组织
中的表达差异,为揭示GPIHBP1基因影响绵羊产奶性状的作用机制提供参考依据。
1材料与方法
1.1试验材料
在西藏班戈县挑选3头体格相近、健康的色瓦绵羊,屠宰后采集乳腺、肌肉、心脏、肾脏、肝脏、小肠、瘤胃和卵巢等组织样品;以Hank's液将各组织样品清洗3次,去除结缔组织和脂肪组织,分别剪取适量组织并编号放入冷冻管中,液氮冻存备用。动物试验由西南科技大学生物与健康伦理委员会批准,批准号L2022014。Hank's液购自福州飞净生物科技有限公司;TRIzol试剂购自广州济恒医药科技有限公司;Taq DNA聚合酶和SuperReal荧光定量预混试剂增强版购自天根生化科技(北京)有限公司;RNase-Free ddH₂O购自北京兰杰柯科技有限公司。主要仪器设备:电泳仪(南京普阳科学仪器研究所)、SpectraMax QuickDrop超微量分光光度计(济南来宝医疗器械有限公司)、高速离心机[阿法拉伐(上海)技术有限公司]、生化培养箱(宁波江南仪器厂)及超净工作台(济南童鑫生物科技有限公司)。
1.2总RNA提取及cDNA合成
按照TRIzol试剂说明分别提取色瓦绵羊乳腺、肌肉、心脏、肾脏、肝脏、小肠、瘤胃和卵巢等组织总RNA,以0.8%琼脂糖凝胶电泳检测RNA完整性,采用SpectraMax QuickDrop超微量分光光度计检测其质量和浓度。以提取的总RNA为模板,按照ReverAid First Strand cDNA Synthesis Kit反转录试剂盒说明合成cDNA,反转录合成程序:42℃15min,85℃5s,冰上孵育2min。合成的cDNA置于-20℃冰箱保存备用。
1.3GPIHBP1基因引物设计与合成
根据NCBI已公布的绵羊GPIHBP1基因(XM_012183471)序列,利用Primer Premier5.0设计GPIHBP1基因特异性引物及实时荧光定量PCR扩增引物(表1),以GAPDH基因(NM_001190390.1)为内参基因,委托生工生物工程(上海)股份有限公司合成。
1.4色瓦绵羊GPIHBP1基因克隆及测序
以色瓦绵羊各组织反转录合成的cDNA为模板进行PCR扩增,反应体系20.0μL:cDNA模板1.0μL,Taq DNA聚合酶10.0μL,上、下游引物各1.0μL,ddH₂O7.0μL。扩增程序:94℃预变性2min;95℃30s,62℃30s,72℃33s,进行40个循环;72℃延伸30s。PCR扩增产物经1.0%琼脂糖凝胶电泳检测合格后,切胶回收目的片段并连接至pMD18-T载体上,转化大肠杆菌DH5α感受态细胞,扩大培养后进行菌液PCR鉴定,阳性质粒送至成都擎科梓熙生物技术有限公司测序。
1.5生物信息学分析
通过BioXM2.6获得色瓦绵羊GPIHBP1基因推导氨基酸序列排列图,并利用ProtPara、ProtScale、SOPMA、SWISS-MODEL、TMHMM-2.0等在线软件对GPIHBP1蛋白进行生物信息学分析。相关生物信息学分析软件及其功能见表2。
1.6实时荧光定量PCR检测
实时荧光定量PCR按照SuperReal PreMix Plus(SYBR Green)试剂盒说明进行操作,反应体系20.0pμL:2×SG Fast qPCR Master Mix10.0μL,色瓦绵羊各组织cDNA模板1.0μL,上、下游引物各1.0μL,PCR-grade Water7.0μL。扩增程序:94℃预变性2min;95℃30s,60℃30s,72℃8s,进行40个循环。每个组织样品设3个重复。
1.7统计分析
将GPIHBP1基因在色瓦绵羊肌肉组织中的表达量设为1,通过2-法换算GPIHBP1基因在色瓦绵羊其他组织中的相对表达量,利用GraphPad Prism9.0绘制表达量差异图,并以SPASS29.0进行单因素方差分析(One-wayANOVA)。
2结果与分析
2.1色瓦绵羊GPIHBP1基因克隆及测序结构
以乳腺组织cDNA为模板,PCR扩增色瓦绵羊GPIHBP1基因编码区(CDS)序列,经1.0%琼脂糖凝胶电泳检测获得与预期结果相符的目的基因片段,表明成功扩增出色瓦绵羊GPIHBP1基因。经测序分析得知,色瓦绵羊GPIHBP1基因CDS序列长519bp,共编码172个氨基酸残基。将色瓦绵羊GPIHBP1氨基酸序列与山羊GPIHBP1氨基酸序列(XM_018058666.1)进行比对分析,结果发现有4处氨基酸发生改变(图1),分别是:第32位的丙氨酸突变为脯氨酸(¹2A→P),第52位的缬氨酸突变为丙氨酸(2V→A),第130位的丝氨酸突变为天冬酰胺(130S→N),第170位的蛋氨酸突变为缬氨酸(170M→V)。
2.2色瓦绵羊GPIHBP1基因生物信息学分析结果
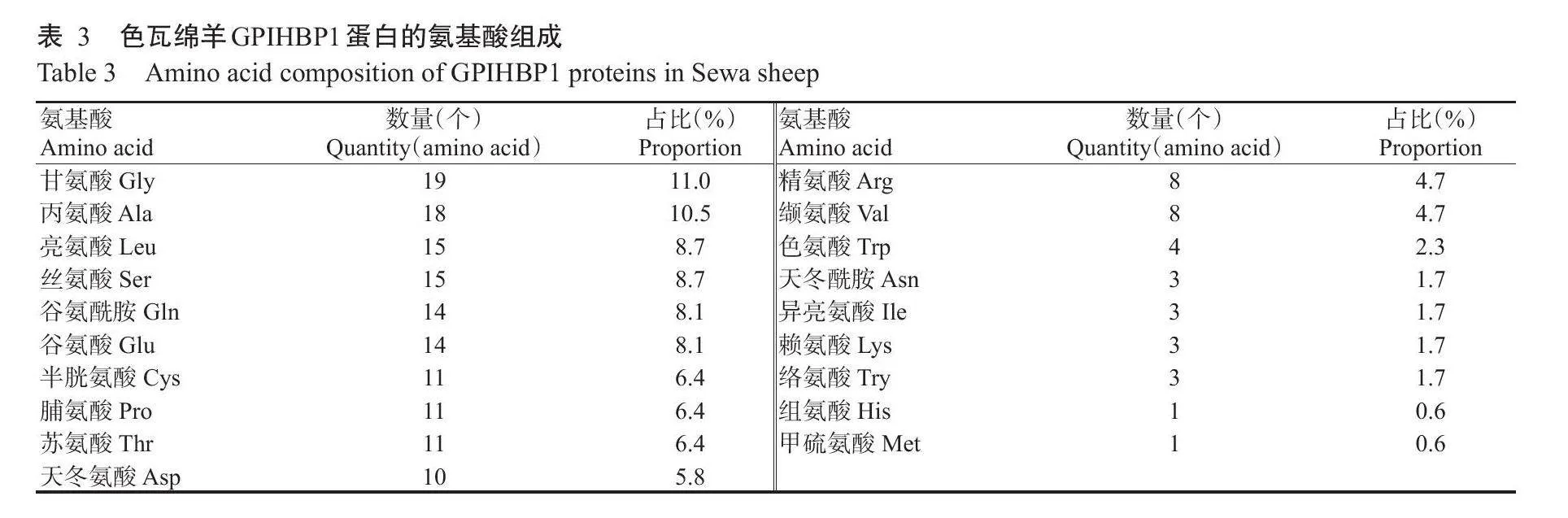
2.2.1理化性质分析结果EXPASY预测结果显示,色瓦绵羊GPIHBP1蛋白包含172个氨基酸(表3)。其中,甘氨酸(Gly)含量最高,占11.0%;其次是丙氨酸(Ala,占10.5%)和亮氨酸(Leu,占8.7%);组氨酸(His)和甲硫氨酸(Met)含量最低,各占0.6%。色瓦绵羊GPIHBP1蛋白分子量为18063.87Da,理论等电点(pI)为4.29,分子式为CsH116N222O₂67S12。色瓦绵羊GPIHBP1蛋白序列中带负电荷氨基酸(Asp+Glu)为24个,带正电荷氨基酸(Arg+Lys)为11个,属于酸性蛋白。
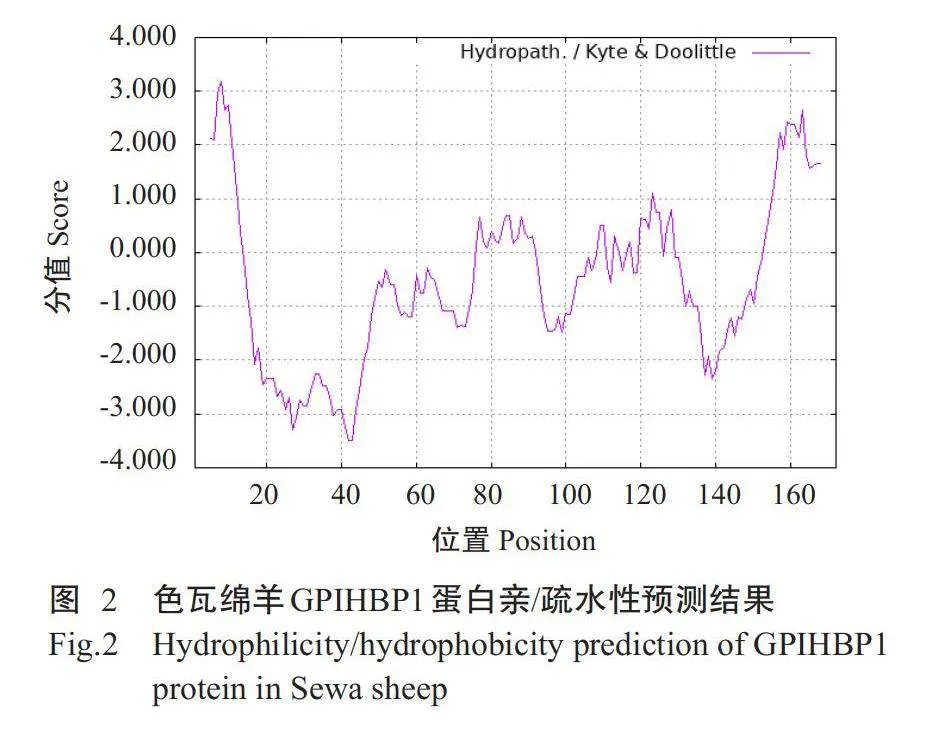
2.2.2亲/疏水性预测结果采用ProtScale预测色瓦绵羊GPIHBP1蛋白亲/疏水性,结果(图2)显示,处于负值区域的氨基酸数量明显多于处于正值区域的氨基酸,高峰值(正值)区域表示疏水区域,最高点为3.178,位于第8位氨基酸位点上;低谷区(负值)区域为亲水区域,最低值为-3.500,位于第42和43位氨基酸位点上,即色瓦绵羊GPIHBP1蛋白属于亲水性蛋白。
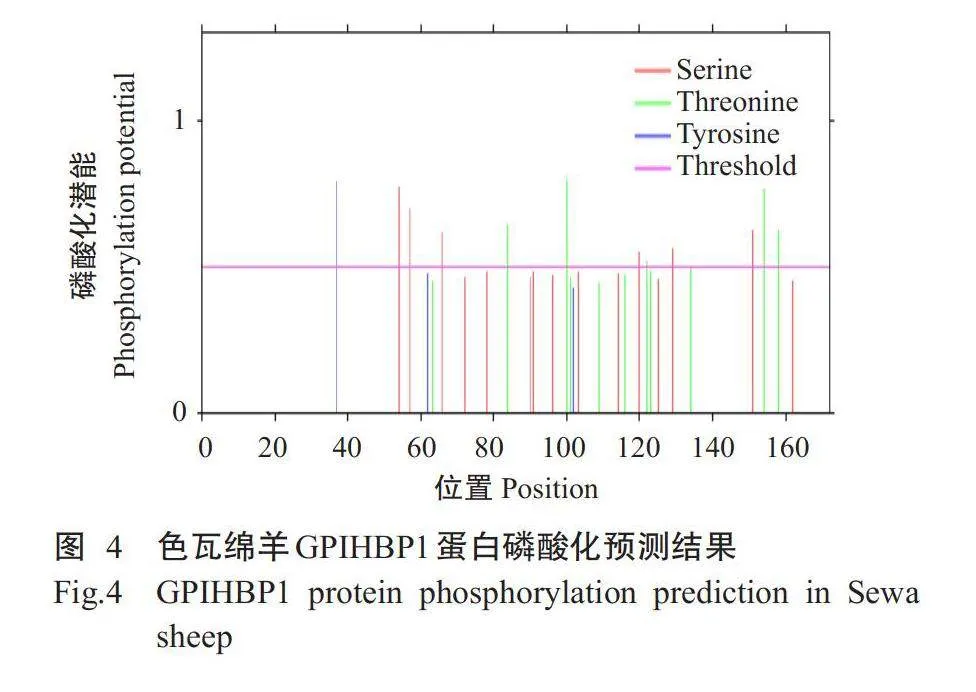
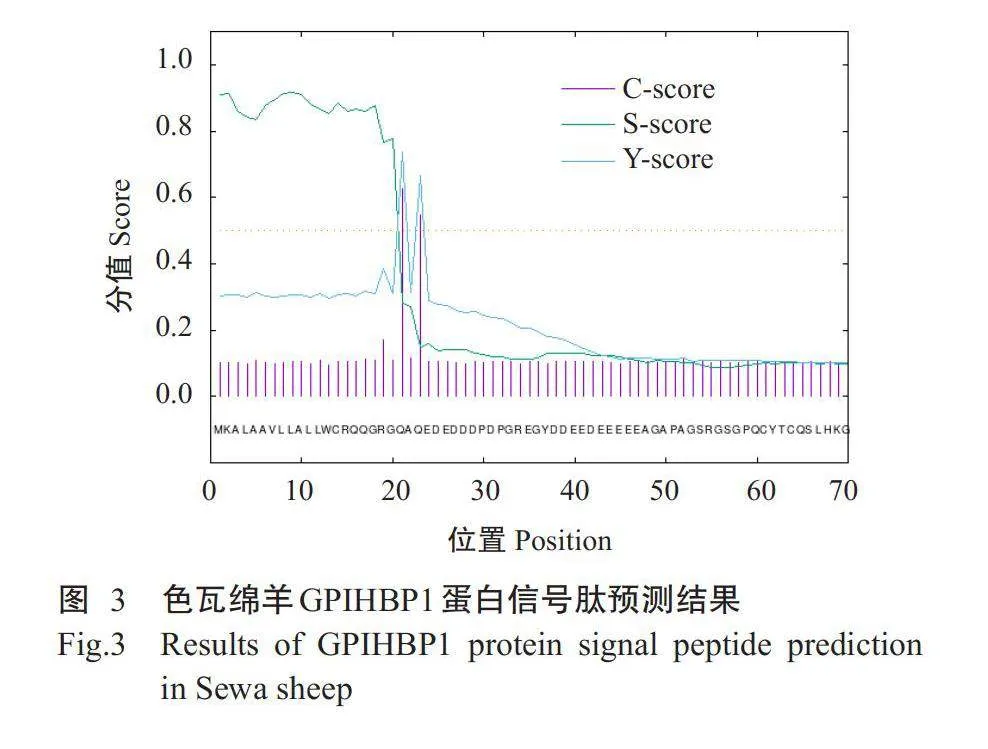
2.2.3信号肽及磷酸化位点预测结果使用Sig-nalP4.1预测结果(图3)显示,色瓦绵羊GPIHBP1蛋白存在信号肽,且信号肽剪切位点位于第20~21位氨基酸处。NetPhos3.1预测结果(图4)显示,色瓦绵羊GPIHBP1蛋白存在12个磷酸化位点,其中,丝氨酸磷酸化位点有6个,苏氨酸磷酸化位点有5个,酪氨酸磷酸化位点有1个。
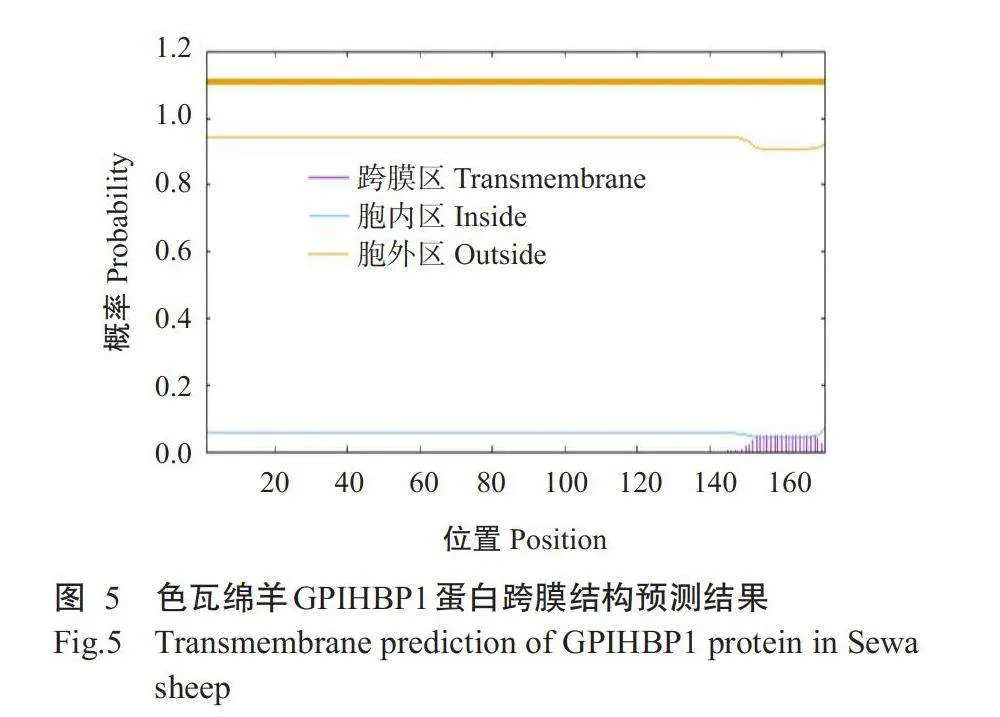
2.2.4亚细胞定位及跨膜结构预测结果通过PSORTⅡ预测色瓦绵羊GPIHBP1蛋白亚细胞定位情况,结果表明,44.4%定位于细胞外,33.3%定位于内质网,22.3%定位于高尔基体。TMHMM-2.0预测GPIHBP1蛋白跨膜结构,结果(图5)显示色瓦绵羊GPIHBP1蛋白不包含跨膜螺旋结构。
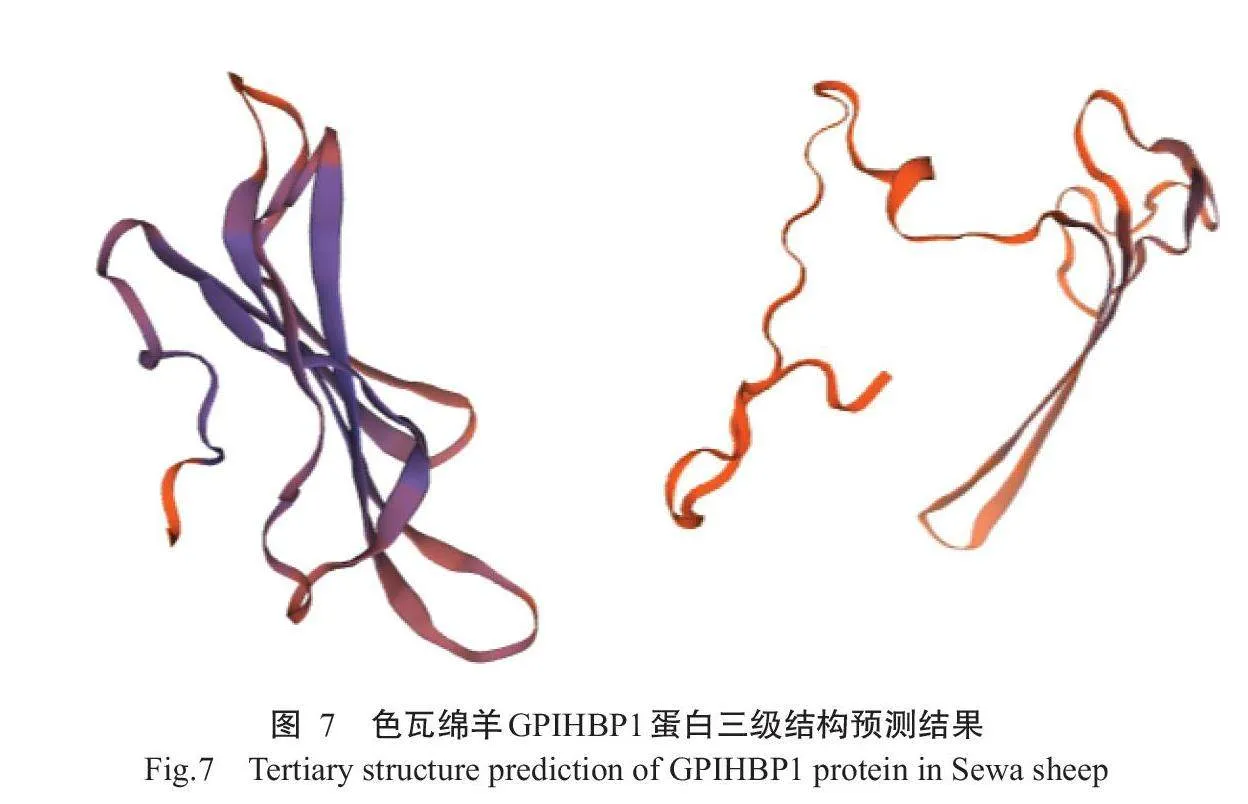
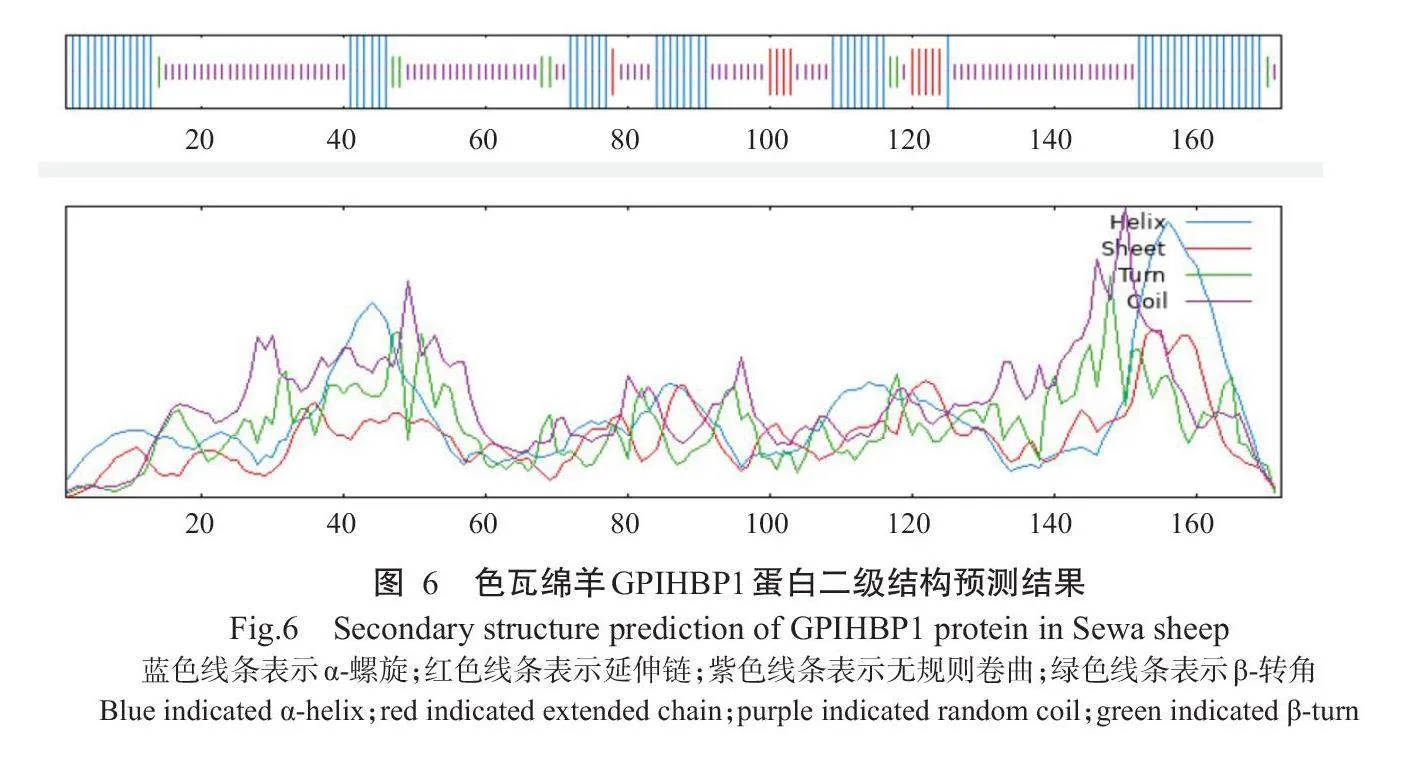
2.2.5蛋白二、三级结构测定结果SOPMA预测结果(图6)显示,色瓦绵羊GPIHBP1蛋白由172个氨基酸组成。其中,有61个氨基酸组成α-螺旋,占35.47%;有10个氨基酸组成延伸链,占5.81%;有8个氨基酸组成β-转角,占4.65%;有93个氨基酸处于无规则状态,占55.07%。采用TMHMM-2.0预测色瓦绵羊GPIHBP1蛋白三级结构,结果发现存在2种三级结构模型,如图7所示。
2.3色瓦绵羊各组织中GPIHBP1基因的表达特征
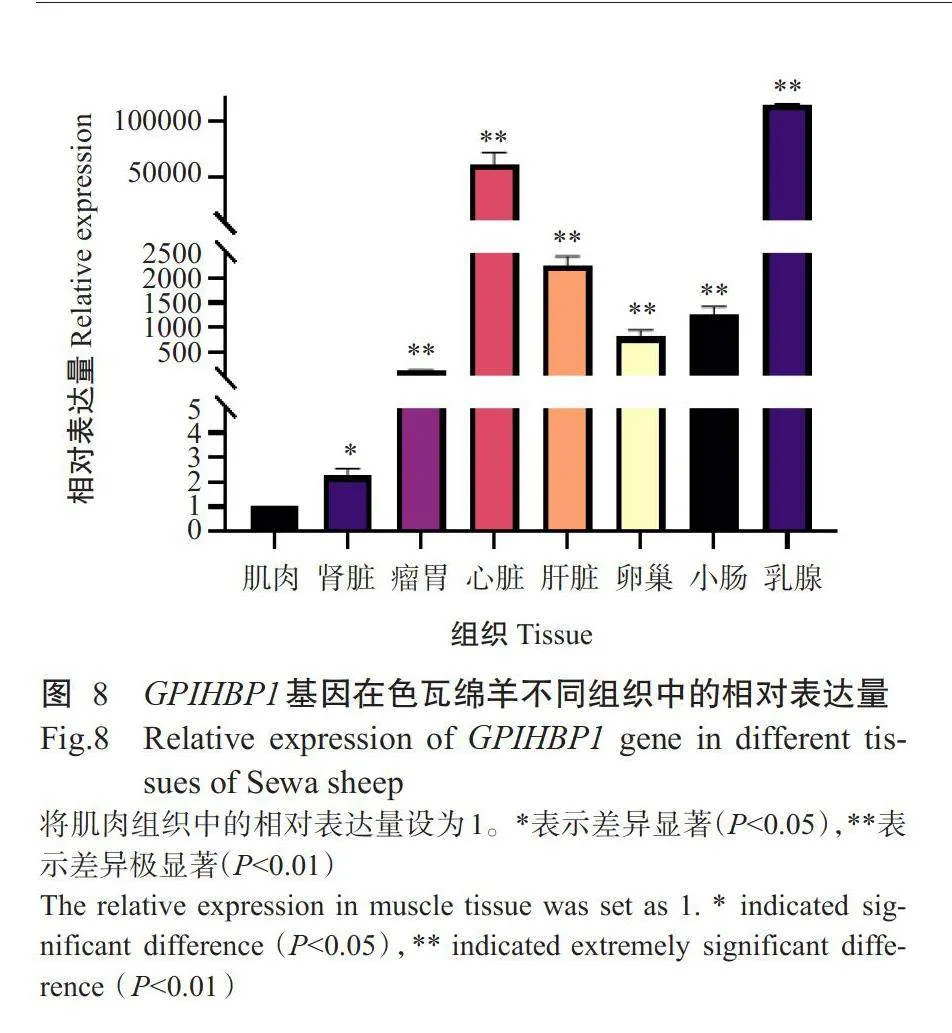
通过实时荧光定量PCR检测GPIHBP1基因在色瓦绵羊乳腺、肌肉、心脏、肾脏、肝脏、小肠、瘤胃和卵巢等组织中的表达情况,结果表明GPIHBP1基因在8个组织中均有表达(图8),以乳腺中的相对表达量最高,其次是心脏和肝脏,均极显著高于在肌肉中的相对表达量(Plt;0.01)。
3讨论
目前,有关GPIHBP1基因的研究主要集中于疾病治疗(李蓝江等,2015;柳鑫等,2020),在猪和牛等家畜上的研究主要用于繁殖调控(侯飞,2011;邢淑华,2013;杨洁,2014;陈建宁,2015)。乳腺是具有泌乳功能的特殊腺体,在哺乳动物的生长发育过程中经历多次生长、分化和退化阶段,其泌乳性能影响后代的存活率和生长速度;而哺乳动物的泌乳规律性变化(泌乳量、乳成分等)取决于乳腺组织中相关基因的表达差异(郝志云,2018)。本研究结果显示,色瓦绵羊GPIHBP1基因CDS序列长519bp,共编码172个氨基酸残基;色瓦绵羊GPIHBP1氨基酸序列与山羊GPIHBP1氨基酸序列相比,共有4处氨基酸发生突变,分别是³2A→P、⁵2V→A、30S→N和170M→V。
色瓦绵羊GPIHBP1蛋白分子量为18063.87Da,pl为4.29,是一种细胞外的酸性亲水性蛋白,在乳腺组织中的相对表达量最高。
LPL是血浆脂蛋白代谢中最重要的生物酶之一,可为横纹肌提供能量物质,或在脂肪组织中以甘油三酯的形式储存,其正常调控对于机体向组织提供脂质营养至关重要(Merkel et al.,2002;Wang and Eckel,2009)。Merkel等(2002)通过探讨牛GPIHBP1基因对乳蛋白乳脂相关基因的调控作用,结果表明,当GPIHBP1基因高表达时,LPL和CD36基因表达水平呈明显上升趋势,即GPIHBP1基因表达量升高后所结合的LPL表达量也增加,从而有效促进乳脂分解。Yang等(2014)通过研究过表达和沉默GPIHBP1基因对乳脂相关基因表达的影响,结果发现GPIHBP1基因启动子区SNP位点(chr14:2553525)与乳脂含量间存在强烈的关联性,当GPIHBP1基因表达降低时,LPL与GPIHBP1的结合随之减少,致使甘油三酯的脂解过程在乳腺上皮细胞中被抑制,进而导致甘油三酯积累及乳脂含量增加。本研究结果表明,GPIHBP1基因在色瓦绵羊乳腺组织中高表达,可能是GPIHBP1与LPL共同作用的结果。
Ly6保守域及酸性区域对于GPIHBP1与LPL和乳糜微粒相结合具有重要作用(Gin et al.,2008)。GPIHBP1在体内代表着LPL的重要结合位点,对LPL的运输和定位起关键作用,还可作为内皮细胞的脂解平台(Young et al.,2007;Dallinga-Thie et al.,2010;Beigneux et al.,2011;Davies et al.,2012)。有关山羊的研究发现,不同泌乳阶段乳腺组织中的LPL基因表达水平存在差异,泌乳初期LPL基因表达量最高,而泌乳中期和干奶期的表达水平明显下降,LPL基因在乳腺中合成并介导乳腺内的脂肪分解过程,对提供脂肪营养以生产乳脂具有重要意义(Olivecrona et al.,2010)。LPL基因在山羊泌乳初期高表达,与其在泌乳初期脂肪组织动员体脂用于乳脂合成的情况相符(韩雪峰,2007)。鉴于GPIHBP1与LPL的关联性,故推测GPIHBP1也参与乳脂合成,与GPIHBP1基因在色瓦绵羊乳腺组织中高表达的结论相符。陈建宁(2015)研究表明,GPIHBP1基因主要在猪的心脏、骨骼肌、脂肪和肺脏等4个组织中高表达;但在人类疾病和小鼠中的研究显示,GPIHBP1基因在肌肉组织中的表达量相对较低(姜延志等,2013;李蓝江等,2015;柳鑫等,2020)。本研究结果显示,GPIHBP1基因在色瓦绵羊乳腺、肌肉、心脏、肾脏、肝脏、小肠、瘤胃和卵巢等8个组织中均有表达,以乳腺中的相对表达量最高,其次是心脏和肝脏,在肌肉中的表达量最低。
综上所述,GPIHBP1基因在哺乳动物泌乳过程中发挥重要作用,且与LPL紧密相连,共同发挥作用,故推测GPIHBP1通过调节乳腺组织内脂蛋白代谢而影响乳脂的再合成,从而影响绵羊泌乳量(杨洁,2014)。本研究结论进一步证实,在色瓦绵羊的生长发育过程中,GPIHBP1基因与LPL基因共同作用而参与其泌乳调控作用,但今后还需深入研究GPIHBP1基因在乳腺组织中的生物学功能和调控机制,以揭示GPIHBP1与LPL共同作用乳脂脂解的具体作用机理。
4结论
GPIHBP1基因在色瓦绵羊不同组织中均有表达,且以乳腺中的相对表达量最高,可能与乳脂相关基因表达的增减有关,其中,GPIHBP1基因与LPL基因共同作用而参与绵羊泌乳调控。
参考文献:
陈建宁.2015.猪GPIHBP1基因启动子功能研究[D].雅安:四川农业大学.[Chen JN.2015.Analysis of pig GPIHBP gene promoterfunction[D].Ya'an:Sichuan Agricultura University.]
符汉宇,石华辉,张路清,谭占坤,刘锁珠,徐业芬.2023.电刺激器法在西藏色瓦绵羊人工采精中的应用试验[J].高原农业,6(1):24-30.[Fu HY,Shi HH,Zhang LQ,Tan ZK,Liu SZ,XuYF.2023.Experimental application of the electric stimulator method in the artificial semen collection of Tibetan Seva sheep[J].Journal of Plateau Agriculture,6(1):24-30.]doi:10.19707j.cnki.jpa.2023.01.004.
韩雪峰.2007.西农萨能奶山羊乳腺cDNA文库构建和LPL基因的克隆与序列分析[D].杨凌:西北农林科技大学.[Han XF.2007.Construction of cDNA library of Xinong Saaned dairy goat mammary glamd and cloning and sequence analysis of LPL gene[D].Yangling:Northwest Aamp;FUniversity.]
郝志云.2018.绵羊乳腺组织RNA-Seq及STAT5a基因遗传特征分析[D].兰州:甘肃农业大学.[Hao ZY.2018.Sheep mammary gland RNA-Seq and genetic characteristics of STAT5a genes[D].Lanzhou:Gansu Agricultural Univer-sity.]
侯飞.2011.黄牛ANGPTL4、GPIHBP1基因SNPs检测及其与生长性状的关联分析[D].杨凌:西北农林科技大学[Hou F.2011.The analysis ANGPTL4,GPIHBP1 SNP of"bovine and association with growth traits[D].Yangling:Northwest Aamp;FUniversity.]
姜延志,岑王敏,邢淑华,陈建宁,李学伟.2013.GPIHBP1分子与血浆中甘油三酯脂蛋白脂解代谢研究进展[J].畜牧兽医学报,44(5):665-672.[Jiang YZ,Cen WM,Xing SH,Chen JN,LiXW.2013.Newinsights in GPIHBP1and the intravascular processing of triglyceride-rich lipopro-teins[J].Acta Veterinaria et Zootechnica Sinica,44(5):665-672.]doi:10.11843/j.issn.0366-6964.2013.05.001.
李蓝江,李贺,黄颖,杨瑞,廖泽容,张鸿明,许冰莹.2015.GPIHBP1基因rs142861814位点多态性与高甘油三酯血症的相关性[J].昆明医科大学学报,36(7):50-53.[Li LJ,Li H,Huang Y,Yang R,Liao ZR,Zhang HM,Xu BY.2015.The correlation between GPIHBP1 gene rs142861814loci polymorphism and hypertriglyceridemia[J].Journal of Kunming Medical University,36(7):50-53.]doi:10.3969/j.issn.1003-4706.2015.07.011.
李永青,操礼军.2022.荷斯坦奶牛泌乳相关基因研究进展[J].草食家畜,(3):1-5.[LiYQ,Cao LJ.2022.Research progress on lactation related genes in Holstein dairy cows[J].Grass-feeding Livestock,(3):1-5.]doi:10.16863/j.cnki.1003-6377.2022.03.001.
柳鑫,徐有青,崔纯莹,赵志刚.2020.GPIHBP1基因敲除小鼠在严重高三酰甘油血症急性胰腺炎导致肺损伤研究中的应用[J].首都医科大学学报,41(4):564-569.[Liu X,Xu YQ,Cui CY,Zhao ZG.2020.Application of GPIHBP1 gene knockout mice in the study of lung injury induced by acute pancreatitis with severehypertriglyceride-mia[J].Journal of Capital Medical University,41(4):564-569.]doi:10.3969/j.issn.1006-7795.2020.04.012.
邵会,程志鹏,孙家乐,任子利.2022.日粮中添加不同浓度牛至油对色瓦绵羊血液生理生化指标的影响[J].高原农业,6(4):356-361.[Shao H,Cheng ZP,Sun JL,Ren ZL.2022.Effects of different concentrations of oregano essen-tial oil on blood physiological and biochemical indexes of Sewa sheep[J].Journalof Plateau Agriculture,6(4):356-361.]doi:10.19707j.cnki.jpa.2022.04.006.
王耀梅,田孟芳,孙家乐,任子利,赵彦玲.2021.不同蛋白质水平精料对色瓦绵羊生产性能及生长速度、肉品质相关基因表达的影响[J].黑龙江畜牧兽医,(16):92-98.[Wang YM,Tian MF,Sun JL,Ren ZL,Zhao YL.2021.Effects of different protein concentrate level on production performance,growth speed and meat quality related gene expression in Sewa sheep[J].Heilongjiang Animal Scien ce and Veterinary Medicine,(16):92-98.]doi:10.13881j.cnki.hljxmsy.2021.03.0400.
邢淑华.2013.猪GPIHBPl和ApoCI基因分子作用机理的初步研究[D].雅安:四川农业大学.[Xing SH.2013.Primary study on molecular mechanism of the porcine GPIHBP1 and ApoCIl genes[D].Ya'an:Sichuan Agricul-tural University.]
杨洁.2014.奶牛产奶性状候选基因GPIHBP1功能验证及基于RNA-seq候选基因挖掘[D].北京:中国农业大学[Yang J.2014.Functional verification of GPIHBP1 for milk production traits and detection of candidate genes based onRNA-sequencing[D].Beijing:China Agricultural University.]
扎西次仁,扎西旺杰,次仁桑珠,鲍兴旺,尼玛拉姆,白久扎西,宋天增.2020.色瓦绵羊肉营养品质特性研究[J].当代畜禽养殖业,(11):8-10.[Tashitsering,Tashiwangjie,Tseringsangzhu,Bao XW,Nimalam,Baijiutashi,Song TZ.2020.Study on nutritional quality characteristics of Sewa sheep[J].Modern Animal Husbandry,(11):8-10.]doi:10.14070/j.cnki.15-1150.2020.11.002.
Beigneux AP,Davies BS J,Tat S,Chen J,Gin P,Voss CV,Weinstein MM,Bensadoun A,Pullinger CR,Fong LG,Young SG.2011.Assesing the role of the glycosylphosp-hatidylinositol-anchored high density lipoprotein-binding protein1(GPIHBP1)three-finger domain in binding lipo-protein lipase[J].Journal of Biological Chemistry,286(22):19735-19743.doi:10.1074/jbc.M111.242024.
Beigneux AP,Weinstein MM,Davies BS J,Gin P,Bensa-doun A,Fong LG,Young SG.2009a.GPIHBP¹and"lipolysis:An update[J].CurrentOpinion in Lipidology,20(3):211-216.doi:10.1097/mol.0b013e32832ac026.
Beigneux AP,Davies BS J,Gin P,Weinstein MM,Farber E,Qiao X,Peale F,Bunting S,WalzemR L,Wong JS,Blaner WS,Ding ZM,Melford K,WongsirirojN,Shu X,de Sauvage F,Ryan RO,Fong LG,Bensadoun A,Young SG.2007.Glycosylphosphatidylinositol-anchored high-density lipoprotein-binding protein Iplays acritical rolein the lipolytic processing of chylomicrons[J].Cell Meta-bolism,5(4):279-291.doi:10.1016/j.cmet.2007.02.002.
Beigneux AP,Gin P,Davies BSJ,Weinstein MM,Bensa-doun A,Fong LG,Young SG.2009b.Highly conserved cysteines within the Ly6domain of GPIHBP1 are crucial for the binding of lipoprotein lipase[J].Journal of Biologi-cal Chemistry,284(44):30240-30247.doi:10.1074/jbc M109.046391.
Dallinga-Thie GM,Franssen R,MooijHL,VisserM E,Carli-jne Hassing H,Peelman F,KasteleinJ JP,Péterfy M,Nieuwdorp M.2010.The metabolism of triglyceride-rich lipoproteins revisited:New players,new insight[J].Athe-rosclerosis,211(1):1-8.doi:10.1016/j.atherosclerosis.2009.12.027.
Davies BSJ,Goulbourne CN,Barnes RH,Turlo KA,Gin P,Vaughan S,Vaux DJ,Bensadoun A,Beigneux AP,Fong LG,Young SG.2012.Assessing mechanisms of GPIHBP1and lipoprotein lipase movement across endo-thelial cells[J].Journal of Lipid Research,53(12):2690-2697.doi:10.1194/jlr.m031559.
Gin P,Yin LY,Davies BSJ,Weinstein MM,Ryan RO,Ben-sadounA,Fong LG,Young SG,Beigneux AP.2008.The acidic domain of GPIHBP¹is important for thebinding of lipoprotein lipase and chylomicrons[J].Journalof Biologi-cal Chemistry,283(43):29554-29562.doi:10.1074/jbc.M802579200.
Ioka RX,Kang MJ,Kamiyama S,Kim DH,Magoori K,KamatakiA,Ito Y,TakeiYA,Sasaki M,SuzukiT,Sasano H,Sakai J,Fujino T,Yamamoto TT.2003.Expression cloning and characterization of anovel glycosylphospha-tidylinositol-anchored high density lipoprotein-binding protein,GPI-HBP¹[J].Journal ofBiological Chemistry,278(9):7344-7349.doi:10.1074/jbc.M211932200.
Jang L,Liu JF,Sun DX,Ma PP,Ding XD,Yu Y,Zhang Q.2010.Genome wide association studies for milk produc-tion traits in Chinese Holstein population[J].PLoS One,5(10):el3661.doi:10.1371/journal.pone.0013661.
Merkel M,Eckel RH,Goldberg IJ.2002.Lipoprotein lipase[J].Journal of Lipid Research,43(12):1997-2006.doi:10.1194/jlr.R200015-JLR200.
Olivecrona G,Ehrenborg E,Semb H,Makoveichuk E,Lind-berg A,Hayden MR,Gin P,Davies BS J,Weinstein MM,Fong LG,Beigneux AP,Young SG,Olivecrona T,Hernell O.2010.Mutation of conserved cysteines in the Ly6domain of GPIHBP¹in familial chylomicronemia[J].Journal of Lipid Research,51(6):1535-1545.doi:10.1194/jlr.M002717.
Wang H,Eckel RH.2009.Lipoprotein lipase:From gene to obesity[J].American Journal of Physiology,297(2):E271-E288.doi:10.1152/ajpendo.90920.2008.
Wang J,Hegele RA.2007.Homozygous missense mutation(G56R)in glycosylphosphatidylinositol-anchored high-density lipoprotein-binding protein1(GPI-HBP1)in two siblings withfasting chylomicronemia(MIM144650)[J].Lipids in Health and Disease,6:23.doi:10.1186/1476-511X-6-23.
Weinstein MM,Yin LY,Beigneux AP,Davies BS J,Gin PEstrada K,Melford K,Bishop JR,Esko JD,Dallinga-Thie GM,Fong LG.2008.Abnormal patterns of lipopro-tein lipase release into the plasma in GPIHBP¹-deficient mice[J].Journal ofBiological Chemistry,283(50):34511-34518.doi:10.1074/jbc.m806067200.
Yang J,Liu X,Zhang Q,Jiang L.2014.Identification and quan-titative mRNA analysis of anovel splice variant of GPIHBPl in dairy cattle[J].Journal of Animal Science and"Biotechnology,5(1):50.doi:10.1186/2049-1891-5-50.
Young SG,Davies BSJ,Fong LG,Gin P,Weinstein MM,Bensadoun A,BeigneuxAP.2007.GPIHBP1:An endothe-lial cell molecule important for the lipolytic processing of chylomicrons[J].Current Opinion in Lipidology,18(4):389-396.doi:10.1097/MOL.0b013e3281527914.
(责任编辑 兰宗宝)

