小鼠MyoD基因诱导绵羊脐带间充质干细胞为成肌细胞的研究
张 宝,马丽媛,王春生,杜文敬,朴善花,安铁洙
(东北林业大学生命科学学院,哈尔滨150040)
小鼠MyoD基因诱导绵羊脐带间充质干细胞为成肌细胞的研究
张 宝,马丽媛,王春生,杜文敬,朴善花,安铁洙*
(东北林业大学生命科学学院,哈尔滨150040)
摘 要:为了探讨小鼠MyoD基因诱导绵羊脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)为成肌细胞的可能性,本研究用小鼠MyoD-pcDNA3.1真核表达载体质粒转染绵羊UCMSCs,在观察细胞形态变化的同时,检测成肌细胞标记蛋白表达、表达成肌细胞特异蛋白的细胞比率和成肌细胞特异基因mRNA相对表达量。结果显示,与对照组(未转染)相比,在转染MyoD-pcDNA3.1质粒后第21天,大部分细胞呈现似成肌细胞的细长管状;与对照组未表达相关蛋白相比,转染MyoD-pcDNA3.1后第8天,在荧光倒置显微镜下观察到细胞表达MyoD和Desmin蛋白荧光,转染后第16天,不仅观察到细胞表达MyoD和Desmin,而且观察到MyoG蛋白的表达;对于转染细胞后22d的细胞进行流式细胞仪检测显示,表达MyoD、MyoG和Desmin的细胞比率分别达93.5%、97.4%和99.5%;此外,实时荧光定量PCR检测显示,转染MyoD-pcDNA3.1后第28天,其细胞中的MyoD、MyoG和Desmin mRNA相对表达量分别提高2.046、2.389和5.489倍。上述结果表明,利用小鼠MyoD构建真核表达载体具有诱导UCMSCs分化为成肌细胞的功效。
关键词:小鼠;MyoD基因;绵羊脐带间充质干细胞;诱导;成肌细胞
脐带间充质干细胞(Umbilical cord mesenchymal stem cells,UCMSCs)具有与其他成体干细胞类似的自我更新和多向分化能力。诱导UCMSCs为其他体细胞的相关研究在探明细胞重编程机制中具有重要意义。目前,已建立包括人在内的多种动物UCMSCs分离培养及纯化流程[1-2],该细胞分离培养简便,且因其体外可分化为胰岛β细胞[3]、肝细胞[4]、心肌细胞[5]等而备受关注。研究证实,利用MyoD基因构建的真核表达质粒,不仅能够诱导肌卫星细胞为成肌细胞,而且能诱导其他已分化细胞为成肌细胞[6]。韦林盖等[7]利用分离培养的蒙古羊骨髓间充质干细胞诱导成脂、成骨和成软骨细胞获得成功。但有关动物异源MyoD基因诱导分化UCMSCs为成肌细胞的研究鲜有报道。鉴于此,本研究利用前期构建的小鼠MyoD-pcDNA3.1真核表达载体转染绵羊UCMSCs,探讨其诱导绵羊UCMSCs为成肌细胞的可能性,为建立简便、有效的利用UCMSCs获取成肌细胞新方法提供依据。
1 材料与方法
1.1材料
DMEM/F12培养基、0.25%Trypsin、bFGF和EGF均购自Gibco公司;GFP质粒由东北林业大学生命科学学院动物发育研究室制备;脂质体转染试剂购自TIANGEN公司;反转录试剂盒购自TaKaRa公司;MyoD1Rabbit PolyAb、Desmin Rabbit PolyAb和MyoG Rabbit PolyAb1均购自Proteintech公司;Goat Anti-rabbit IgG FITC购自康为世纪公司;绵羊UCMSCs为实验室冷冻储备细胞;小鼠MyoD-pcDNA3.1真核表达载体由东北林业大学生命科学学院动物发育研究室构建[8]。
1.2绵羊UCMSCs的培养与诱导
用DMEM/F12(1∶1)(含10%FBS、1%谷氨酰胺、1%双抗、4ng/mL EGF和4ng/mL bFGF),采用常规方法将冷冻保存的绵羊UCMSCs进行复苏培养和传代培养。传代培养至3~4代,在细胞达到50%~60%汇合时,按照脂质体转染试剂说明书分别转染GFP质粒(阳性对照)和小鼠MyoD-pcDNA3.1真核表达载体质粒;转染24h后,用DMEM/F12(1∶1)(含10%FBS、1%谷氨酰胺、1%双抗)培养基进行连续培养。
1.3诱导细胞的检测
1.3.1细胞形态特点 当用GFP质粒和小鼠MyoD-pcDNA3.1真核表达载体质粒转染绵羊UCMSCs并对其进行连续培养后,每隔24h在荧光倒置显微镜下观察转染细胞的形态变化和细胞表达GFP而发出绿色荧光的情况。
1.3.2成肌细胞标记物的检测 用12孔培养板培养对照组(未经转染细胞)和诱导细胞,在开始培养后的第8和16天,用预冷的PBS轻轻漂洗,室温下添加4%多聚甲醛进行固定15min,PBS清洗3次;添加1.0%TritonX-100并置于冰上5min,PBS清洗3次;分别添加稀释100倍的MyoD1Rabbit PolyAb、Desmin Rabbit PolyAb和MyoG Rabbit PolyAb1(一抗),置于37℃培养箱中孵育45min,PBS清洗3次;添加稀释500倍的Goat Anti-rabbit IgG FITC(二抗),置于37℃培养箱中孵育45min,PBS清洗2次。经上述处理后,在荧光倒置显微镜下观察细胞是否有表达相应蛋白所发出的荧光。
1.3.3表达成肌细胞特异蛋白的细胞比率检测
将对照组和诱导培养细胞,在开始培养后的第22天,用BD Accuri-C6个人流式细胞仪检测,所获数据通过Accuri CFlow Plus软件输出后,利用FlowJo软件进行数据分析,获得表达成肌细胞MyoD、Desmin和MyoG蛋白的细胞比率。
1.3.4成肌细胞特异基因mRNA相对表达量的检测 在开始诱导培养后的第28天,利用反转录试剂盒,分别提取对照组和诱导培养细胞的RNA并反转录为cDNA,用实时荧光定量PCR检测成肌细胞的标记基因MyoD、MyoG和Desmin,内参用GAPDH基因。根据GenBank中山羊GAPDH基因序列和标记基因序列,利用Oligo 6.0和Primer Premier 6.0软件设计引物,引物序列见表1。PCR反应体系20μL:SYBR Premix ExTaq(2×)10μL,上、下游引物各0.4μL,模板cDNA 2μL,ROX Reference DyeⅡ(50×)0.4μL,ddH2O 6.8μL。PCR反应条件:95℃30s;95℃3s,60℃34s。

表1 引物序列Table 1 Primer sequences
2 结果与分析
2.1诱导细胞的形态学特征
采用脂质体转染法将GFP质粒转染绵羊UCMSCs,结果发现,转染24h后,在荧光倒置显微镜下有少量发出荧光细胞,在转染后的48h有80%以上细胞发出荧光(图1)。采用相同方法,将MyoD-pcDNA3.1质粒转染绵羊UCMSCs,结果发现,与未经转染的细胞(对照组)呈长梭形且旋涡状排列(图2A)相比,在转染MyoD-pcDNA3.1质粒后第12天,可见部分细胞呈现似成肌细胞的细长状或星形(图2B);在转染后的第21天,大部分细胞呈现似成肌细胞的细长管状(图2C)。

图1 转染GFP质粒的绵羊UCMSCs(50×)Fig.1 Sheep UCMSCs transfected with GFP plasmid(50×)

图2 转染MyoD-pcDNA3.1的绵羊UCMSCs形态Fig.2 Morphology of sheep UCMSCs transfected with MyoD-pcDNA3.1
2.2诱导细胞表达成肌细胞标记物的检测
将MyoD-pcDNA3.1转染传代培养的绵羊UCMSCs并诱导培养后,采用免疫组织化学方法检测细胞表达成肌细胞标志蛋白情况,结果发现,与对照组(图3A)未表达相关蛋白相比,经转染MyoD-pcDNA3.1的绵羊UCMSCs,在开始诱导培养后第8天,在荧光倒置显微镜下,分别观察到细胞表达MyoD和Desmin蛋白所呈现的荧光(图3B、3C);在转染MyoD-pcDNA3.1后第16天,分别观察到诱导细胞表达MyoD、Desmin和MyoG蛋白所呈现的荧光(图3D、3E、3F)。
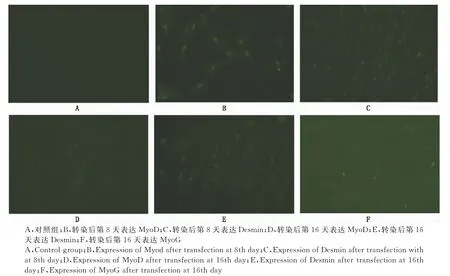
图3 诱导细胞表达成肌细胞标记物的检测(50×)Fig.3 Detection of induced cell myoblast markers(50×)
2.3 表达成肌细胞特异蛋白的细胞比率检测
当用MyoD-pcDNA3.1转染传代培养的绵羊UCMSCs后第22天,用BD Accuri-C6流式细胞仪检测表达成肌细胞特异蛋白的细胞比率,其数据通过Accuri CFlow Plus软件输出,并利用FlowJo软件分析获得表达MyoD、Desmin和MyoG蛋白的细胞比率,结果见图4。由图4可知,所检测的细胞中表达成肌细胞特异因子MyoD、MyoG和Desmin蛋白的细胞比率分别为93.5%、97.4%和99.5%。

图4 诱导细胞表达MyoD(A)、MyoG(B)和Desmin(C)流式分析图Fig.4 The flow analysis chart of MyoD(A),MyoG(B)and Desmin(C)induced cell
2.4诱导细胞的成肌细胞特异基因mRNA相对表达量的检测
以GAPDH基因为内参,通过实时荧光定量PCR扩增、熔解曲线分析及根据2-ΔΔCt计算方法,分别检测未经诱导(对照组)的绵羊UCMSCs和经MyoD- pcDNA3.1转染诱导培养后的第28天诱导细胞的MyoD、MyoG和Desmin基因mRNA的相对表达量,结果见图5。由图5可知,当对照组的表达量为1时,诱导细胞的MyoD、MyoG和Desmin mRNA相对表达量较对照组分别提高2.046、2.389和5.489倍。

图5 诱导细胞成肌细胞特异基因mRNA相对表达量Fig.5 The mRNA relative expression of myoblast specific genes induced culture
3 讨 论
研究证实,受肌肉生长抑制素(myostatin,MSTN)调控的MyoD和Myf5在干细胞分化为成肌细胞过程中起作用[9-10]。肌分化因子MyoD(myf3)和肌细胞生成素MyoG在成肌细胞及骨骼肌中高表达[11-12]。Li等[13]研究表明,在未分化的肌源性细胞中Desmin表达被抑制,但随着成肌细胞的融合,其表达量逐渐增加至最高值。研究发现,小鼠Desmin基因的启动子中具有CREB结合位点,MyoD可以与CREB结合蛋白相互作用[14-15]。上述结果表明,MyoD蛋白能够激活Desmin和MyoG基因表达,从而引起未分化的肌源性细胞分化为成肌细胞,并诱发其向骨骼肌分化。
Rudnicki等[16]建立了利用MyoD基因构建真核表达载体以诱导成肌细胞的方法。采用该方法,不仅能够诱导肌卫星细胞为成肌细胞,而且能诱导其他已分化细胞为成肌细胞[17-18]。上述结果表明,MyoD基因构建的真核表达载体方法诱导成肌细胞有效。此外,MyoD和MyoG在成肌细胞及骨骼肌中高表达[11-12]。此外,随着成肌细胞的融合,Desmin表达量逐渐增加。上述结果表明,MyoD、MyoG和Desmin可作为检测成肌细胞的标志性蛋白。
以往在转染MyoD质粒以诱导成肌细胞的相关研究中,主要利用源于同种动物(包括人)的MyoD基因,鲜有利用异源动物MyoD诱导成肌细胞的相关报道。为了探讨利用异源MyoD诱导成肌细胞的可能性,本研究将前期工作中构建的小鼠MyoD真核表达质粒[8]转染绵羊UCMSCs后,检测其是否分化为成肌细胞,结果显示,在转染MyoD-pcDNA3.1质粒后第21天,大部分细胞呈现似成肌细胞的细长管状;在转染MyoD-pcDNA3.1第8天,可观察到细胞表达MyoD和Desmin蛋白,转染后第16天,不仅观察到细胞表达MyoD和Desmin,而且MyoG蛋白表达呈阳性;对转染细胞后22d的细胞进行流式细胞仪检测显示,表达MyoD、MyoG和Desmin的细胞比率分别达93.5%、97.4%和99.5%;实时荧光定量PCR检测显示,转染MyoD-pcDNA3.1后第28天,其细胞中的MyoD、MyoG和Desmin mRNA相对表达量分别提高2.046、2.389和5.489倍。上述结果表明,利用异源MyoD构建的真核表达载体具有诱导UCMSCs分化为成肌细胞的功效,但能否利用异源MyoD诱导其他成体细胞干细胞或体细胞分化为成肌细胞有待于进一步研究探讨。
4 结 论
本研究用小鼠MyoD-pcDNA3.1真核表达载体质粒转染绵羊UCMSCs,结果发现,在转染后的第21天,大部分细胞呈现似成肌细胞的细长管状;在开始诱导培养后的第8天,分别观察到细胞表达MyoD和Desmin蛋白所呈现的荧光,转染后第16天,分别观察到诱导细胞表达MyoD、Desmin和MyoG蛋白所呈现的荧光。表明利用异源MyoD构建的真核表达载体具有诱导MSCs分化为成肌细胞的功效。
参考文献:
[1] von Heimburg D,Zachariah S,Low A,et al.Influence of different biodegradable carriers on theinvivobehavior of human adipose precursor cells[J].Plast ReconstrSurg,2001,108(2):411-420.
[2] Qiu P B,Bai Y F,Liu C H,et al.A dose-dependentfunction of follicular fluid on the proliferation and differentiation of umbilical cord mesenchymal stem cells(UCMSCs)of goat[J].HistochemCellBiol,2012,138(4):593-603.
[3] Tang D Q,Cao L Z,Burkhardt B R,et al.Invivoandinvitrocharacterization of insulin-producing cells obtained from murine bone marrow[J].Diabetes,2004,53(7):1721-1732.
[4] Min J S,Su Y S,Yong C B,et al.Differentiation of human adipose stromal cells into hepatic lineagein vitroandinvivo[J].Biochemical&BiophysicalResearchCommunications,2005,328(1):258-264.
[5] Pereira W C,Khushnooma I,Madkaikar M,et al.Reproducible methodology for the isolation of mesenchymal stem cells from human umbilical cord and its potential for cardiomyocyte generation[J].Journal ofTissueEngineeringandRegenerativeMedicine,2008,2(7):394-399.
[6] Rudnicki M A.Jaenisch R.The MyoD family of transcription factors and skeletal myogenesis[J].Bioessays,1995,17(3):203-209.
[7] 韦林盖,刘宗正,高晋芳,等.蒙古羊骨髓间充质干细胞的分离培养及多向诱导分化[J].中国畜牧兽医,2013,40(8):7-12.
[8] 马丽媛,王春生,杜文敬,等.小鼠MyoD基因真核表达载体的构建与检测[J].黑龙江畜牧兽医,2015,7:47-51.
[9] Sharma M,Kambadur R.Myostatin,a transforming growthfactors-beta superfamily member is expressed in heartmuscle and id up-regulated in cardiomyocytes after in farct[J].JCellPhysiol,1999,180(1):1-9.
[10] Langley B,Thomas M,Bishop A,et al.Myostatin inhibits myoblast differentiation by down-regulating MyoD expression[J].JBiolChem,2002,277(51):49831-49840.
[11] Rawls A,Morris J H,Rudnicki M,et al.Myogenin's functions do not overlap with those of MyoD or Myf-5 during mouse embryogenesis[J].Developmental Biology,1995,172(1):37-50.
[12] Molkentin J D,Olson E N.Combinatorial control of muscle development by basic helix-loop-helix and MADS-box transcription factors[J].Proceedingsof theNationalAcademyofSciences,1996,93(18):9366-9373.
[13] Li Z,Mericskay M,Agbulut O,et al.Desmin is essential for the tensile strength and integrity of myofibrils but not for myogenic commitment,differentiation,and fusion of skeletal muscle[J].Journalof CellBiology,1997,139(1):129-144.
[14] Li H,Capetanaki Y.Regulation of the mouse desm in gene:Transactivation by MyoD,myogenin,MRF4and Myf5[J].NucleicAcidsResearch,1993,2:335-343.
[15] 薛 超,安星兰,王春生,等.小鼠骨骼肌Desmin启动子的克隆及表达活性分析[J].黑龙江畜牧兽医,2011,4:12-15.
[16] Rudnicki M A,Jaenisch R.The MyoD family of transcription factors and skeletal myogenesis[J].Bioessays,1995,17(3):203-209.
[17] 李 冲.猪MyoD、MSTN基因RNA干扰及其功能相互关系的研究[D].哈尔滨:东北农业大学,2007.
[18] 周秀娟,黄 峻,姚 堃,等.MyoD基因诱导大鼠心脏成纤维细胞分化为成肌细胞的实验研究[J].南京医科大学学报(自然科学版),2006,26(4):238-241.
(责任编辑 晋大鹏)
中图分类号:Q813
文献标识码:A
文章编号:1671-7236(2016)12-3232-07
doi:10.16431/j.cnki.1671-7236.2016.12.022
收稿日期:2016-05-09
基金项目:黑龙江省自然科学基金面上项目(2016012);国家自然科学基金(31000990)
作者简介:张 宝(1992-),男,内蒙古呼伦贝尔人,硕士,研究方向:干细胞定向分化,E-mail:zhangbao182@163.com
通信作者:*安铁洙,教授,博士生导师,研究方向:转基因动物与体细胞重编程,Tel:0451-82191785;E-mail:antiezhu@qq.com
Study on Differentiation of Sheep Umbilical Cord Mesenchymal Stem Cells into Muscle Cells Induced by MouseMyoDGene
ZHANG Bao,MA Li-yuan,WANG Chun-sheng,DU Wen-jing,PIAO Shan-hua,AN Tie-zhu*
(CollegeofLifeScience,NortheastForestryUniversity,Harbin150040,China)
Abstract:In order to investigate the differentiation of sheep umbilical cord mesenchymal stem cells(UCMSCs)into muscle cells induced by mouseMyoDgene.This study based on the previous work constructed the eukaryotic expression vector of MyoD-pcDNA3.1in mice,and the vector was transfected into sheep UCMSCs.The morphological changes of cells were observed by fluorescent microsco,the expression ofMyoD,DesminandMyoGgenes were detected by immunofluorescence,the percentage of cells expressing the cell specific factor(MyoD,Desmin and MyoG)was analyzed by flow cytometry and Real-time quantitative PCR to detect the relative expression of mRNA relative to muscle cell specific factor.Compared with the control group(no transfection),the vector was transfected into sheep UCMSCs,it was found that the cells were transformed into a long,slender,muscular cell state,and the cell spiral gradually disappeared at 21th day.It was found that MyoD and Desmin showed positive expression by immunofluorescence assay at 8th day,the expression of MyoG was also found after 16dof induction,and the expression of MyoD decreased,the amount of Desmin expression was no change;By flow cytometry,the percentages of the expression of MyoD,MyoG and Desmin were 93.5%,97.4%and 99.5%,re-spectively;Real-time quantitative PCR results showed that the relative expression of MyoD,MyoG and Desmin were increased and compared with the control group(non transfected cells),the cells were increased by 2.046,2.389and 5.489times,respectively.The results showed that mouceMyoDgene could induce the differentiation of sheep UCMSCs into muscle cells.
Key words:mouse;MyoDgene;sheep umbilical cord mesenchymal stem cells;induction;myoblasts

