上海市肉鸽沙门氏菌的分离鉴定及流行血清型和耐药性分析
梁德媚,许学斌,王伟芳,詹泽强,任行星,林嘉特,廖 明,张建民*
(1.华南农业大学兽医学院,广东省动物源性人兽共患病预防与控制重点实验室,广州510642;2.上海市疾病预防控制中心,上海200336;3.广州市白云区江高镇畜牧兽医站,广州510450)
上海市肉鸽沙门氏菌的分离鉴定及流行血清型和耐药性分析
梁德媚1,许学斌2,王伟芳3,詹泽强1,任行星1,林嘉特1,廖 明1,张建民1*
(1.华南农业大学兽医学院,广东省动物源性人兽共患病预防与控制重点实验室,广州510642;2.上海市疾病预防控制中心,上海200336;3.广州市白云区江高镇畜牧兽医站,广州510450)
摘 要:为了解上海市农贸市场肉鸽群体中沙门氏菌流行血清型和耐药情况,本试验于2011—2014年间从上海市各区农贸市场采集肉鸽新鲜粪便样本92份,用XLD平板和沙门氏菌属显色培养基分离疑似沙门氏菌,革兰氏染色镜检并进行生化试验,共获得沙门氏菌24株,分离率为26.1%。采用Kauffmann-White法和K-B纸片法对24株沙门氏菌进行血清型鉴定和16种抗生素的药敏试验。血清型鉴定显示,24株沙门氏菌可分为鼠伤寒(66.7%)、阿贡纳(25.0%)和科瓦利斯(8.3%)3种血清型。药敏试验结果显示,有75.0%(18株)的分离株表现出不同程度耐药,其中分离株对四环素和磺胺异�唑耐药率最高,均达到62.5%,其次为链霉素(58.3%)、萘啶酸(50.0%)、氨苄西林(20.8%)。多重耐药菌株15株(62.5%),耐4种抗菌药物的菌株最多,占16.7%(7株)。另外,分离菌株对头孢吡肟、头孢噻肟、头孢噻甲羧肟、亚胺培南、氧氟沙星等5种药物的敏感率为100.0%,对奥格门丁和环丙沙星有12.5%的中介敏感率。本研究结果表明,上海市肉鸽中沙门氏菌的携带率较高,且菌株多重耐药现象较严重,这为食品中沙门氏菌的防控工作带来较大的挑战和风险,肉鸽沙门氏菌的流行和耐药情况应值得密切关注。
关键词:肉鸽;沙门氏菌;血清型;耐药性
沙门氏菌是一种重要的人兽共患病原菌,其对人、家畜、家禽及其他动物均有致病性。据数据显示,沙门氏菌每年可造成8×103~1.65×104万人感染,60万人死亡,给人类健康和社会经济带来巨大威胁[1]。在公共卫生学意义上,沙门氏菌也是导致人类食物中毒的主要食菌之一,其分布广泛,污染途径也较多,动物肉制品、蔬菜水果及饮水都可通过食物链直接或间接引起人类感染。世界各国的各类细菌性食物中毒的统计数据显示,由沙门氏菌引起的食物中毒在英国和中国内陆地区排第1位,在美国则为第2位。在中国,由沙门氏菌引起的食物中毒占细菌性食物中毒的70%~80%,其中沙门氏菌污染最为严重的是动物源性食品[2]。随着人们生活水平的提高,人类的肉类消费习惯呈现多样化,鸽子作为一种食物出现在餐桌上的频率也逐渐增多。沙门氏菌作为鸽子的一种常见病原体,其引起沙门氏菌的风险也在随着肉鸽消费量的升高而逐渐增大。国外相关研究[3]表明,鸽子是沙门氏菌的重要储存宿主之一,病原体污染食物后通过食物链传播给人类,有危及公共健康的风险。然而,目前国内关于鸽源沙门氏菌的流行血清型和耐药情况的研究较少,大多局限于沙门氏菌的临床鉴定和治疗。因此,及时了解和掌握肉鸽食品中沙门氏菌的流行及耐药情况,才能更好地应对其对人类食品安全带来的挑战和风险,这在兽医学及公共卫生学上均具有重要意义。本研究通过分析了解2011—2014年上海市肉鸽沙门氏菌的流行血清型和耐药特征,为预防肉鸽沙门氏菌感染的发生及公共卫生意义上的抗生素使用策略提供参考。
1 材料与方法
1.1材料
2011—2014年从上海市各区农贸市场随机采集肉鸽新鲜粪便样本92份;法国科玛嘉沙门显色培养基、XLD琼脂粉均购自青岛海博生物技术有限公司;革兰氏染色液购自江苏宝莱生物科技有限公司;肠杆菌科细菌GYZ-15e生化编码鉴定管、M-H琼脂购自上海星科生物科技有限公司;沙门氏菌诊断血清O抗原和H抗原均购自S&A公司;16种药敏纸片:四环素(TET,30μg/片)、氯霉素(C,30μg/片)、氨苄西林(AMP,25μg/片)、亚胺培南(IMP,10μg/片)、奥格门丁(AMC,30μg/片)、头孢吡肟(FEP,30μg/片)、头孢噻肟(CTX,30μg/片)、头孢噻甲羧肟(CAZ,30μg/片)、庆大霉素(CN,30μg/片)、链霉素(S,25μg/片)、环丙沙星(CIP,10μg/片)、氧氟沙星(OFX,5μg/片)、奈啶酸(NA,30μg/片)、复方新诺明(SXT,25μg/片)、磺胺异恶唑(SF,300μg/片)、甲氧苄胺嘧啶(W,5μg/片)均购自Oxoid公司;生物显微镜(型号CX12)购自北京瑞科中仪科技有限公司;质控菌株大肠埃希菌ATCC 25922由华南农业大学兽医学院动物传染病教研室保存。
1.2细菌分离培养
采集肉鸽新鲜粪便置于无菌容器中及时送检。将92份肉鸽粪便样本无菌划线接种于XLD琼脂平板,37℃恒温培养18~24h,然后取培养皿上的典型菌落(无色半透明有黑色中心或几乎全为黑色)接种于法国科玛嘉显色培养基,37℃增菌培养18~24h。大肠埃希菌ATCC 25922作为质控菌。
1.3细菌染色镜检
挑取上述显色培养基上的圆形、光滑、淡紫色的可疑菌落,在洁净玻片上滴一滴无菌水,涂片固定制成菌膜后,再按结晶紫初染1min,碘液媒染1min,酒精脱碘30s,蕃红复染1min的步骤依次进行革兰氏染色操作,待玻片干燥,在显微镜镜下观察分离菌株的形态特征。若为革兰氏阴性(染成红色),两端钝圆的较细长短杆菌,则将其所在的培养皿单个菌落无菌接种于普通营养琼脂培养基获得纯培养物。
1.4细菌生化鉴定
取上述分离细菌纯培养物分别接种肠杆菌科细菌GYZ-15e生化编码鉴定管,进行硫化氢、苯丙氨酸、葡萄糖酸盐、蛋白胨水(靛基质试验)、葡萄糖磷酸盐胨水(MR)、西蒙氏柠檬酸盐、尿素、半固体琼脂、三糖铁琼脂、赖氨酸脱羧酶、鸟氨酸脱羧酶、棉子糖、山梨醇、侧金盏花醇、木糖15项生化试验,37℃培养24h,根据细菌的生化特征确定沙门氏菌株。
1.5血清型鉴定
用上述分离株进行血清型鉴定。分离株的血清型鉴定按照沙门氏菌血清型凝集试验说明书进行,参照White-Kauffmann-Le Minor(WKLM)抗原表,确定每株沙门氏菌分离株的血清型。
1.6药物敏感试验
选用16种临床常用抗菌药物,采用WHO推荐的药敏纸片琼脂扩散法(Kirby-Baue法)测定分离菌株对抗菌药物的敏感性。最后测量药敏试验抑菌环直径,严格依照美国临床实验室标准化委员会(CLSI/NCCLS)制定的标准[4]判定敏感(S)、中介(I)和耐药(R)。
2 结果与分析
2.1细菌分离培养结果
初步分离出的疑似沙门氏菌菌株在XLD培养基呈边缘光滑、圆形、大的带光泽的黑色菌落形态(图1),在法国科玛嘉沙门氏菌显色培养基呈圆形、边缘光滑、淡紫色菌落形态(图2)。

图1 XLD平板上的疑似沙门氏菌菌落Fig.1 Suspected colonies from XLD plates

图2 沙门氏菌属显色培养基上的疑似菌落Fig.2 Suspected colonies fromSalmonellachromogenic medium
2.2染色镜检结果
革兰氏染色后显微镜观察纯化培养物的染色特性,为革兰氏阴性、两端钝圆短杆菌(图3)。
图3 革兰氏染色镜检结果(125×)Fig.3 Gram stain microscopy image(125×)
2.3生化鉴定结果
对分离出来的疑似沙门氏菌进行生化鉴定,结果见表1。结合选择培养基分离及染色镜检结果,根据生化鉴定结果判断,从92份肉鸽粪便样本中共分离得到24株沙门氏菌,分离率为26.1%。
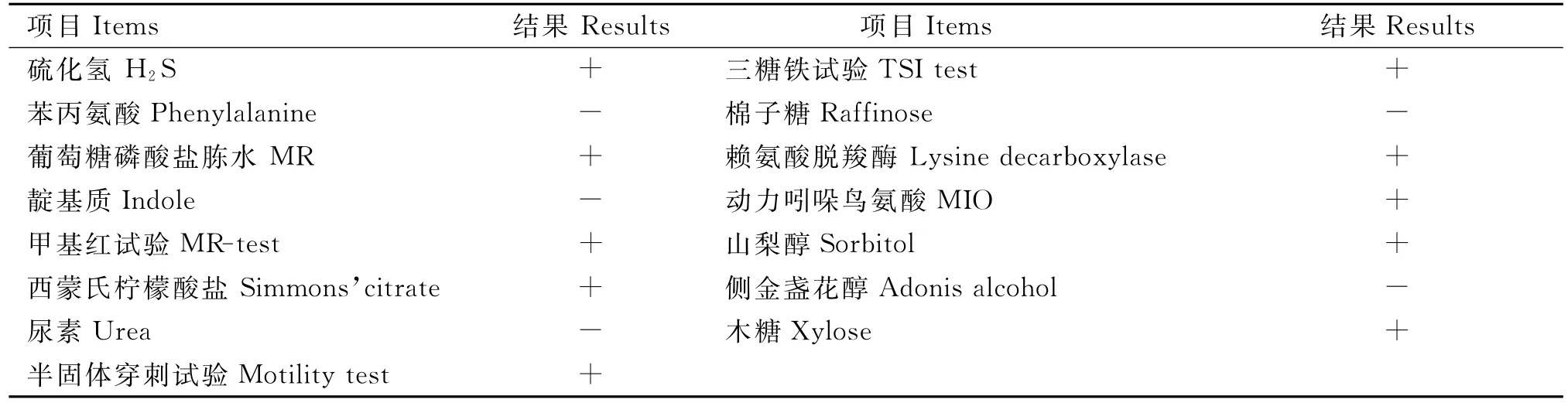
表1 生化鉴定结果Table 1 Biochemical test results
2.4沙门氏菌血清型分析
由图4可知,对24株分离株进行沙门氏菌抗原血清型鉴定发现,24株分离株可分为3个血清型,其中鼠伤寒沙门氏菌16株(66.7%),阿贡纳沙门氏菌6株(25.0%),科瓦利斯沙门氏菌2株(8.3%)。

图4 沙门氏菌血清型鉴定结果Fig.4 Identification result ofSalmonellaserotype
2.5 药敏试验结果
药敏试验结果显示,24株沙门氏菌株中有18株(75.0%)表现不同程度的耐药,其中鼠伤寒沙门氏菌13株(72.2%)、阿贡纳沙门氏菌3株(16.7%)、科瓦利斯沙门氏菌2株(11.1%)。沙门氏菌分离株对四环素和磺胺异唑耐药率最高,均为62.5%;对头孢吡肟、头孢噻肟、头孢噻甲羧肟及奥格门丁、亚胺培南、氧氟沙星、环丙沙星7种药物则均未表现明显耐药;对奥格门丁和环丙沙星两者中度敏感比例均达12.5%。耐链霉素、萘啶酸、氨苄西林、庆大霉素的分离菌株分别占58.3%、50.0%、20.8%和8.3%;耐氯霉素、复方新诺明、甲氧苄胺嘧啶的菌株则均占12.5%。总体看来,分离株对第3代、第4代头孢菌素最为敏感,抑菌率均高达100.0%(表2)。
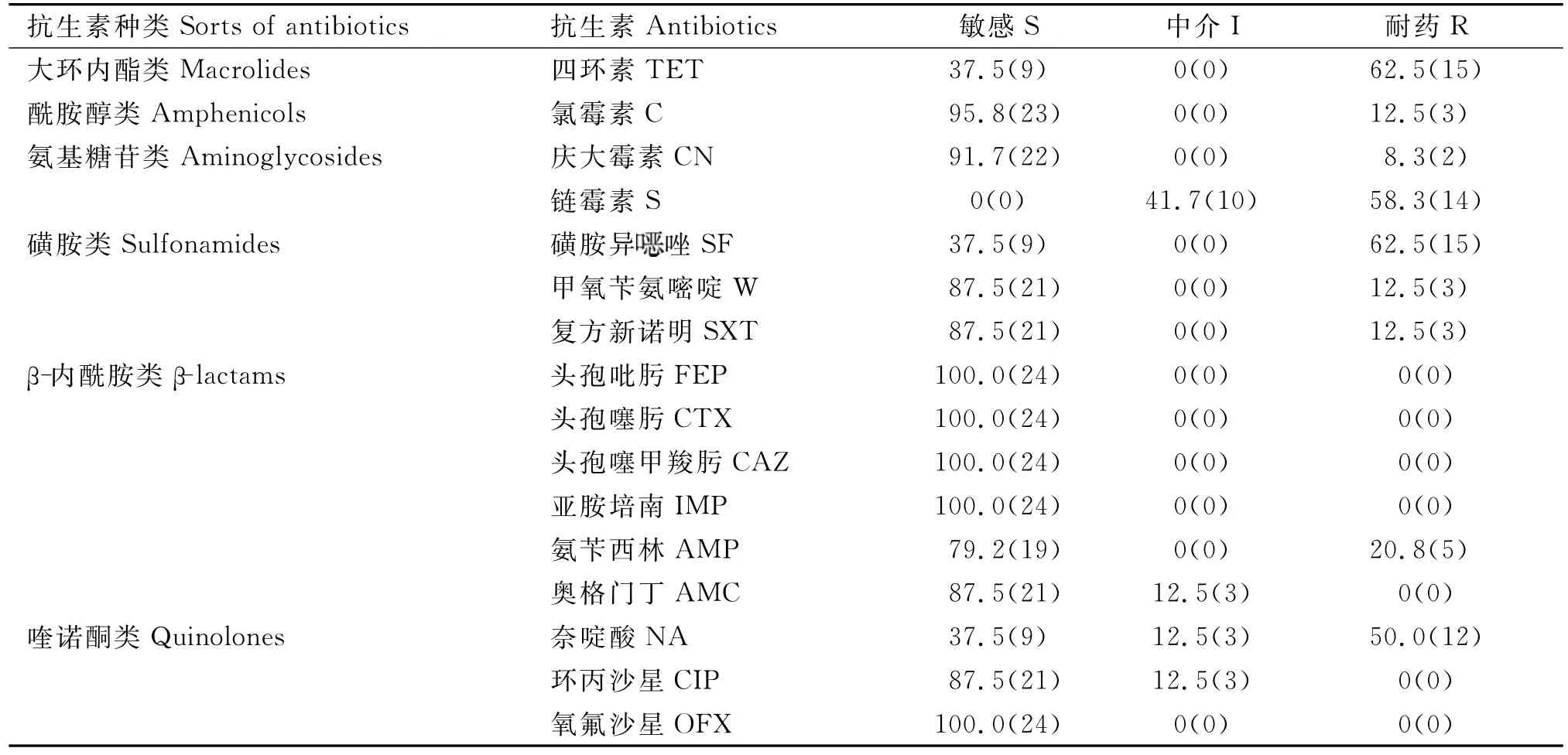
表2 药敏试验结果(%)Table 2 Results of drug susceptibility test
多重耐药菌株(耐3种及3种抗生素)的耐药谱见表3。由表3可知,多重耐药菌株有15株,占菌株总数的62.5%,其中有2株鼠伤寒沙门氏菌最高耐受7种抗生素。最常见的耐药谱是四环素(TET)/萘啶酸(NA)/磺胺异恶唑(SF)/链霉素(S)。鼠伤寒沙门氏菌、阿贡纳沙门氏菌和科瓦利斯沙门氏菌分别有4、2、2种不同的耐药谱,总体来看,不同血清型的耐药谱虽有差异但相似度较高。

表3 多重耐药沙门氏菌的耐药谱分析Table 3 Resistance spectrum analysis of multi-drug resistantSalmonella
3 讨 论
沙门氏菌是一种常见的人畜共患病原体,血清型复杂,有2 500多种,据报道,中国目前存在的血清型有292种[5],其中多种血清型可交叉感染人和动物,在畜禽中出现较多的鼠伤寒沙门氏菌、肠炎沙门氏菌及猪霍乱沙门氏菌等可引起人类发生伤寒、胃肠炎和败血症等疾病。沙门氏菌病常通过摄入被沙门氏菌污染的各种畜禽产品、水果、蔬菜而感染,尤其是被污染的动物及其制品[6]。沙门氏菌是鸽子的一种常见病原体,可通过食物链传给人类,因此,研究肉鸽群体沙门氏菌血清型和耐药性有助于预防食品沙门氏菌感染的发生,为控制沙门氏菌病、减少耐药性菌株的出现和扩散提供科学依据。
本试验结果发现,肉鸽群体沙门氏菌分离率为26.1%,与国外研究结果一致[7],但与国内有关研究显示的多种动物沙门氏菌平均携带率为11.1%(其中鸡14.38%、鸭11.28%、犬8.74%、猪8.65%)[8]相比,沙门氏菌在肉鸽群体的分离率相对较高。血清型鉴定结果表明,一方面,24株肉鸽沙门氏菌分离株以鼠伤寒沙门氏菌(66.7%)为优势血清型,这与中国华南地区的报道一致[9],与此同时,赵玉林[10]报道的杨凌、西安、宝鸡3个地区中,牛源、鸡源、猪源、羊源鼠伤寒沙门氏菌的检出率比肉鸽群体低,分别为12.5%、13.0%、15.8%和12.5%,这表明肉鸽群体中鼠伤寒沙门氏菌的检出率较高。另一方面,根据上海市临床监测数据[11],由沙门菌引起腹泻的病人中,鼠伤寒沙门菌也是优势血清型,这也说明肉鸽群体中致病性沙门菌很有可能通过食物链使人类感染。鼠伤寒沙门氏菌目前是中国临床常见的沙门氏菌致病血清型,其在动物、食品和低龄儿童中的感染率和致病力很高,因此加强肉鸽群体沙门氏菌的防控十分必要。阿贡纳沙门氏菌也是较为常见的血清型,近年来国内外因阿贡纳沙门氏菌感染引起食物中毒和疾病的例子也屡有报道。本试验结果发现阿贡纳沙门氏菌的检出率达25.0%,较目前其他报道的检出率(3.0%)高[12],应引起重视。
随着抗生素在临床上的广泛使用,沙门氏菌耐药问题越发突出,质粒、整合子、转座子介导等方式可使耐药基因在细菌之间进行广泛传播,从而导致新的耐药菌株乃至超级菌株不断出现,给人类和动物沙门氏菌感染的治疗带来严峻挑战[13]。本研究药敏试验结果显示,75.0%(18株)沙门氏菌株表现出不同程度耐药,分离株对传统抗生素如四环素、磺胺异唑、链霉素、萘啶酸等耐药率较高(50.0%以上),与沈海燕等[14]、沈隽卿等[15]结果一致。分离菌株对链霉素耐药的中介率高达41.7%,表明在药物的持续诱导和选择作用下,沙门氏菌对链霉素的耐药性会持续上升,这提示在临床选择药物时应谨慎选用链霉素。第3代头孢菌素和第3代喹诺酮类药物是治疗沙门氏菌感染的常用药物,本试验结果发现所有沙门氏菌分离株对头孢噻肟和环丙沙星分别为100.0%、87.5%的敏感率,与现有研究结果相近[16]。但也有文献报道,人临床分离株对头孢噻肟和环丙沙星的耐药率分别为10%和19%以上[17-18],因此,临床用药应引起重视。
本试验结果发现,62.5%(15株)沙门氏菌株耐3种(含3种)以上抗菌药物,多重耐药现象严重。本试验中最常见的多重耐药谱为四环素(TET)-萘啶酸(NA)-磺胺异唑(SF)-链霉素(S),这4类抗生素都是常用的,多重耐药表型的出现主要是因为抗生素滥用产生的高选择压力和耐药基因的水平传递,具有此耐药谱的菌株能否成为优势菌株值得密切关注。鼠伤寒沙门氏菌有3个不同的耐药谱,至少可耐受3种抗菌药物,还有2株鼠伤寒沙门氏菌可耐受7种以上的抗菌药物,这与张增峰[19]对上海市临床鼠伤寒沙门氏菌的耐药性检测数据相似。随着鼠伤寒沙门氏菌越来越成为食源性沙门氏菌的重要检出血清型,分析其耐药情况,对临床治疗药物筛选有着重要的指导作用。阿贡纳沙门氏菌的多重耐药谱与禽源、人源阿贡纳分离株的耐药谱相似[20-21],表明沙门氏菌的耐药性可在不同动物之间进行交叉传播。科瓦利斯沙门氏菌在中国属于罕见血清型,本试验中,仅有的2株科瓦利斯沙门氏菌耐药谱与鼠伤寒沙门氏菌和阿贡纳沙门氏菌耐药谱相似,均表现多重耐药。
4 结 论
本研究获得了上海市肉鸽致病沙门氏菌流行血清学和耐药情况的数据,对制定肉鸽群体中沙门氏菌疾病防控措施及治疗方法具有重要意义。本研究发现上海市农贸市场肉鸽群体沙门氏菌携带率较高,耐药情况较严重,对沙门氏菌病原体的防控工作带来较大挑战和风险。为确保食品安全,有关食品监管部门应改进和加强禽类农贸产品的卫生管理工作,杜绝沙门氏菌的产生源头。另外,在养殖生产中,应该科学用药,如采取交替用药、轮换用药、联合用药等方式,有条件的最好结合实验室药物敏感试验选择所用的药物,以避免或减少耐药菌株的产生。
参考文献:
[1] Zhang J,Wang F,Jin H,et al.Laboratory monitoring of bacterial gastroenteric pathogensSalmonellaandShigellain Shanghai,China 2006—2010[J].EpidemiolInfect,2015,143(3):478-485.
[2] 杨德胜,张险朋,黄炳炽,等.动物产品沙门菌污染情况调查[J].中国畜牧兽医,2010,37(10):202-203.
[3] Tanaka C,Miyazawa T,Watarai M,et al.Bacteriological survey of feces from feral pigeons in Japan[J].VeterinaryMedicalScience,2005,67(9):951-953.
[4] Clinical and Laboratory Standards Institute(CLSL).M100-S19Performance Standards for Antimicrobial Susceptibility Testing;Nineteenth Informational Supplement[S].USA,2009.
[5] 吕殿红,温肖会,翟少伦,等.蛋鸡群沙门氏菌的监测[J].安徽农业科学,2016,44(19):163-165.
[6] 焦新安,屠常春,黄金林,等.我国食源性人兽共患细菌病流行现状及其防控对策[J].中国家禽,2009,31(19):4-11.
[7] Vlahovic K,Matica B,Bata I,et al.Campylobacter,SalmonellaandChlamydiain free-living birds of Croatia[J].WildlifeReseach,2004,50(3):127-132.
[8] 李红星,王晓梅,马 莉,等.动物携带沙门菌监测结果分析[J].中国卫生检验杂志,2005,15(5):581-582.
[9] 李雪雁,付 涛,纪桂云,等.华南地区肉鸽源沙门氏菌的鉴定及遗传进化分析[J].中国畜牧兽医,2014,41(7):207-211.
[10] 赵玉林.鸡源多重耐药沙门菌Ⅰ类整合子与耐药基因特征研究[D].杨凌:西北农林科技大学,2012.
[11] 倪佳琳,马 蓉,胡雪明,等.159株沙门菌血清型鉴定和耐药性分析[J].中国卫生检验杂志2013,23(4):1012-1014.
[12] Russo E T,Biggerstaff G,Hoekstra R M A,et al.A recurrent,multistate outbreak ofSalmonellasero-type agona infections associated with dry,unsweetened cereal consumption,United States,2008[J].FoodProtection,2013,76(2):227-230.
[13] 杜雄伟,李 叶,王晓辉,等.沙门菌耐药机制的研究进展[J].江苏农业科学,2010,6:487-490.
[14] 沈海燕,郭慧霞,许学斌,等.上海市零售禽肉制品和活禽中沙门氏菌血清型与耐药性研究[J].中国畜牧兽医,2014,41(11):263-266.
[15] 沈隽卿,张月娟,袁国平,等.2012—2014年上海宝山区沙门菌监测分析及能力评估[J].疾病检测,2016,31(7):546-553.
[16] Zhang J,Jin H,Hu J,et al.Serovars and antimicrobial resistance of non-typhoidSalmonellafrom human patients in Shanghai,China,2006—2010[J].EpidemiolInfect,2014,142(4):826-832.
[17] 程春荣,安 戈,罗 琦,等.145株株沙门菌耐药性分析[J].河南预防医学杂志,2012,23(4):256-261.
[18] 吴建宁,吴佳音,李舒宁,等.厦门地区156株儿童感染型腹泻沙门菌的血清学分型及耐药性分析[J].现代预防医学,2016,43(13):2435-2438.
[19] 张增峰.上海市临床鼠伤寒沙门氏菌耐药性和食品载体溯源研究[D].杨凌:西北农林科技大学,2016.
[20] 杨筱薇,旷 代,张建民,等.上海市禽源阿贡纳沙门菌耐药性及脉冲场凝胶电泳分型研究[J].中国畜牧兽医,2014,41(2):213-217.
[21] Dai K,Zhang J,Yang X W,et al.Antimicrobial susceptibility and molecular typing ofSalmonellaagona isolated from humans and other sources[J].FoodbornePathogens andDisease,2014,11(11):1-6.
(责任编辑 董晓云)
中图分类号:S836
文献标识码:A
文章编号:1671-7236(2016)12-3322-07
doi:10.16431/j.cnki.1671-7236.2016.12.035
收稿日期:2016-05-12
基金项目:公益性行业(农业)科研专项(201403054);广东省大学生科技创新培育专项资金(pdjh2016a0072)
作者简介:梁德媚(1992-),女,广东云浮人,学士,研究方向:细菌传染病,E-mail:wyyxldm@163.com
通信作者:*张建民(1983-),河南内黄人,副教授,硕士生导师,研究方向:动物传染病,E-mail:junfeng-v@163.com
Isolation,Identification and Analysis of Serotype and Drug Resistance ofSalmonellafrom Pigeon in Shanghai
LIANG De-mei1,XU Xue-bin2,WANG Wei-fang3,ZHAN Ze-qiang1,REN Xing-xing1,LIN Jia-te1,LIAO Ming1,ZHANG Jian-min1*
(1.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China;2.ShanghaiCenterforDiseaseControl,Shanghai200336,China;3.GuangzhouAnimalHusbandryand
VeterinaryStationofHighRiverTowninBaiyunDistrict,Guangzhou510450,China)
Abstract:The purpose of this study was to investigate the molecular types and antimicrobial resistance ofSalmonellaisolated from pigeon in Shanghai from 2011to 2014.A total of 92fecal samples were collected from markets.XLD plate andSalmonellachromogenic medium were used to isolate suspectedSalmonellacolonies,and then determined the number ofSalmonellathrough gram staining and biochemical tests.Among them,24(26.1%)were positive forSalmonella.Kauffmann-White method and the K-B method were used respectively for serotype identification and susceptibility testing.In result,serological identification showed that 24isolates from pigeon could be divided into 3serotypes includingS.typhimurium(66.7%),S.agona(25.0%)andS.corvallis(8.3%).Drug susceptibility test showed that 75.0%of the isolates were resistant to one antibiotic at least.The highest level resistance were found for tetracycline as well as sulfisox-azole(62.5%),followed by streptomycin(58.3%),nalidixic acid(50.0%)and ampicillin(20.8%).Multi-drug resistant strains accounted for 62.5%(15),in which the largest number of strains(7,16.7%)were resistant to four drugs.In addition,isolates were 100.0%susceptible to cefepime,cefotaxime,ceftazidime,imipenem and ofloxacin,but 12.5%were moderately sensitive to the amoxicillin/clavulanic acid and ciprofloxacin.The study showed thatSalmonellahad a high separation rate of pigeon in Shanghai farmers market and performed serious multidrug resistance,which would bring great challenges and risks to the prevention and control ofSalmonellain food,so that the prevalence and drug resistance ofSalmonellain pigeon deserved close attention.
Key words:pigeon;Salmonella;serotype;drug resistance

