Nsp9基因在Marc-145细胞上对猪繁殖与呼吸综合征病毒复制的影响
赵孟孟,冯松林,王文佳,邢 星,冯嘉萍,张桂红*
(1.河南农业大学牧医工程学院,郑州450002;2.华南农业大学兽医学院,国家生猪种业工程技术研究中心,
广东省动物源性人兽共患病预防与控制重点实验室,广州510642;3.河南牧业经济学院制药工程学院,郑州450046;4.广西钦州保税港区出入境检验检疫局,钦州535008)
Nsp9基因在Marc-145细胞上对猪繁殖与呼吸综合征病毒复制的影响
赵孟孟1,2,冯松林2,王文佳3,邢 星4,冯嘉萍2,张桂红2*
(1.河南农业大学牧医工程学院,郑州450002;2.华南农业大学兽医学院,国家生猪种业工程技术研究中心,
广东省动物源性人兽共患病预防与控制重点实验室,广州510642;3.河南牧业经济学院制药工程学院,郑州450046;4.广西钦州保税港区出入境检验检疫局,钦州535008)
摘 要:试验旨在验证Nsp9基因是否影响猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的复制。构建含有Nsp9全长基因的质粒pIRES2-EGFP-Nsp9,并转染到Marc-145细胞中,接毒之后分别通过实时荧光定量PCR和Western blotting方法测定PRRSV N蛋白在mRNA和蛋白水平的表达。结果显示,转染Nsp9基因的Marc-145细胞上PRRSV的N蛋白在mRNA水平上显著高于未转染Nsp9基因的对照组(P<0.05),是对照组的1.5倍,同时转染Nsp9基因后的Marc-145上PRRSV N蛋白水平也明显高于对照组。随着剂量的增加,N蛋白的表达量在mRNA和蛋白水平都有所增加。由以上结果初步可知,Nsp9基因可以在Marc-145细胞上促进PRRSV的复制,Nsp9基因与其复制密切相关。
关键词:猪繁殖与呼吸综合征病毒;Nsp9基因;Marc-145细胞;复制
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)属于套式病毒目(Nidovirales)、动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus)成员[1-3],是一种有囊膜的单股正链RNA病毒,同属的还有马动脉炎病毒(EAV)、鼠乳酸脱氢酶病毒(LDV)及猴出血热病毒(SHFV)。其基因组长度为15kb,包含有10个开放阅读框(ORFs)。从5′端到3′端依次为ORFla、ORFlb和ORF2-ORF7,每个ORF和其相邻的ORF部分重叠。在其5′端和3′端分别有一非编码区,5′端非编码区前有一个“帽子”结构,3′端非编码区后有多聚腺苷酸(poly A)尾巴[4-6]。ORF2-ORF7编码病毒结构蛋白,其中ORF2-ORF5编码病毒的糖基化蛋白,ORF6编码膜基质蛋白(M),ORF7编码核衣壳蛋白(N)。ORF1占病毒基因组的80%,编码病毒的非结构蛋白(nonstructural protein,Nsp),参与病毒的复制。ORF1a可继续水解为Nsp1a、Nsp1b、Nsp2-Nsp6、Nsp7a、Nsp7b及Nsp8,ORFlb水解为Nsp9、Nsp10、Nsp11、Nsp12。
Nsp9基因位于ORFlb中,编码RNA依赖的RNA聚合酶(RNA dependent RNA polymerase,RdRp),RdRp在所有正链RNA病毒中都编码,进而形成转录复制混合物的亚单位结构[7]。有报道称,Nsp9基因与宿主蛋白视网膜神经胶质瘤蛋白、膜联蛋白A2、DEAD-box RNA解旋酶相互作用促进病毒复制[8-10],针对Nsp9基因的siRNA及化合物会抑制病毒复制[11-16],并且Nsp9基因相对其他病毒蛋白高度保守[17-18],但Nsp9基因本身是否可以促进病毒复制鲜有报道。本试验旨在通过过表达Nsp9基因来验证其是否可以促进病毒复制,为研究Nsp9基因的作用奠定基础。
1 材料与方法
1.1材料
1.1.1细胞、菌株和质粒 BHK细胞、pIRES2-EGFP载体和pMD18-T-Nsp9模板均由农业部兽用疫苗创制重点实验室保存;胎牛血清、培养细胞所用DMEM均购自Gibco公司;双抗购自广州展晨公司;大肠杆菌DH5α感受态细胞购自天根生化科技(北京)有限公司。
1.1.2主要试剂及仪器 Premix Ex Taq DNA聚合酶、内切酶XhoⅠ和HindⅢ、DL2000DNA Marker、SYBR?Premix Ex Taq(Tli RNaseH Plus)均购自宝生物工程(大连)有限公司;凝胶回收和质粒提取试剂盒均购自Omega公司;总RNA提取试剂TRIzol?Reagent购自Invitrogen公司;琼脂糖购自Biowest公司;溴化乙锭(EB)购自宝泰克生物科技(北京)有限公司;EZNA Endo-free Plasmid Mini KitⅠ购自Omega公司;裂解液RIPA购自北京百泰克生物技术有限公司;PRRSV Nsp9蛋白单克隆抗体、PRRSV N蛋白单克隆抗体均由农业部兽用疫苗创制重点实验室保存;GAPDH购自北京博奥森生物科技有限公司。
1.2方法
1.2.1引物设计与合成 根据PRRSV Nsp9基因序列特征,应用Primer Premier 6.0软件设计引物,引物序列为:上游引物(Nsp9P3-F):5′-AGCT GTCGATTTAAACTGCTAGCCGCCAGCG-3′;下游引物(Nsp9P4-R):5′-ATAGGATCC CTCATGATTGGACCCTGAGTTTTTC-3′,下划线部分分别为XhoⅠ、HindⅢ酶切位点。PRRSV N蛋白实时荧光定量引物:qN-F:5′-AAACCAGTCCAGAGGCAAGG-3′;qN-R:5′-GCAAACTAAACTCCACAGTGTAA-3′。GAPDH实时荧光定量引物:GAPDH-F:5′-CTGCCGCCTGGAGAAACCT-3′;GAPDH-R:5′-GCTGTAGCCAAATTCATTGTCG-3′。引物均由上海立菲生物科技有限公司合成。
1.2.2pIRES2-EGFP-Nsp9真核表达载体的构建以pMD18-T-Nsp9质粒为模板进行PCR扩增,PCR反应体系50μL:Premix Ex Taq DNA聚合酶25μL,上、下游引物(10pmol/μL)各1μL,cDNA 2μL,去离子水21μL。PCR反应程序:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸3min,30个循环;72℃延伸7min。PCR产物用1.0%琼脂糖凝胶(含0.5μg/mL EB)电泳检测后纯化回收。将PCR产物与pIRES2-EGFP空载体分别用XhoⅠ、HindⅢ内切酶进行双酶切。酶切产物使用T4DNA连接酶连接后构建pIRES2-EGFP-Nsp9真核表达载体。
1.2.3转染Marc-145细胞 连接产物转化大肠杆菌DH5α感受态细胞并通过菌液PCR电泳筛选出阳性克隆送往上海立菲生物科技有限公司测序。序列测定为阳性的菌液参照Endo-free Plasmid Mini说明书进行去内毒素重组质粒的抽提。参照脂质体Lipofectamine 2000说明书将构建的pIRES2-EGFP-Nsp9真核表达载体转染到Marc-145细胞中。
1.2.4Western blotting 将转染48h的细胞样品弃去上清,用PBS清洗细胞3次,用100μL RIPA裂解液进行裂解,之后加入25μL上样缓冲液,沸水中加热10min,13 000r/min离心10min,取上清进行SDS-PAGE蛋白胶电泳,电泳结束后取出凝胶。采用半干转膜方法,15V电压转移60min,5%脱脂奶粉封闭1h,过夜封闭一抗(Nsp9单克隆抗体),洗膜3次,每次5min,用TBST缓冲液按1∶8 000稀释的IRDye 800CW Goat Antimouse IgG(H+L)37℃孵育1h,洗膜3次,每次5min,放入双色激光分析系统Odyssey(LI-COR公司生产),设置适当的参数后拍照记录。
1.2.5Marc-145细胞的接毒 Marc-145细胞转染24h之后,以MOI=1的剂量接种PRRSV XH-GD毒株,24h后采集样品。
1.2.6N蛋白mRNA的表达水平 接毒后24h,将病变细胞培养液反复冻融3次,4℃、12 000r/min离心10min,取上清液250μL置于DEPC水处理过的1.5mL灭菌离心管中,按照Trizol?Reagent RNA提取试剂的使用说明书提取病毒总RNA。参照M-MLV反转录酶的说明书进行反转录。反转录体系20μL:RNA 9.5μL,RNase Inhibitor 0.5μL,5×MLV Buffer 4.0μL,dNTPs 4.0μL,M-MLV 1.0μL,反转录引物1.0μL。混匀后,置42℃水浴1h,冰浴2min,反转录产物(cDNA)直接进行实时荧光定量PCR反应或-20℃保存备用。同时设置转染空载体对照组。
以反转录完的样品为模板进行实时荧光定量PCR反应。PCR反应体系20μL:SYBR?Premix Ex Taq(Tli RNaseH Plus)(2×)10μL,上、下游引物各0.4μL,ROX Reference DyeⅡ(50×)0.4μL,DNA模板2μL,ddH2O 6.8μL。PCR反应程序:94℃预变性5min;94℃变性10s,55℃退火20s,72℃延伸30s,45个循环。
1.2.7Western blotting验证N蛋白的表达水平
具体操作步骤参照1.2.4,其中一抗为N蛋白或GAPDH抗体。
1.2.8TCID50的测定 在96孔细胞培养板上接种Marc-145细胞,待细胞生长达到85%以上时即可用样品进行接种。每个样品做10倍倍比稀释(即10-1至10-8倍比稀释,每个稀释度接种8孔,100μL/孔)。接毒后,将细胞板置于37℃、5%CO2细胞培养箱中孵育1.5h。孵育完毕后弃去病毒液,补入含2%新生牛血清的DMEM,然后置于37℃、5%CO2细胞培养箱中继续培养。连续观察2~7d,记录每个稀释度样品发生细胞病变的孔数,重复3次求其平均值,并按照Reed-Muench法计算各个样品的TCID50。
1.2.9剂量变化对N蛋白表达影响 在Marc-145细胞中转染不同的剂量(500、200、100ng)的质粒,接毒后分别参照1.2.6和1.2.7方法在mRNA和蛋白水平上检测N蛋白的表达变化。
1.2.10数据分析 实时荧光定量PCR数据采用GraphPad软件进行处理,统计学分析计算方法采用2-ΔΔCt,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1pIRES2-EGFP-Nsp9重组质粒的构建
以克隆质粒pMD18-T-Nsp9为模板,PCR扩增获得Nsp9基因的目的片段,产物进行1.0%琼脂糖凝胶电泳检测,结果见图1。由图1可知,目的片段在1 900bp左右,与理论值相符,可以进行后续试验。

图1 PCR产物凝胶电泳结果Fig.1 Agarose gel electrophoresis of PCR product
2.2 pIRES2-EGFP-Nsp9重组质粒的鉴定
对PCR纯化产物及pIRES2-EGFP空载体进行XhoⅠ、HindⅢ双酶切,回收酶切产物,转化至大肠杆菌DH5α感受态细胞中,挑菌进行菌落PCR鉴定,结果见图2。由图2可知,重组质粒经过XhoⅠ、HindⅢ双酶切后出现1 900和5 600bp左右的片段,与预期结果相符,表明载体构建成功。

图2 pIRES2-EGFP-Nsp9重组质粒的双酶切Fig.2 Double enzyme digestion of pIRES2-EGFP-Nsp9
2.3转染Marc-145细胞
将质粒转染后的细胞进行Western blotting验证,一抗为Nsp9单抗。由图3可知,得到100ku的目的条带,与预期结果一致,说明质粒在Marc-145细胞中得到了有效的表达。
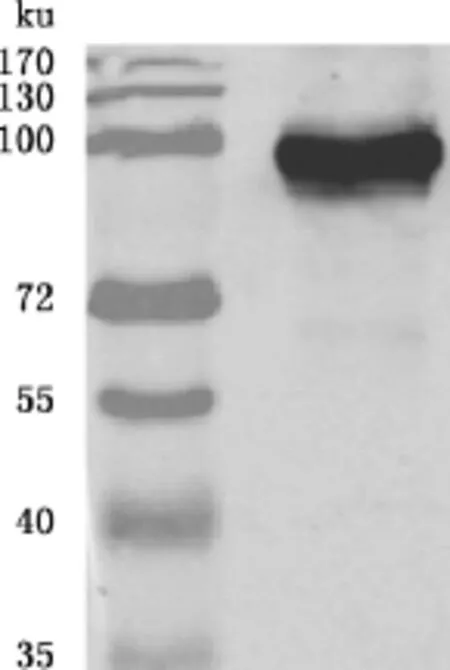
图3 质粒在Marc-145细胞上的表达Fig.3 Plasmid expressed in Marc-145cells
2.4N蛋白表达水平变化
通过实时荧光定量PCR方法检测N蛋白在mRNA表达水平上的变化,Western blotting检测在蛋白水平上的表达量,结果见图4。由图4可知,转染Nsp9基因的Marc-145细胞中病毒N蛋白的表达量在mRNA和蛋白水平均显著高于转染空载体的细胞(P<0.05)。

图4 N蛋白表达水平的变化Fig.4 Expression change of N protein
2.5TCID50变化
转染结束之后接毒,进行TCID50测试,结果见图5。由图5可知,转染Nsp9的细胞中病毒滴度显著高于转染空载的细胞(P<0.05),与mRNA和蛋白水平结果一致。
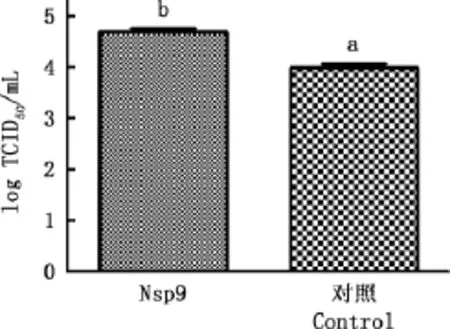
图5 病毒滴度的差异Fig.5 Variance of viral titer
2.6剂量变化对N蛋白的mRNA表达水平变化
在Marc-145细胞中转染不同剂量的质粒,接毒之后进行PCR检测,结果见图6。由图6可知,随着质粒剂量的增加,PRRSV病毒N蛋白的表达量在mRNA和蛋白水平上也有所增加。

图6 不同剂量下N蛋白水平的变化Fig.6 Expression change of N protein at different dose
3 讨 论
RNA病毒传播迅速,常给动物和人类造成巨大危害。许多RNA病毒的结构蛋白在基础研究和应用方面已日趋完善。相比之下,就非结构蛋白所做的研究较少,存在许多未知问题。在这些非结构蛋白中,病毒自身编码的RdRp对病毒的复制起关键作用[19]。对RdRp进行研究可以进一步阐明RNA病毒复制机理,为研制新的抗病毒靶标和诊断试剂提供可能。
PRRSV属于套式病毒目动脉炎病毒科,是一种专嗜在巨噬细胞内生长、有囊膜、单股正链RNA病毒[20]。病毒基因组全长约15kb,包括10个ORFs,其中ORF1a和ORF1b位于基因组的5′端,占据整个基因组的80%,编码RNA聚合酶和相关的蛋白酶,为非结构蛋白(Nsp1-Nsp12)。ORF2-ORF7位于基因组的3′端,编码主要和次要的结构蛋白。核苷酸序列分析表明,非结构蛋白Nsp9在不同PRRSV间同源性超过99.0%,具有较高的保守性。Nsp9为病毒复制酶,与其他动脉炎病毒一样,有1个核心氨基酸三体SDD和4个保守性的单股正链RNA病毒所共有的基序,突变其中的关键核心氨基酸三体SDD对病毒均为致死突变[21]。报道称,Nsp9不仅与毒力密切相关[22-23],还与细胞免疫、抗药性存在关联[24-26]。
已经有报道称针对Nsp9的siRNA可以抑制病毒的复制,针对Nsp9的化合物也可以抑制病毒复制,从侧面证明了Nsp9对病毒复制的影响。本试验在过表达Nsp9基因后,研究N蛋白在mRNA和蛋白水平的表达变化,研究其是否对PPRSV复制起关键作用。结果显示,Nsp9基因过表达后,N蛋白在mRNA和蛋白水平的表达均增加,且随着剂量的不断增加,N蛋白mRNA表达量有增加的趋势,说明Nsp9在体外就可以促进病毒复制,这前人研究结果一致。NCBI上预测Nsp9的活性区域在1 000~1 075nt,本研究克隆的是Nsp9基因全长,包括活性区域,而是否只表达活性区域就可以促进病毒的复制,需要进一步的试验验证。
Nsp9在PRRSV发生、发展中的具体作用尚不明确,同时该病毒Nsp9蛋白的提取较为困难,因此,用外源基因插入真核细胞进行表达成为有效方法之一。本研究前期利用pIRES2-EGFP载体表达Nsp9基因,通过IFA和Western blotting方法均得到验证,同时亚细胞定位结果表明该蛋白主要定位在细胞质中,与软件预测结果保持一致。
构建目的基因真核表达载体是开展基因治疗及进行相应的基础理论研究的关键因素。在本研究中所使用的pIRES2-EGFP真核表达载体,进入靶细胞后以附加体的形式存在,具有安全性好、容量大等特点。pIRES2-EGFP在多克隆位点与EGFP基因区之间有IRES区,可以使外源基因和EGFP基因同步表达,用于基因功能的研究。由于EGFP作为报告基因具有直观、及时、应用范围广等特点,因而在基因整合、细胞分选及转基因动物的研究中是其他报告基因所无法比拟的。另一方面,有报道指出将真核质粒pIRES2-EGFP直接注射到动物体内,在注射部位会有其携带基因的表达。因此,本研究中所构建的pIRES2-EGFP-Nsp9可以作为Nsp9蛋白生理功能研究的重要工具。
目前PRRSV呈世界性广泛分布,在主要养殖国家如美国、英国、中国、荷兰、德国等都有流行[27-29]。其长时间持续感染和抗体依赖性增强效应使得猪场的净化十分困难。而Nsp9对病毒的复制有至关重要的作用,设计针对该聚合酶基因的抑制剂可能是未来防制蓝耳病的一个方向。
4 结 论
本试验成功构建了真核表达载体pIRES2-EGFP-Nsp9,并将其转染至Marc-145细胞中,通过Nsp9基因过表达研究PPSRV N蛋白的表达变化。结果显示,Nsp9基因过表达使N蛋白表达量在mRNA和蛋白水平上增加,促进了病毒的复制,证明Nsp9基因参与病毒的复制,为进一步研究该基因的聚合酶活性与作用奠定了基础。
参考文献:
[1] Andreyev V G,Wesley R D,Mengeling W L,et al. Genetic variation and phylogenetic relationships of 22 porcine reproductive and respiratory syndrome virus(PRRSV)field strains based on sequence analysis of open reading frame 5[J].ArchVirol,1997,142(5):993-1001.
[2] Benfield D A,Nelson E,Collins J E,et al.Characterization of swine infertility and respiratory syndrome(SIRS)virus(isolate ATCC VR-2332)[J].JVetDiagnInvest,1992,4:127-133.
[3] Cavanagh D.Nidovirales:A new order comprising Coronaviridae and Arteriviridae[J].ArchVirol,1997,142:629-633.
[4] den Boon J A,Faaberg K S,Meulenberg J J,et al.Processing and evolution of the N-terminal region of the arterivirus replicase ORF1aprotein:Identification of two papainlike cysteine proteases[J].JVirol,1995,69:4500-4505.
[5] Snijder E J,Meulenberg J J.The molecular biology of arteriviruses[J].JGenVirol,1998,79(5):961-979.
[6] Meulenberg J J,Petersen den Besten A,de Kluyver E,et al.Molecular characterization of Lelystad virus[J].VetMicrobiol,1997,55(1-4):197-202.
[7] Beerens N,Selisko B,Ricagno S,et al.De novo initiation of RNA synthesis by the arterivirus RNA-dependent RNA polymerase[J].JVirol,2007,81(16):8384-8395.
[8] Dong J,Zhang N,Ge X,et al.The interaction of nonstructural protein 9with retinoblastoma protein benefits the replication of genotype 2porcine reproductive and respiratory syndrome virusinvitro[J].Virology,2014,464-465:432-440.
[9] Li J,Guo D,Huang L,et al.The interaction between host Annexin A2and viral Nsp9is beneficial for replication of porcine reproductive and respiratory syndrome virus[J].VirusRes,2014,189:106-113.
[10] Zhao S,Ge X,Wang X,et al.The DEAD-box RNA helicase 5positively regulates the replication of porcine reproductive and respiratory syndrome virus by interacting with viral Nsp9invitro[J].VirusRes,2015,195:217-224.
[11] Liu H,Wang Y,Duan H,et al.An intracellularly expressed Nsp9-specific nanobody in Marc-145cells inhibits porcine reproductive and respiratory syndrome virus replication[J].VetMicrobiol,2015,181:252-260.
中国特色社会主义道路自信是在探索民族解放和国家发展之道的过程中形成的。道路自信是对中国特色社会主义发展方向和未来命运的自信,也是对党领导中国人民走过的革命、建设和改革道路的自信。不论是“农村包围城市、武装夺取政权”的新民主主义革命道路,还是“一个中心,两个基本点”改革开放道路,都具有鲜明的、适合中国国情的中国特色。“走自己的路”无疑是中国共产党最大的道路自信;带领中华民族走出一片广阔天地,进一步强化了这种道路自信。中国特色社会主义道路的开创,对推进世界社会主义运动和发展中国家走向现代化的都具有重大意义。中国共产党的道路自信,不仅改变了中国,而且影响着世界。
[12] Gao L,Wang L,Huang C,et al.HP-PRRSV is attenuated by de-optimization of codon pair bias in its RNA-dependent RNA polymeraseNsp9gene[J].Vi-rology,2015,485:135-144.
[13] Gao L,Zhang W W,Sun Y P,et al.Cryptoporus volvatus extract inhibits porcine reproductive and respiratory syndrome virus(PRRSV)invitroandin vivo[J].PLoSOne,2013,8(5):e63767.
[14] Yang Q,Zhang Q,Tang J,et al.Lipid rafts both in cellular membrane and viral envelope are critical for PRRSV efficient infection[J].Virology,2015,484:170-180.
[15] Xie J,Zhou H,Cui J,et al.Inhibition of porcine reproductive and respiratory syndrome virus by specific siRNA targetingNsp9gene[J].InfectGenetEvol,2014,28:64-70.
[16] 袁 威,邓穗丹,邓又天,等.中药防制猪繁殖与呼吸综合征的研究进展[J].中国畜牧兽医,2013,40(2):193-197.
[17] Zhao M,Ning Z,Wang H,et al.Sequence analysis ofNSP9gene of 25PRRSV strains from Guangdong province,subtropical Southern China[J].Virus Genes,2013,46:88-96.
[18] 李嘉彬,赵孟孟,李玉谷,等.猪繁殖与呼吸综合征病毒变异株FS的分离鉴定与全基因组序列分析[J].中国畜牧兽医,2012,39(3):60-64.
[19] Den B A,Snijder E J,Chirnside E D,et al.Equine arteritis virus is not a togavirus but belongs to the coronaviruslike superfamily[J].JVirol,1991,65:2910-2920.
[20] Rascon-Castelo E,Burgara-Estrella A,Mateu E,et al.Immunological features of the non-structural proteins of porcine reproductive and respiratory syndrome virus[J].Viruses,2015,7(3):873-886.
[21] Zhou Y,Zheng H,Gao F,et al.Mutational analysis of the SDD sequence motif of a PRRSV RNA-dependent RNA polymerase[J].SciChinaLifeSci,2011,54(9):870-879.
[22] Li Y,Zhou L,Zhang J,et al.Nsp9and Nsp10contrib-ute to the fatal virulence of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China[J].PLoSPathog,2014,10(7):e1004216.
[23] Leng X,Li Z,Xia M,et al.Mutations in the genome of the highly pathogenic porcine reproductive and respiratory syndrome virus potentially related to attenuation[J].VetMicrobiol,2012,157(1-2):50-60.
[24] Burgara-Estrella A,Diaz I,Rodriguez-Gomez I M,et al.Predicted peptides from non-structural proteins of porcine reproductive and respiratory syndrome virus are able to induce IFN-gamma and IL-10[J].Viruses,2013,5(2):663-677.
[25] Parida R,Choi I S,Peterson D A,et al.Location of T-cell epitopes in nonstructural proteins 9and 10of type-Ⅱporcine reproductive and respiratory syndrome virus[J].VirusRes,2012,169(1):13-21.
[26] Tian D,Meng X J.Amino acid residues Ala283and His421in the RNA-dependent RNA polymerase of porcine reproductive and respiratory syndrome virus play important roles in viral ribavirin sensitivity and quasispecies diversity[J].JGenVirol,2016,97(1):53-59.
[27] An T Q,Zhou Y J,Liu G Q,et al.Genetic diversity and phylogenetic analysis of glycoprotein 5of PRRSV isolates in mainland China from 1996to 2006:Coexistence of two NA-subgenotypes with great diversity[J].Vet Microbiol,2007,7(20):43-52.
[28] Zhou L,Chen S,Zhang J,et al.Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China[J].VirusResearch,2009,10(1):97-105.
[29] Zhou L,Wang Z,Ding Y,et al.NADC30-like strain of porcine reproductive and respiratory syndrome virus,China[J].EmergInfectDis,2015,21:2256-2257.
(责任编辑 姚倩倩)
中图分类号:Q785
文献标识码:A
文章编号:1671-7236(2016)12-3114-07
doi:10.16431/j.cnki.1671-7236.2016.12.005
收稿日期:2016-02-16
基金项目:国家自然科学基金:猪繁殖与呼吸综合征病毒非结构蛋白Nsp9功能研究(31272564);公益性行业(农业)科研专项经费(201203039);国家生猪现代农业产业技术体系项目(CARS-36);国家重点研发计划课题(2016YFD0500707)
作者简介:赵孟孟(1986-),男,河南汝州人,博士,研究方向:猪繁殖与呼吸综合征病毒的致病机理,E-mail:zhaomengmeng502@163.com
通信作者:*张桂红(1968-),女,黑龙江哈尔滨人,博士,教授,研究方向:动物传染病,E-mail:guihongzh@scau.edu.cn
Effect ofNsp9Gene on Replication of PRRSV in Marc-145Cells
ZHAO Meng-meng1,2,FENG Song-lin2,WANG Wen-jia3,XING Xing4,FENG Jia-ping2,ZHANG Gui-hong2*
(1.CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China;2.KeyLaboratoryofZoonosisPreventionandControlofGuangdongProvince,CollegeofVeterinary andNationalEngineeringResearchCenterforBreedingSwineIndustry,SouthChinaAgriculturalUniversity,Guangzhou510642,China;3.SchoolofPharmaceuticalEngineering,HenanUniversityof AnimalHusbandryandEconomy,Zhengzhou450046,China;4.GuangxiQinzhouFreeTradePort AreaEntry-exitInspectionandQuarantineBureau,Qinzhou535008,China)
Abstract:In order to evaluate whether Nsp9could enhance the replication of porcine reproductive and respiratory syndrome virus(PRRSV),pIRES2-EGFP-Nsp9plasmid containing whole Nsp9 genome were transfected into Marc-145cells,Real-time PCR and Western blotting were used to evaluate the expression of N protein after PRRSV was inoculated.The results showed that the level of N protein in the Nsp9transfected cells was significantly higher than control group(P<0.05),which was 1.5times higher.Meanwhile,the expression at protein level had the same trend as the mRNA level.When the dose of plasmid was increasing,the expression of N protein both at the mRNA and protein levels were increased.In conclusion,Nsp9gene could enhance the replication of PRRSV in Marc-145cells.
Key words:PRRSV;Nsp9gene;Marc-145cell;replication

