猪圆环病毒2型山西株全基因组序列分析
孟 帆,吴 忻*,姚敬明,樊振华,刘文俊,王娟萍,韩一超,薛翼鹏,米瑞娟,李玉斌
(1.山西省农业科学院畜牧兽医研究所,太原030032;2.陵川县畜牧兽医局,晋城048300)
猪圆环病毒2型山西株全基因组序列分析
孟 帆1,吴 忻1*,姚敬明1,樊振华1,刘文俊1,王娟萍1,韩一超1,薛翼鹏1,米瑞娟1,李玉斌2
(1.山西省农业科学院畜牧兽医研究所,太原030032;2.陵川县畜牧兽医局,晋城048300)
摘 要:为了解山西省猪圆环病毒2型(PCV2)的遗传变异情况,本试验采用PCR方法对山西省分离的4株猪圆环病毒流行株(SXXZ1株、SXXZ2株、SXTY株和SXJZ株)的全基因组进行了扩增、克隆和测序,并将其全基因组序列与国内外34株主要流行毒株进行核苷酸同源性与系统进化树分析。结果显示,4株PCV2山西流行株全基因组核酸序列全长SXJZ株为1 768bp,其余均为1 767bp,分别占25%和75%。4株毒株核苷酸同源性为95.9%~100.0%,与国内外34株参考株同源性为94.5%~99.9%,与国产疫苗株同源性为95.6%~99.8%;PCV2全基因组序列进化分析表明,本研究分离的SXXZ1株、SXXZ2株和SXTY株属于PCV-2b基因型,SXJZ株属于PCV-2e基因型,其中SXXZ1株和SXXZ2株与广东QY株的进化关系最近,SXTY与奥地利AUT5株的进化关系最近,SXJZ与福建FJ株的进化关系最近;而SXXZ1株、SXXZ2株和SXTY株与山西PCV2疫苗DBN-SX07-2株的进化关系较近,SXJZ株与国内PCV2疫苗LG株的进化关系较近。从而证实在山西省流行的PCV2毒株以PCV-2b为主,同时还分离出了PCV-2e亚型,表明山西省存在PCV-2e亚型毒株。本试验结果为山西省PCV2的分子流行病学、遗传变异及防控奠定了基础。
关键词:猪圆环病毒2型;全基因组;序列分析
猪圆环病毒2型(porcine circovirus type 2,PCV2)是DNA病毒,属于圆环病毒科、圆环病毒属,病毒无囊膜包裹,是圆环状的单股负链,是当前已知的最小动物病毒之一[1]。PCV2是断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrome,PMWS)的主要病原之一,由Allan等[2]首先从患PMWS的猪群中分离到。除此之外,PCV2也与猪圆环病毒病(porcine circovirus disease,PCVD)(如母猪繁殖障碍、猪呼吸道综合征(PRDC)、猪皮炎肾病综合征(PNDS)、仔猪先天性震颤、胎儿心肌炎和扩张性坏死性肺炎等)紧密相关。自首次由加拿大报道以来,PCV2已在许多国家出现感染和流行,成为影响世界养猪业发展的重要传染病病原之一。近年来,PCV2在中国猪群中也开始流行,朗洪武等[3]于1999年首次检测到PCV2在中国的存在。各地关于PCV2遗传变异分析的研究不断增多,为此项目组对从山西发病猪群中分离出的4株猪圆环病毒进行了全基因组测序及遗传变异分析,通过分析PCV2山西流行株与国内外流行株间的关系,以探求山西猪圆环病毒毒株变异情况,为PCV2的分子流行病学调查和致病机制的研究积累资料,并为今后PCVD的防控提供理论依据。
1 材料与方法
1.1PCV2阳性样品来源
对2014年来自山西省不同地区疑似猪圆环病毒病猪进行剖检,采集淋巴结、脾脏、肾脏等作为检测PCV2的样品,将经鉴定为PCV2阳性的样品于-70℃保存备用。取适量PCV2阳性样品按1∶5的比例加入PBS制成组织匀浆,然后加入双抗(2 000U/mL),反复冻融3次,12 000r/min离心30min,取上清液,经0.22μm滤膜除菌后,取1mL接种于长成单层的PK-15细胞,37℃吸附作用1h,加入适量含2%小牛血清的维持营养液,37℃培养72h。将培养物反复冻融3次,3 000r/min离心10min,收获上清。按此法盲传15代后,收获病毒,获得细胞毒进行RT-PCR检测。共获得4株PCV2分离株,均由山西省农业科学院畜牧兽医研究所动物基础医学研究室保存。
1.2主要试剂
猪圆环病毒PCR检测试剂盒由北京世纪元亨动物防疫技术有限公司提供。TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0和PremixTaqTM(ExTaqTMVersion 2.0)试剂盒均购自宝生物工程(大连)有限公司;DNA胶回收试剂盒、普通质粒小提取试剂盒均购自上海生工生物工程技术服务有限公司。
1.3引物设计与合成
根据GenBank中收录的PCV2AUT5(登录号:AY424405)、Huanan-8(登录号:EF421973)、Fh14(登录号:AY321982)和SD-09(登录号:GQ449669)等毒株的全基因组序列,应用Primer Premier 5.0软件,设计1对扩增PCV2全基因组序列的特异性引物。引物序列:上游引物P1:5′-ACCAGCGCACTTCGGCAG-3′;下游引物P2:5′-AATACTTACAGCGCACTTCTTTCGT-3′,预期扩增长度为1 767或1 768bp。引物由上海生工生物工程技术服务有限公司合成。
1.4PCV2病毒基因组DNA提取
将收获的病毒液反复冻融3次,5 000r/min离心10min,取上清,按照TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0试剂盒操作说明书,从PCV2中提取病毒基因组DNA,-70℃保存备用。
1.5PCV2全基因组的PCR扩增
PCR扩增方法按试剂盒说明书进行。以提取的总DNA为模板,用PremixTaqTM(ExTaqTMVersion2.0)扩增全基因。经多次重复试验,优化PCR反应条件,PCR反应体系50μL:PremixTaqTM(ExTaqTMVersion 2.0)25μL,上、下游引物(20μmol/L)各1μL,模板3μL,灭菌超纯水补至50μL。PCR反应条件:94℃预变性3min;94℃变性45s,62℃退火45s,72℃延伸2min,共30个循环;72℃延伸10min。反应结束后,取5μL PCR产物用1.0%琼脂糖凝胶电泳检测扩增结果。
1.6PCV2全基因组的克隆及序列测定
将PCV2全基因组的PCR产物回收纯化,将回收纯化的PCR产物与pMD18-T载体连接过夜,再将连接产物转化E.coliDH5α感受态细胞,筛选重组菌进行PCR鉴定,将鉴定正确的阳性菌液送上海生工生物工程技术服务有限公司进行测序。
1.7PCV2全基因组序列比对分析
对测得的4株PCV2毒株全基因组核苷酸序列用DNAStar软件进行分析,并与已发表的34株国内外PCV2参考毒株的全基因组序列进行同源性比对及遗传进化分析。参考毒株信息见表1。
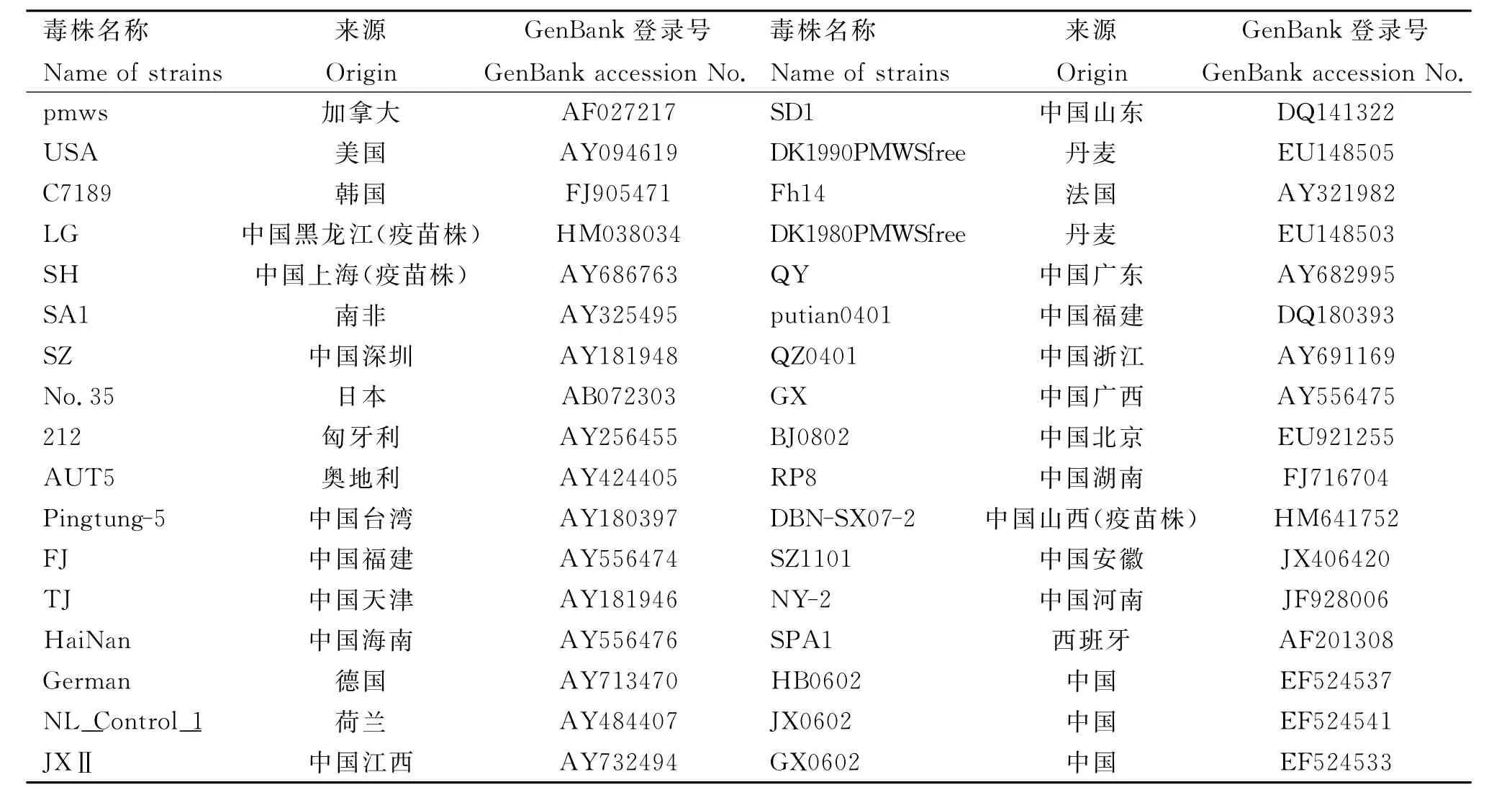
表1 PCV2参考毒株信息Table 1 Information of PCV2reference strains
2 结果与分析
2.1PCV2全基因组PCR扩增结果
经PCR扩增后,凝胶电泳结果显示扩增出片段大小约1 767bp的条带(图1),与预期片段大小相同。
2.2PCV2全基因组核苷酸序列分析
测序结果显示,测定的4株PCV2毒株的全基因组核苷酸序列长度其中3株均为1 767bp,1株为1 768bp,按基因组长度划分为两种类型,分别占75%和25%。已收录入GenBank中,登录号分别为KX068219(SXXZ1)、KX068219(SXXZ2)、KX068219(SXJZ)和KX068219(SXTY)。用DNAStar软件对获得的4株PCV2的全基因序列与从GenBank收录的不同国家和地区的34株PCV2毒株的全基因序列进行了核苷酸序列同源性比对,序列分析结果见图2。由图2可知,所有PCV2毒株之间的序列同源性均相对较高,介于94.1%~100.0%之间。本研究所获得4株PCV2毒株的全基因序列之间核苷酸同源性为95.9%~100.0%,与34株来自世界不同地区的PCV2参考株之间同源性为94.6%~99.9%,与国产疫苗株(LG株、SH株、DBN-SXO7-2株)同源性为95.6%~99.8%。其中,SXXZ1株和SXXZ2株序列之间同源性高达100.0%,与其他2株之间同源性为96.0%及98.8%,SXTY和其他3株之间同源性为95.9%~98.8%,SXJZ与其他3株之间同源性较低为95.9%~96.0%。进一步分析结果表明,SXXZ1株和SXXZ2株与QY株(广东)同源性最高,为99.7%,与DK1990PMWSfree同源性最低,为95.2%;SXTY株与AUT5株(奥地利)同源性最高,为99.9%,与DK1990PMWSfree和DK1980PMWSfree同源性最低,为95.4%;SXJZ株与HB0602株同源性最高,为99.5%,与DK1990PMWSfree和DK1980PMWSfree同源性最低,为94.6%。SXTY株与山西疫苗株DBNSXO7-2株全基因核苷酸序列同源性最高,为99.8%,SXXZ1株和SXXZ2株次之,为98.7%,SXJZ株同源性最低,为95.9%;SXXZ1株和SXXZ2株与中国疫苗株SH株(上海)全基因核苷酸序列同源性较高,为96.8%,SXTY株次之,为96.2%,SXJZ株同源性最低,为95.6%;SXJZ株与中国疫苗株LG株(黑龙江)全基因核苷酸序列同源性较高,为96.7%,SXTY株次之,为95.9%,SXXZ1株和SXXZ2株同源性最低,为95.6%。另外,4株山西PCV2分离株基因组上都具有保守的茎环结构(5′-GAAGTGCGCTGTAAGTATTACCAGCGCACTTC-3′)和9碱基基序(5′-AAGTATTAC-3′),与其他PCV2分离株一致。
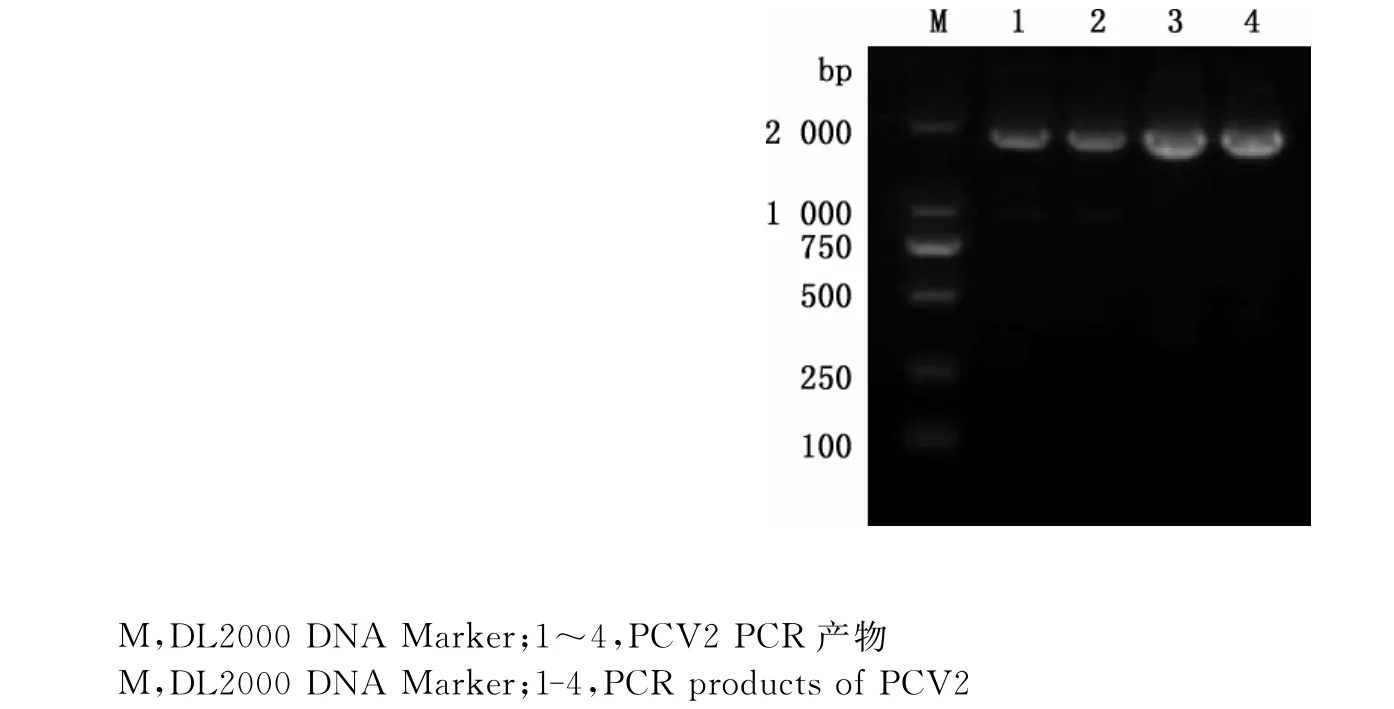
图1 PCV2PCR扩增结果Fig.1 PCR amplification results of PCV2
2.3PCV2全基因遗传进化树分析
根据获得的4株PCV2毒株的全基因组和GenBank中收录的34株国内外参考毒株的全基因组核苷酸同源性分析结果绘制了PCV2系统进化树,以确定其基因型。由图3可知,所比对的38株PCV2毒株明显分为5个基因型,分别为PCV-2a、PCV-2b、PCV-2c、PCV-2d和PCV-2e,其中本研究分离的SXXZ1株、SXXZ2株和SXTY株均属于PCV-2b亚群,占75%,SXJZ株属于PCV-2e亚群,占25%;且SXXZ1株和SXXZ2株与QY株(广东)亲缘关系最近,SXTY株与AUT5株(奥地利)及DBN-SX07-2株(山西疫苗株)亲缘关系最近,SXJZ株与与FJ株(福建)亲缘关系最近。另外,与疫苗株的比对可知,SXXZ1株、SXXZ2株和SXTY株与DBN-SX07-2株(山西疫苗株)亲缘关系最近,SXJZ株与LG株(黑龙江疫苗株)的亲缘关系最近。

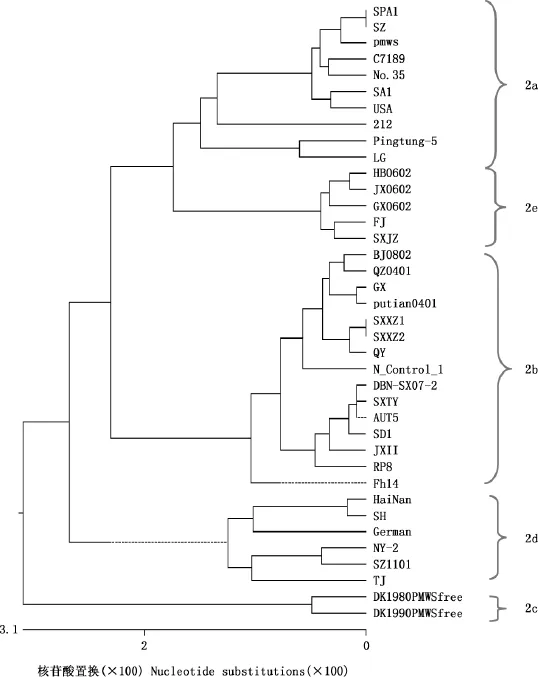
图3 PCV2系统进化树Fig.3 Phylogenic tree of PCV2
3 讨 论
PCV2感染普遍存在于中国猪群,近年来因该病毒感染所导致的疾病加大了中国规模化猪场疫病的复杂程度,给中国养猪业造成了巨大的经济损失。山西省众多养猪场也深受其害,韩一超等[4]2010—2012年对山西省进行的猪病毒性疫病流行病学调查工作中发现,感染率最高的疫病就是PCV2引起的,在各地区调查猪场42个,检出平均阳性率56.98%,最低地区为43.52%,最高地区为81.59%,感染率在有的调查猪场中可达到100.00%,对猪场各种疫病的控制和生产性能的发挥都有很大影响。本研究3株PCV2山西流行株全基因组序列长度为1 767bp,1株为1 768bp,与国内大多数流行毒株基因组长度相同,且3株基因组全长为1 767bp的分离株与基因组全长为1 768bp的分离株相比均在1 042处缺失1个碱基(T),与报道一致[5]。另外这4株PCV2山西流行株基因组上都具有保守的茎环结构和9碱基基序,研究已证实PCV2基因组滚环复制的起始与这两个结构有关,PCV2中9碱基基序的第1个碱基由PCV-1中的T突变为A,当改变该基序的前两个碱基时,病毒的复制能力也随之消失[6-7]。
通过全基因组比对和核苷酸同源性分析发现4株山西PCV2分离株的全基因序列之间核苷酸同源性为95.9%~100.0%,与34株来自世界不同地区的PCV2参考株之间同源性为94.5%~99.9%,由此可见,山西省的PCV2与世界不同地域PCV2分离株的基因序列差异不大。4株山西PCV2分离株与国产疫苗株(LG株、SH株、DBN-SXO7-2株)同源性为95.6%~99.8%,其中SXTY株、SXXZ1株和SXXZ2株与山西疫苗株DBN-SXO7-2株全基因组核苷酸序列同源性较高,分别为99.8%、98.7%和98.7%,而SXJZ株与中国疫苗株LG株(黑龙江)全基因组核苷酸序列同源性较高,为96.7%,表明目前疫苗还能对大部分猪群提供保护,但最好能对发病猪群进行基因测序,分析其遗传变异情况,确定最佳疫苗进行免疫。进一步分析结果表明,SXXZ1株和SXXZ2株与QY株(广东)同源性最高,为99.7%,SXTY株与AUT5株(奥地利)同源性最高,为99.9%,SXJZ株与HB0602株同源性最高,为99.5%,可见山西PCV2流行株来源并不单一,这可能与频繁的种猪交流和防控措施不利有关。
根据基因遗传距离大小的不同,早期研究将PCV2全基因组序列划分为3个基因型,即PCV-2a、PCV-2b和PC-V2c,其中PCV-2a基因组全长为1 768bp,主要在中国和欧洲国家有报道;PCV-2b基因组全长为1 767bp,致病性最强,造成猪圆环病毒近年来在世界范围内普遍感染和流行[8-10];PCV-2c仅在丹麦有报道[11]。在最新的研究中,PCV2被分为5种基因亚型,分别为PCV-2a、PCV-2b、PCV-2c、PCV-2d和PCV-2e,其中传统分类方法中的PCV-2a又分为PCV-2a和PCV-2e,PCV-2b又分为PCV-2b、PCV-2c和PCV-2d。虽然PCV2和大多数猪群的感染有关,但Hesse等[12]认为PCV2的临床表现在不同基因型并不相同,即两者的毒力不同,普遍认为PCV-2a的致病性要弱于PCV-2b。而Opriessnig等[13]认为在毒力方面,PCV-2a和PCV-2b没有不同,且二者存在交叉保护力。为更好地了解PCV2毒株的遗传变异情况及亲缘关系的远近,本试验在对所有毒株同源性分析的基础上绘制了系统进化树,从中可看出38株分离株分为5个大的分支(PCV-2a、PCV-2b、PCV-2c、PCV-2d和PCV-2e)。其中本研究分离的SXXZ1株、SXXZ2株和SXTY株均属于PCV-2b亚群,占75%,SXJZ株属于PCV-2e亚群,占25%;从而证实在山西以PCV-2b亚型毒株流行为主,这与许多学者报道的PCV-2b在中国很多地区为主要流行基因型的说法一致[14-21];同时还分离出了PCV-2e亚型,表明山西存在PCV-2e亚型,但因过去几年山西分子流行病学的资料较少,看不出山西PCV2基因型转换的特点。SXXZ1株和SXXZ2株与QY株(广东)亲缘关系最近,SXTY株与AUT5株(奥地利)及DBNSX07-2株(山西疫苗株)亲缘关系最近,SXJZ株与FJ株(福建)亲缘关系最近。可见这4株PCV2山西分离株彼此之间及与国内PCV2分离株、欧洲株之间更接近,而与韩国、中国台湾、日本和美洲毒株之间则稍远。另外,与疫苗株的比较可看出,SXXZ1株、SXXZ2株和SXTY株与DBN-SX07-2株(山西疫苗株)亲缘关系最近,SXJZ株与LG株(黑龙江疫苗株)的亲缘关系最近。因而,建议山西省在选PCV2疫苗免疫时,尽量使用国内生产的疫苗进行免疫。
4 结 论
本研究通过对山西省PCV2分离株序列的分析研究,明确了目前山西省PCV2流行株基因组的特征,支持了中国PCV2分型的依据,为PCV2的防控和疫苗研究提供了理论依据。
参考文献:
[1] 殷 震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997.
[2] Allan G M,Mcneily F,Kennedy S,et al.Isolation of porcine circovirus-like virus from pigs with a wasting disease in the USA and Europe[J].JVetDiagnInvest,1998,10(1):3-10.
[3] 郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[4] 韩一超,吴 忻,姚敬明,等.山西省四种猪繁殖障碍性疫病流行病学调研与分析[J].中国畜牧兽医,2011,38(11):195-200.
[5] 王亚丹,卢权威,陈红英,等.猪圆环病毒2型河南株全基因组的克隆和序列分析[J].中国兽医学报,2012,32(10):1429-1434.
[6] Mankertz A,Persson F,Mankertz J,et al.Mapping and characterization of the origin of DNA replication of porcine circovirus[J].JGenViroh,1997,71(3):2562-2566.
[7] Mankertz A,Hillenbrand B.Replication of porcine circovirus type 1requires two protein encoded by the viralrepgene[J].Virology,2001,279(2):429-438.
[8] 吴德铭,曹永长,毕英佐.猪圆环病毒研究进展[J].中国预防兽医学报,2004,26(1):76-78.
[9] Segales J,Olvera A,Grau-Roma L.Further com-ments on porcine circovirus type 2(PCV2)genotype definition and nomenclature[J].VirusMicrobiol,2011,149(3-4):522-523.
[10] Wang F,Guo X,Ge X.Genetic variation analysis of Chinese strains of porcine circovirus type 2[J].Virus Reascher,2009,145(1):151-156.
[11] Segales J,Olvera A,Grau-Roma L,et al.PCV-2genotype definition and nomenclature[J].VetRec,2008,162(26):867-868.
[12] Hesse R,Kerrigan M,Row landrr R.Evidence for recombination between PCV2aand PCV2bin the field[J].VirusRes,2008,132(1-2):201-207.
[13] Opriessnig T,Ramamoort H Y S,Madsond H,et al.Differences in virulence among porcine circovirus type 2 isolates are unrelated to cluster type 2aor 2band prior infection provides heterologous protection[J].JGenVirol,2008,89(10):2482-2491.
[14] 黄 新,康立超,韩猛立,等.猪圆环病毒2型XJ-SW株全基因组的克隆与序列分析[J].中国兽医科学,2012,42(5):461-466.
[15] 李文洁,李文涛,严伟东.中国部分地区猪圆环病毒2型的基因型分析[J].畜牧兽医学报,2009,40(9):1358-1362.
[16] 莫 敏,王静梅,李 劼,等.16株猪2型圆环病毒全基因组克隆及序列分析[J].石河子大学学报,2012,30(1):37-42.
[17] 刘 健,周锦萍,王 建,等.上海及周边地区猪圆环病毒型基因型分析[J].中国动物传染病学报,2011,19(1):27-30.
[18] 郭龙军,陆月华.我国部分地区猪圆环病毒2型分离株的遗传变异分析[J].中国预防兽医学报,2009,31(11):856-859.
[19] Dupont K,Nielsen E O,Bakbo P,et al.Genetic analysis of PCV2isolates from Danish archives and a current PMWS case-control study supports a shift in genotypes with time[J].VetMicrobiol,2008,128(1-2):56-64.
[20] 郭 旋,肖 雄,黎木兰,等.猪圆环病毒2型广西株的分型及基因重组分析[J].中国兽医科学,2013,43(9):888-892.
[21] 李海花,李秀丽,张 莉,等.猪圆环病毒2型天津株的全基因组克隆与序列分析[J].动物医学进展,2014,35(1):58-63.
(责任编辑 董晓云)
中图分类号:S858.28
文献标识码:A
文章编号:1671-7236(2016)12-3127-08
doi:10.16431/j.cnki.1671-7236.2016.12.007
收稿日期:2016-05-05
基金项目:山西省科技攻关项目(20130311026-4)
作者简介:孟 帆(1980-),女,山西太原人,硕士,助理研究员,研究方向:动物疫病分子生物学检测与诊断技术,E-mail:mengfan0525@163.com
通信作者:*吴 忻(1966-),男,山西人,学士,副研究员,研究方向:畜禽传染病,E-mail:jcbyjs@sohu.com
Genome Sequence Analysis of Porcine Circovirus Type 2Strains from Shanxi Province
MENG Fan1,WU Xin1*,YAO Jing-ming1,FAN Zhen-hua1,LIU Wen-jun1,WANG Juan-ping1,HAN Yi-chao1,XUE Yi-peng1,MI Rui-juan1,Li Yu-bin2
(1.InstituteofAnimalHusbandryandVeterinary,ShanxiAcademyofAgriculturalSciences,Taiyuan030032,China;2.BureauofAnimalHusbandryofLingchuan,Jincheng048300,China)
Abstract:In order to study genetic variation of porcine circovirus type 2(PCV2)strains in Shanxi province,the genomic sequences of four PCV2strains which were SXXZ1,SXXZ2,SXTY and SXJZ were isolated recently from some areas of Shanxi province,they were amplified,cloned and sequenced.The amplified PCV2genomic sequences of these four strains were analyzed and compared with that of 34published PCV2stains by DNAStar and drawing phylogenetic tree.The results showed that the genomic sequences of SXJZ PCV2strain was 1 768bp,and the others were 1 767bp,which accounted for 25%and 75%,respectively.The homologies of nucleotide sequences of the four strains were 95.9%to 100.0%,the homologies of nucleotide sequences of the four strains with the 34isolates from different regions of the world PCV strain were 94.5%to 99.9%,and the homologies of nucleotide sequences of the four strains with the domestic vaccine strains were 95.6%to 99.8%.The phylogenetic tree analysis showed that SXXZ1,SXXZ2and SXTY belonged to PCV-2bgenotype,and SXJZ belonged to PCV-2egenotype.The evolutionary rela-tionship among SXXZ1,SXXZ2and the QY strain of Guangdong were closer,we also found a recent evolutionary relationship between SXTY and AUT5of Austria,and a recent evolutionary relationship between SXJZ and FJ of Fujian.Besides the evolutionary relationship among SXXZ1,SXXZ2,SXTY and the DBN-SX07-2of PCV2vaccine of Shanxi province,a recent evolutionary relationship between SXJZ and LG of PCV2vaccine were found.Thus PCV2strains were popular based on PCV-2bin Shanxi province,also PCV-2ewas isolated and existed.It laid a foundation for the molecular epidemiology,genetic variation,prevention and control of PCV2in Shanxi province.
Key words:porcine circovirus type 2;genome;sequence analysis

