山羊莱氏无胆甾原体FJ-NP株的分离鉴定
江锦秀,林裕胜,游 伟,江 斌,胡奇林
(福建省农业科学院畜牧兽医研究所,福州350013)
山羊莱氏无胆甾原体FJ-NP株的分离鉴定
江锦秀,林裕胜,游 伟,江 斌,胡奇林*
(福建省农业科学院畜牧兽医研究所,福州350013)
摘 要:为明确福建省某羊场发生的疑似羊支原体性肺炎病例的病原,利用支原体培养基对发病羊肺脏组织的病原进行分离培养和纯化,通过生化试验和特异性PCR方法进行鉴定,并对分离株16SrRNA进行测序分析。结果显示,分离株菌落呈油煎蛋状,有棕黄色中心突起;能发酵葡萄糖,不能水解精氨酸,不分解尿素,氯化四氮唑还原反应、胆固醇需要试验、血细胞吸附试验及溶血试验的结果均为阴性,美兰还原反应阳性。经PCR扩增出莱氏无胆甾原体支原体(Acholeplasmalaidlawii,AL)大小为505bp的特异性目的片段,分离株16SrRNA序列与莱氏无胆甾原体标准株PG8同源性为99.8%。鉴定结果表明,本次从山羊肺脏组织分离到的支原体为莱氏无胆甾原体,命名为FJ-NP株,但该分离株与山羊发病性的关系有待进一步研究。
关键词:山羊支原体性肺炎;莱氏无胆甾原体;分离;鉴定
莱氏无胆甾原体(Acholeplasmalaidlawii,AL)属于柔膜体纲,支原体目,无胆甾原体科,无胆甾原体属。莱氏无胆甾原体最初分离自污水、肥料、腐土质、土壤和植物组织[1],后来人们发现在牛生殖道和鼻腔、猪鼻腔、人口腔、鸡窦等各种哺乳动物和鸟类中均发现其寄生现象。莱氏无胆甾原体也是常见的污染细胞的支原体之一[2-4]。1950年,Edward从牛生殖道中分离到莱氏无胆甾原体,首次证实了该支原体与动物宿主的相关性。2002年,权忠会等[5]从陕北患流行性阴道子宫内膜炎的驴生殖道分泌物中分离到一株莱氏无胆甾原体,该分离株与驴地方流行性阴道和子宫炎的关系需进一步确定。目前尚未见从羊肺脏中分离到莱氏无胆甾原体的报道。2014年福建省某山羊场疑似发生羊支原体性肺炎,为了明确病原,本研究对该养殖场疑似羊支原体性肺炎病例进行了支原体分离和鉴定,旨在为福建省羊支原体性肺炎和山羊传染性胸膜肺炎的流行病学研究提供科学依据。
1 材料与方法
1.1材料
1.1.1病料 疑似发生羊支原体性肺炎的病山羊1只(临床见喘气、咳嗽、流鼻涕、消瘦,剖检见部分肺脏、肝脏病变),由福建省某发病羊场提供。
1.1.2主要试剂 PPLO肉汤(不含结晶紫)购自青岛海博生物科技高科园;灭活马血清、青霉素和酵母浸粉均购自上海铭睿生物科技有限公司;BACTOTM琼脂购自美国BD公司;Premix Taq和DL2000DNA Marker均购自宝生物工程(大连)有限公司;组织DNA提取试剂盒购自生工生物工程(上海)股份有限公司;葡萄萄、丙酮酸钠和酚红均购自国药集团化学试剂公司。
1.2方法
1.2.1支原体培养基的配制 将Thiaucourt等[6]方法中的Hayflick’s培养基略作修改。成分:不含结晶紫的PPLO肉汤(21g/L)、酵母浸粉(1.5g/L)、葡萄糖(4g/L)、0.5%酚红(3.2mL/L)、丙酮酸钠(2g/L)、青霉素(20万IU/L)。制法:将上述成分溶于800mL去离子水后高压灭菌,固体培养基另加入Difco琼脂10g,冷却至50℃左右(血琼脂平板中另外加入10%无菌绵羊脱纤维血),加入过滤的丙酮酸钠(2g/L)、青霉素(20万IU/L)及灭活马血清(200mL/L),用1mol/L NaOH调pH至7.6~7.8,倾倒平皿,4℃保存备用。
1.2.2支原体的分离和纯化 无菌取病料肺脏组织的病健交界处,加入适量培养液研磨,3 000r/min离心5min后取上清,用0.45μm过滤器过滤,加入PPLO液体培养,待培养物变色后再次过滤,倍比稀释,接种于PPLO固体培养基,置于支原体培养装置中培养,经3次纯化得到纯培养物[7]。
1.2.3菌体形态观察 取1mL变黄的液体培养基,用接种棒挑取液体,均匀涂布于载玻片上,用吉姆萨染色液染色,用蒸馏水冲洗干净,待干镜检。
1.2.4L-型细菌的检验 将分离株接种到无抑菌剂的液体培养基中,连续传10代,经染色镜检和固体培养,观察分离株是否恢复成细菌形态[7]。
1.2.5生化鉴定 发酵葡萄糖、水解精氨酸和分解尿素试验:参考文献[8-12]将分离菌株分别接种于含10%葡萄糖、10%精氨酸及10%尿素的PPLO培养基中,设不接菌的对照管培养基作为对照管;胆固醇需要试验:分离菌株在无血清的PPLO液体培养基中传5代,同时设不接菌株的PPLO液体培养基作为对照管;美兰还原试验:在长出菌落的PPLO固体培养基表面加入等量的0.5mL/L美兰和0.5%鸡红细胞,37℃放置30min,菌落上或周围的红细胞被着色为阳性,未着色为阴性;氯化四氮唑还原试验:分离株接种于不含酚红和葡萄糖,但含0.2g/L氯化三苯基四氮唑的PPLO液体培养基中,不接种菌株的为阴性对照管,接种菌株的培养基变成砖红色或者红色,而对照管不变色为阳性;血细胞吸附试验:在长出菌落的PPLO固体培养基表面加入0.25%鸡红细胞,室温放置20min,吸掉红细胞,用生理盐水洗涤,菌落表面布满红细胞者为阳性;溶血试验:分离株接种于含10%绵羊脱纤维血的固体培养基上培养7d,在菌落周围出现绿色带为α溶血,有透明带为β溶血。
1.2.6PCR检测及16SrRNA克隆测序
1.2.6.1引物设计及合成 用支原体目通用引物[13]、丝状支原体簇特异性引物[14]、绵羊肺炎支原体特异性引物[15]、精氨酸支原体特异性引物[15]、莱氏无胆甾原体特异性引物[15]和无乳支原体特异性引物[16]对支原体分离株的DNA进行PCR扩增,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.2.6.2PCR检测及分离株16SrRNA克隆测序
取1mL支原体培养液加入1.5mL离心管中,10 000r/min离心1min,弃上清收集菌体,用组织DNA提取试剂盒(离心柱型)提取DNA。PCR反应体系20μL:PremixTaq10μL,RNA Free H2O 4μL,上、下游引物各1μL,模板4μL。反应程序根据各引物参考文献进行[13-17],PCR产物进行1.0%琼脂糖凝胶电泳检测。鉴定为阳性的产物用16SrRNA通用引物[17]对支原体分离株的DNA进行PCR扩增。扩增产物送生工生物工程(上海)有限公司进行克隆测序。
1.2.7分离株16SrRNA基因序列同源性分析
采用DNAStar软件中的MegAlign将测定序列与GenBank中登录的莱氏无胆甾原体标准株PG8(AL PG8)、丝状支原体山羊亚种标准株PG3(Mmc PG3)、丝状支原体丝状亚种SC型PG1标准株(MmmSC PG1)、山羊支原体山羊亚种分离株G5(Mcc G5)、山羊支原体山羊肺炎亚种标准株F38(Mccp F38)及绵羊肺炎支原体标准株Y98(Mo Y98)等支原体的16SrRNA基因进行同源性分析,构建系统进化树。参考序列信息见表2。

表2 GenBank中公布的参考序列Table 2 Reference sequences in GenBank
2 结果与分析
2.1菌落形态观察
病羊肺脏组织在液体培养基上传至第1代,培养6d后,培养基颜色变黄且不浑浊,第2代液体培养2d后培养基颜色变黄且不浑浊,经液体、固体培养基进行3轮克隆纯化后,在显微镜下可见菌落呈油煎蛋状,有棕黄色中心突起(图1),将此菌株命名为FJ-NP株。

图1 分离株的菌落形态(50×)Fig.1 Colonial morphology of the isolate(50×)
2.2菌体形态观察
用吉姆萨染色,在1 000倍显微镜下观察,可见分离菌呈淡紫色,具有高度多形性,以小球状和杆状为主(图2)。

图2 分离株吉姆萨染色结果(1 000×)Fig.2 Giemsa staining of the isolate(1 000×)
2.3L-型细菌检验
FJ-NP株在无抑菌剂的培养液中传10代,经染色镜检和固体培养均未见细菌形态。
2.4生化鉴定
分离菌株FJ-NP能发酵葡萄糖,不能水解精氨酸,不分解尿素,氯化四氮唑还原反应阴性,胆固醇需要试验阴性,能还原美兰(图3A),溶血试验结果阴性(图3B),血细胞吸附试验阴性(图3C)。

图3 分离株部分生化试验结果(50×)Fig.3 Part of biochemical test results of isolate(50×)
2.5 支原体分离株PCR检测
用支原体目16SrRNA通用引物扩增获得目的条带560bp,与预期片段大小相符(图4A)。用莱氏无胆甾原体特异性引物扩增也获得目的条带505bp,与预期片段大小相符(图4B)。用丝状支原体簇丝状支原体簇特异性引物、绵羊肺炎支原体特异性引物、无乳支原体特异性引物及精氨酸支原体特异性引物均未扩增出任何条带。
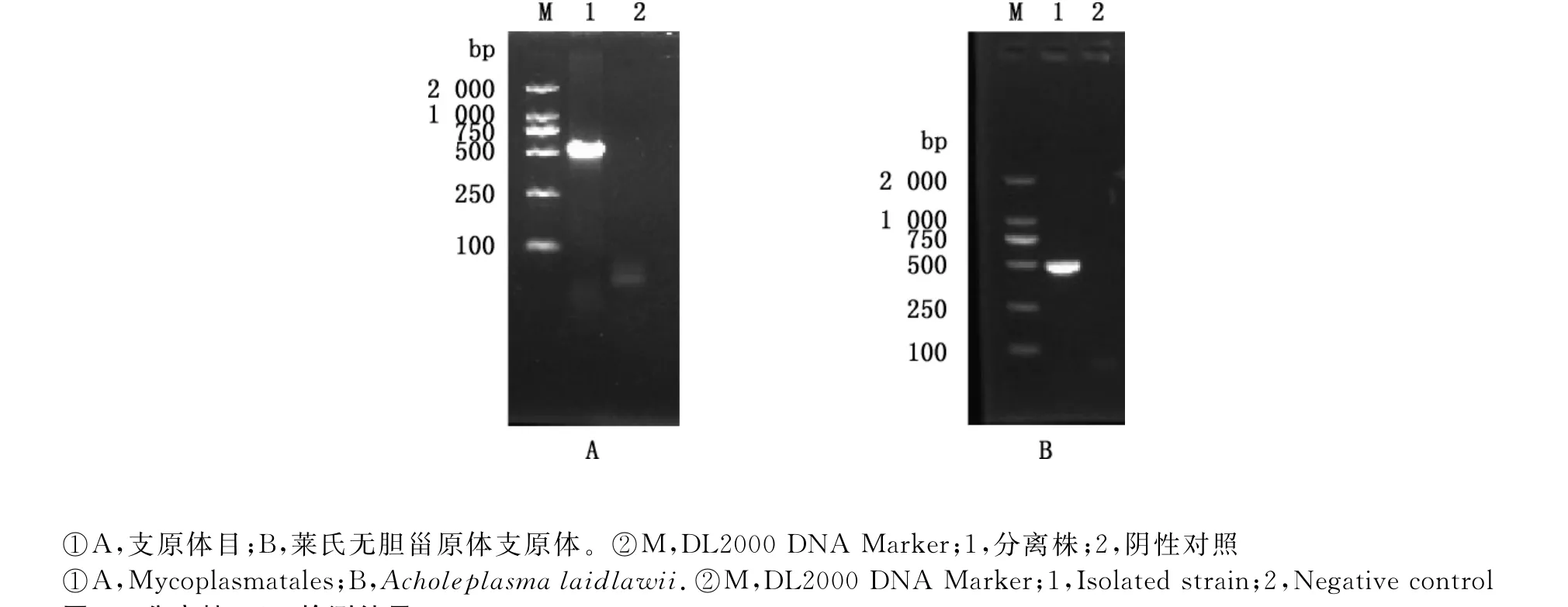
图4 分离株PCR检测结果Fig.4 PCR result of isolated strain
2.6支原体分离株基因序列同源性比对及进化树分析
将FJ-NP分离株的16SrRNA基因的测序结果提交到NCBI,登录号:KU870649,该菌株的16SrRNA基因序列与AL PG8株16SrRNA基因序列的同源性为99.8%,与Mcc G5株的同源性为82.8%,与Mccp F38株的同源性为82.2%,与Mmc PG3株的同源性为82.8%,与MmmSC PG1株的同源性为82.8%,与Mo Y98株的同源性为77.7%(图5)。用DNAStar中的MegAlign软件构建AL FJ-NP 16SrRNA基因序列的进化树见图6。由图6可知,分离菌株与AL PG8株同属进化树的同一分支,亲缘关系最近,与其他标准株的亲缘关系较远。
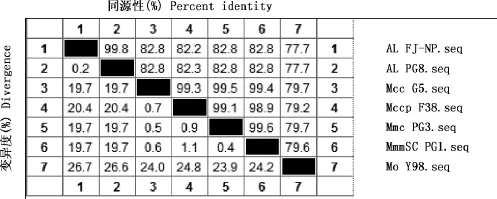
图5 16SrRNA基因序列同源性比对Fig.5 Homology comparison of 16SrRNA gene sequence

图6 支原体16SrRNA基因的进化树分析Fig.6 Phylogenetic tree ofMycoplasma16SrRNA gene sequence
3 讨 论
本研究从疑似发生山羊传染性胸膜肺炎的病羊肺脏组织中分离到一株支原体,对其进行生化鉴定,结果显示,该分离株能发酵葡萄糖,不能水解精氨酸,不分解尿素,胆固醇需要试验、氯化四氮唑还原反应、溶血试验和血细胞吸附试验的结果均为阴性,美兰还原反应为阳性。这些特性与莱氏无胆甾原体的生化试验特征相一致;分离株的16SrRNA基因序列与AL PG8的同源性为99.8%,且分离株与其处于支原体16SrRNA进化树的同一分支上,证明本次从羊肺脏组织中分离到的支原体是莱氏无胆甾原体。
目前,国内外未见从发病羊肺脏中分离到莱氏无胆甾原体的报道。仅见从牛生殖道中、种马精液和陕北患流行性阴道子宫内膜炎的驴生殖道分泌物[5]中分离到莱氏无胆甾原体的报道,但这些分离株与动物疫病的关系尚需进一步研究确定。已证实莱氏无胆甾原体是一种植物支原体病的病原,当前尚无可靠证据表明莱氏无胆甾原体能导致人类的疾病,但是近年来的研究发现莱氏无胆甾原体能产生含有大量毒力因子的细胞外囊泡至环境中[18]。Chernov等[19]研究结果提示,莱氏无胆甾原体的细胞外囊泡从毒力标准的角度(侵袭性、感染性和产毒性)来看,能够感染植物,同时具有促进支原体对植物致病的能力。Chernov等[20]研究结果表明,莱氏无胆甾原体的胞外囊泡富集于在支原体诱导的发病机制中起关键作用的蛋白质中。本研究结果证实从羊的肺脏组织中分离到的支原体是莱氏无胆甾原体,提示该养殖场应加强莱氏无胆甾原体的防制,但该分离株与山羊致病性的关系有待进一步的研究。
4 结 论
本研究从疑似发生羊支原体性肺炎的病山羊肺脏组织中分离到一株疑似莱氏无胆甾原体菌株,菌落形态观察、生化鉴定、PCR扩增及克隆测序结果显示,该分离株为莱氏无胆甾原体,但该分离株与山羊致病性关系有待进一步研究。
参考文献:
[1] Razin S,Yogev D,Naot Y.Molecular biology and pathogenicity of mycoplasmas[J].MicrobiolMolBiol R,1998,62(4):1094-1156.
[2] 刘 江,姜述德.细胞培养中支原体污染的PCR检测[J].细胞生物学杂志,1996,18(3):134-139.
[3] 丁 敏,张瑞婷,毛开荣,等.应用SYBR green Realtime PCR技术检测细胞培养物中支原体污染[J].畜牧与兽医,2009,1:82-85.
[4] Windsor H M,Windsor G D,Noordergraaf J H.The growth and long term survival ofAcholeplasmalaidlawiiin media products used in biopharmaceutical manufacturing[J].Biologicals,2010,38(2):204-210.
[5] 权忠会,张百祥,王文科.驴生殖道支原体的研究Ⅰ.莱氏无胆固醇支原体的分离与鉴定[J].甘肃农业大学学报,2002,3:338-341.
[6] Thiaucourt F,Bölske G,Leneguersh B,et al.Diagnosis and control of contagious caprine pleuropneumonia[J].RevSci TechOffimEpiz,1996,15(4):1415-1429.
[7] 江锦秀,林 甦,林裕胜,等.绵羊肺炎支原体FJ01-CL株的分离和鉴定[J].福建农业学报,2015,30(5):430-434.
[8] 王建昌.绵羊肺炎支原体山东株的分离鉴定和标准株外膜蛋白特性研究[D].泰安:山东农业大学,2007.
[9] 孙喜安.绵羊肺炎支原体内蒙古地方株的分离鉴定及交叉反应性的测定[D].呼和浩特:内蒙古农业大学,2012.
[10] 刘聚祥,张 利,孙继国,等.河北省部分地区羊肺炎霉形体的分离和鉴定[J].中国兽医科技,2003,33(9):37-41.
[11] 白永平.绵羊肺炎支原体的分离鉴定与敏感药物试验的研究[D].雅安:四川农业大学,2007.
[12] 陈宏伟.绵羊肺炎支原体的分离、鉴定及部分生物学特性的研究[D].石河子:石河子大学,2005.
[13] Hotzel H,Sachse K.Improvement and acceleration of the diagnosis of contagious bovine pleuropneumonia by direct detection of the microbe using polymerase chain reaction(PCR)[J].BedMunchTierarztl Wochenschr,1998,111(7-8):268-272.
[14] Bascuñana C R,Mattsson J G,Bölske G,et al.Characterization of the 16SrRNA genes fromMycoplasmasp.strain F38and development of an identification system based on the polymerase chain reaction[J].J ApplBacteriol,1994,176(9):2577-2586.
[15] Timenetsky J,Santos L M,Buzinhani M,et al.Detection of multiple mycoplasma infection in cell cultures by PCR[J].BrazJMedBiolRes,2006,39(7):907-914.
[16] Subramaniam S,Bergonier D,Poumarat F,et al.Spe-cies identification ofMycoplasmabovisandMycoplasmaagalactiaebased on theuvrCgenes by PCR[J].MolCellProbe,1998,12:161-169.
[17] 石 磊,龚 瑞,尹争艳,等.肉牛传染性牛支原体肺炎流行的诊断[J].华中农业大学学报,2008,27(5):629-633.
[18] Mouzykantov A A Baranova N B,Medvedeva E S,et al.Exported mycoplasmal proteins:Proteome of extracellular membrane vesicles ofAcholeplasma laidlawiiPG8[J].DoklBiochemBiophys,2014,455(1):43-48.
[19] Chernov V M,Chernova O A,Mouzykantov A A,et al.Extracellular membrane vesicles and phytopathogenicity ofAcholeplasmalaidlawiiPG8[J].DoklBiochemBiophys,2013,450:155-159.
[20] Chernov V M,Mouzykantov A A,Baranova N B,et al.Extracellular membrane vesicles secreted bymycoplasma AcholeplasmalaidlawiiPG8are enriched in virulence proteins[J].JProteomics,2014,110:117-128.
(责任编辑 姚倩倩)
中图分类号:S858.27
文献标识码:A
文章编号:1671-7236(2016)12-3329-07
doi:10.16431/j.cnki.1671-7236.2016.12.036
收稿日期:2016-04-27
基金项目:福建省科技计划项目-省属公益类科研院所基本科研专项“山羊支原体肺炎流行病学和快速检测技术研究”(2014R1023-6);福建省科技创新平台建设项目“羊支原体肺炎和山羊传染性胸膜肺炎病原快速检测试剂研究”(2014N2003-5)
作者简介:江锦秀(1987-),女,福建福州人,硕士,研究实习员,研究方向:动物传染病,E-mail:15080453371@163.com
通信作者:*胡奇林(1963-),男,湖南邵阳人,硕士,研究员,研究方向:动物传染病学和免疫学,E-mail:hql562713@163.com
Isolation and Identification ofAcholeplasmalaidlawiiFJ-NP Strains in Goat
JIANG Jin-xiu,LIN Yu-sheng,YOU Wei,JIANG Bin,HU Qi-lin*
(InstituteofAnimalHusbandry&VeterinaryMedicine,FujianAcademyof AgriculturalSciences,Fuzhou350013,China)
Abstract:To confirm the pathogen of a suspected mycoplasmal pneumonia of goat in a farm of Fujian province,the pathogen in the lung tissue was isolated and purified using medium forMycoplasma.It was identified by biochemical test and PCR method,and 16SrRNA gene of the isolate was sequenced.The results showed that the isolate colonies were like fried eggs with brown protrusion in the center,and it could ferment glucose,not hydrolyze arginine and decompose urea,meanwhile,four azole nitrogen chloride reduction reaction,cholesterol test,hemadsorption test,blood adsorption experiment and hemolysis test of isolate were all negative,however,Meilan reduction reaction was positive.The productions of PCR amplification was about 505bp which wasAcholeplasmalaidlawiispecific band.The result of sequence analysis indicated that there was 99.8%homology between the nucleotide sequence of 16SrRNA gene of the isolate and that ofAcholeplasmalaidlawiistrain PG8.The identification results showed that the isolated from the lung tissue of goat wasAcholeplasmalaidlawiicalled FJ-NP strain,while futher study would be needed for the relationship between the pathogentic isolates and goat disease.
Key words:goat mycoplasmal pneumonia;Acholeplasmalaidlawii;isolation;identification

