黑羽番鸭成肌细胞的分离培养与鉴定
王丽 王锋超 张玲 王洁 董飚 王军 陈嘉皓 王健


摘要:为建立番鸭成肌细胞体外分离培养和鉴定体系,选取不同胚龄黑羽番鸭为材料,利用Ⅱ型胶原酶和胰酶消化鸭胚腿肌获得成肌细胞,再经过3次差速贴壁进一步纯化,最后采用含2%马血清的培养基对分离纯化的成肌细胞进行分化诱导,结合细胞形态的观察、成肌细胞增殖期及分化期的标志基因的表达情况的检测鉴定分离的成肌细胞。结果显示,分离纯化得到的成肌细胞在贴壁后呈现纺锤形,进行分化处理后出现细胞融合。从E17鸭胚腿肌中获得的成肌细胞较E15、E16和E18中分离培养的效果更好,且经差速贴壁法纯化后大部分细胞中均检测到标志基因Desmin的表达,表明纯化后成肌细胞纯度较好。成肌细胞诱导分化处理48 h后,成肌调控因子MyoD的表达显著上调;成肌细胞增殖期特异性表达的Myf5显著性降低;分化期特异性表达的基因MyHC、MyoG以及MRF4均显著性增加。综上所述,本试验成功分离和鉴定了黑羽番鸭成肌细胞,可为研究番鸭肌肉发育和分子调控机制提供参考。
关键词:黑羽番鸭;成肌细胞;细胞分离培养;细胞分化;细胞鉴定
中图分类号:S834.1 文献标志码:A
文章编号:1002-1302(2023)24-0155-06
随着我国家禽养殖业的发展,人们对优质肉鸭的需求逐渐上升,品质优良肉鸭的开发成为水禽育种者的重点工作之一。黑羽番鸭是利用原产于南美洲和中美洲番鸭资源,进行羽色和经济性状选育形成,具有“五黑”,即黑羽、黑喙、黑蹼、黑胫和黑爪特色,味道鲜美、肉质细嫩、生长速度快及抗逆性好[1]。本研究以黑羽番鸭鸭胚为试验材料,建立黑羽番鸭成肌细胞体外分离培养和鉴定的体系,为黑羽番鸭的进一步选育和生产性能提升提供研究模型。
成肌细胞是来源于中胚层的肌组织前体干细胞,其胞质中含有肌丝,具有多向分化能力。增殖分化后会融合为多核肌管,形成多核肌纤维,广泛用于肌肉生长发育和相关的疾病或营养调控的研究。成肌细胞的增殖和分化的过程受到许多生肌因子的调控,其中,发挥关键作用的是成肌调控因子。成肌调控因子家族成员有生肌决定因子(MyoD)、肌细胞生成素(MyoG)、成肌因子5(Myf5)、成肌调节因子(MRF4),在肌肉组织中特异性表达,参与调控多种肌肉细胞的发育[2]。MyoD是在成肌细胞分化过程早期表达的基因之一,促使中胚层细胞转化为成肌细胞,也可促进成纤维细胞和平滑肌细胞等多种类型的细胞向成肌细胞转化[3]。MyoD在8~12 d的金定鸭鸭胚骨骼肌中的表达平稳,在13~23 d的鸭胚中随着成肌细胞的分化,其表达呈现先增加后降低直至平稳的趋势,在17 d鸭胚骨骼肌中表达量最高[4-5]。Myf5是成肌调控因子家族中最早诱导表达的转录因子,参与调控机体多个组织的发育[3]。MyoG在成肌细胞分化末期高表达,是其定向分化的标志基因,促进多核肌管的形成,进而参与调控成肌细胞分化为肌纤维[6]。MRF4在骨骼肌中的表达量远高于其他成肌调控因子家族成员。当同时敲除Myf5与MyoD,MRF4能够代偿性表达,促进起始肌肉的形成[7]。结蛋白(Desmin)是肌细胞特异性表达的细胞骨架蛋白,可作为成肌细胞的标志蛋白用于成肌细胞的鉴定[8]。此外,肌球蛋白重链(MyHC)是骨骼肌中肌球蛋白的重要组成部分,被称为肌纤维分化标志蛋白,是常用的鉴定成肌分化的标记基因[9]。
成肌细胞最初是在蛙骨骼肌中发现并分离得到,随后在人、小鼠、大鼠、猪、绵羊和山羊中建立了成熟的体外分离和培养体系[9]。家禽成肌细胞的体外分离和培养技术也逐步发展起来,由于家禽与哺乳动物的生理特性不同,不同品种间家禽的生理差异也比较大,使不同品种家禽成肌细胞的分离和培养仍有待完善。关于黑羽番鸭成肌细胞体外分离和纯化培养相关的研究相对较少,限制了黑羽番鸭肌肉发育机理的研究。胶原酶和胰蛋白酶相结合的方法是骨骼肌成肌细胞消化分离最主要的方法,该方法快速简便[10]。而成肌细胞纯化最常用的方法是差速贴壁法和梯度密度离心法[11-12]。梯度密度离心法所需要的原始细胞数量较多,且存在需要多次纯化分离或对细胞活性有影响的问题,然而差速贴壁法利用了成肌细胞贴壁速度较其他杂细胞速度慢的特点,可获得纯度较高的成肌细胞,还能保障细胞的生长状态良好和稳定[9]。
本研究选用黑羽番鸭鸭胚腿肌组织作为试验材料,采用Ⅱ型胶原酶和胰蛋白酶消化法结合差速贴壁法对腿肌中的成肌细胞进行分离和纯化。为鉴定獲得成肌细胞,利用细胞免疫荧光检测了Desmin的表达定位情况。采用2%马血清对获得的成肌细胞进行分化处理,再用荧光定量PCR检测了MyoD、MyoG、Myf5、MRF4和MyHC的基因表达情况,进一步鉴定分离获得的为成肌细胞,建立黑羽番鸭成肌细胞的分离培养体系,为黑羽番鸭肌肉发育和机理研究提供参考。
1 材料与方法
1.1 试验材料
试验于2022年5—9月在江苏农牧科技职业学院科创基地实验室进行。新鲜黑羽番鸭受精蛋由江苏农牧科技职业学院国家水禽基因库(江苏)馈赠。
DEME高糖培养基、胎牛血清(FBS)、孕马血清(HS)、谷氨酰胺替代物Gluta MAXTM-Ⅰ(100×)购自Gibco公司;磷酸盐缓冲液(PBS)、0.25%胰蛋白酶溶液购自Hyclone公司;青-链霉素混合液购自Biosharp公司;兔多克隆一抗Desmin和FITC标记的山羊抗兔二抗,均购自武汉博士德公司;细胞组织RNA提取试剂盒、cDNA反转录试剂盒、ChamQ Universal SYBR qPCR Master Mix,购自南京诺唯赞公司;胶原酶Ⅱ型、DABCO,购自Sigma公司;离心管、细胞培养板/瓶,购自康宁公司。
1.2 试验方法
1.2.1 培养液配制
基础培养液:在DMEM高糖培养基中FBS、谷氨酰胺替代物和青-链霉素混合液的占比分别为15%、1%和1%。
分化培养液:在DMEM高糖培养基中HS、谷氨酰胺替代物和青-链霉素混合液的占比分别为2%、1%和1%。
1.2.2 酶消化法进行成肌细胞的分离
将鸭胚蛋用医用乙醇棉进行清洗和消毒,再用刀柄钝头将蛋壳大头敲开,剥离蛋壳后将鸭胚缓慢取出,置于75%乙醇中浸泡清洗1次,然后将其放入含有双抗的 PBS 中,清洗2~3 次,最终放置在盛有PBS的干净培养皿中。使用镊子将腿肌分离并移入另一个干净的培养皿中,PBS清洗2~3 次后,采用刀片将分离出来的腿肌切成肉糜,并添加适量PBS制成腿肌肉糜混合液。将肉糜混合液转移至15 mL離心管中,置于离心机中1 500 r/m离心5 min。弃上清,向离心管中加入DMEM高糖培养基,然后加入适量0.25%胰蛋白酶和0.1%胶原蛋白酶Ⅱ。将混合液置于37 ℃水浴消化10~15 min。其中,每2~3 min观察下肉糜的消化情况,待肉糜完全消化成絮状时,加入含有血清的高糖DMEM 终止消化。随后,室温离心1 500 r/m离心5 min,弃上清后,采用基础培养基吹打混匀,过70 μm细胞滤筛,将得到的较纯净细胞悬液于1 500 r/m离心5 min后,再采用基础培养基清洗1次。将获得的细胞沉淀用基础培养基进行悬浮,并转入细胞培养瓶中,置于5% CO2、39 ℃的细胞培养箱中培养。
1.2.3 差速贴壁法进行成肌细胞的纯化培养
将分离得到的成肌细胞在细胞培养箱中培养30 min后,将细胞培养基吸取并轻移至一个新的培养瓶中进行培养,并放入5% CO2、39 ℃的细胞培养箱中继续培养,此时细胞培养基中含有未贴壁的成肌细胞。进行3次这样的差速贴壁所获得的成肌细胞纯度高,形态一致。
将纯化的成肌细胞置于5% CO2、39 ℃的细胞培养箱中培养,每隔24 h更换细胞基础培养液,并观察细胞形态和状态。当细胞密度达80%时进行细胞传代,吸去培养液后采用PBS清洗2~3 次,每个培养瓶(2.5 cm2)中加入1 mL 0.25%胰蛋白酶和 1 mL PBS,置于CO2培养箱中3~5 min后,采用含有FBS的培养液终止消化,吸取培养液吹打瓶壁,使细胞脱落更完全,将细胞悬液收集于15 mL离心管中1 500 r/min离心5 min,弃上清,再采用PBS悬浮清洗2次,每次5 min,离心转速为1 500 r/min,最后采用基础培养液悬浮细胞沉淀,并按照需求进行分瓶培养或移入细胞培养板,于5% CO2、39 ℃的细胞培养箱中继续培养。
1.2.4 马血清诱导成肌细胞的分化
当成肌细胞密度达80%以上时,去除基础培养液,加入含2% HS的分化培养液,每隔24 h观察成肌细胞的形态和肌管融合的情况,并更换细胞培养液。
1.2.5 实时荧光定量PCR检测基因表达
按照细胞组织RNA提取试剂盒说明书步骤提取细胞组织总RNA,使用超微量分光光度计(NanoPhotometer[KG-*3]N60)仪器检测RNA浓度和纯度,RNA样品的D260 nm/D280 nm 全部在1.8~2.2范围内。
根据反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser)说明书步骤,总反应体系为 20 μL,分2步进行,第1步去除基因组DNA:4 μL 4×gDNA Wiper Mix、1 μL oligo(dT)23VN、1 μL Random hexamers、10 μL总RNA,反应条件42 ℃,2 min;第2步cDNA的合成:在第1步反应后的溶液中加入2 μL 10×RT Mix、2 μL Hiscript Ⅱ Enzyme Mix。反应条件:50 ℃ 15 min;85 ℃ 2 min;-20 ℃保存。
目标基因的引物委托生工生物工程(上海)有限公司合成,引物信息见表1。进行荧光定量PCR,反应体系总体积 20.0 μL:10.0 μL SYBR qPCR Master Mix、0.4 μL上游引物、0.4 μL下游引物、2.0 μL cDNA模板、7.2 μL ddH2O;反应条件为 95 ℃ 预变性 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.2.6 成肌细胞Desmin细胞免疫荧光鉴定
取适量分离的成肌细胞,铺于12孔板中,待细胞密度达60%~80%后即可利用Desmin的抗体进行细胞免疫荧光化学鉴定。具体步骤:采用预冷的PBS清洗细胞3次,每次5 min。再用4%多聚甲醛固定细胞10~15 min,PBS清洗3次,每次5 min。采用0.1% Triton X-100透膜10 min,PBS清洗3次,每次 5 min。用含2% BSA的PBS封闭非特异性位点 1~2 h,于4 ℃用Desmin的兔多克隆一抗(1 ∶50稀释)孵育12~16 h。PBST(PBS溶液中添加1‰的吐温-20)清洗3次,每次5 min。于37 ℃采用山羊抗兔FITC标记的二坑孵育1~2 h。PBST清洗3次,每次5 min。DAPI染色5~10 min。PBS清洗3次,每次5 min,加入适量防荧光淬灭剂DABCO后,于倒置荧光显微镜下观察。
1.3 数据统计与分析
使用SPSS 27.0软件对试验数据进行独立样本t检验分析,数据结果表示为“平均值±标准误”,α=0.05。
2 结果与分析
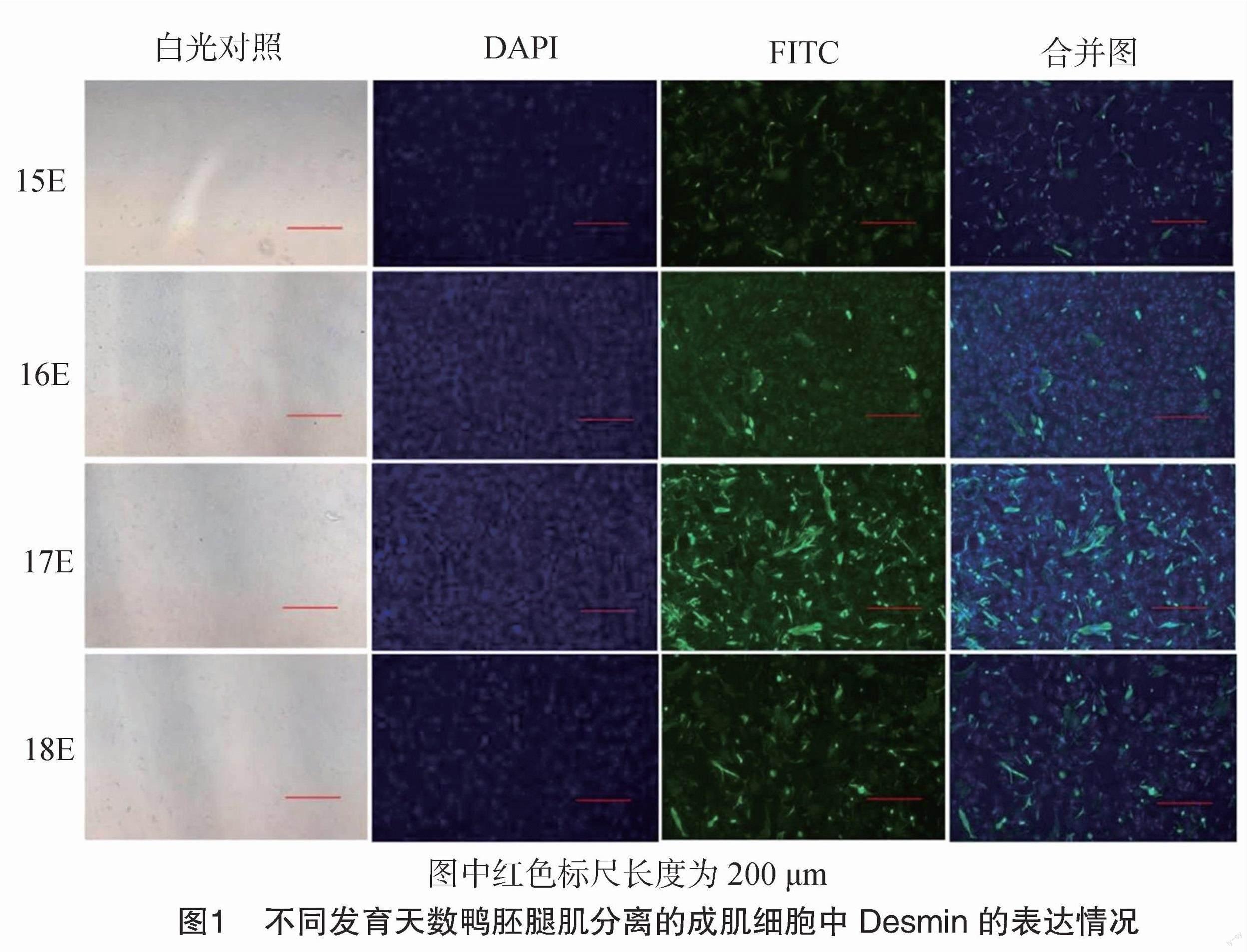
2.1 黑羽番鸭腿肌成肌细胞分离的时间确定
采用Ⅱ型胶原酶和胰酶混合液消化不同孵化天数鸭胚腿肌,将收集到的混合细胞培养24 h后观察,呈现不规则纺锤形或细长梭形,利用细胞免疫荧光检测肌细胞特异性表达蛋白Desmin的表达情况。由图1可知,Desmin蛋白经FITC标记后经激发呈现绿色,细胞核经DAPI染色后经激发呈现蓝色,在E15、E16、E17和E18的鸭胚腿肌分离的未经纯化的成肌细胞中均有Desmin的表达,且E17腿肌中分离的细胞中有较多的细胞显示出Desmin的表达。因此,后续试验选择E17的腿肌进行试验。
2.2 黑羽番鸭腿肌成肌细胞的形态特征
将17 d鸭胚腿肌进行酶消化处理后,再用差速贴壁法进一步纯化3次。由图2可知,分离得到成肌细胞呈现细长形或者纺锤形,在采用2% HS分化处理48 h后有肌管融合的现象。将差速贴壁处理时,在30 min内贴壁的细胞继续培养,细胞呈现不规则纺锤形,进行2% HS处理48 h后细胞形态没有变化,说明30 min内贴壁的细胞不能被HS诱导分化,即这些快速贴壁的细胞不是成肌细胞,表明差速贴壁法可以有效纯化成肌细胞。
2.3 黑羽番鸭成肌细胞中Desmin的表达定位情况
利用细胞免疫荧光技术检测纯化后的成肌细胞中Desmin的表达情况,由图3可知,Desmin蛋白经FITC标记后经激发呈现绿色,细胞核经DAPI染色后经激发呈现蓝色,95% 细胞均能显示Desmin的表达,即呈现绿色,表明分离的黑羽番鸭腿肌成肌细胞纯度较好。
2.3 成肌细胞增殖和分化阶段特异性表达基因的mRNA表达水平
将分离纯化后的成肌细胞利用2% HS进行诱导分化处理48 h,对照组采用基础培养基培养,收集细胞提取RNA,反转录后利用荧光定量PCR检测成肌细胞增殖和分化阶段特异性表达基因的mRNA表达水平。由图4可知,分化处理48 h后,MyoD、MyoG、MyHC、MRF4的mRNA表达水平显著升高,而Myf5的mRNA表达水平显著降低。
3 讨论
成肌细胞的生长发育对于肉鸭的生长性状有着重要影响,关于肉鸭体外分离成肌细胞培养方法的完善,对肉鸭肌肉发育的生长发育研究具有重要意义。
成肌干细胞比例是影响成肌细胞分离成功的重要因素之一,不同品种的水禽孵化期有所不同,肌纤维中肌源干细胞的比例也会随着蛋胚的发育而改变。研究表明,在马岗鹅的鹅胚中分离成肌细胞时,从E23的胸腿肌中分离出成肌细胞的效率明显比E15中分离的低,且39 ℃较37 ℃更有利于水禽成肌细胞的发育[10]。樱桃谷鸭鸭胚发育至13 d时,比较适合分离培养成肌细胞[3]。研究发现,在仅利用酶消化法从黑羽番鸭E15、E16、E17、E18腿肌中分离成肌细胞时,细胞免疫荧光结果显示,Desmin在从15 d至18 d的鸭胚腿肌中分离获得的细胞中均有表达,且在E17腿肌分离的细胞中表达量最高,表明E17黑羽番鸭鸭胚最适合分离成肌细胞。酶消化法处理鸭胚腿肌时,会获得除成肌细胞以外的细胞,主要是成纤维细胞,由于成纤维细胞贴壁的速度较成肌细胞快。因此,在使用酶消化法获取到成肌细胞混合液后,需要利用差速贴壁法对成肌细胞进行纯化。经3次差速贴壁处理后,大部分获取的成肌细胞中均能检测到Desmin,表明纯化效果较好,这与陈凯凯等从肉鸡鸡胚中分离成肌细胞时的结果[9]相符合。
成肌细胞可被马血清诱导分化,2%马血清诱导分化的效果较1%和5%的效果更好[13]。本试验中利用2%马血清对分离获得的成肌细胞进行诱导分化, 结果显示在诱导分化48 h后, 成肌细胞的形态较对照组比出现肌管融合的现象,而分离培养时 30 min 内贴壁的细胞受到马血清处理后,细胞形态无变化,提示本试验中分离纯化的细胞是成肌细胞。为进一步确认,分离出来的成肌细胞被诱导处理,确实有开始分化。利用RT-PCR检测了分化处理前后,成肌调控因子家族成员的表达及肌纤维分化标志蛋白MyHC的基因表达。结果显示,分化处理48 h后,成肌细胞增殖期特异性表达的基因Myf5显著性降低;分化期特异性表达的基因MyoG、MRF4及MyCH均显著性增加。此外,成肌调控因子MyoD的表达也显著上调,这与研究中显示的MyoD的表达在早期分化处理时会出现上调的现象[14]相符合。
4 结论
本试验发现,黑羽番鸭分离获取成肌细胞的最佳时间在孵化17 d左右,通过检测Desmin、成肌调控因子家族成员及肌纤维分化标志蛋白MyHC的表达,表明利用胶原酶Ⅱ和胰酶消化法结合多次差速贴壁法可得到纯度较高的黑羽番鸭成肌细胞。
参考文献:
[1]孙国波,董 飚,卞友庆,等. 黑羽番鸭不同饲养方式下生产性能的比较[J]. 黑龙江畜牧兽医,2016(12):73-74.
[2]Shirakawa T,Toyono T,Inoue A,et al. Factors regulating or regulated by myogenic regulatory factors in skeletal muscle stem cells[J]. Cells,2022,11(9):1493.
[3]孙文强. Akirin基因调控鸭成肌细胞增殖与分化的作用研究[D]. 雅安:四川农业大学,2019:2-38.
[4]陶志云,朱春红,姬改革,等. 鸭胚骨骼肌成肌细胞中MyoD1和Myf5基因的表达与分析[J]. 福建农林大学学报(自然科学版),2014,43(3):299-303.
[5]刘宏祥,胡 艳,单艳菊,等. 鸭胚胎发育早期MyoD和MSTN的表达变化规律[J]. 东北农业大学学报,2015,46(6):79-85.
[6]Vicente-García C,Hernández-Camacho J D,Carvajal J J. Regulation of myogenic gene expression[J]. Experimental Cell Research,2022,419(1):113299.
[7]Kassar-Duchossoy L,Gayraud-Morel B,Gomès D,et al. Mrf4 determines skeletal muscle identity in Myf5:Myod double-mutant mice[J]. Nature,2004,431(7007):466-471.
[8]Agnetti G,Herrmann H,Cohen S. New roles for desmin in the maintenance of muscle homeostasis[J]. The FEBS Journal,2022,289(10):2755-2770.
[9]陈凯凯,张 成,赵 菲,等. 肉鸡成肌细胞的分离培养与鉴定[J]. 中国农业大学学报,2020,25(9):72-79.
[10]王金辉,黄运茂,李秀金,等. 鹅成肌细胞的体外培养、鉴定及温度对细胞增殖分化的影响[J]. 仲恺农业工程学院学报,2020,33(2):21-27.
[11]喻宗岗,马海明. 猪骨骼肌卫星细胞体外分离培养研究进展[J]. 中国畜牧兽医,2022,49(8):2931-2942.
[12]刘璐璐,胡文萍,尚明玉,等. 湖羊胚胎来源成肌细胞的培养方法改良与特性分析[J]. 基因组学与应用生物学,2022,41(7):1440-1451.
[13]孟依然,史成良,宋春雨,等. 采用不同浓度马血清诱导C2C12肌前体细胞分化的实验研究[J]. 中国保健營养,2020,30(4):25.
[14]Sun W Q,Hu S Q,Hu J W,et al. miR-365 inhibits duck myoblast proliferation by targeting IGF-I via PI3K/Akt pathway[J]. Bioscience Reports,2019,39(11):BSR20190295.

