猴痘病毒B20R蛋白原核表达及其多克隆抗体的制备

摘要:【目的】构建猴痘病毒B20R蛋白原核表达系统,并评价原核表达获得的融合蛋白免疫原性,为后续的猴痘病毒检测及新型治疗方法开发提供技术支撑。【方法】参照GenBank已公布的猴痘病毒基因组序列,按照大肠杆菌密码子偏好性对B20R基因DNA序列进行优化,人工合成B20R基因并将其分别克隆至表达载体pET-28a和pET-32a以构建原核表达载体;以构建的2种原核表达载体分别转化大肠杆菌BL21感受态细胞,经IPTG诱导表达后使用SDS-PAGE和Western blotting检测融合蛋白B20R的表达情况。通过控制变量法优化融合蛋白B20R的诱导表达条件,使用Ni柱亲和层析进行纯化;以纯化的融合蛋白B20R经腹腔注射免疫昆明小鼠,定期采集昆明小鼠血样,采用ELISA检测血清抗体效价。【结果】将B20R基因克隆至表达载体pET-32a能成功构建原核表达载体pET-32a-B20R,经IPTG诱导后,可在大肠杆菌BL21感受态细胞中表达出融合蛋白B20R,且主要以不可溶的包涵体形式进行表达。融合蛋白B20R最佳诱导表达条件为37℃下以0.6mmol/L IPTG诱导12h,Ni柱亲和层析纯化的最佳咪唑洗脱浓度为40mmol/L。以纯化的融合蛋白B20R接种免疫昆明小鼠,可在短时间内引起昆明小鼠产生强烈的体液免疫,且至免疫第42d仍然维持较高的抗体水平,抗体效价高达1:409600。【结论】构建的猴痘病毒B20R蛋白原核表达载体可在大肠杆菌BL21细胞中以包涵体形式成功表达出融合蛋白B20R,且融合蛋白B20R具有良好的免疫原性,可在短时间内引起昆明小鼠产生强烈的体液免疫。
关键词:猴痘病毒;B20R蛋白;原核表达;免疫原性;抗体效价
中图分类号:S852.659.1文献标志码:A文章编号:2095-1191(2024)01-0217-09
Prokaryotic expression and polyclonal antibody preparation of monkeypox virus B20R protein
YANG Ling-di¹2,LI Xiao-mei¹,LU Xiao-ou¹,PENG Qi¹-2,KONG Ling-bao'2*,WANG Yu¹-2
('College of Bioscience and Bioengineering,JiangxiAgricultural University,Nanchang,Jiangxi330045,China; 2Nanchang City Key Laboratory of Animal Virus and Genetic Engineering,Nanchang,Jiangxi330045,China)
Abstract:[Objective]To construct aprokaryotic expression system for monkeypox virus B20R protein and evaluate the immunogenicity of the fusion protein obtained from prokaryotic expression,to provide technical support for subse-quent monkeypox virus detection and the development of novel treatment methods.【Method]Refering to the monkeypox virus genome sequence publishedin GenBank,the DNAsequence of B20R gene was optimized according to codon preferen-ce of Escherichia coli.B20R gene was synthesized,and cloned to expression vectors pET-28a and pET-32a to construct prokaryotic expression vectors.The two constructed prokaryotic expression vectors were individually transformed into E.coli BL21competent cells.After IPTG induced expression,both SDS-PAGE and Westen blotting were performed to de-tect the expression of B20R fusion protein.The induced expression conditions of B20R fusion protein were optimized by the control variable method,and Ni-column affinity chromatography was used for purification.Kunming mice were im-munized with the purified B20R fusion protein through intraperitoneal injection.Blood samples were collected regularly from Kunming mice,and the serum antibody titers were detected using ELISA.【Result]JThe B20R gene was successfully cloned into the pET-32a expression vector resulting in the construction of prokaryotic expression vector pET-32a-B20R.After induction with IPTG,the B20R fusion protein could be expressed in the main form of insoluble inclusion bodies in E.coli BL21competent cells.The optimal induced expression conditions for B20R fusion protein were0.6mmol/L IPTG induction at37℃for12h,and the optimal imidazole elution concentration for Ni-column affinity chromatography purifi-cation was40mmol/L.Immunization of Kunming mice with purified B20R fusion protein could rapidly induce strong hu-moral immunity in Kunming mice,and the high antibody level could still be maintained on the42day after immuniza-tion,with an antibody titer as high as1:409600.[Conclusion]The constructed prokaryotic expression vector of monkey-pox virus B20R protein can successfully express the B20R fusion protein in the form of inclusion bodies in E.coli BL21cells,and the B20R fusion protein has good immunogenicity,which can rapidly induce strong humoral immunity in Kun-ming mice.
Keywords:monkeypox virus;B20R protein;prokaryotic expression;immunogenicity;antibody titer
Foundation items:National Natural Science Foundation of China(31860038,32360908);Key Project of Jiangxi Natural Science Foundation(20224ACB205004)
0引言
【研究意义】猴痘(Monkeypox,MPX)是由猴痘病毒(Monkeypox virus,MPXV)感染引起的一种人兽共患传染病,潜伏期通常为6~13d,感染发病后的临床症状主要表现为高热、局部淋巴结肿大及全身水疱脓包,少数病例由于出血性疱疹或其他并发症导致病情加重,甚至死亡(Shchelkunov et al.,2001;Arndt et al.,2015;Petersen et al.,2019)。猴痘病毒此前主要流行于非洲中部和西部地区,2022年初欧美地区暴发猴痘疫情,同年9月我国出现首例猴痘病例(李婷婷等,2022)。猴痘病毒的传染性极高,具有在全世界大面积暴发流行的潜在风险,已被世界卫生组织(WHO)列为国际关注的突发公共卫生事件(Kumar et al.,2022),但目前针对猴痘病毒的研究相对较少,其生物学特性、致病机理及病毒蛋白的免疫原性等尚未明确。因此,亟待对猴痘病毒蛋白进行原核表达纯化并检测其免疫原性,为深入探究猴痘病毒蛋白生物学功能及其诊断试剂和疫苗研发提供理论依据。【前人研究进展】猴痘病毒于1958年首次从丹麦实验室的猴子皮肤疱疹(痘)中分离获得,是一种双链DNA病毒,其基因组全长197kb,具有190个开放阅读框(ORF),隶属于痘病毒科(Poxviridae)正痘病毒属(Orthopoxvirus)(McCollum and Damon,2014;Sklenovska and van Ranst,2018;Al-Gburi and Namuq,2022;Laiton-Donato et al.,2022)。猴痘病毒与天花病毒和牛痘病毒同属,三者间具有较高的同源性。猴痘病毒基因组的中心区域编码必需酶和结构蛋白,与天花病毒中心区域的相似性为96.3%,故早期采用接种牛痘天花疫苗来预防猴痘,其保护率可达85.0%(Nasir et al.,2018;Sklenovska and van Ranst,2018;Quarleri et al.,2022;Saxena et al.,2022);但这种免疫接种办法存在明显的副作用,因此亟待开发出更安全高效的疫苗来预防和治疗猴痘。2022年美国食品药品监督管理局(FDA)临时批准了Jynneos疫苗和ACAM2000疫苗可用于预防及治疗猴痘。临床统计数据显示,Jynneos疫苗的预防效果优于ACAM2000疫苗,故Jynneos疫苗被批准为预防猴痘的疫苗,是目前唯一获批的猴痘疫苗,但至今尚未研发出防治猴痘病毒的特效药(Brown and Leggat,2016;Karim et al.,2022;Meo et al.,2022;Saxena et al.,2022)。有研究证实,特考韦瑞ST-246是一种针对正痘病毒小分子的抑制剂,于2022年在欧洲获批用于治疗猴痘(Zhao et al.,2024);病毒DNA聚合酶抑制剂西多福韦和布林西多福韦衍生物对正痘病毒具有较强的抗病毒活性(Baker et al.,2003;Stafford et al.,2023);Nioch-14作为核苷类似物抑制剂也可用于治疗猴痘(Mazurkov et al.,2016);利巴韦林、噻唑呋喃、C-CA3-ADO、C3-NPC A、DNA聚合酶抑制剂HPMA和腺苷N1氧化物(ANO)等均具有良好的抗痘病毒活性(Baker et al.,2003)。虽然这些药物对治疗猴痘有一定疗效(Baker et al.,2003;Delaune and Iseni,2020),但都不是针对猴痘病毒的特效抗病毒药物。【本研究切入点】目前,市面上尚无猴痘病毒抗原检测试剂盒,猴痘病毒诊断试剂也较匮乏。猴痘病毒蛋白B20R由190个氨基酸组成,蛋白大小21.5kD,具备作为抗原检测蛋白的潜能(Shchelkunov et al.,2002),但天花病毒和痘苗病毒并无对应的同源蛋白,导致其生物学功能完全未知。【拟解决的关键问题】参照GenBank已公布的猴痘病毒基因组序列,对B20R基因进行密码子优化及人工合成,通过构建原核表达载体pET-32a-B20R,利用原核表达系统诱导表达融合蛋白并优化其表达条件,以纯化的融合蛋白免疫接种昆明小鼠进行免疫原性评价,以期为后续的猴痘病毒检测及新型治疗方法开发提供技术支撑。
1材料与方法
1.1试验材料
表达载体pET-32a及大肠杆菌DH5α和BL21感受态细胞由南昌市动物病毒与基因工程重点研究室保存提供;DL2000DNA Marker、DL15000DNA Marker、限制性核酸内切酶、T4DNA连接酶及核酸染料购自翌圣生物科技(上海)股份有限公司;十二烷基硫酸钠(SDS)、30%丙烯酰胺、IPTG、三羟甲基氨基甲烷、甘氨酸、氨苄青霉素、卡那霉素及琼脂糖购自北京索莱宝科技有限公司;胰蛋白胨、酵母提取物及过硫酸铵购自英国Oxoid公司;DNA纯化回收试剂盒购自生工生物工程(上海)股份有限公司;质粒小提试剂盒购自天根生化科技(北京)有限公司;弗氏完全佐剂与弗氏不完全佐剂购自美国Sigma公司;ECL发光液和TMB显色液购自上海碧云天生物技术股份有限公司。主要仪器设备有梯度PCR仪(SimpliAmpThermal C)、凝胶成像分析系统(GelDox XR)、台式高速冷冻离心机、琼脂糖水平电泳仪(EPS-600)及培英2-1台式恒温摇床等。
1.2B20R蛋白结构预测
参照NCBI已公布的猴痘病毒基因组序列(MPXV_USA_2022_MA001,登录号ON563414.3),选择B20R基因并翻译成氨基酸序列,然后通过ExPASy、IEDB和TMHMM等在线软件分别进行B20R蛋白亲/疏水性、抗原表位及跨膜结构预测。
1.3原核表达载体构建
1.3.1原核表达载体pET-28a-B20R构建参照NCBI已公布的猴痘病毒基因组序列(MPXV_USA_2022_MA001),委托北京擎科新业生物技术有限公司按照大肠杆菌密码子偏好性对B20R基因进行DNA序列优化及人工合成,并将合成的目的基因插入载体pET-28a的BamHI与Hind III酶切位点之间,构建原核表达载体pET-28a-B20R。
1.3.2原核表达载体pET-32a-B20R构建以构建的原核表达载体pET-28a-B20R为模板、B20R-F(5'-CGCGGATCCATGACCATTTATGGTC-3')和B20R-R(5'-CGCTCGAGACCATCAACGCC-3')为引物,使用高保真酶PCR扩增B20R基因。通过BamHI和Xho I内切酶分别双酶切表达载体pET-32a及扩增获得的B20R基因片段,回收酶切产物并以T4DNA连接酶进行连接,然后转化DH5α感受态细胞。挑取DH5α菌株转化子进行菌落PCR鉴定及双酶切鉴定,阳性质粒送至北京擎科新业生物技术有限公司进行Sanger测序。
1.4融合蛋白表达与验证
以原核表达载体pET-28a-B20R和pET-32a-B20R分别转化BL21感受态细胞,37℃培养箱过夜培养。挑取单菌落接种至5.0mL含抗生素的LB液体培养基中,37℃振荡培养至OD₆为0.6~0.8,即获得种子液。将种子液按1%的接种量接种至5.0mL含抗生素的LB液体培养基中,37℃振荡培养至ODo为0.6~0.8,加入终浓度为1.0mmol/L的IPTG,37℃摇床诱导表达8h。取1.5mL诱导表达的菌液,12000×g离心2min收集菌体,加入PBS重悬后与蛋白上样缓冲液混匀,沸水浴20min,12000×g离心2min,弃上清液。取10μL菌体蛋白样品进行SDS-PAGE,考马斯亮蓝染色分析融合蛋白表达情况;同时取10μL菌体蛋白样品进行SDS-PAGE,再通过Western blot-ting验证目的蛋白是否表达。
1.5融合蛋白诱导表达条件优化
(1)诱导温度优化:将种子液接种至5.0mL含抗生素的LB液体培养基中,37℃振荡培养至OD₆为0.6~0.8,加入终浓度为1.0mmol/L的IPTG,分别在18、22、27、32、37和42℃下诱导表达8h,以未添加IPTG的菌液为阴性对照。取等量菌液制备样品,通过SDS-PAGE检测融合蛋白表达效果。(2)诱导时间优化:将种子液接种至5.0mL含抗生素的LB液体培养基中,37℃摇床培养至ODo为0.6~0.8,加入终浓度为1.0mmol/L的IPTG,在37℃下分别诱导表达4、8、12、16、20和24h,以未添加IPTG的菌液为阴性对照。取等量菌液制备样品,通过SDS-PAGE检测融合蛋白表达效果。(3)IPTG浓度优化:将种子液接种至5.0mL含抗生素的LB液体培养基中,37℃摇床培养至OD₆o为0.6~0.8,分别加入终浓度为0.2、0.4、0.6、0.8、1.0和1.2mmol/L的IPTG,37℃下诱导表达8h,以未添加IPTG的菌液为阴性对照。取等量菌液制备样品,通过SDS-PAGE检测融合蛋白表达效果。
1.6融合蛋白表达形式验证
在最佳诱导表达条件下大量诱导表达融合蛋白B20R,收集菌液,12000×g离心10min,弃上清液,加入PBS重悬后以超声波破碎仪破碎菌体细胞,12000xg离心30min,分别收集上清液和沉淀物制备样品,通过SDS-PAGE检测融合蛋白B20R表达形式。
1.7融合蛋白纯化
包涵体沉淀采用包涵体洗涤液I(2%Triton X-100,2mol/L Urea,50mmol/L Tris-HCl,0.5mol/L NaCl)重悬,室温摇转洗涤20min,12000×g离心10min,重复洗涤2次;再以包涵体洗涤液Ⅱ(1%Triton X-100,50mmol/L Tris-HC1,0.5mol/L NaCl)重悬,室温摇转洗涤15min,12000×g离心10min,重复洗涤2次;最后以包涵体洗涤液Ⅲ(50mmol/L Tris-HCl,0.5mol/L NaC1)重悬,摇转洗涤20min,12000×g离心10min,重复洗涤2次。12000×g离心10min,弃上清液,用10.0mL包涵体溶解液(100mmol/LNaH₂PO₄,10mmol/L Tris-HCl,8mol/LUrea,0.3mol/L NaCl)进行重悬,常温下过夜摇转溶解,次日20000×g离心30min,收集上清液,以0.45μm滤膜过滤备用。通过Ni柱亲和层析纯化融合蛋白,以10.0mL的20、40、60和80mmol/L梯度咪唑洗脱目的蛋白,分别取少量蛋白洗脱液制备样品,以SDS-PAGE检测目的蛋白浓度及纯度。
1.8融合蛋白多克隆抗体效价测定及特异性分析
准备8只6周龄雌性昆明小鼠,随机分为2组,试验组(4只)腹腔注射纯化后的融合蛋白B20R,对照组(4只)腹腔注射纯化后的TrxA标签蛋白。首次免疫,将融合蛋白B20R或TrxA标签蛋白与弗式完全佐剂充分混匀,每只小鼠腹腔注射40μg蛋白;首免2周后,将融合蛋白B20R或TrxA标签蛋白与弗式不完全佐剂充分混匀,以相同方法加强免疫1次,之后隔1周实施第2次强化免疫,共免疫3次。于首免开始,每周采集小鼠尾部静脉血1次,血样37℃静置1h后,4℃下16000×g离心30min,收集血清,-80℃保存备用。动物试验由江西农业大学动物伦理委员会批准,批准号JXAU20180072。
通过ELISA检测多克隆抗体效价:纯化后的融合蛋白B20R稀释至2μg/mL,接种至96孔细胞板中,每孔加入50μL稀释后的融合蛋白,4℃包被过夜;次日,以PBST洗涤5次,每次1min;然后每孔加入100μ L10%脱脂牛奶,37℃封闭1h;PBST洗涤6次后每孔加入50μL免疫小鼠血清(一抗),37℃孵育2h;PBST洗涤7次,每孔加入50μL HRP标记山羊抗鼠IgG(二抗),37℃孵育1h;PBST洗涤8次,每孔加入100μL TMB显色液,37℃避光孵育30min,再每孔加入50μL的2mol/L H₂SO₄终止反应,使用酶标仪在450nm波长处测量吸光值,并计算多克隆抗体效价。
2结果与分析
2.1B20R蛋白结构特性预测结果
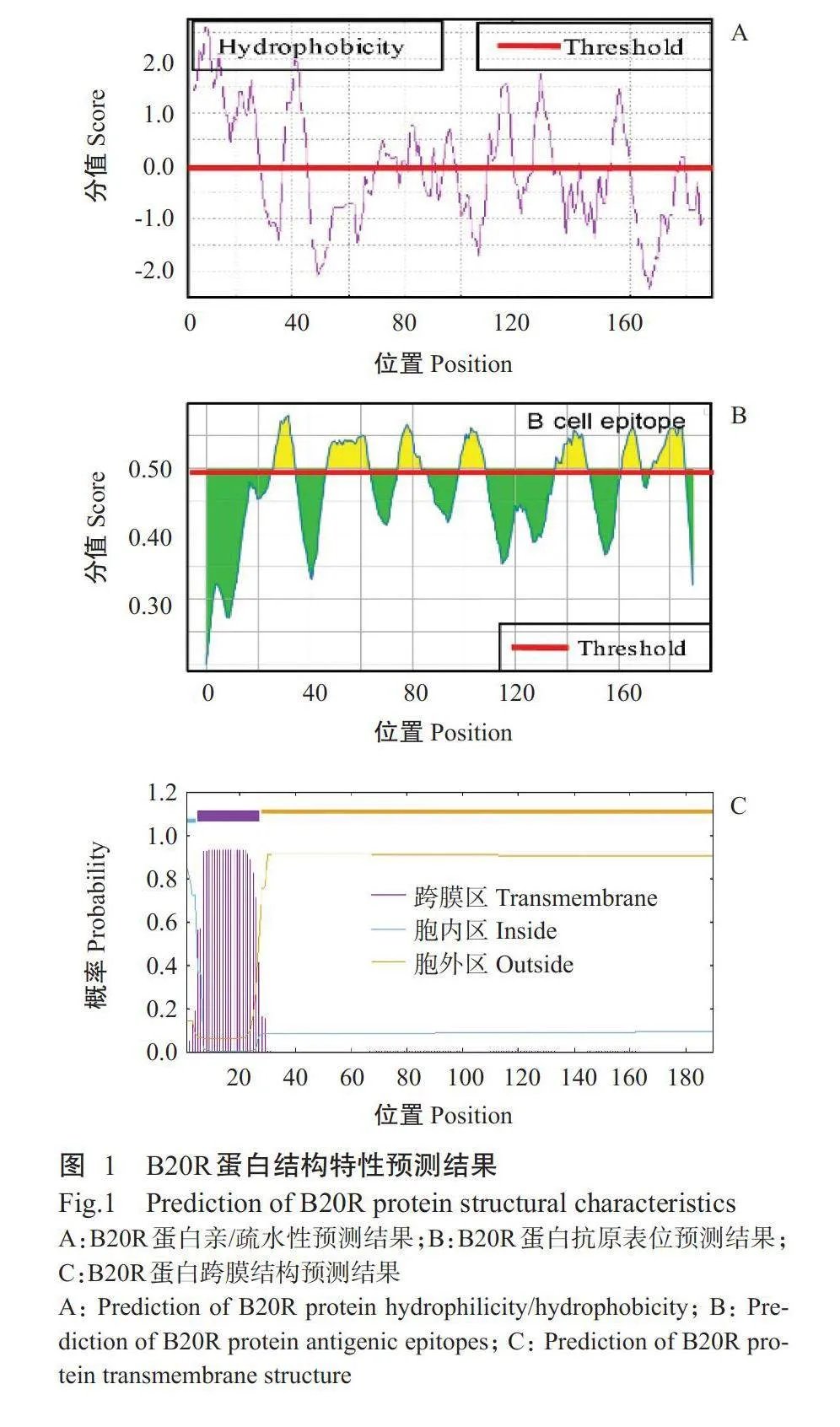
猴痘病毒B20R蛋白由190个氨基酸组成,其分子量为21.5kD,理论等电点(pI)为5.48。ExPASy预测结果(图1-A)显示,B20R蛋白N端疏水性较高,其余部分亲水性较高,平均亲水性系数(GRAVY)为-0.097,属于亲水性蛋白。通过IEDB预测B20R蛋白抗原表位,设阈值为0.50(对应于75%的特异性截止值),结果显示,B20R蛋白存在多个B细胞抗原表位和非B细胞抗原表位(图1-B)。采用TMHMM预测B20R蛋白跨膜结构,结果发现,B20R蛋白N端含有1个跨膜结构域(图1-C),与ExPASy预测显示N端疏水性较高及IEDB预测显示N端有1个较大的非B细胞抗原表位相符合。
2.2原核表达载体pET-32a-B20R构建及鉴定结果
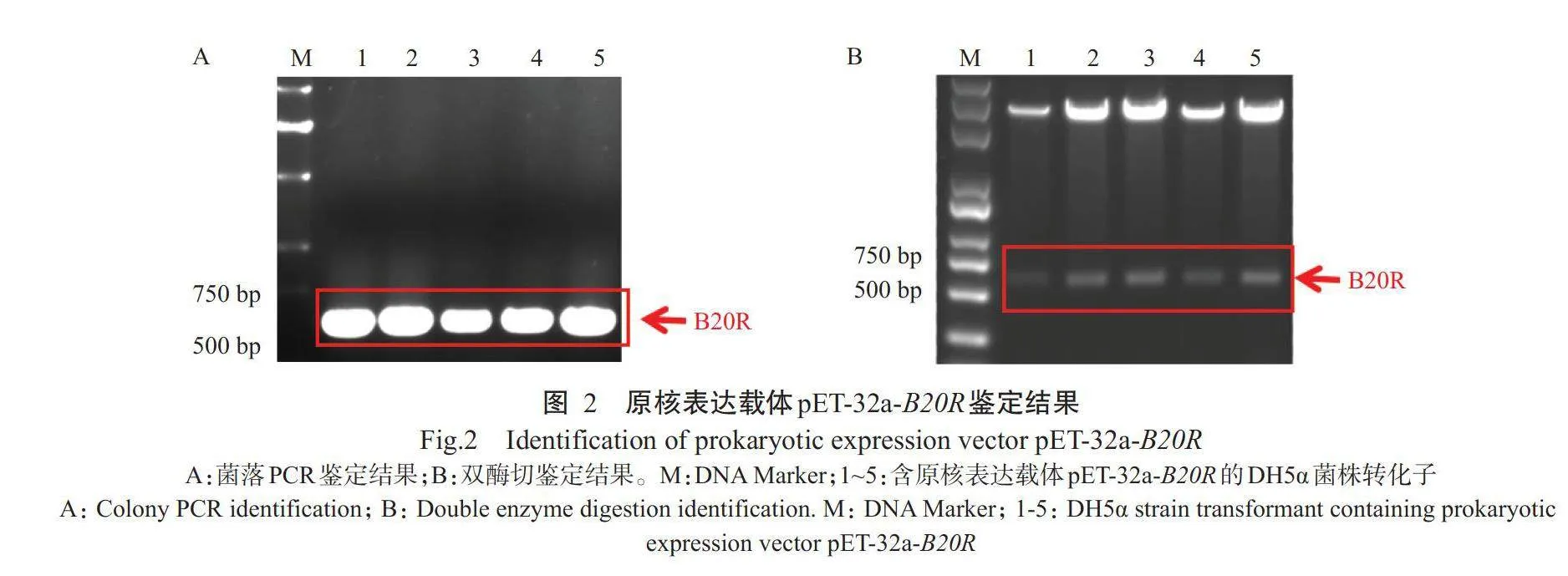
随机挑取5个含原核表达载体pET-32a-B20R的DH5α菌株转化子进行菌落PCR验证,结果显示,均能扩增出明亮单一且大小在500~750bp的目的条带(图2-A),与预期结果相符;经BamH I和Xho I双酶切鉴定,同样获得与预期结果相符的目的条带(图2-B)。将阳性质粒送至北京擎科新业生物技术有限公司进行Sanger测序,结果表明,B20R基因已成功克隆至表达载体pET-32a,且序列完全正确,即原核表达载体pET-32a-B20R构建成功。
2.3融合蛋白B20R诱导表达及验证结果
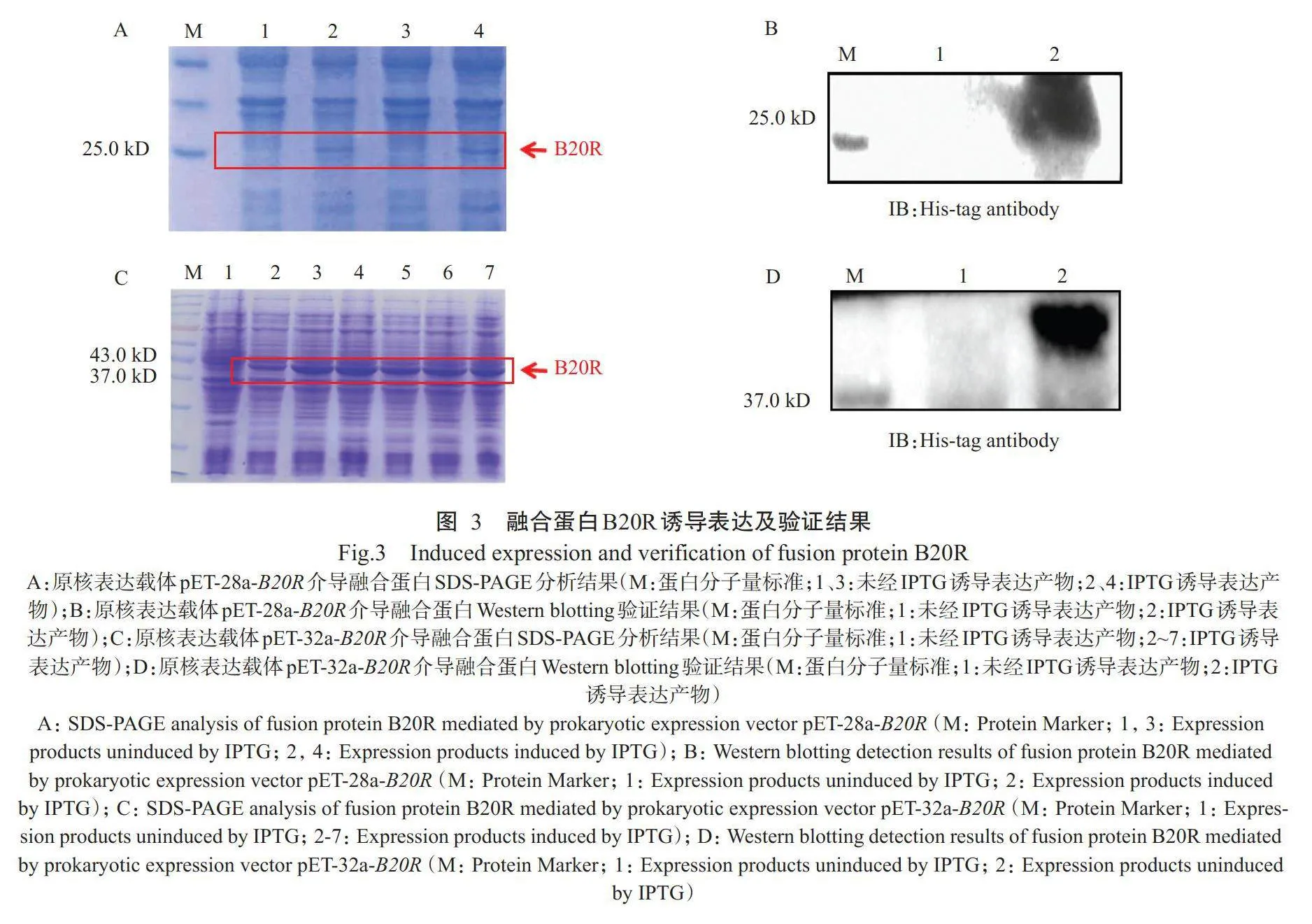
以原核表达载体pET-28a-B20R和pET-32a-B20R分别转化BL21感受态细胞,经IPTG诱导表达后,分别采用SDS-PAGE分析融合蛋白表达情况,结果表明:(1)以原核表达载体pET-28a-B20R转化BL21感受态细胞时,与未经IPTG诱导的泳道1和泳道3相比,IPTG诱导的泳道2和泳道4均可观察到约26.8kD的蛋白条带(图3-A),与预期的B20R蛋白分子量大小相符;通过His标签抗体进行Western blotting检测,结果显示蛋白条带位置正确(图3-B),说明原核表达载体pET-28a-B20R可在BL21感受态细胞中表达出融合蛋白B20R,但表达量相对较低。(2)以原核表达载体pET-32a-B20R转化BL21感受态细胞时,与未经IPTG诱导的泳道1相比,IPTG诱导后的泳道2~泳道7均可观察到预期大小的目的蛋白条带(图3-C);使用His标签抗体进行Western blotting检测,检测结果(图3-D)进一步证实获得的目的条带即为融合蛋白B20R。可见,构建的原核表达载体pET-28a-B20R和pET-32a-B20R均能通过BL21感受态细胞表达出融合蛋白B20R,但以原核表达载体pET-32a-B20R的表达量更高,故选择原核表达载体pET-32a-B20R进行后续研究。
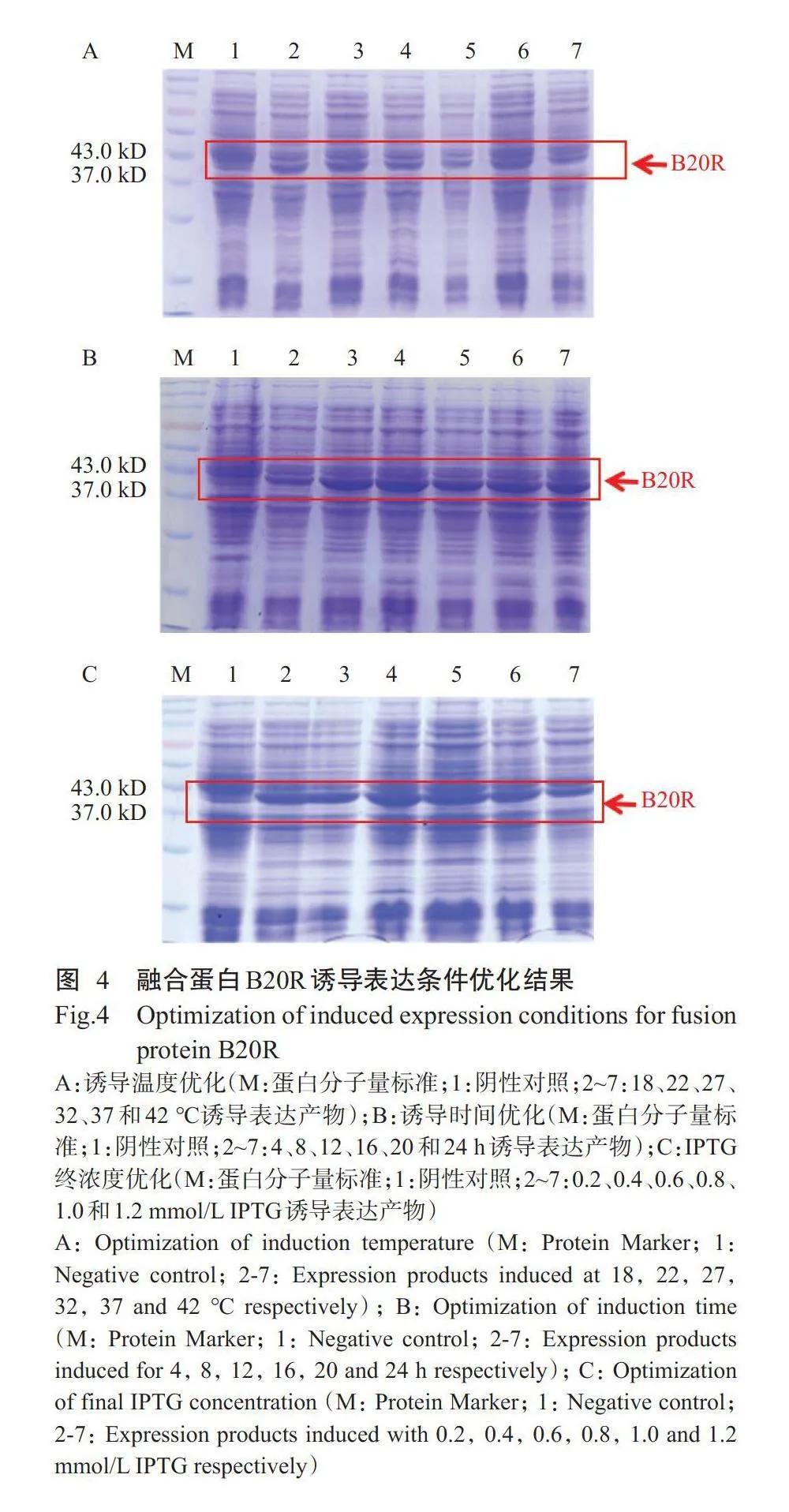
2.4融合蛋白诱导表达条件优化结果
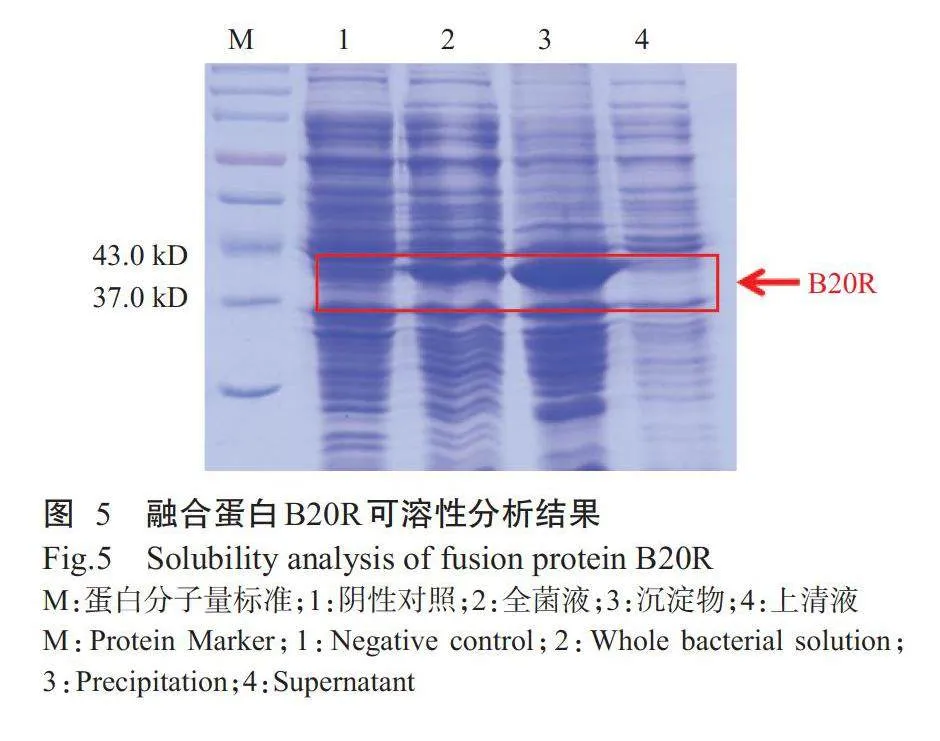
为实现原核表达载体pET-32a-B20R最大量表达出融合蛋白B20R,对其诱导表达条件进行优化。首先,在IPTG终浓度为1.0mmol/L、诱导时间为8h的条件下,设6个不同的诱导温度(18、22、27、32、37和42℃),结果(图4-A)显示,融合蛋白B20R在18~42℃下均有表达且表达量差异较小,表明诱导温度对其表达量的影响不明显。综合考虑大肠杆菌的最适生长温度,故选择37℃为最佳诱导温度。然后,在IPTG终浓度为1.0mmol/L、诱导温度为37℃的条件下,设6个不同的诱导时间(4、8、12、16、20和24h),结果(图4-B)发现,融合蛋白B20R在诱导4~24h内均有表达,且随诱导时间的推移其表达量呈先增加后降低的变化趋势,诱导时间为12h时可获得最大的表达量。最后,在诱导温度为37℃、诱导时间为12h的条件下,设6个不同的IPTG终浓度(0.2、0.4、0.6、0.8、1.0和1.2mmol/L),结果(图4-C)显示,融合蛋白B20R在IPTG终浓度为0.2~1.2mmol/L的条件下均有表达,且表达趋势随IPTG终浓度的增加呈先增加后降低趋势,IPTG终浓度为0.6mmol/L时表达量达峰值。综上所述,融合蛋白B20R最佳诱导表达条件为37℃下以0.6mmol/LIPTG诱导12h。2.5融合蛋白可溶性分析结果为确定融合蛋白B20R的表达方式及其存在形式,分别取超声波破碎后的全菌液、沉淀物和上清液进行SDS-PAGE分析,结果(图5)显示,融合蛋白B20R主要存在于沉淀物中,上清液中基本不存在融合蛋白B20R,表明融合蛋白B20R在菌体中不可溶,主要以包涵体形式存在。
2.6融合蛋白纯化效果
由于融合蛋白B20R的N端含有6×His标签,因此选用Ni柱亲和层析进行纯化,以不同浓度梯度(20、40、60和80mmol/L)咪唑进行洗脱,SDS-PAGE分析结果(图6)显示,融合蛋白B20R的最佳咪唑洗脱浓度为40mmol/L。
2.7B20R多克隆抗体效价测定及特异性分析结果
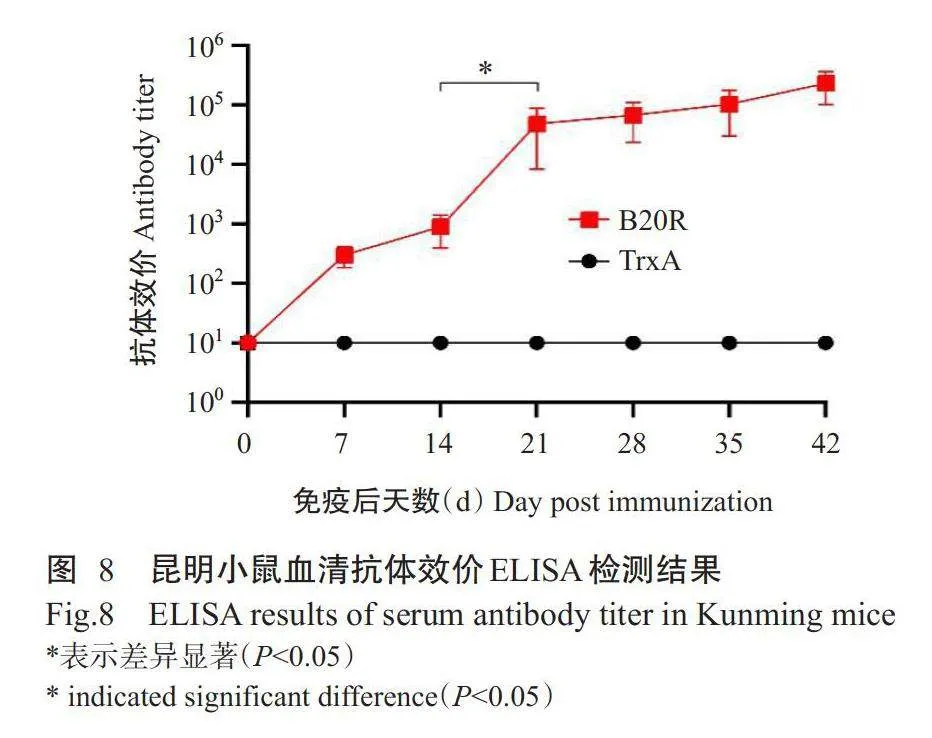
将纯化的融合蛋白B20R通过腹腔注射形式免疫昆明小鼠,并定期采血检测血清抗体效价,具体免疫程序及采血方案如图7所示。通过ELISA检测免疫小鼠血清抗体效价,结果(图8)显示,融合蛋白B20R首次免疫后即诱导昆明小鼠产生明显的体液免疫,第1次加强免疫后血清抗体效价显著提升(Plt;0.05),但第2次加强免疫后血清抗体效价无显著变化(Pgt;0.05)。综上所述,融合蛋白B20R可在短时间内引起昆明小鼠产生强烈的体液免疫,且至免疫第42d仍然维持较高的抗体水平,抗体效价高达1:409600。
3讨论
猴痘是一种由猴痘病毒感染所致的人兽共患传染病,此前主要流行于非洲中部和西部地区,但从2022年起猴痘疫情开始在世界各地不断涌现,已成为严重危害人类健康的重大公共卫生事件。据中国疾病预防控制中心官网(https://www.chinacdc.cn/)统计数据显示,2023年6月2—30日,我国内地(不含港澳台)就新增报告106例猴痘确诊病例,表明了当前猴痘病毒诊断和治疗的重要性及紧迫性。至今,国内外尚缺乏安全有效的猴痘疫苗及抗猴痘病毒的特效药物,究其原因是对猴痘病毒的了解不够深入,尚未明确其致病机理及宿主免疫反应等(Karim et al.,2022;Meo et al.,2022;Saxena et al.,2022)。因此,亟待开展猴痘病毒蛋白功能及其免疫原性研究,以应对猴痘疫情的暴发流行。
本研究根据蛋白抗原表位多及种属特异性强等标准筛选出猴痘病毒B20R蛋白,该蛋白是猴痘病毒的特有蛋白,其生物学功能和免疫原性尚不清楚。蛋白功能及免疫学研究离不开对目的蛋白的大量表达与纯化(牛铮等,2021;王毅豪等,2023)。本研究将猴痘病毒B20R蛋白编码基因按照大肠杆菌密码子偏好性进行全基因合成,并将合成的B20R基因分别克隆至表达载体pET-28a和pET-32a,成功构建了B20R蛋白原核表达载体pET-28a-B20R和pET-32a-B20R。Western blotting检测结果显示,构建的原核表达载体pET-28a-B20R和pET-32a-B20R均可在大肠杆菌BL21感受态细胞中成功诱导表达出融合蛋白B20R,表达形式以包涵体为主,且原核表达载体pET-32a-B20R的融合蛋白表达量更高,故选择pET-32a-B20R作为B20R蛋白后续研究的原核表达载体。融合蛋白B20R最佳诱导表达条件为37℃下以
0.6mmol/L IPTG诱导12h。在此条件下大量表达获得的融合蛋白B20R经Ni柱亲和层析纯化后,免疫接种昆明小鼠并定期采集小鼠血样检测血清抗体效价,结果显示,融合蛋白B20R可在短时间内引起昆明小鼠产生强烈的体液免疫,且至免疫第42d仍然维持较高的抗体水平,抗体效价高达1:409600,说明原核表达获得的融合蛋白B20R具有良好的免疫原性。该结论为后续解析B20R蛋白生物学功能及开发基于B20R蛋白的新型诊断试剂和疫苗等打下了基础。
与利用昆虫细胞等真核表达系统表达病毒蛋白相比,本研究选用大肠杆菌BL21菌株为宿主细胞的原核表达系统具有培养成本低、表达水平高、操作相对简单、易于规模化生产等优点,且有研究证实以原核表达系统表达的抗原蛋白制备抗体具有良好的反应活性和特异性(方剑玉等,2023;贾梦乐等,2023)。可见,本研究建立的猴痘病毒B20R蛋白原核表达体系可有效降低融合蛋白B20R生产成本,有利于后续开展B20R蛋白生物学功能及免疫原性研究。此外,选用昆明小鼠制备B20R多克隆抗体,具有饲养成本低、制备时间短、可重复性好及适合大规模制备等优点,能在短时间内大量制备出B20R多克隆抗体。融合蛋白B20R在大肠杆菌BL21感受态细胞中主要以不可溶的包涵体形式表达,但表达量不高,即使在最佳诱导表达条件下的表达量也不足细胞总蛋白的20%,可能与B20R蛋白N端存在1个高疏水性的跨膜结构域有关。因此,后续研究拟尝试去除B20R蛋白N端跨膜结构域,构建B20R蛋白截短体,进一步验证其表达量、表达形式及其免疫原性的变化。
4结论
构建的猴痘病毒B20R蛋白原核表达载体可在大肠杆菌BL21感受态细胞中以包涵体形式成功表达出融合蛋白B20R,且融合蛋白B20R具有良好的免疫原性,可在短时间内引起昆明小鼠产生强烈的体液免疫。
参考文献:
方剑玉,张青娴,郎利敏,徐彬,王改利,席燕燕,冯现明,王克领,李绍钰.2023.猪IFN-α8的原核表达及抗猪繁殖与呼吸综合征病毒活性研究[J].河南农业科学,52(9):141-147.[Fang JY,Zhang QX,Lang LM,Xu B,Wang GL,XiYY,Feng XM,Wang KL,LiSY.2023.Prokaryo-tic expression and anti-PRRSV activity study of porcine IFN-a8[J].Journal of Henan Agricultural Sciences,52(9):141-147.]doi:10.15933/j.cnki.1004-3268.2023.09.014.
贾梦乐,熊嘉琦,杨领弟,王毅豪,孙静婷,王婷,黎美凤,孔令保,彭棋.2023.猴痘病毒E2L蛋白的表达、纯化及免疫原性评价[J/OL].南方农业学报.https:/kns.cnki.net/kcms2/detail/45.1381.S.20230713.1437.002.html.[Jia ML,Xiong JQ,Yang LD,Wang YH,Sun JT,Wang T,LiM F,Kong LB,Peng Q.2023.Expression,purification and immunogenicity evaluation of monkeypox virus E2L pro-tein[J/OL].Journal of Southern Agriculture.https:/kns.cnki.net/kcms2/detail/45.1381.S.20230713.1437.002.html.]
李婷婷,李柏松,唐文革,曾德唯,黄中,李周蓉,杨钰隆,黄为,凌华,李勤,漆莉.2022.中国大陆首例猴痘确诊病例流行病学调查和处置[J].国际病毒学杂志,29(5):391-394.[LiT T,Li BS,Tang WG,Zeng DW,Huang Z,Li ZR,Yang YL,Huang W,Ling H,LiQ,Qi L.2022.Epi-demiological investigation and management of the first confirmed human monkeypox case in Chinese mainland[J].International Journal of Virology,29(5):391-394.]doi:10.3760/cmaj.issn.1673-4092.202205.011.
牛铮,徐沙沙,张静怡,张依玲,阚子斐,张淑娟,邹宏,邹卓岚,冉玲,宋振辉.2021.猫传染性腹膜炎病毒N蛋白的原核表达及多抗制备[J].西南大学学报(自然科学版),43(12):642-648.[Niu Z,XuS S,Zhang JY,Zhang YL,Kan ZF,Zhang SJ,Zou H,Zou ZL,Ran L,SongZ H.2021.Prokaryotic expression of Nprotein offeline infec-tious peritonitis virus and preparation of polyclonal anti-bodies[J].Journal of Southwest University(Natural Scien-ce),43(12):642-648.]doi:10.13718/j.cnki.xdzk.2021.12.001.
王毅豪,李名志,贾梦乐,杨领弟,熊嘉琪,王婷,王宇,刘树荣,郭韫丽,孔令保,黎美凤.2023.猴痘病毒A23R蛋白的表达、纯化及其小鼠抗血清制备[J].细胞与分子免疫学杂志,39(7):642-648.[Wang YH,LiMZ,Jia ML,Yang LD,Xiong JQ,Wang T,Wang Y,Liu SR,Guo WL,Kong LB,LiMF.2023.Protein expression,purifica-tion and mouse antiserum preparation of monkeypox virus A23R[J].Chinese Journal of Cellular and Molecular Immunology,39(7):642-648.]doi:10.13423/j.cnki.cjcmi.009614.
Al-Gburi S,Namuq Z.2022.A review of the recent monkeypox outbreak in2022[J].Cureus,14(8):e27880.doi:10.7759/cureus.27880.
Arndt WD,Cotsmire S,Trainor K,Harrington H,Hauns K,Kibler KV,Huynh TP,Jacobs BL.2015.Evasion of the innate immune type Iinterferon system by monkeypox virus[J].Journal of Virology,89(20):10489-10499.doi:10.1128/JVL.00304-15.
Baker RO,Bray M,Huggins JW.2003.Potential antivira therapeutics for smallpox,monkeypox and other orthopox-virus infections[J].Antiviral Research,57(1-2):13-23.doi:10.1016/s0166-3542(02)00196-1.
Brown K,Leggat PA.2016.Human monkeypox:Current state of knowledge and implications for the future[J].Tropical Medicine and Infectious Disease,1(1):8.doi:10.3390/tropicalmed1010008
Delaune D,Iseni F.2020.Drug development against smallpox:Present and future[J].Antimicrobial Agents and Chemo-therapy,64(4):01683-19.doi:10.1128/AAC.01683-19.
Karim AM,Kwon JE,Karim MA,Iftikhar H,Yasir M,Ullah I,Kang SC.2022.Comprehensive update on the monkey-pox outbreak[J].Frontiers in Microbiology,13:1037583.doi:10.3389/fmicb.2022.1037583.
Kumar N,Acharya A,Gendelman HE,Byrareddy SN.2022.The2022outbreak and the pathobiology of the monkey-pox virus[J].Journal of Autoimmunity,131:102855.doi:10.1016/j.jaut.2022.102855.
Laiton-Donato K,Alvarez-Diaz DA,Franco-Muioz C,Ruiz-Moreno HA,Rojas-Estévez P,Prada A,Rosales A,Ospina ML,Mercado-Reyes M.2022.Monkeypox virus genome sequence from an imported human case in Colombia[J].Biomédica,42(3):541-545.doi:10.7705/biomedica.6647.
MazurkovO Y,Kabanov AS,Shishkina LN,Sergeev AA,Skarnovich MO,Bormotov NI,Skarnovich MA,Ovchin-nikova AS,Titova KA,Galahova DO,Bulychev LE,Ser-geev AA,Taranov OS,Selivanov BA,Tikhonov AY,Zavjalov EL,Agafonov AP,Sergeev AN.2016.New effective chemically synthesized anti-smallpox compound NIOCH-14[J].Journal of General Virology,97(5):1229-1239.doi:10.1099/jgv.0.000422.
McCollum AM,Damon IK.2014.Human monkeypox[J].Clinical Infectious Diseases,58(2):260-267.doi:10.1093/cid/cit703.
Meo SA,Al-Masri AA,Klonoff DC,Alshahrani AN,Al-Khlaiwi T.2022.Comparison of biological,pharmacologi-cal characteristics,indications,contraindications and adver-se effects of JYNNEOS and ACAM2000monkeypox vac-cines[J].Vaccines,10(11):1971.doi:10.3390/vaccines10111971.
Nasir IA,Dangana A,Ojeamiren I,Emeribe AU.2018.Remi-niscing the recent incidence of monkeypox in Nigeria:Its ecologic-epidemiology and literature review[J].Port Har-court Medical Journal,12(1):1-9.doi:10.4103/phmj.phmj_47_17.
Petersen E,Kantele A,Koopmans M,Asogun D,Yinka-Ogunleye A,Ihekweazu C,Zumla A.2019.Human mon-keypox:Epidemiologic and clinical characteristics,diag-nosis,and prevention[J].Infectious Disease Clinics of North America,33(4):1027-1043.doi:10.1016/j.idc.2019.03.001
Quarleri J,Delpino MV,Galvan V.2022.Monkeypox:Consi-derations for the understanding and containment of thecur-rent outbreak in non-endemic countries[J].Geroscience,44(4):2095-2103.doi:10.1007/s11357-022-00611-6.
Saxena SK,Ansari S,Maurya VK,Kumar S,Jain A,Paweska JT,TripathiAK,Abdel-Moneim AS.2022.Re-emerging human monkeypox:A major public-health debacle[J].Jour-nal of Medical Virology,95(1):e27902.doi:10.1002/jmv.27902.
Shchelkunov SN,Totmenin AV,Babkin IV,Safronov PF,Ryazankina OI,Petrov NA,Gutorov VV,Uvarova EA,Mikheev MV,Sisler JR,Esposito JJ,Jahrling PB,Moss
B,Sandakhchiev LS.2001.Human monkeypox and small-pox viruses:Genomic comparison[J].FEBS Letters,509(1):66-70.doi:10.1016/s0014-5793(01)03144-1.
Shchelkunov SN,Totmenin AV,Safronov PF,MikheevMV,Gutorov VV,Ryazankina OI,Petrov NA,Babkin IV,Uvarova EA,Sandakhchiev LS,SislerJR,Esposito JJ,Damon IK,Jahrling PB,Moss B.2002.Analysis of the monkeypox virus genome[J].Virology,297(2):172-194.doi:10.1006/viro.2002.1446.
Sklenovska N,van Ranst M.2018.Emergence of monkeypox as the most important orthopoxvirus infection in humans[J].Frontiers in Public Health,6:241.doi:10.3389/fpubh.2018.00241.
Stafford A,Rimmer S,Gilchrist M,Sun K,Davies EP,Wad-dington Cs,Chiu C,Armstrong-James D,Swaine T,Davies F,GómezCHM,Kumar V,EIHaddad A,Awad Z,Smart C,Mora-Peris B,Muir D,Randell P,Peters J,Chand M,Warrell CE,Rampling T,Cooke G,DhanjiS,Campbell V,Davies C,Osman S,Abbara A.2023.Use of cidofovir in apatient with severe mpox and uncontrolled HIV infection[J].The Lancet Infectious Diseases,23(6):E218-E226.doi:10.1016/S1473-3099(23)00044-0.
Zhao WB,TangXC,Zhang LL.2024.Virus-containng mig-rasomes enable poxviruses to evade tecovirimat/ST-246treatment[J].Journal of infection,88(2):203-205.doi:10.1016jinf.2023.12.005.
(责任编辑 兰宗宝)

