SOCS1基因过表达对猪乳腺上皮细胞增殖和凋亡的影响



摘要:【目的】明确细胞因子信号转导抑制因子1基因(SOCS1)过表达对乳腺发育关键信号通路(JAK/STAT)相关基因表达的影响,为揭示SOCS1基因调节猪乳腺上皮细胞增殖和凋亡的作用机制提供参考依据。【方法】构建SOCS1基因过表达载体pcDNA3.1-SOCS1和阴性对照载体pcDNA3.1-NC,分别转染猪乳腺上皮细胞,然后通过CCK-8检测细胞增殖情况,流式细胞术检测细胞周期及细胞凋亡情况,实时荧光定量PCR检测转染后JAK/STAT信号通路相关基因的表达变化。【结果】以过表达载体pcDNA3.1-SOCS7和阴性对照载体pcDNA3.1-NC分别转染猪乳腺上皮细胞,过表达载体pcDNA3.1-SOCS1转染组的SOCS1基因相对表达量极显著高于阴性对照载体pcDNA3.1-NC转染组(Plt;0.01,下同);转染48和72h后,过表达载体pcDNA3.1-SOCS1转染组猪乳腺上皮细胞的OD值极显著低于阴性对照载体pcDNA3.1-NC转染组,说明过表达载体pcDNA3.1-SOCS1能有效抑制猪乳腺上皮细胞的增殖能力;过表达载体pcDNA3.1-SOCS1转染组的细胞凋亡率[(36.15±0.92)%]显著高于阴性对照载体pcDNA3.1-NC转染组[(30.55±0.35)%](Plt;0.05,下同),且过表达载体pcDNA3.1-SOCS₇转染组中的G1期细胞比例极显著降低,而S期和G2期细胞比例显著升高。与阴性对照载体pcDNA3.1-NC转染组相比,除JAK2、STAT3和TYK2基因外,过表达载体pcDNA3.1-SOCS1转染组中的SOCS2、SOCS3、JAK1、STAT2、STAT5A、IL-6、PRLR、MCL1和PIAS3等9个JAK/STAT信号通路相关基因的相对表达量均极显著升高。【结论]SOCS1基因过表达可抑制猪乳腺上皮细胞增殖及促进细胞凋亡,并影响JAK/STAT信号通路相关基因的表达变化,从而在猪的乳腺发生发育调控机制中发挥重要作用。
关键词:猪;乳腺上皮细胞;SOCS1基因;细胞增殖;细胞凋亡;JAK/STAT信号通路
中图分类号:S828.3文献标志码:A文章编号:2095-1191(2024)01-0207-10
Effects of SOCS1 gene overexpression on proliferation and apoptosis of porcine mammary epithelial cells
MAO Tong-hui¹22,YANG Suan³,LUO Jie2,SU Zheng2,ZHANG Yi-yu³⁴
('Tongren Animal Husbandry Technology Promotion Station,Tongren,Guizhou554300,China;2Tongren Polytechnic College,Tongren,Guizhou554300,China;³College of Animal Science,Guizhou University/Key Laboratory of Animal Genetics,Breedingand Reproduction in the Plateau Mountainous Region,Ministry of Education,Guiyang,Guizhou550025,China)
Abstract:[Objective]The purpose of the study was to clarify the effect of overexpressed cytokine signal transducer suppressor1(SOCS1)gene on the expression of key signaling pathway(JAK/STAT)related genes in mammary gland de-velopment,and to provide reference for revealing the mechanism of SOCS1 gene regulating proliferation and apoptosis of porcine mammary epithelial cells.【Method]The overexpressed vector pcDNA3.1-SOCS1 and the negative control vector pcDNA3.1-NC were constructed and transfected into porcine mammary epithelial cells,respectively.Then,cell prolifera-tion was detected by CCK-8,cell cycle and apoptosis were detected by flow cytometry,and the expression changes of JAK/STAT signaling pathway related genes after transfection were detected by real-time fluorescence quantitative PCR【Result]Porcine mammary epithelial cells were transfected with overexpressed vector pcDNA3.1-SOCS1 and negative control vector pcDNA3.1-NC,respectively.The relative expression of SOCS1 gene in the overexpressed vector pcDNA3.1-SOCS1 transfection group was extremely significantly higher than that in the negative control vector pcDNA3.1-NC transfection group(Plt;0.01,thesame below).After transfection for48and72h,the OD value of porcine mammary epithelial cells in the overexpressed vector pcDNA3.1-SOCS1 transfection group was extremely significantly""""" lower than that in the negative control vector pcDNA3.1-NC transfection group,indicating that the overexpressed vector pcDNA3.1-SOCS1 could effectively inhibit the proliferation ability of porcine mammary epithelial cells.The apoptosis"""""" rate of cells in the overexpressed vector pcDNA3.1-SOCS1 transfection group[(36.15±0.92)%]was significantly higher"""" than that of the negative control vector pcDNA3.1-NC transfection group[(30.55±0.35)%](Plt;0.05,the same below),""" and the rate of G1phase cells in the overexpressed vector pcDNA3.1-SOCS1 transfection group was extremely signifi-cantly decreased,while the rates of Sand G2phase cells were significantly increased.Compared with thenegative control vector pcDNA3.1-NC transfection group,except for JAK2,STAT3and TYK2genes,the relative expressions of9JAK/STAT signaling pathway related genes,including SOCS2,SOCS3,JAK1,STAT2,STAT5A,IL-6,PRLR,MCLI and PLAS3,in the overexpressed vector pcDNA3.1-SOCS1 transfection group were extremely significantly increased.【Con-" clusion]Overexpression of SOCS1gene can inhibit the proliferation of porcine mammary epithelial cells and promote the""" apoptosis of cells and affect the expression changes of JAK/STAT signaling pathway related genes,thus playing an impor-"""" tan rolein the regulation mechanism of mammarygland development in pigs
Keywords:pig;porcine mammary epithelial cells;SOCS1 gene;cell proliferation;cell apoptosis;JAK/STAT sig-naling pathway
Foundation items:Guizhou Outstanding Young Scientific and Technological Talents Training Project(QKHPTRC〔2021〕5630);Guizhou Science and Technology Support Plan Project(QKHZC〔2021〕Yiban147,QKHZC〔2022〕1Y038);Animal Husbandry and Veterinary Professional Group Technical Skills Platform Project of Tongren Polytechnic College(〔2022〕02)
0引言
【研究意义】猪作为产仔数较多的家畜,其乳腺发育情况直接影响仔猪的生长,从而关系到整体的生产力。在哺乳动物的乳腺发育过程中,由关键调控因子和激素控制的遗传信息与表皮生长因子家族成员调控的通路协同作用,在青春期、怀孕及哺乳期间协调生长和形态发生(Macias and Hinck,2012;刘嘉烁等,2023),但有关各类调控因子与生长因子通路之间的相互作用机制尚未明确。因此,亟待开展相关基因超表达对猪乳腺上皮细胞增殖和凋亡的影响研究,探明其调控机制,为研究猪乳腺发育提供科学依据。【前人研究进展】Chu等(2018)通过抑制和过表达miR-15b,结果发现miR-15b能下调小鼠乳腺上皮细胞的脂质代谢;华丽萍等(2020)通过干扰和过表达盘状蛋白结构域受体1基因(DDR1),证实该基因能促进奶牛乳腺上皮细胞增殖,并显著抑制细胞凋亡;Li等(2022)在探究牛miR-199a-3p调节牛乳腺上皮细胞炎症免疫反应的潜在机制时发现,miR-199a-3p的沉默能完全逆转其过表达所产生的效应,进一步揭示miR-199a-3p可作为治疗牛乳腺炎的有效靶点;朱俊儒等(2023)通过干扰和过表达方式探究程序性细胞死亡因子4(PDCD4)对奶山羊乳腺上皮细胞凋亡的影响,结果发现干扰PDCD4基因表达可促进乳腺上皮细胞增殖并降低凋亡水平,过表达PDCD4基因则抑制细胞增殖及促进细胞凋亡。细胞因子信号转导抑制因子(SOCS)家族蛋白通过SH2结构域和SOCS box结构域调控下游蛋白GHR、JAK激酶、STAT蛋白的磷酸化作用,进而影响GH信号通路反应,调控动物生长发育(González et al.,2002;杨忠诚等,2015)。细胞因子信号转导抑制因子1(SOCS1)作为SOCS家族的成员之一,近年来在人类疾病和药物研发领域已有大量研究,尤其是探究SOCS1在各类癌症及炎症疾病中的调控机制(邓桢等,2021)。Lindeman等(2001)利用SOCS1基因缺陷小鼠研究SOCS1基因作为催乳素反应调节剂的作用,结果发现SOCS1基因缺陷小鼠在妊娠晚期和早泌乳期表现出乳腺小叶肺泡发育加速,证实了SOCS1基因在分娩前预防泌乳机制中的关键性。与SOCS1基因同样具有KIR特殊结构的SOCS3基因,参与JAK2-STAT5A信号通路而调控奶牛乳腺上皮细胞增殖及泌乳,且SOCS3基因沉默能促进奶牛乳腺上皮细胞泌乳和增殖相关基因的表达(Huang et al.,2013;Geng et al.,2021)。由此推测,干扰SOCS1基因也可抑制猪乳腺上皮细胞细胞增殖,但其作用机制尚未明确。【本研究切入点】至今,已发掘出大量乳腺相关调控关键因子,但还需从关键基因的变量表达进一步验证其调控效应,包括SOCS1基因在不同物种乳腺中如何调节信号转导途径等,尤其对于繁殖性能较差的地方猪种,亟待揭示SOCS1基因调控猪乳腺发育的作用机制以推进地方猪种的品种改良。【拟解决的关键问题】通过构建SOCS1基因过表达载体并转染猪乳腺上皮细胞,采用实时荧光定量RCR、CCK-8试剂及流式细胞术等检测方法分析SOCS1基因对乳腺发育关键信号通路(JAK/STAT)相关基因表达的影响,为揭示SOCS1基因调节猪乳腺上皮细胞增殖和凋亡的作用机制提供参考依据。
1材料与方法
1.1试验材料
供试健康母猪由贵州省赫章县种猪场提供,其经产3代,乳腺发育良好,无病灶。于断奶后1周屠宰,以无菌剪刀采集其乳腺组织进行原代乳腺上皮细胞分离培养。动物试验由贵州大学动物伦理委员会批准,批准号EAE-GZU-2022-P049。胎牛血清、0.25%胰蛋白酶、F12培养基、Opti-MEMIM减血清培养基和青链霉素混合液购自Gibco公司;Lipofectamine3000转染试剂购自Invitrogen公司;2×T5Fast qPCR Mix和核酸染料购自天根生化科技(北京)有限公司;RNA提取液及cDNA逆转录试剂盒购自Thermo-Fisher Scientific公司;细胞内角蛋白18(CK18)抗体(10712-1-AP,一抗)和Alexa Fluor488标记山羊抗兔IgG(H+L)(SA00006-2,二抗)购自Proteintech公司。
1.2猪乳腺上皮细胞培养及鉴定
参照张亚林(2016)的方法,将乳腺组织置于无菌培养皿中,PBS多次清洗,采用眼科剪修剪整块乳腺,剔除皮肤和脂肪等多余组织,剪成1mm
大小的颗粒并装入50mL无酶离心管中,加入组织块体积3倍的IV型胶原酶溶液,置于37℃恒温水浴锅中消化50min,期间每隔5min摇晃1次;消化结束后吸取离心管内的上清液,用400目不锈钢细胞过滤筛将其过滤至培养皿中,向滤液加入适量的完全培养基终止消化,制成细胞消化液。将细胞消化液转入15mL离心管中,1000r/min离心10min,弃上清液;再加入5mL完全培养基重悬细胞沉淀,再次离心;最后以2mL完全培养基重悬细胞沉淀并铺板,置于37℃、5%CO₂细胞培养箱中培养。
为鉴定猪乳腺上皮细胞,采用间接免疫荧光法对细胞CK18进行染色,具体操作如下:将玻璃爬片平放于细胞培养板中,加入适量培养基,细胞数量控制在2000个孔,置于CO₂培养箱培养过夜。待细胞爬片后弃培养基,以PBS清洗,加入4%多聚甲醛(PFA),在4℃下固定30min,再以PBS清洗3次。将玻璃爬片取出,置于培养皿支撑物上,滴加50.0μL破膜封闭液(0.5%Trition X-100与PBS按1:1混合,再加入10%血清)于防水膜上封闭约2h。取50.0μL一抗(用PBS按1:100稀释)滴加于防水膜上,4℃下孵育过夜;二抗避光孵育(用PBS按1:500稀释)2h,以PBS清洗3次,加入300.0μLDAPI染色5min,以PBS再清洗3次。每个样品玻璃爬片上各滴加1滴Fluoromount-G荧光封片剂,避光封片1h后置于倒置荧光显微镜下观察拍照。
1.3SOCS1基因过表达载体构建及转染
以pcDNA3.1为载体,委托北京擎科生物科技股份有限公司构建过表达载体pcDNA3.1-SOCS1和阴性对照载体pcDNA3.1-NC。SOCS1基因过表达载体引物序列信息见表1。将状态良好的猪乳腺上皮细胞接种至6孔细胞板,待细胞生长汇合度达70%左右时,按Lipofectamine3000转染试剂说明进行转染,在2支1.5mL无菌无酶EP管中各加入125.0μLOpti-MEMTM减血清培养基,然后向其中一支EP管中加入5.0μL Lipofectamine3000转染试剂,而另一支EP管中加入5.0μLP3000M试剂和5.0μL表达载体(500ng/μL),最后将2支EP管溶液混合,室温孵育30min,将孵育好的混合溶液均匀滴加到6孔细胞板中,置于37℃、5%CO₂培养箱中转染24~48h,利用倒置荧光显微镜观察绿色荧光的发光情况。
1.4CCK-8检测细胞增殖
将猪乳腺上皮细胞接种至96孔细胞板中,分别以过表达载体pcDNA3.1-SOCS1和阴性对照载体pcDNA3.1-NC进行转染,于细胞贴壁后6、12、24、48和72h,按CCK-8试剂盒说明向对应细胞孔各加入15.0μL CCK-8试剂,继续培养2h后通过酶标仪于450nm处检测不同处理组的细胞吸光值。每个转染载体设5个重复细胞孔,每个转染组重复3次。
1.5流式细胞术检测细胞周期及细胞凋亡
猪乳腺上皮细胞转染48h后弃原培养液,PBS洗涤2次,以不含EDTA的0.25%胰蛋白酶进行消化,1000r/min离心5min,弃上清液,获得细胞沉淀,通过流式细胞仪测定细胞周期及细胞凋亡情况。(1)细胞周期检测:用PBS洗涤细胞沉淀,250r/min离心6min,弃上清液,加入2mL预冷的70%乙醇,-20℃保存或用于DNA染色;取出细胞样本,250r/min离心5min,弃上清液,PBS洗涤2次,相同条件重复离心1次,弃上清液;加入60.0μLRNase(10mg/mL),37℃水浴30min,加入400.0μLPI染液,混匀,4℃避光反应20min,在激发波长488nm、发射波长585±21nm下进行流式细胞术检测。(2)细胞凋亡检测:向细胞
沉淀加入500.0μLPBS,1000r/min离心6min,弃上清液;加入1×Binding Buffer缓冲液,制成1×106个/mL的细胞悬液,采用AnnexinV-FITC/PI细胞凋亡双染试剂盒(BD5556574)进行检测。流式细胞仪测定参数:激发波长为488nm,发射波长FL1为525±20nm FL2为585±21nm。
1.6总RNA提取及cDNA合成
猪乳腺上皮细胞转染48h后弃原培养液,PBS洗涤2次,每孔加入1mL TRIzol裂解液,将混合溶液转入EP管并加入200.0μL氯仿,混匀,4℃孵育10min后,4℃下12000r/min离心15min。吸取上层水相至新的EP管中,加入500.0μL异丙醇,混匀,冰上静置15min,4℃下12000r/min离心10min,弃上清液;向EP管中加入1mL75%乙醇洗涤沉淀,4℃下7500r/min离心5min,弃上清液;打开EP管置于超净工作台中风干,待沉淀由白色变成透明时加入30.0μL DEPC水溶解沉淀,利用超微量紫外可见分光光度计检测RNA浓度和纯度。按照cDNA逆转录试剂盒说明逆转录合成cDNA,经紫外可见分光光度计测定其浓度后,-20℃保存备用。
1.7实时荧光定量PCR检测JAK/STAT信号通路相关基因表达
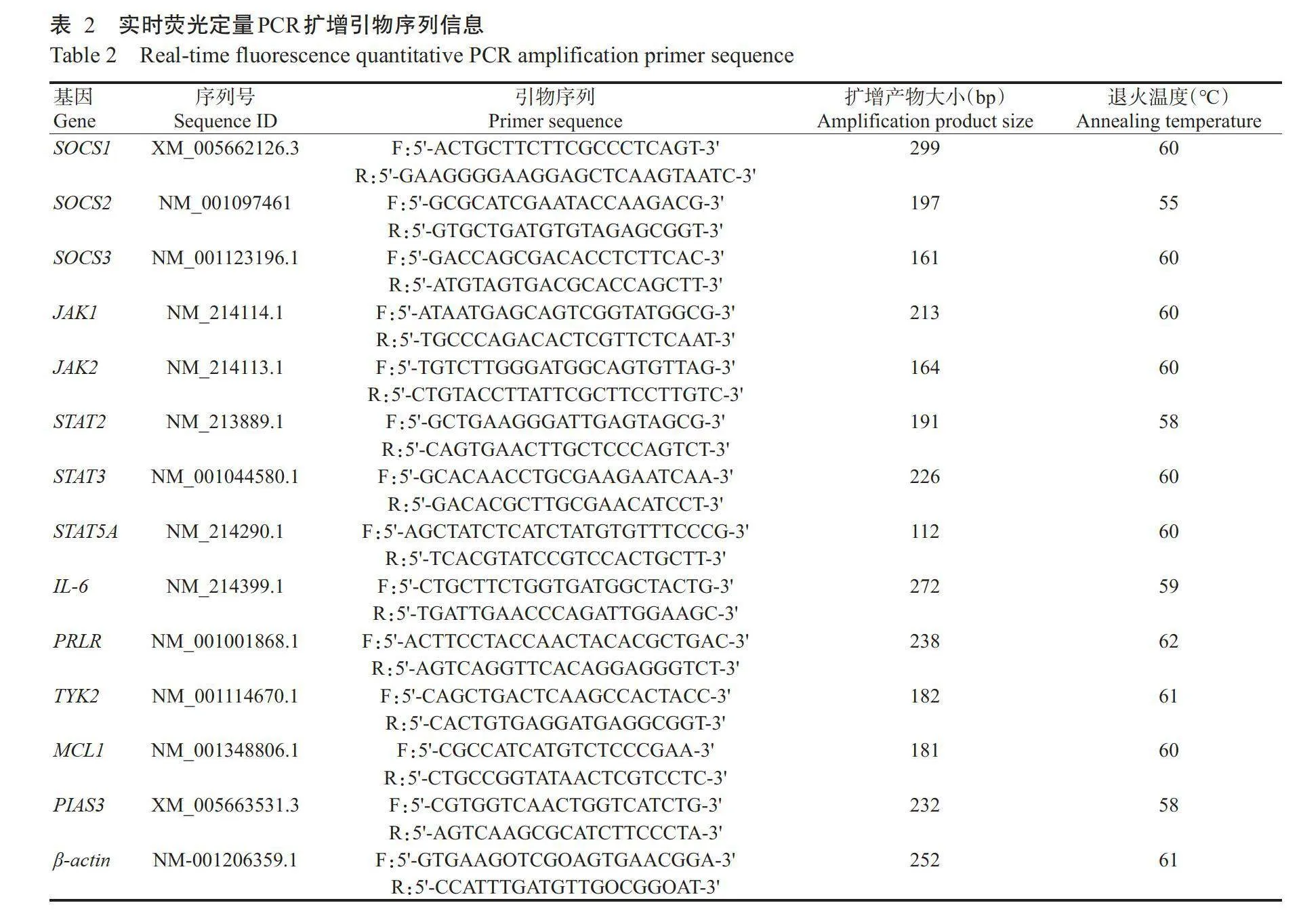
根据NCBI已公布的猪SOCS1基因和JAK/STAT信号通路相关基因序列,利用Primer-BLAST设计实时荧光定量PCR扩增引物(表2),委托生工生物工程(上海)股份有限公司合成。以β-actin为内参基因进行实时荧光定量PCR检测,反应体系10.0μL:2×UltraSYBR Mixture5.0μL,cDNA模板(100ng/μL)1.0μL,上、下游引物(10μmol/L)各0.5μL,ddH₂O补足至10.0μL。扩增程序:95℃预变性10min;95℃10s,退火45s,72℃32s,进行35个循环。每个样设3次重复,采用2-~法计算目的基因相对表达量。
1.8统计分析
利用WPS Office对猪乳腺上皮细胞的增殖、凋亡和周期,以及SOCS1基因和JAK/STAT信号通路相关基因的相对表达量进行统计分析;采用Modfit分析流式细胞数据,以确定细胞周期分布情况;使用FlowJo10.0.0分析猪乳腺上皮细胞在不同状态下的凋亡比例;利用SPSS26.0对各基因相对表达量进行单因素方差分析(One-way ANOVA),并以Graphpad Prism6.0制图。
2结果与分析
2.1猪乳腺上皮细胞培养及鉴定结果
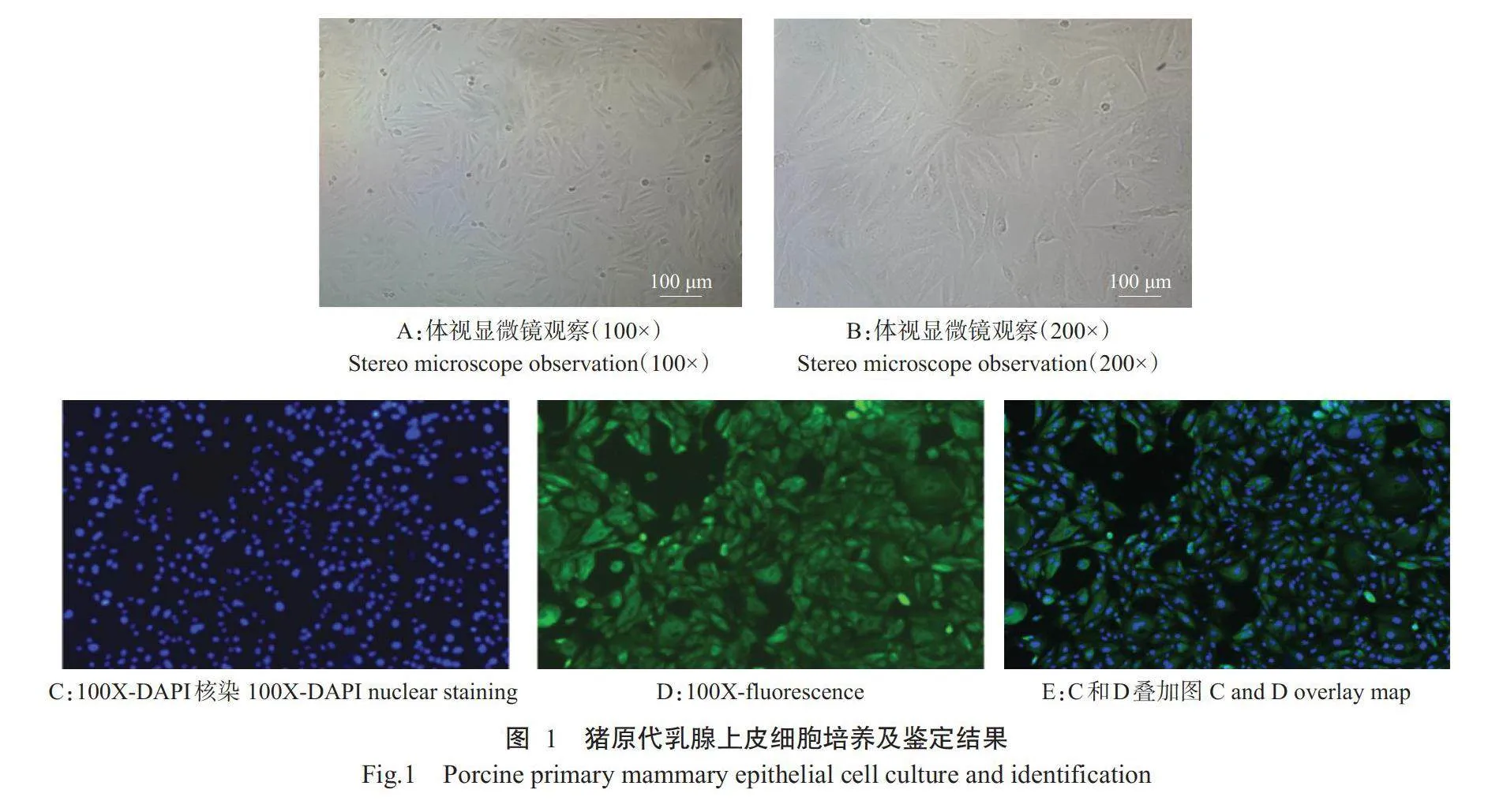
由母猪乳腺组织分离培养获得的猪乳腺上皮细胞如图1所示。分离获得的猪原代乳腺上皮细胞呈上皮样,其形状不规则,以铺路石状生长分裂(图1-A和图1-B)。细胞免疫荧光鉴定结果(图1-C、图1-D和图1-E)显示,CK18免疫荧光染色呈阳性,且细胞纯度在90%以上。
2.2SOCS1基因过表达载体构建情况
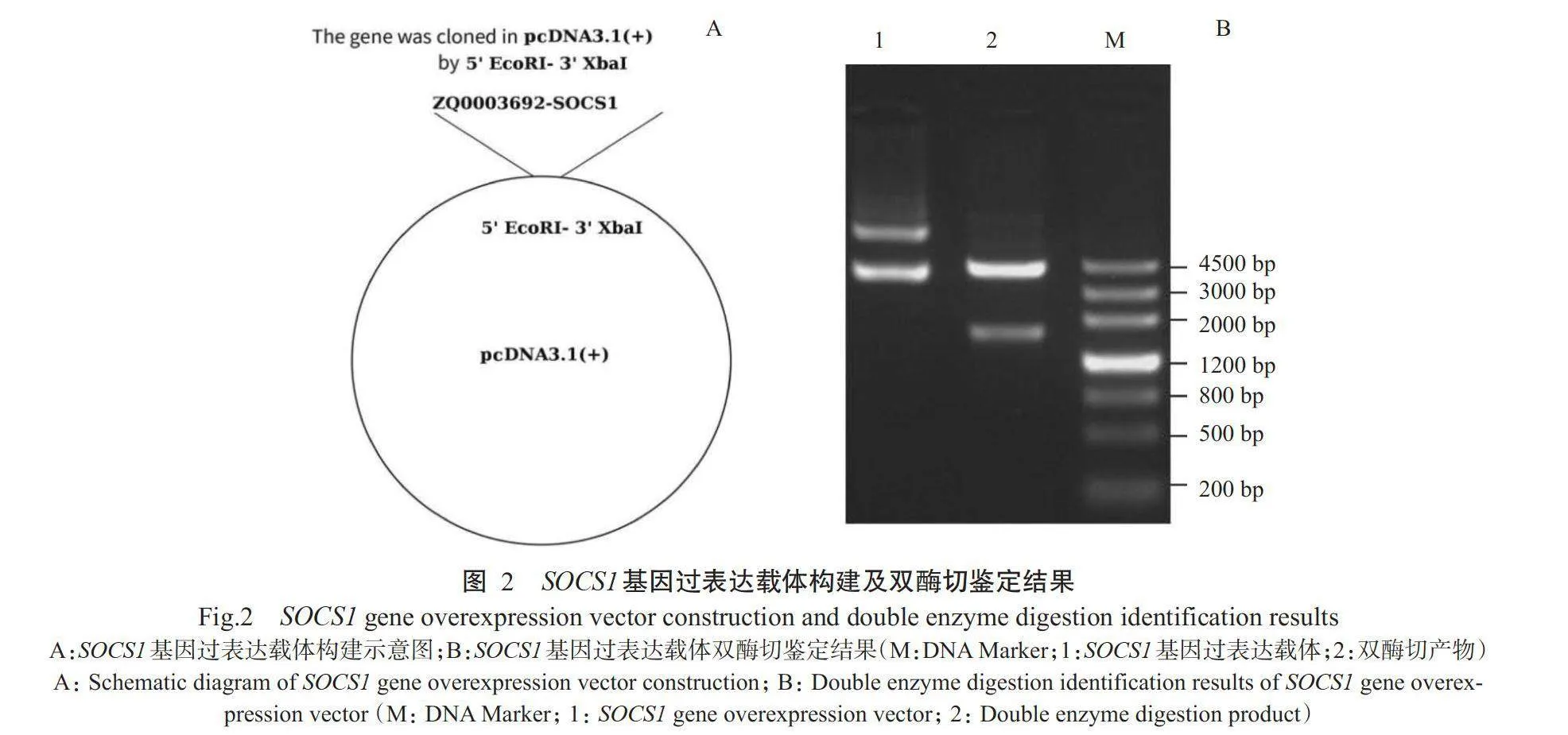
对完成测序的SOCS7基因过表达载体pcDNA3.1-SOCS1进行EcoRI和AvrⅡ双酶切鉴定,结果(图2)显示获得的目的条带大小(1756bp/4326bp)与预期结果相符,其中1条与SOCS1基因大小一致,表明成功构建获得过表达载体pcDNA3.1-SOCS1。
2.3SOCS1基因在猪乳腺上皮细胞中的表达情况
分别以过表达载体pcDNA3.1-SOCS1和阴性对照载体pcDNA3.1-NC瞬时转染猪乳腺上皮细胞,转染24h后即可观察到载体pcDNA3.1(+)中的绿色荧光蛋白普遍发光(图3-A),能明显观察到上皮样细胞,说明过表达载体pcDNA3.1-SOCS7和阴性对照载体pcDNA3.1-NC均成功转染猪乳腺上皮细胞。实时荧光定量PCR检测结果(图3-B)显示,过表达载体pcDNA3.1-SOCS1转染猪乳腺上皮细胞中的SOCS1基因相对表达量极显著高于阴性对照载体pcDNA3.1-NC转染猪乳腺上皮细胞(Plt;0.01,下同)。
2.4SOCS1基因过表达对猪乳腺上皮细胞增殖的影响
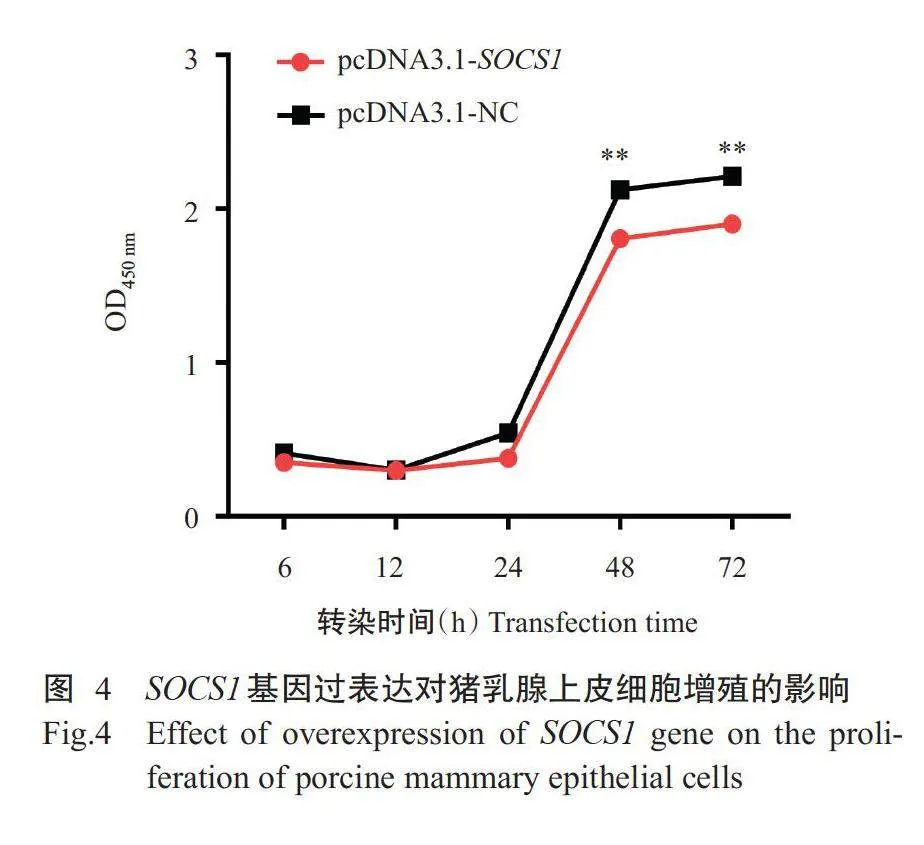
分别以过表达载体pcDNA3.1-SOCS1和阴性对照载体pcDNA3.1-NC转染猪乳腺上皮细胞,采用CCK-8法在酶标仪450nm波长处检测转染6、12、24、48和72h后猪乳腺上皮细胞的增殖情况,结果(图4)显示:与阴性对照载体pcDNA3.1-NC转染组相比,过表达载体pcDNA3.1-SOCS1转染组猪乳腺上皮细胞OD值在转染48和72h时极显著降低,说明过表达载体pcDNA3.1-SOCS1能有效抑制猪乳腺上皮细胞的增殖能力。
2.5SOCS1基因过表达对猪乳腺上皮细胞凋亡及细胞周期的影响
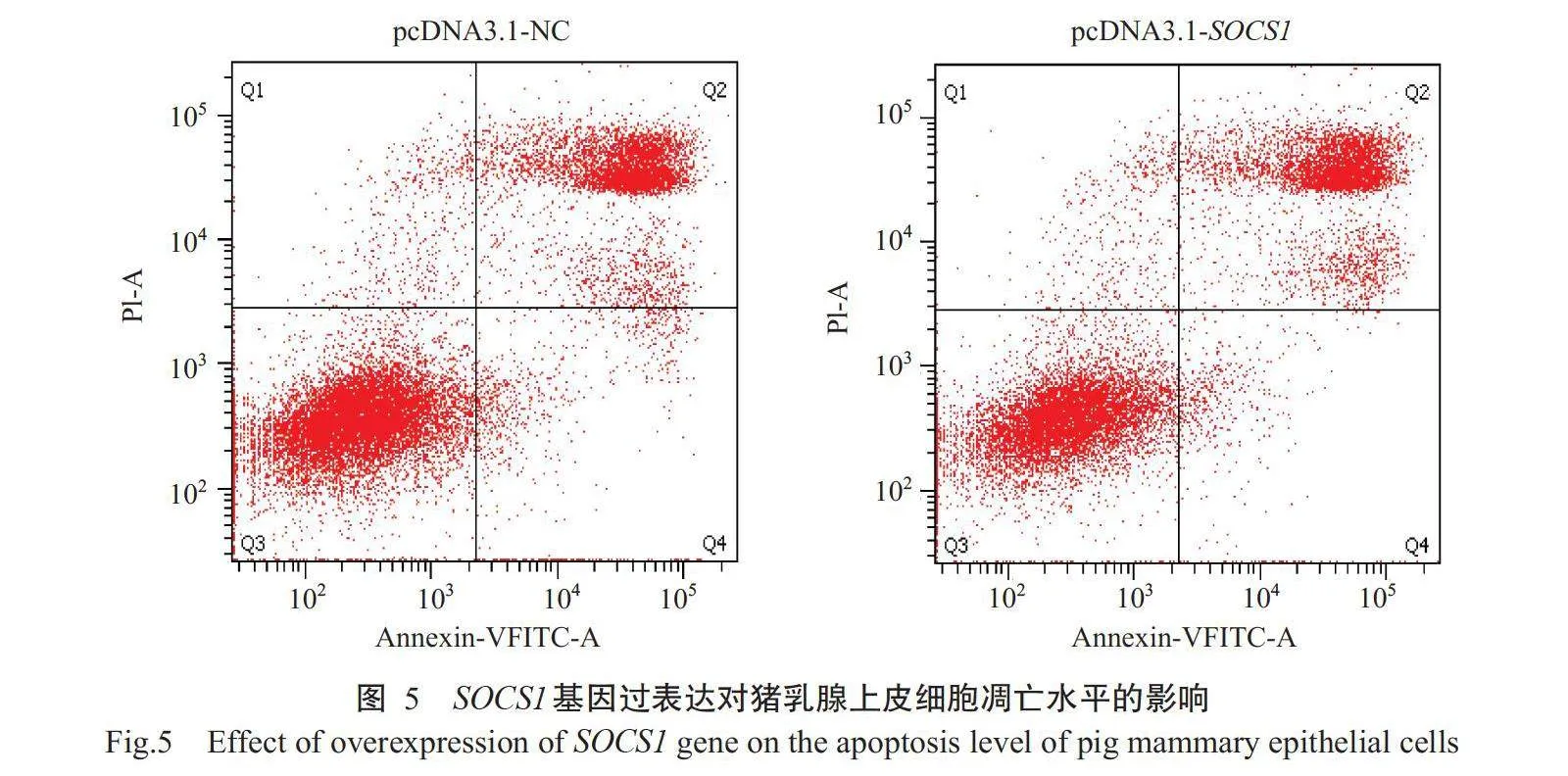
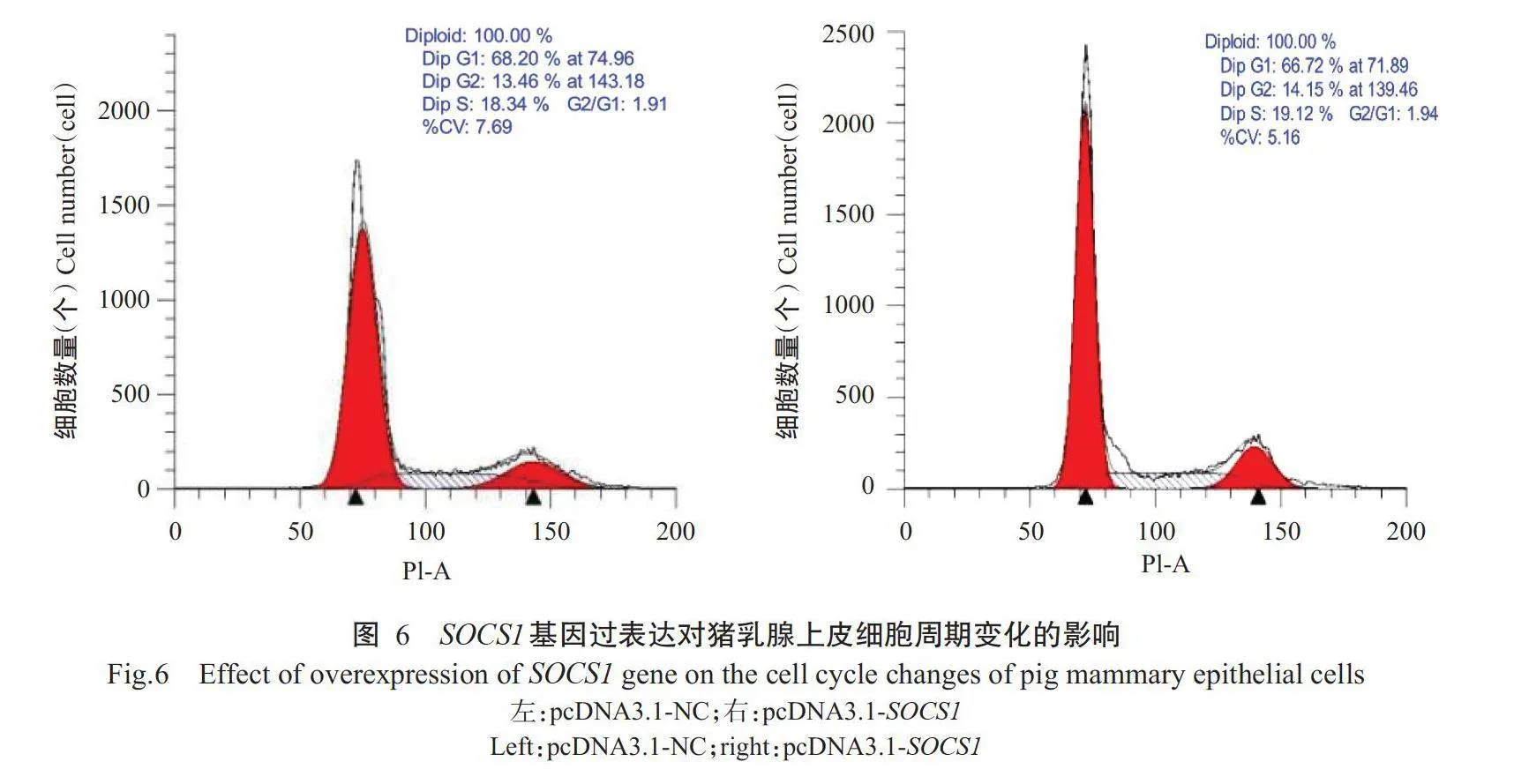
以流式细胞仪检测过表达载体pcDNA3.1-SOCS1和阴性对照载体pcDNA3.1-NC转染后的猪乳腺上皮细胞凋亡水平,结果(图5)显示,过表达载体pcDNA3.1-SOCS1转染组的细胞凋亡率[(36.15±0.92)%]显著高于阴性对照载体pcDNA3.1-NC转染组[(30.55±0.35)%](Plt;0.05,下同)。由图6可看出,与阴性对照载体pcDNA3.1-NC转染组相比,过表达载体pcDNA3.1-SOCS1转染组中的G1期细胞比例极显著降低,而S期和G2期细胞比例显著升高,说明过表达SOCS1基因将促使猪乳腺上皮细胞阻滞于G2期和S期,从而改变细胞周期进程。
2.6SOCS1基因过表达对JAK/STAT信号通路相关基因表达的影响
采用实时荧光定量PCR对SOCS1基因过表达后JAK/STAT信号通路相关基因的相对表达量进行检测,结果(表3)显示,与阴性对照载体pcDNA3.1-NC转染组相比,除JAK2、STAT3和TYK2基因外,过表达载体pcDNA3.1-SOCS1转染组中的SOCS2、SOCS3、JAK1、STAT2、STAT5A、IL-6、PRLR、MCLI和PIAS3等9个JAK/STAT信号通路相关基因的相对表达量均极显著升高。
3讨论
在哺乳动物的一生中,其乳腺上皮细胞不断经历增殖、分化和凋亡等过程。已有许多研究表明,乳腺上皮细胞的增殖和凋亡受许多因素影响,包括激素(Annen et al.,2008)、营养(Meng et al.,2017)及环境(Kapila et al.,2018)等。酵母硒(SeY)和蛋氨酸硒(Sel-Met)通过p38/JNK信号通路调控硒蛋白表达和抗氧化能力,从而抑制猪乳腺上皮细胞凋亡(Wu et al.,2020);血清素(5-HTP)通过MAPK/ERK/Bcl-3途径能抑制山羊乳腺上皮细胞凋亡(Zhao et al.,2021);补充叶酸可促进牛乳腺上皮细胞增殖并减少凋亡(Bae et al.,2022);橙皮苷通过Bcl-2/Bax-Caspase3信号通路能阻抑H₂O₂诱导的奶牛乳腺上皮细胞凋亡,有效提高细胞活性(刘嘉烁等,2023)。SOCS家族基因与JAK/STAT信号通路调控多种细胞的增殖与凋亡变化,敲除SOCS1基因可促进人类肺泡上皮细胞凋亡(Qian et al.,2012);非编码microRNA-155(miR-155)通过沉默SOCS1基因而促进肝星状细胞周期进程及减少细胞凋亡,而沉默miR-155可上调SOCS1基因并促使MAPK信号通路失活,进而抑制酒精性肝星状细胞增殖及促进细胞凋亡(Liu et al.,2020);SOCS1基因过表达能诱导G2/M期细胞周期阻滞和凋亡,显著降低细胞增殖(Kajiyama et al.,2022)。综上所述,SOCS1基因能抑制细胞增殖及促进细胞凋亡,且与相关泌乳的信号通路紧密相关。此外,与SOCS1基因同样具有特殊结构KIR的SOCS3基因沉默会促进奶牛乳腺上皮细胞泌乳及上调相关基因表达(Huang et al.,2013),且有研究证实SOCS3基因能促进卵巢上皮癌细胞凋亡(王茹等,2022),故推测过表达SOCS1基因能抑制猪乳腺上皮细胞增殖并促进细胞凋亡。
在动物生产方面,已有研究围绕SOCS基因及JAK/STAT信号通路在奶牛产奶量、乳房炎症、乳蛋白合成等作用机制方面开展深入探索(Coskun et al.,2013;Khan et al.,2020),证实JAK/STAT信号通路是在几种多肽激素和细胞因子的下游运作,且这些激素和细胞因子是乳腺产后分泌功能的关键(Hennighausen and Robinson,2001)。JAK/STAT信号通路的激活参与促进多种细胞增殖。Yin等(2021)研究表明,在细胞滋养层中过表达SOCS3基因能减少细胞凋亡,敲低SCOS3基因则获得相反效果,证实SOCS3基因过表达能抑制JAK2和STAT3磷酸化。郝兰等(2022)在探究祛腐生肌合剂联合表皮细胞生长因子调控压疮创面修复作用机制时发现,上调SOCS1蛋白表达水平能抑制JAK2/STAT3信号通路表达。此外,有研究报道沉默.JAK2基因表达后牛乳腺上皮细胞的增殖和分化降低95%以上(Shillingford et al.,2002)。在本研究中,SOCS1基因过表达能极显著提高JAK/STAT信号通路内大部分相关基因(SOCS2、SOCS3、JAK1、STAT2、STAT5A、IL-6、PRLR、MCL1和PIAS3)的相对表达量。其中,JAK2和STAT3基因相对表达量呈降低趋势,不仅证实了SOCS1基因与JAK2和STAT3基因间的负反馈抑制关系,还提示JAK2和STAT3基因在猪乳腺上皮细胞增殖与凋亡调控中与SOCS1基因存在密切关系。STAT3基因能特异性二聚化诱导细胞凋亡,而STAT5基因会减弱由STAT3基因诱导剂LIF介导的细胞凋亡(Clarkson et al.,2006)。STAT3和STAT5A在整个乳腺发育周期中具有相互激活的作用模式,其中,STAT5A可能是分化乳腺上皮细胞的生存因子,而STAT3可能是细胞凋亡的关键因子(Chapman et al.,2000)。李辉(2014)研究表明,抑制STAT5A基因表达后,山羊乳腺上皮细胞增殖受抑制,而细胞凋亡率明显上升。本研究中,随着SOCS1基因在猪乳腺上皮细胞中的过表达,STAT3和STAT5A基因的表达呈现相反的变化趋势,其中STAT5A基因表达量极显著升高。综合STAT家族基因在乳腺上皮细胞中的调控研究结论,以及SOCS蛋白是STATs的直接转录靶点,可推测SOCS1基因与STAT3和STAT5A基因间的相互作用对于猪乳腺上皮细胞的增殖和凋亡起关键作用,但具体调控机制还需进一步探究。
4结论
SOCS1基因过表达可抑制猪乳腺上皮细胞增殖及促进细胞凋亡,并影响JAK/STAT信号通路相关基因的表达变化,从而在猪的乳腺发生发育调控机制中发挥重要作用。
参考文献:
邓桢,雷钊,朱红伟,李志强,余枭,杨智,孙吉春,金晓馨.2021.SOCS1调控JAK/STAT通路传导抑制肝癌细胞增殖、侵袭、迁移的机制研究[J].中国现代手术学杂志,25(1):8-14.[Deng Z,Lei Z,Zhu HW,LiZQ,Yu X,Yang Z,Sun JC,Jin XX.2021.SOCS1inhibits the prolifera-tion,invasion and migration of hepatoma cell by regula-ting the JAK/STAT signaling pathway[J].Chinese Journal of Modern Operative Surgery,25(1):8-14.]doi:10.16260/j.cnki.1009-2188.2021.01.002.
郝兰,郭元,夏鹏辉.2022.祛腐生肌合剂联合表皮细胞生长因子对压疮创面修复的作用及SOCS1/JAK2/STAT3信号通路的影响[J].四川中医,40(12):36-41.[Hao L,Guo Y,Xia PH.2022.Effect of Qufu Shengji mixture combined with epidermal growth facor for pressure ulcer wound repair and its influence on SOCS1/JAK2/STAT3signal pathway[J].Journal of Sichuan of Traditional Chi-nese Medcine,40(12):36-41.]
华丽萍,刘双行,赵鑫哲,叶挺柱,熊家军,杨利国,梁爱心.2020.DDR1对奶牛乳腺上皮细胞增殖与凋亡的调控作用[J].畜牧兽医学报,51(9):2109-2119.[Hua LP,Liu S"X,Zhao XZ,Ye TZ,Xiong JJ,Yang LG,Liang AX.2020.Effects of interference andoverexpression of DDR1on proliferation and apoptosis of mammary epithelial cells in dairy cows[J].Acta Veterinaria et Zootechnica Sinica,51(9):2109-2119.]doi:10.11843/j.issn.0366-6964.2020.09.008.
李辉.2014.Stat5a对山羊乳腺上皮细胞凋亡的调控研究[D].杨凌:西北农林科技大学.[LiH.2014.Signal trans-ducer and activatorof transcription5a regulates goat mam-mary gland epithelial cells apoptosis[D].Yangling:North-west Aamp;F University.]
刘嘉烁,彭灿,汤少勋,韩雪峰,谭支良.2023.橙皮苷调控Bcl-2/Bax-Caspase3信号通路阻抑H₂O₂诱导的奶牛乳腺上皮细胞凋亡[J].南方农业学报,54(10):3037-3046.[Liu JS,Peng C,Tang SX,Han XF,Tan ZL.2023.Hes-peridin inhibits H₂O₂-induced apoptosis of bovine mam-mary epithelial cells by regulatingBcl-2/Bax-Caspase3sig-nal pathway[J].Journal of Southern Agriculture,54(10):3037-3046.]doi:10.3969/j.issn.2095-1191.2023.10.022.
王茹,钟桂兰,王小花,林芳婷,吴清瑜,2022.SOCS3介导IL-6/STAT3通路在卵巢上皮癌细胞增殖凋亡过程中的作用机制[J].中国老年学杂志,42(23):5753-5757.[Wang R,Zhong GL,Wang XH,Lin FT,Wu QY.2022.The mechanism of SOCS3mediating IL-6/STAT3pathway in the proliferation and apoptosis of ovarian epithelial can-cer cells[J].Chinese Journal of Gerontology,42(23):5753-5757.]
杨忠诚,龚俞,杨永强,刘若余,2015.威宁黄牛SOCS4基因多态性及其与生长性状的关联分析[J].南方农业学报,46(4):687-691.[Yang ZC,Gong Y,Yang YQ,Liu RY.2015.Correlation analysis of SOCS4gene polymorphism with growth traits in Weining cattle[J].Journal of Southern Agriculture,46(4):687-691.]doi:10.3969/j:issn.2095-1191.2015.4.687.
张亚林.2016.不同蛋氨酸源对猪乳腺上皮细胞蛋白质合成的调控及其机制研究[D].成都:四川农业大学.[Zhang YL.2016.Regulation of methionine sources on protein synthesis in porcine mammary epithelial cells and tissues[D].Chengdu:Sichuan Agricultural University.]
朱俊儒,韦唯,裴党帅,张芬鹊,段瑜,郭永峰,江悦,夏树立,韩静,侯金星,安小鹏.2023.PDCD4对奶山羊乳腺上皮细胞的凋亡及β-酪蛋白和TG合成的影响[J].畜牧兽医学报,54(4):1429-1440.[Zhu JR,Wei W,Pei DS
Zhang FQ,Duan Y,Guo YF,Jiang Y,Xia SL,Han J,Hou JX,An XP.2023.Effects of PDCD4on the apopto-sis of dairy goat mammary epithelial cellsand the synthe-sis of β-casein andTG[J].Acta Veterinaria et Zootechnica"Sinica,54(4):1429-1440.]doi:10.11843/j.issn.0366-6964.2023.04.008.
Annen EL,Stiening CM,Crooker BA,Fitzgerald AC,Collier"R J.2008.Effect of continuous milking and prostaglandin E₂on milkproduction and mammary epithelial cell turn-over,ultrastructure,and gene expression[J].Journal of"Animal Science,86(5):1132-1144.doi:10.2527jas.2007-0726.
Bae D,Chon JW,Kim DH,Kim H,Seo KH.2022.Effect of folic acid supplementation on proliferation and apoptosis in bovine mammary epithelial(MAC-T)cells[J].Animal"Biotechnology,33(1):13-21.doi:10.1080/10495398.2020.1758123.
Chapman RS,Lourenco P,Tonner E,Flint D,SelbertS,Takeda K,Akira S,Clarke AR,Watson CJ.2000.The role of Stat3in apoptosis and mammary gland involution[J].Advances in Experimental Medicine and Biology,480:129-138.doi:10.1007/0-306-46832-8_16.
Chu MQ,Zhao Y,Yu S,Hao YN,Zhang PF,Feng YN,ZhangHF,Ma DX,Liu J,Cheng M,LiL,Shen W,Cao HF,LiQ,Min LJ.2018.miR-15b negatively corelates with lipid metabolism in mammary epithelialcells[J].Ame-rican Journal of Physioogy.Cell Physiology,314(1):C43-C52.doi:10.1152/ajpcell.00115.2017
Clarkson RWE,Boland MP,Kritikou EA,Lee JM,Freeman TC,Tiffen PG,Watson CJ.2006.The genes induced by signal transducer and activators of transcription(STAT)3and STAT5in mammary epithelialcellsdefine the roles of these STATs in mammary development[J].Molecular En-docrinology,20(3):675-685.doi:10.1210/me.2005-0392.
Coskun M,Salem M,Pedersen J,Nielsen OH.2013.Involve-ment of JAK/STAT signaling in the pathogenesis of inflam-matory bowel disease[J].Pharmacological Research,76:1-8.doi:10.1016/j.phrs.2013.06.007.
Geng ZJ,Shan XF,Lian S,Wang JF,Wu R.2021.LPS-induced SOCS3antagonizes the JAK2-STAT5pathway and inhibits β-casein synthesis in bovine mammary epithe-lial cells[J].Life Science,278:119547.doi:10.1016j.1fs.2021.119547.
González L,Miquet JG,Sotelo AI,Bartke A,Turyn D.2002Cytokine-inducible SH2protein up-regulation is associa-ted with desensitization of GH signaling in GHRH-transgenic mice[J].Endocrinology,43(2):386-394.doi:10.1210/endo.143.2.8616.
Hennighausen L,Robinson GW.2001.Signaling pathways in mammary gland development[J].Developmental Cell,1(4):467-475.doi:10.1016/S1534-5807(01)00064-8.
Huang YL,Zhao F,Luo CC,Zhang X,SiY,Sun Z,Zhang L,LiQZ,Gao XJ.2013.SOCS3-mediated blockade reveals major contribution of JAK2/STAT5signaling pathwayto lactation and proliferation of dairy cow mammary epithe-lial cells in vitro[J].Molecules,18(10):12987-3002.doi:10.3390/molecules181012987.
Kajiyama T,Serada S,Fujimoto M,Ohkawara T,Komori M,Hyodo M,Naka T.2022.SOCS1 gene therapy for head"and neck cancers:An experimental study[J].Anticancer Research,42(7):3361-3372.doi:10.21873/anticanres.15823.
Kapila N,Sharma,A,Kishore,A,Sodhi,M,Tripathi,P.K,Mohanty AK,Mukesh M.2018.Correction:Impact of heat stress on cellular and transcriptional adaptation of mammary epithelial cells in riverine buffalo(Bubalusbuba-lis)[J].PLoS One,13(1):e0191380.doi:10.1371/journal.pone.0191380.
Khan MZ,Khan A,Xiao JX,Ma YL,Ma JY,Gao J,Cao ZJ.2020.Role of the JAK-STAT pathway in bovine mastitis and milk production[J].Animals,10(11):2107.doi:10.3390/anil0112107.
LiYH,Ren QQ,Wang XP,Luoreng Z,Wei DW.2022.Bta-miR-199a-3p inhibits LPS-induced inflammaion in bovine mammary epithelial cells via the PI3K/AKT/NF-kB signa-ling pathway[J].Cells,11(21):3518.doi:10.3390/cells11213518.
Lindeman GJ,Wittlin S,Lada H,Naylor MJ,Santamaria M,Zhang JG,Starr R,Hilton DJ,Alexander WS,Ormandy CJ,Visvader J.2001.SOCS1 deficiencyresults in accelera-ted mammary gland development and rescues lactation in prolactinreceptor-deficient mice[J].Genesamp;Development,15(13):1631-1636.doi:10.1101/gad.880801.
Liu DT,Han P,Gao CH,Gao W,Yao XC,Liu SL.2020.microRNA-155modulates hepatic stellate cell prolifera-tion,apoptosis,and cell cycle progression in rats with alco-holic hepatitis via the MAPK signaling pathway through targeting SOCS1[J].Frontiers in Pharmacology,11:270.doi:10.3389/fphar.2020.00270.
Macias H,Hinck L.2012.Mammary gland development[J].WIREs Developmental Biology,1(4):533-557.doi:10.1002/wdev.35.
Meng YY,Yuan C,Zhang J,Zhang FL,Fu Q,Zhu XT,Shu"G,Wang L,GaoP,XiQY,Sun JJ,Zhang YL,Jiang QY,Wang SB.2017.Stearic acidsuppresses mammary gland development by inhibiting PI3K/Akt signaling pathway through GPR120in pubertal mice[J].Biochemical and Biophysical Research Communications,491(1):192-197.doi:10.1016j.bbrc.2017.07.075.
Qian YR,Zhang QR,Cheng T,Wan HY,Zhou M.2012.RNA interference-mediated silencing of SOCS-1via lenti-viral vector promotes apoptosis of alveolar epithelial cells in vitro[J].Molecular Medicine Reports,5(2):452-456.doi:10.3892/mmr.2011.672.
Shillingford JM,Miyoshi K,Robinson GW,Grimm SL,Rosen JM,Neubauer H,Pfeffer K,Hennighausen L.2002.JAK2isan essential tyrosine kinase involved in pregnancy-mediated development of mammary secretory epithelium[J].Molecular Endocrinology,16(3):563-570.doi:10.1210/mend.16.3.0805.
Wu ZH,Heng JH,Tian M,Song HQ,Chen F,Guan WT,Zhang SH.2020.Amino acid transportation,sensing and signal transduction inthe mammary gland:Key molecular signalling pathways in the regulation of milk synthesis[J].Nutrition Research Reviews,33(2):287-297.doi:10.1017/S0954422420000074.
Yin Y,Qu L,Zhu DC,Wu Y,Zhou X.2021.Effect ofSOCS3on apoptosis of human trophoblasts via adjustment of the JAK2/STAT3signalingpathway in preterm birth[J].Trans-lational Pediatrics,10(6):1637-1646.doi:10.21037/tp-21-39
Zhao HY,Chen SX,Hu KZ,Zhang ZF,Yan XR,Gao HJ,Du W,Zheng HL.2021.5-HTP decreases goat mammary epithelial cells apoptosis through MAPK/ERK/Bcl-3path-way[J].Gene,769:145240.doi:10.1016/j.gene.2020.145240.
(责任编辑 兰宗宝)

