超声辅助低共熔溶剂提取肾茶黄酮和多酚的工艺及其抗氧化活性



摘要: 【目的】优化超声辅助低共熔溶剂(deep eutectic solvents,DESs) 同时提取肾茶黄酮和多酚的工艺,评价提取物的抗氧化活性。【方法】从6 种不同组分的DESs 中筛选出黄酮和多酚得率最高的组分,再采用单因素试验和响应面Box-Behnken 设计试验优化超声辅助DESs 提取肾茶黄酮和多酚的工艺,并测定肾茶DESs 提取物的DPPH·清除能力、ABTS+清除能力和还原能力。【结果】单因素试验结果表明:n氯化胆碱∶n乙二醇为1∶5、含水量30%、料液比为1∶20 (g∶mL)、提取温度为70 ℃、提取时间为40 min 是提取肾茶黄酮和多酚的最佳条件。响应面Box-Behnken 设计表明: n氯化胆碱∶n乙二醇为1∶5、含水量30%、料液比为1∶21(g∶mL)、提取温度为67 ℃、提取时间为42 min 时,肾茶黄酮得率为140.87 mg/g,多酚得率为63.58 mg/g,均显著高于50% 乙醇提取的得率。肾茶DESs 提取物清除DPPH·、ABTS+能力和还原能力均高于50% 乙醇提取物。【结论】DESs 可作为一种新型的溶剂,绿色、高效地同时提取肾茶中的黄酮和多酚,为肾茶的深度开发提供基础技术支撑。
关键词: 低共熔溶剂;肾茶;黄酮;多酚;抗氧化活性
中图分类号: S567.239.01 文献标志码: A 文章编号: 1004–390X (2024) 03−0099−08
肾茶在中国已有2 000 多年的应用历史。肾茶[Clerodendranthus spicatus (Thunb.) C. Y. Wu]又名猫须草,傣名“雅糯秒”,全草入药,傣族医书《贝叶经》和《档哈雅》均有记载,具有清火解毒、利尿排石、凉血止血的功效,是传统傣医用于预防和治疗肾、膀胱、尿道等泌尿系统疾病的首选药材[1]。肾茶深受傣族民众喜爱,常用其叶作为茶叶和药用,在中国主要分布于云南、海南、广西、广东、福建、台湾等地,以云南普洱和西双版纳地区栽培最多[2]。肾茶含有黄酮类、多酚类、二萜类、三萜类等化合物,主要活性成分是黄酮类[3]和多酚类[4],具有抗氧化、抗炎、抗癌、利尿、神经保护等多种生物活性[2, 5-6]。
目前,通常采用有机溶剂提取肾茶中的活性成分[7-10]。近年来,绿色溶剂的开发促进了现代绿色化学的发展,其通过取代挥发性溶剂达到高利用率及低毒性的效果[11]。低共熔溶剂(deep eutecticsolvents,DESs) 是由一定化学计量比的固体卤化物盐的氢键受体 (如季铵盐) 和氢键供体 (如酰胺、羧酸、多元醇、糖等化合物) 组合而成的2 组分或3 组分低共熔混合物,其熔点显著低于各个组分纯物质的熔点[12]。DESs 可完全生物降解且具有良好的生物相容性[13-14],其结合了离子液体的特点,具有生产廉价、无毒、制备工艺较简单、提取程度高等优势,自首次报道[12]以来,以氯化胆碱为基础的DESs 成功地从金银花[15]、草果[16]、山楂[17]、玫瑰[18]、桑叶[19]、红枣[20]、葛根[21]、黄精[22]、麦冬[23]、覆盆子[24]、枇杷叶[25]、黄芩[26]等药材中提取到活性成分,且该方法比传统方法更高效。本研究以DESs 为提取溶剂,采用单因素结合响应曲面设计—中心组合设计的方法,确定肾茶黄酮类和多酚类成分的最佳提取工艺,以期为肾茶的深度开发提供技术支撑。
1 材料与方法
1.1 试验材料
肾茶药材购于云南省昆明市新螺蛳湾药材市场,经云南中医药大学中药学院中药鉴定教研室李学芳正高级工程师鉴定为肾茶的干燥全草。
1.2 仪器与试剂
754 型紫外可见光分光光度计(上海元析仪器有限公司);超声波清洗机SB-5200DT (宁波新生物科技股份有限公司);BT125D 双量程电子分析天平(德国多利斯公司);TGL-16.5 M 台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);600 T 多功能粉碎机(永康市铂欧五金制品有限公司);RTC-2(加热型) 磁力搅拌器[ 大龙新创实验仪器(北京) 股份公司 ];DRRH-S4 数显恒温水浴锅(上海双捷仪器设备有限公司)。
芦丁对照品(批号DL001701,纯度≥99%) 和没食子酸对照品(批号DM000801,纯度≥98%),购于森岚科技有限公司;氯化胆碱和DL-乳酸均为分析纯,购于上海阿拉丁生化科技股份有限公司;乙二醇、1,2-丙二醇、丙三醇和尿素均为分析纯,购于天津市风船化学试剂科技有限公司;1,4-丁二醇、过硫酸钾、铁氰化钾、三氯乙酸、氯化铁、磷酸二氢钠和磷酸氢二钠均为分析纯,购于国药集团化学试剂有限公司;无水乙醇和甲醇均为分析纯,购于利安隆博华(天津) 医药化学有限公司;亚硝酸钠、九水合硝酸铝、氢氧化钠和十水合碳酸钠均为分析纯,购于四川西陇科学有限公司;福林酚试剂、DPPH·试剂、ABTS+试剂和抗坏血酸均为优级纯,购于上海源叶生物科技有限公司;纯净水由 Milli-Q 纯水制备系统制备。
1.3 试验方法
1.3.1 DESs 的制备
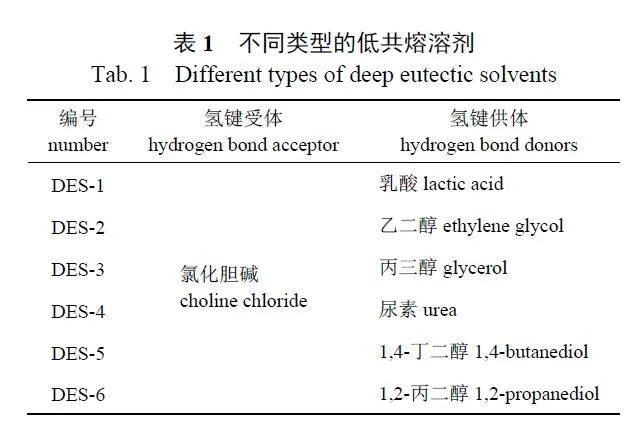
不同种类DESs 对活性成分提取效果不同。为筛选不同的DESs,参考文献[27-28] 的方法,以氯化胆碱为氢键受体与不同种的氢键供体按照物质的量比为1∶2 混合,80 ℃ 水浴加热搅拌至形成澄清均匀的液体,制得DESs (表1)。
1.3.2 肾茶活性成分的提取
肾茶药材去除杂质后50 ℃ 减压干燥24 h,粉碎过 65 目筛,即为肾茶粉末。取肾茶粉末2.0 g置于具塞锥形瓶中,加入一定体积的不同DESs混合均匀;充分浸泡后,在一定温度下超声(功率250 W,频率40 kHz) 提取,溶液转移至离心管中,8 000 r/min 离心20 min,取上清液,备用。
1.3.3 肾茶黄酮得率的测算
黄酮含量的测定采用亚硝酸钠—硝酸铝比色法。吸取提取液0.5 mL,加入60% 乙醇2.0 mL 稀释混匀,准确移取0.2 mL,加入5% 亚硝酸钠溶液0.5 mL,摇匀,室温反应6 min;加入10% 硝酸铝溶液0.5 mL,摇匀,溶液络合6 min;再加入4% 氢氧化钠溶液4.0 mL,摇匀,显色15 min,在波长510 nm 处测定吸光度。以芦丁为标准品,测得质量浓度为0.059 8~0.598 0 mg/mL 的芦丁标准溶液吸光度(A1),得到标准曲线A1=0.460 3ρ1+0.011 5 (R2=0.999 2),其中,ρ1 为芦丁质量浓度。将吸光度值代入标准曲线求得对应的黄酮质量浓度(ρ),再按照公式计算肾茶黄酮得率:
得率=ρ×V×N/m。
式中:V 为提取液体积,mL;N 为稀释倍数;m为样品干质量,g。
1.3.4 肾茶多酚得率的测算
多酚含量的测定采用Folin-Ciocalteu 比色法[4]。吸取提取液0.2 mL 置于50 mL 棕色容量瓶中,用纯水稀释至刻度,摇匀,即为供试溶液。吸取供试溶液0.5 mL,加入10% 福林酚试剂2.5 mL,摇匀,室温静置8 min;加入7.5% 碳酸钠溶液2.0 mL,摇匀,30 ℃ 水浴避光反应60 min,在波长765 nm 处测定吸光度。以没食子酸为标准品,测得质量浓度为0.000 6~0.030 0 mg/mL 的没食子酸标准溶液吸光度(A2),得到标准曲线A2=11.508 0ρ2+0.056 2 (R2=0.999 1),其中,ρ2 为没食子酸质量浓度。将吸光度值代入标准曲线求得对应的多酚质量浓度(ρ),再计算肾茶多酚得率。计算公式同1.3.3 节。
1.3.5 超声辅助DESs 提取肾茶活性成分的单因素优化试验
单因素考察提取工艺对肾茶黄酮和多酚得率的影响,包括提取溶剂(6 种不同类型DESs)、DES 物质的量比(1∶1、1∶2、1∶3、1∶4、1∶5、1∶6)、DES 含水量(0%、10%、20%、30%、40%、50%)、料液比[1∶5、1∶10、1∶15、1∶20、1∶25 (g∶mL)]、提取温度(40、50、60、70、80 ℃)、提取时间(10、20、30、40、50 min)。考察提取溶剂时,其他参数固定为:n氢键受体∶n氢键供体为1 ∶ 2, DESs 含水量10%, 料液比为1 ∶ 15(g∶mL),提取温度为50 ℃,提取时间为20 min;考察DES 物质的量比时,提取溶剂选用最佳提取溶剂,其他参数不变[DES 含水量10%,料液比为1∶15 (g∶mL),提取温度为50 ℃,提取时间为20 min];考察DES 含水量时,提取溶剂和物质的量比选用最佳参数,其他参数不变[ 料液比为1∶15 (g∶mL),提取温度为50 ℃,提取时间为20 min];以此类推。
1.3.6 超声辅助DESs 提取肾茶活性成分的响应面优化试验
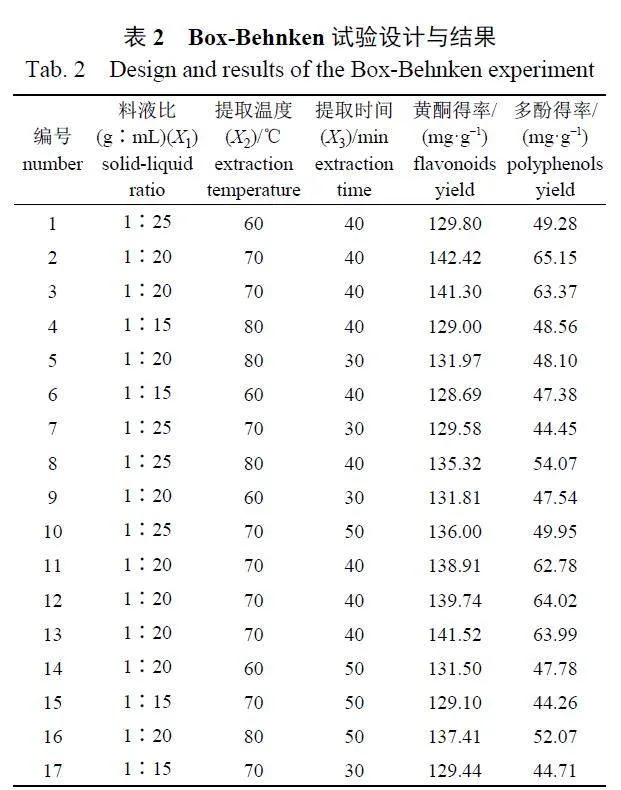
在单因素试验的基础上,选择3 因素3 水平的响应曲面设计—中心组合设计(Box-Behnken 设计) 试验优化提取条件,以黄酮得率、多酚得率为响应值,运用Design-Expert 8.0.6 软件中的Box-Behnken 模式,选取料液比(X1)、提取温度(X2)和提取时间(X3) 因素中影响最大的3 水平(表2),优化肾茶活性成分的提取工艺。
1.3.7 不同溶剂肾茶活性成分提取效果对比
在响应面设计的最佳提取条件下,分别用50% 乙醇[4, 7]和DES 提取肾茶黄酮和多酚,计算得率。
1.3.8 抗氧化活性评价
取不同溶剂提取的肾茶提取液,经大孔吸附树脂吸附→80% 乙醇解吸附→减压浓缩→冷冻干燥,得到肾茶提取物冻干粉,制成1.0~1.5 mg/mL样品溶液,进行抗氧化活性评价,并与相同质量浓度的抗坏血酸溶液作比较。DPPH·清除能力参考李晓花等[4]的方法测定,ABTS+清除能力参考苏德禹等[3]的方法测定,还原能力参考蔡旋等[29]的方法测定,且均有改进。
1.4 数据处理与分析
响应曲面模型的回归方程式和显著性统计采用Design Expert 8.0.6 软件进行计算和分析,数据结果采用SPSS 20.0 软件进行方差分析。所有试验均平行重复3 次。
2 结果与分析
2.1 单因素试验结果
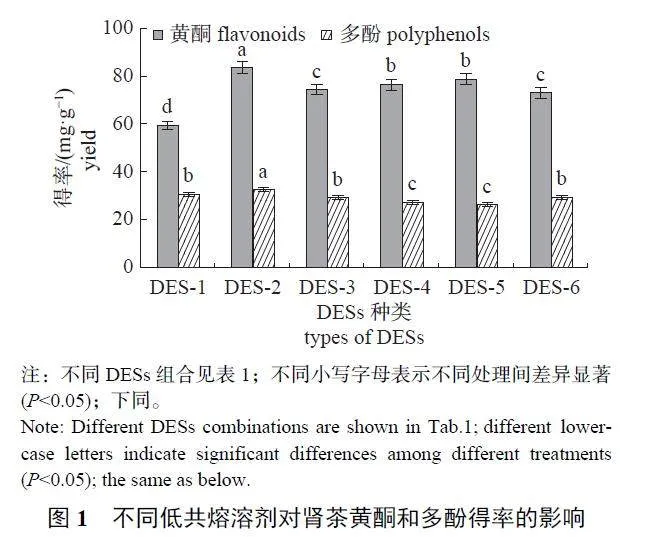
2.1.1 DES 的筛选
由图1 可知:6 种DESs 中,DES-2 的提取效果最好,黄酮得率为(83.52±2.50) mg/g,多酚得率为(32.49±0.84) mg/g,均显著高于其他DESs 的提取效果。因此,确定DES-2 (氯化胆碱—乙二醇) 为最佳提取溶剂。
2.1.2 物质的量比
由图2 可知:随着乙二醇比例的增大,黄酮和多酚的提取效果均呈先升高后降低的变化趋势。当n氯化胆碱∶n乙二醇=1∶5 时,提取效果最佳,黄酮得率为(93.54±3.71) mg/g,多酚得率为(36.59±1.83) mg/g。因此,选择氯化胆碱和乙二醇最佳物质的量比为1∶5。
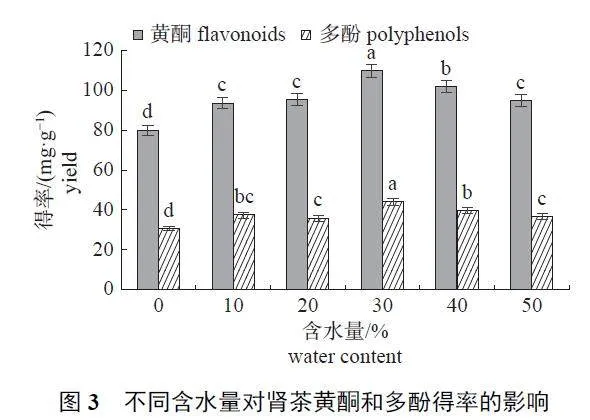
2.1.3 含水量
随着DESs 体系中含水量的增加,黄酮和多酚得率均呈先升高后降低的变化(图3)。当含水量为30% 时,提取效果最佳,黄酮得率为(109.84±3.27) mg/g,多酚得率为(36.59±1.76) mg/g。因此,选择30% 为最适含水量。
2.1.4 料液比
料液比(g∶mL) 从1∶5 到1∶20 的过程中,肾茶黄酮和多酚的得率逐渐增加,当料液比为1∶20 时,黄酮得率为(119.97±3.54) mg/g,多酚得率为(46.34±2.31) mg/g,提取效果最佳(图4)。因此,选择1∶20 为最佳料液比。
2.1.5 提取温度
由图5 可知:提取温度从40 ℃ 升至70 ℃的过程中,肾茶黄酮和多酚的得率逐渐增加;当提取温度为70 ℃ 时,得率达到最大值,黄酮为(130.54±3.92) mg/g,多酚为(54.36±2.17) mg/g;随着提取温度继续增加,提取效果呈下降趋势。因此,选择70 ℃ 为最佳提取温度。
2.1.6 提取时间
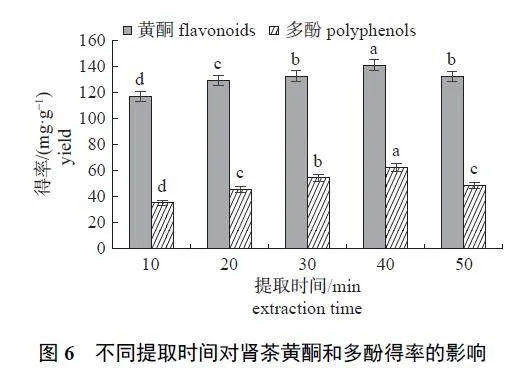
提取时间从10 min 到40 min 的过程中,肾茶黄酮和多酚的得率逐渐增加;当提取时间为40 min 时,黄酮得率为(141.26±4.38) mg/g,多酚得率为(62.53±2.83) mg/g,提取效果最佳;随着提取时间继续增加,提取效果呈下降趋势(图6)。因此,选择40 min 为最佳提取时间。
2.2 响应面试验结果
2.2.1 统计分析和模型拟合
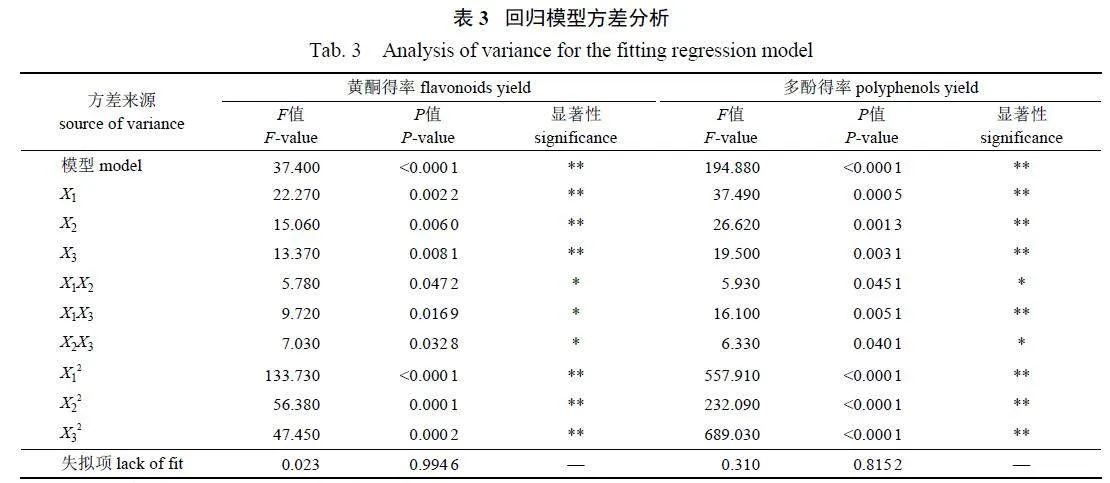
Box-Behnken 响应面优化试验结果见表2,经Design-Expert 8.0.6 软件拟合,得到各因素(X1:料液比,X2:提取温度,X3:提取时间) 对黄酮得率(Y1) 和多酚得率(Y2) 的回归方程分别为:Y1=140.78+1.81X1+1.49X2+1.40X3+1.30X1X2+1.69X1X3+1.44X2X3−6.11X12−3.97X22−3.64X32;Y2=63.86+1.61X1+1.35X2+1.16X3+0.90X1X2+1.49X1X3+0.93X2X3−8.53X12−5.50X22−9.48X32。
方差分析结果(表3) 显示:2 个数据模型的Plt;0.000 1,表明模型具有极显著性;失拟项Pgt;0.05,差异不显著,表示模型的拟合良好,试验误差小。模型决定系数R2pred和调整系数R2adj均接近于1, 二者差异在合理范围内(|R2adj-R2pred|<0.2),说明该模型具有较好的回归性。工艺参数对肾茶黄酮和多酚得率的影响强弱(F 值的大小)为:料液比(X1)gt;提取温度(X2)gt;提取时间(X3)。
2.2.2 验证试验
根据拟合方程和方差分析结果,肾茶黄酮和多酚的最佳提取条件为:料液比1∶20.64 (g∶mL)、提取温度67.08 ℃、提取时间41.68 min,预测黄酮得率为141.39 mg/g,多酚得率为64.09 mg/g。为方便试验操作,将提取参数调整为料液比1∶21 (g∶mL)、提取温度67 ℃、提取时间42 min,进行3 次平行验证试验,肾茶黄酮得率为140.87mg/g,多酚得率为63.58 mg/g,均与预测结果相近(Pgt;0.05),表明模型预测良好,可用于肾茶黄酮和多酚的同时提取。
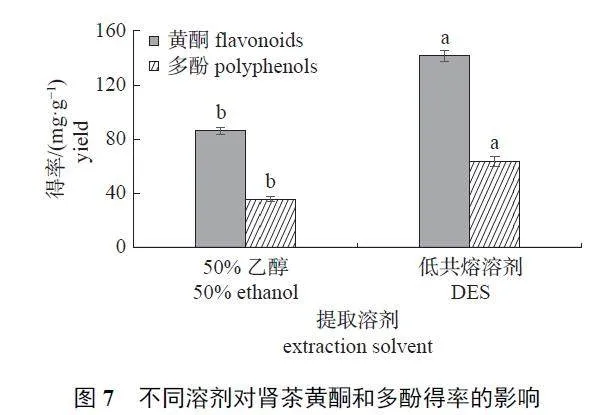
2.3 不同溶剂对肾茶黄酮和多酚的提取效果
由图7 可知:DES 对肾茶黄酮和多酚的提取效果显著高于50% 乙醇。
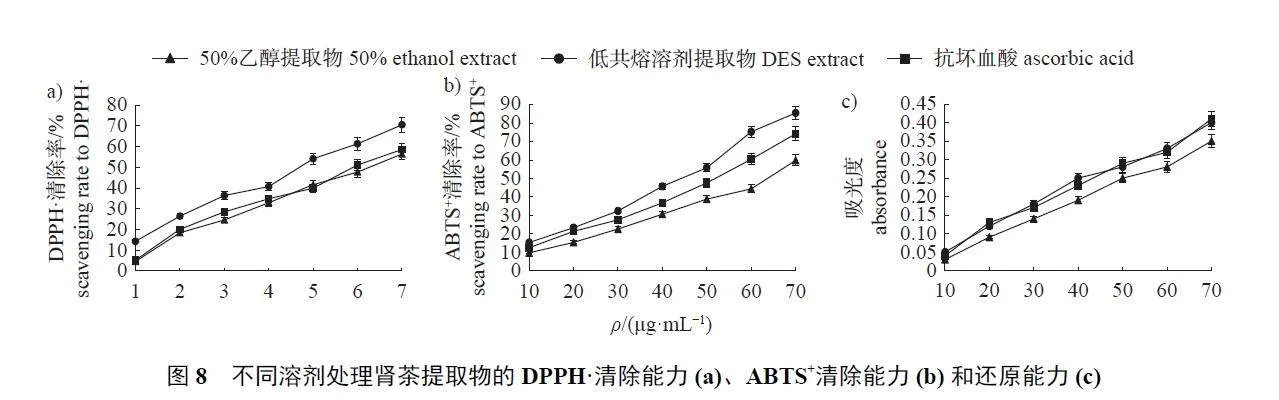
2.4 肾茶提取物的抗氧化活性
由图8 可知:不同溶剂得到的肾茶提取物均表现出一定的抗氧化活性,且活性随着提取物质量浓度的升高而增强。DES 提取物对DPPH·和ABTS+的清除率均优于抗坏血酸和50% 乙醇提取物;DES 提取物的还原能力与抗坏血酸相当,优于50% 乙醇提取物。其中,DES 提取物和50%乙醇提取物清除DPPH·的IC50 分别为4.72 和6.14 μg/mL,清除ABTS+的IC50 分别为41.97 和62.93 μg/mL,还原能力的斜率分别为0.056 1 和0.051 8。
3 讨论
传统有机溶剂较难实现极性差异较大化学成分的同时提取,而DESs 具有良好的生物相容性和结构可设计性,能够应用于极性差异较大的多种成分的高效提取,并已在多个品种上实现了不同成分的同时提取[27, 30-31]。DESs 的组分一般来源于植物的初级代谢产物,无毒无害,同时,DESs不易挥发、蒸气压小、不可燃、热稳定性和化学稳定性好,与传统提取溶剂相比,其提取更加高效,已在多个品种上得到验证[32-36]。肾茶主要活性成分为黄酮类和多酚类,本研究利用DESs 同时提取黄酮类和多酚类成分,与已报道的常规溶剂[9-10]相比,DESs 提取效率更加高效,能为其他民族药多种活性成分的高效提取提供借鉴。
DESs 由氢键受体和氢键供体组合而成,氢键受体和氢键供体的种类较多,可选择性较强,能形成多种不同类型溶剂,可根据试验材料选择适宜的类型和比例。在氯化胆碱—乙二醇的物质的量比单因素试验中,随着乙二醇比例的增加,提取率先升高后降低,可能是乙二醇比例增加引入更多氢键形成更完善的溶剂体系,促进黄酮和多酚的溶出,从而改善提取效果;但乙二醇比例过大,过多的氢键是否会破坏溶剂体系分子间的作用力,从而影响提取效果,还需进一步试验验证。DESs 的黏度较大,流动性不强,在提取后的固液分离时操作难度较大,故在溶剂制备过程中需加入水。DESs 由氢键维持其性能,水的加入引入了较强的氢键,如何影响DESs 体系进而影响提取效果,还有待进一步研究。肾茶DESs提取物的含量和体外抗氧化活性明显优于传统溶剂,提取物的多种生理活性是否强于传统溶剂以及是否具有明显毒性,是下一步研究的重点。
因DESs 不易挥发,热浓缩并不适用于DESs提取物,提取物的纯化和富集常采用大孔树脂吸附技术,因此,DESs 的回收再利用效能可能不如常规溶剂。在提取和纯化过程中不可避免地会混入难以去除的杂质,或显著改变其含水量,从而影响提取效果[37]。可见,循环利用可能是制约生产的主要瓶颈之一。
4 结论
本研究以DESs 为提取溶剂,采用单因素结合响应曲面设计—中心组合设计的方法,确定肾茶黄酮类和多酚类成分的最佳提取工艺为:n氯化胆碱∶n乙二醇=1∶5,含水量30%,料液比为1∶21 (g∶mL),提取温度为67 ℃,提取时间为42 min。与传统溶剂相比,DESs 的提取效能更佳,提取物的抗氧化活性更好。DESs 可作为一种新型的溶剂,绿色、高效地同时提取肾茶中的黄酮和多酚,为肾茶后续研究奠定基础。
[ 参考文献 ]
[1]林艳芳. 中国傣医药彩色图谱[M]. 昆明: 云南民族出版社, 2003.
[2]姜帅, 邹德志, 徐建平, 等. 肾茶的传统应用调查与研究进展[J]. 中国现代中药, 2015, 17(9): 980. DOI: 10.13313/j.issn.1673-4890.2015.9.023.
[3]苏德禹, 许鲁宁, 汤须崇, 等. 猫须草总黄酮抗氧化活性研究[J]. 海峡药学, 2014, 26(12): 242. DOI: 10.3969/j.issn.1006-3765.2014.12.135.
[4]李晓花, 陈蕾西, 牛迎凤, 等. 肾茶多酚提取工艺及其抗氧化活性研究[J]. 天然产物研究与开发, 2016, 28(2):257. DOI: 10.16333/j.1001-6880.2016.2.016.
[5]LI Y, WANG J, JIANG J H, et al. The protective effectsof Clerodendranthus spicatus (Thunb.) C. Y. Wu extract on oxidative stress induced by 2,2'-azo (2-methylpropamidine)dihydrochloride in HL-1 mouse cardiomyocytes[J]. Frontiers in Cardiovascular Medicine, 2022, 9: 984813. DOI: 10.3389/fcvm.2022.984813.
[6]ZHOU H C, YANG L, GUO R Z, et al. Phenolic acidderivatives with neuroprotective effect from the aqueousextract of Clerodendranthus spicatus[J]. Journal of AsianNatural Products Research, 2017, 19(10): 974. DOI:10.1080/10286020.2016.1277707.
[7]陆应彩, 卯明霞, 彭霞, 等. 肾茶总黄酮的含量测定[J].中国民族民间医药, 2018, 27(11): 37. DOI: 10.3969/j.issn.1007-8517.2018.11.zgmzmjyyzz201811012.
[8]孙影. 猫须草酚酸的提取及其对高尿酸血症的影响[D].杭州: 浙江工业大学, 2018.
[9]蓝伦礼, 刘梦楚, 邹晓红, 等. 肾茶总黄酮的提取纯化工艺优化[J]. 环球中医药, 2017, 10(9): 933. DOI: 10.3969/j.issn.1674-1749.2017.09.001.
[10]薛松, 唐雪澜, 刘哿吚, 等. 肾茶中主要酚类物质的提取工艺研究[J]. 国际药学研究杂志, 2016, 43(2): 365.DOI: 10.13220/j.cnki.jipr.2016.02.031.
[11]ANASTAS P, EGHBALI N. Green chemistry: principlesand practice[J]. Chemical Society Reviews, 2010, 39(1):301. DOI: 10.1039/b918763b.
[12]ABBOTT A P, CAPPER G, DAVIES D L, et al. Novelsolvent properties of choline chloride/urea mixtures[J].Chemical Communications, 2003, 9(1): 70. DOI: 10.1039/b210714g.
[13]KALMODE H P, VADAGAONKAR K S, MURUGANK, et al. Deep eutectic solvent: a simple, environmentallybenign reaction media for regioselective synthesis of2,3,4-trisubstituted 1H-pyrroles[J]. RSC Advances, 2015,5(44): 35166. DOI: 10.1039/C5RA03270A.
[14]ABBOTT A P, BOOTHBY D, CAPPER G, et al. Deepeutectic solvents formed between choline chloride andcarboxylic acids: versatile alternatives to ionic liquids[J].Journal of the American Chemical Society, 2004, 126(29):9142. DOI: 10.1021/ja048266j.
[15]刘小琳, 颜晓云, 谢勇武, 等. 超声波辅助低共熔溶剂提取金银花总黄酮的研究[J]. 云南民族大学学报(自然科学版), 2023, 32(4): 415. DOI: 10.3969/j.issn.1672-8513.2023.04.003.
[16]师聪, 陈学红, 解春芝, 等. 草果不同低共熔溶剂提取物活性成分与其抗氧化活性的相关性分析[J]. 中国食品添加剂, 2022, 33(6): 24. DOI: 10.19804/j.issn1006-2513.2022.06.004.
[17]罗蓉, 蔡旭, 薛宏坤, 等. 响应面法优化超声辅助低共熔溶剂提取山楂总黄酮工艺[J]. 食品工业科技, 2022,43(22): 229. DOI: 10.13386/j.issn1002-0306.2022010235.
[18]王晓艺, 李培坤, 李锦红, 等. 超声辅助低共熔溶剂提取玫瑰多酚及其抗氧化活性[J]. 食品研究与开发, 2022,43(8): 98. DOI: 10.12161/j.issn.1005-6521.2022.08.013.
[19]宋亚宁, 赵春晖, 纪玉涵, 等. 氯化胆碱/尿素低共熔溶剂提取桑树叶中黄酮研究[J]. 德州学院学报, 2022,38(2): 28. DOI: 10.3969/j.issn.1004-9444.2022.02.006.
[20]王小佳, 于有伟, 崔美林, 等. 低共熔溶剂协同超声波提取红枣中总黄酮的研究[J]. 中国调味品, 2022, 47(1):36. DOI: 10.3969/j.issn.1000-9973.2022.01.007.
[21]刘洋旋, 吕庆云, 党允卓, 等. 响应面法优化超声辅助低共熔溶剂提取葛根中黄酮及其抗氧化分析[J]. 食品科技, 2021, 46(11): 195. DOI: 10.13684/j.cnki.spkj.2021.11.030.
[22]王育红, 张晓宇, 钱志伟. 响应面优化低共熔溶剂提取黄精黄酮工艺及其生物活性研究[J]. 中国食品添加剂,2023, 34(4): 116. DOI: 10.19804/j.issn1006-2513.2023.04.014.
[23]王娟, 马春梅, 王丹. 低共熔溶剂协同超声波提取麦冬总黄酮的工艺优化及其抗氧化活性研究[J]. 中国食品添加剂, 2023, 34(3): 125. DOI: 10.19804/j.issn1006-2513.2023.03.015.
[24]于秋菊, 耿凤英, 张磊磊. 微波辅助低共熔溶剂提取覆盆子总黄酮的工艺优化及活性研究[J]. 中国食品添加剂, 2023, 34(2): 43. DOI: 10.19804/j.issn1006-2513.2023.02.006.
[25]唐小强, 何小艳, 张海全, 等. 超声波辅助低共熔溶剂提取枇杷叶总黄酮的工艺研究[J]. 广州化工, 2023, 51(3):96. DOI: 10.3969/j.issn.1001-9677.2023.03.027.
[26]朱溶月, 陈媛, 李博莉, 等. 不同工艺对黄芩总黄酮提取率及其提取物性能的影响[J]. 宁夏医科大学学报,2021, 43(1): 92. DOI: 10.16050/j.cnki.issn1674-6309.2021.01.020.
[27]杜伟伟. 香茶藨子叶片中总酚酸、总黄酮提取及生物活性研究[D]. 哈尔滨: 东北林业大学, 2016.
[28]WEI Z F, WANG X Q, PENG X, et al. Fast and greenextraction and separation of main bioactive flavonoidsfrom Radix Scutellariae[J]. Industrial Crops and Products,2015, 63(4): 175. DOI: 10.1016/j.indcorp.2014.10.013.
[29]蔡旋, 薛慧琴, 杨帆, 等. 猫须草根抗氧化成分提取工艺的优化研究[J]. 上海农业学报, 2017, 33(5): 99. DOI: 10.15955/j.issn1000-3924.2017.05.19.
[30]张玉坤. 茼麻叶挥发油和黄酮的同步提取及黄酮抗氧化活性研究[D]. 哈尔滨: 东北林业大学, 2017.
[31]陈冉, 李德慧, 阮桂发, 等. 基于绿色低共熔溶剂法高效提取鸡骨草中的黄酮和皂苷[J]. 天然产物研究与开发,2019, 31(9): 1632. DOI: 10.16333/j.1001-6880.2019.9.022.
[32]王志轩, 马丽, 郭海平, 等. Box-Behnken响应面法优选低共熔溶剂提取马蹄金总黄酮工艺[J]. 中国药业,2024, 33(1): 45. DOI: 10.3969/j.issn.1006-4931.2024.01.010.
[33]顾东雅, 金绍娣, 谢佳伶, 等. 低共熔溶剂提取鱼腥草中绿原酸工艺优化[J]. 中成药, 2024, 46(2): 573. DOI: 10.3969/j.issn.1001-1528.2024.02.036.
[34]卢娟, 韦新银, 谭春婷, 等. 超声辅助低共熔溶剂提取蒲公英绿原酸的工艺优化及其抗氧化活性研究[J]. 山西化工, 2024, 44(4): 3. DOI: 10.16525/j.cnki.cn14-1109/tq.2024.04.002.
[35]赵惠茹, 张硕, 王晴, 等. 金银花总黄酮低共熔溶剂提取工艺优化[J]. 中成药, 2024, 46(5): 1465. DOI: 10.3969/j.issn.1001-1528.2024.05.008.
[36]付佳乐, 耿直, 郭亚敏, 等. 银杏叶总黄酮绿色提取工艺及抗氧化活性研究[J]. 化学与生物工程, 2024, 41(1):40. DOI: 10.3969/j.issn.1672-5425.2024.01.008.
[37]张成园, 朱昕宇, 曹强, 等. 基于低共熔溶剂体系的中药黄酮类化合物提取研究进展[J]. 山西中医药大学学报,2023, 24(12): 1402. DOI: 10.19763/j.cnki.2096-7403.2023.12.18.
责任编辑:何謦成
基金项目:云南省教育厅研究基金项目(2021J0403) ;云南中医药大学中药学院团队建设项目;云南省科技人才和平台计划(202105AG070012);云南省中青年学术和技术带头人后备人才项目(202205AC160038);云南省科学技术院重大科技专项 (202002AA00007);云南省科技厅基础研究计划中医联合专项重点项目(202001AZ070001-011)。

