增施微藻和牛粪有机肥对土壤化学性质和细菌群落以及烤烟产质量的影响




摘要: 【目的】研究增施微藻和牛粪有机肥对烟草生长、产质量及土壤细菌群落的影响。【方法】设置微藻、牛粪有机肥、微藻+牛粪有机肥和空白对照(CK) 4 个田间试验处理,监测烟株农艺性状、烤后烟叶产量和化学成分,测定土壤化学性质,运用荧光定量PCR、Illumina Miseq 测序等分子生物学技术分析土壤细菌群落丰度和组成。【结果】与CK 相比,增施微藻+牛粪有机肥可显著增加土壤硝态氮、溶解性有机碳、有效磷和速效钾含量,改善土壤pH;烟株圆顶期株高和叶数显著增加,烤后烟叶中总氮、钾、烟碱、总糖和还原糖含量以及氮碱比和钾氯比显著增加,烟叶产量和产值分别提高13.70% 和16.78%;可提高土壤细菌群落多样性,优化土壤细菌群落结构,其中芽孢杆菌属(Bacillus) 的相对丰度升高,提升了土壤细菌群落抑制青枯病害的能力。典型对应分析结果表明:土壤pH 以及硝态氮和速效钾含量是影响土壤细菌群落结构组成的关键因素。【结论】增施微藻和牛粪有机肥可提高土壤养分含量,活化土壤有益微生物,提高细菌群落抑制青枯病菌的能力,改善土壤微生态环境,促进烟草生长,提高烟叶产量和品质。
关键词: 微藻;牛粪有机肥;土壤化学性质;烟叶产质量;细菌群落
中图分类号: S141.2 文献标志码: A 文章编号: 1004–390X (2024) 03−0172−10
烟草是中国重要的经济作物,其种植面积和总产量均占世界1/3 以上[1]。化肥具有速效养分含量高和肥效快等优点,对促进烟草生长和提高烟叶产量具有重要作用,在烟草生产中被广泛施用。然而,化肥长期过量施用,会引起土壤板结、酸化、有机质含量减少和微生物多样性降低等一系列问题,严重影响烟叶的产量和质量,制约烟草产业的可持续发展[2-3]。有机肥施用不仅能提高土壤总孔隙度,使耕层土壤变松和持水能力增加,还能活化土壤养分和促进有机质累积,提高土壤微生物多样性和酶活性等[4]。牛粪含有烤烟生长所必需的氮、磷、钾等营养元素,是优质的有机肥源[5]。增施牛粪不仅能显著改善土壤质地和养分状况,提高土壤微生物数量和多样性[6],还能促进烟株生长,增加烟叶干物质和致香物质总量,促进烟叶化学成分更协调,从而提高烟叶产量和质量[7]。
微藻是一组高度多样化的光合微生物,包括原核生物(如蓝藻) 和真核生物(如绿藻、硅藻、裸藻)[8]。作为新型微生物肥料,微藻具有改良土壤结构、提高土壤肥力、促进植物生长和改善土壤微生物群落结构等优点[9]。目前已应用于水稻、小麦、玉米、番茄等作物生产中[10-13]。RENUKA 等[14]将蓝藻和绿藻复合物施用于小麦后,土壤微生物活性增强,土壤有机碳含量增加,可促进小麦生长和增加产量。沈银武等[15]将蓝藻与无机肥料配施发现:适量的蓝藻有机无机复混肥对烟草产量和质量有促进作用。然而,微藻和有机肥组合施用在烟草生产中的应用鲜有报道,其对土壤化学性质、烟株生长和烟叶产质量及土壤微生物群落结构的影响尚不明确。
本研究选取典型植烟大田,设置空白对照(不施微藻和牛粪有机肥)、微藻、牛粪有机肥、微藻+牛粪有机肥4 种处理,在烟株生长关键期观测烟株农艺性状,测定土壤化学性质、烤后烟叶产量和化学成分,利用荧光定量PCR、Illumina Miseq测序等技术分析土壤细菌群落结构,揭示增施微藻和牛粪有机肥对植烟土壤化学性质、烟株生长、烟叶质量及土壤微生物群落结构的影响,以期为烟草产业绿色可持续发展提供科学依据。
1 材料与方法
1.1 试验地概况和试验材料
试验地位于湖南省张家界市桑植县龙潭坪镇(29°18′N,110°02′E),其土壤基本理化性质为:有机质含量22.36 g/kg,全氮含量1.27 g/kg,全磷含量0.60 g/kg,全钾含量24.84 g/kg,有效磷含量83.44 mg/kg,速效钾含量123.69 mg/kg,铵态氮含量37.41 mg/kg,硝态氮含量7.21 mg/kg,溶解性有机碳含量65.89 mg/kg,pH 值6.48。按照当地烟叶生产实际肥料需求,施氮量为120 kg/hm2,养分比例为N∶P2O5∶K2O=1∶1∶3。
供试烟草品种为K326,由张家界市烟草公司提供。微藻主要成分为固氮蓝藻、蛋白核小球藻和小单岐藻,有效活菌数为3×106 个/mL,由湖南省耕天下生物科技有限公司提供。牛粪有机肥主要成分为牛粪、谷糠、蘑菇菌渣等,有机质含量≥30%,N+P2O5+K2O 含量≥5%,由湖南神隆华绿肥业有限公司提供。
1.2 试验设计
试验共设置4 个处理: 常规施肥(CK); 增施微藻(M),由微藻原液1 mL 兑水稀释100 倍而成;增施牛粪有机肥(NF),施肥量为 3 000 kg/hm2;增施微藻+牛粪有机肥(MNF),微藻配制同M 处理,牛粪有机肥施肥量同NF 处理。微藻于烟苗移栽3 d 后穴施;牛粪有机肥与烟草专用肥混合后作基肥撒施,条施后起垄。试验采用完全随机区组设计,每个处理设置3 个重复,共12 个小区,每个小区7 垄,每垄17 株,株行距为1.2 m×0.5 m,其他生产技术措施和当地一致。
1.3 土壤采集
烟苗于2021 年5 月10 日移栽, 移栽前采集1 次土样作为起始对照(CK0),分别于7 月12 日(旺长期) 和8 月25 日(成熟期) 各取1 次土壤样品。每个小区采用抖根法收集5 株烟草根际土壤并充分混匀,去除土壤中的杂草、石块等杂质,一部分用于测定土壤化学性质,另一部分储存于−80 ℃ 冰箱中,用于分析土壤细菌群落。
1.4 测定方法
1.4.1 土壤化学性质的测定
土壤pH 采用电位法测定; 采用硫酸钾溶液浸提新鲜土壤,铵态氮和硝态氮含量采用AA3 流动注射分析仪测定;土壤溶解性有机碳含量采用可溶性有机碳分析仪测定;采用碳酸氢钠浸提有效磷,再采用AA3 流动注射分析仪测定其含量;采用醋酸铵浸提速效钾,再采用火焰光度计测定其含量[16]。
1.4.2 烤烟农艺性状调查
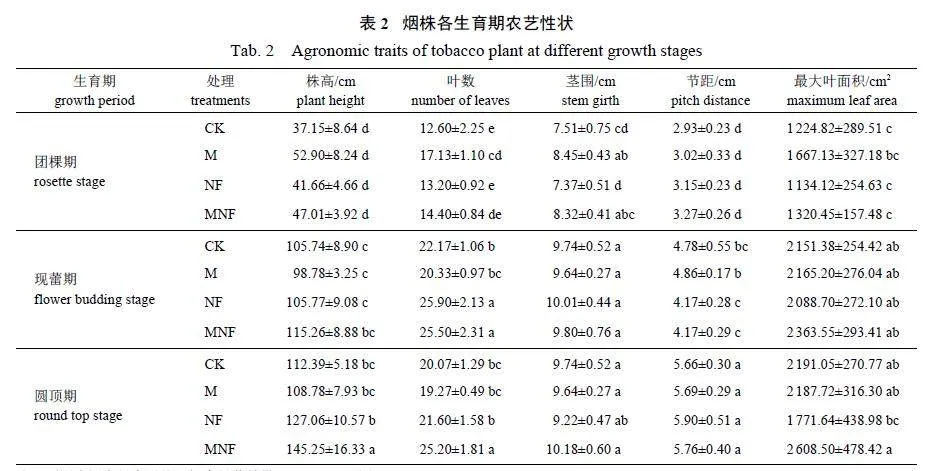
按照《烟草农艺性状调查测量方法》(YC/T142—2010)[17]调查烟草农艺性状,包括团棵期、现蕾期、圆顶期的株高、有效叶数、最大叶面积、茎围和节距。
1.4.3 烤后烟叶经济性状与化学成分
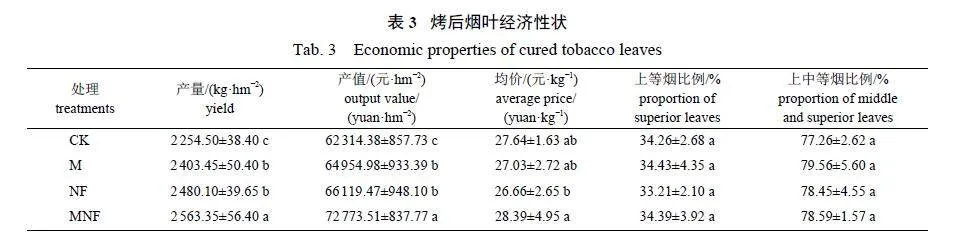
按照《烤烟》(GB 2635—1992)[18]对烤后烟叶进行分级,称量烤后烟叶各等级质量,计算上等烟、中等烟、下等烟的比例和产量,并按当年收购价计算产值。对烤后烟叶的化学成分进行分析,测定指标包括烟碱、总糖、还原糖、总氮、钾和氯含量,测定方法按照文献 [19] 进行,所测化学成分含量换算为百分率。
1.4.4 土壤细菌与青枯菌的荧光定量PCR
16S rRNA 基因定量采用1369F/1492R 通用引物(F: 5′-CGGTGAATACGTTCYCGG-3′; R: 5′-GGWTACCTTGTTACGACT-3′);青枯雷尔氏杆菌定量采用特异性引物(F:5′-GAACGCCAACGGTGCGAACT-3′;R:5′-GGCGCCTTCAGGGAGGTC-3′)[20]。PCR 反应体系均为10 μL,包括SYBRGreen II (Takara) 5 μL,10 μmol/L 上、下游引物各1 μL,DNA 模板1 μL,加RNase-Free ddH2O 补足体系。16S rRNA 的PCR 程序为:95 ℃ 预变性2 min;95 ℃ 变性5 s,58 ℃ 退火20 s,72 ℃ 延伸20 s,循环40 次;溶解曲线程序为:95 ℃ 15 s,60 ℃ 15 s 和95 ℃ 15 s。青枯雷尔氏杆菌的PCR程序为:95 ℃ 预变性2 min;95 ℃ 变性5 s,61 ℃退火20 s,72 ℃ 延伸20 s,循环40 次;溶解曲线程序为95 ℃ 15 s,60 ℃ 15 s 和95 ℃ 15 s。将含有目标基因片段的质粒以10 倍浓度梯度稀释,以制备标准曲线。扩增效率均在90%~110% 范围内,R2 均达到0.99。
1.4.5 土壤细菌群落结构分析
采用CTAB 法[21]提取土壤DNA,通过1% 琼脂糖凝胶电泳和紫外可见分光光度计(ND-1000,德国) 检测DNA 的质量和浓度;将DNA 样品送至上海美吉生物医药科技有限公司进行IlluminaMiseq 测序;上传测序原始数据至NCBI 的SRA数据库,登录号为PRJNA937210。
1.5 数据处理与统计分析
采用SPSS 20.0 对土壤化学性质、烟叶各项指标、土壤细菌和青枯菌的丰度及α 多样性指数进行单因素方差分析;采用Origin pro 2022 绘图;采用Canoco 5 对土壤细菌群落与土壤化学性质之间的关系进行典型对应分析。
2 结果与分析
2.1 土壤化学性质
增施微藻和牛粪有机肥能够提高土壤pH,增加或显著增加土壤硝态氮、溶解性有机碳、有效磷和速效钾含量(表1)。在烟株旺长期(7 月12日),NF 和MNF 处理的土壤pH 以及硝态氮、溶解性有机碳和速效钾含量均显著高于CK 处理,铵态氮含量则显著低于CK 处理。在烟株成熟期(8 月25 日),NF 处理的土壤pH 以及硝态氮、溶解性有机碳、有效磷和速效钾含量均显著高于CK 处理;MNF 处理的土壤硝态氮、溶解性有机碳、有效磷和速效钾含量均显著高于CK 处理。
2.2 烟株农艺性状
增施微藻和牛粪有机肥可促进烟株生长(表2)。烟株团棵期,M 处理的烟株叶数和茎围较CK 处理分别显著提高35.95% 和12.52%;烟株现蕾期,NF 和MNF 处理的烟株叶数较CK 处理分别显著提高16.82% 和16.38%;烟株圆顶期,MNF 处理的烟株叶数和株高显著高于其他处理,较CK 处理分别显著提高29.24% 和25.56%。
2.3 烤后烟叶经济性状与化学成分
增施微藻和牛粪有机肥可提高烟叶产量和产值(表3)。与CK 相比,M、NF 和MNF 处理的烟叶产量和产值均显著提高,产量分别提高6.61%、10.01% 和13.70%,产值分别提高4.24%、6.11%和16.78%,且以MNF 处理的产量与产值最高。
由图1 可知:与CK 处理相比,M 处理的烟叶还原糖含量、总糖含量和糖碱比显著增加;NF处理的烟叶总氮和烟碱含量显著增加,中部叶还原糖含量和氮碱比显著增加,上部叶氯含量显著增加但糖碱比显著减少;MNF 处理的烟叶总氮、钾、烟碱、还原糖和总糖含量以及钾氯比和氮碱比均显著增加,且各含量相对比较适中。
2.4 土壤细菌与青枯菌丰度
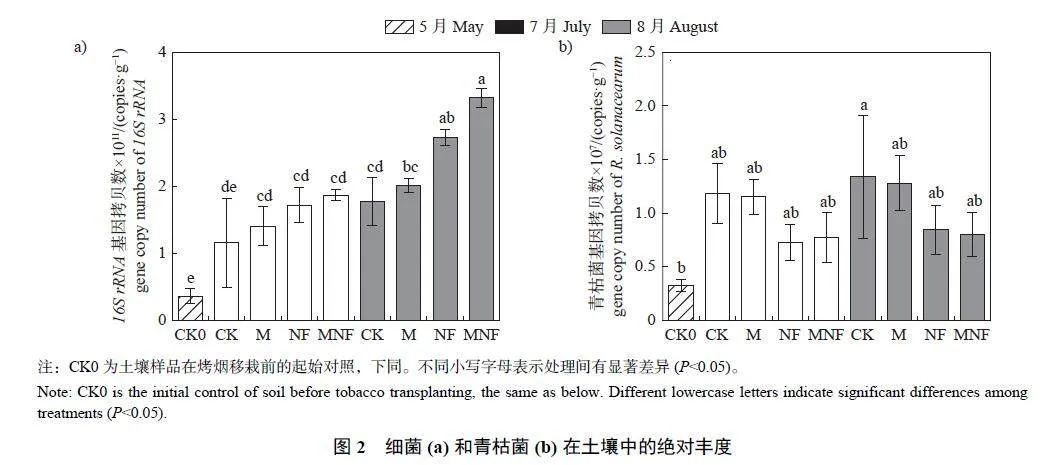
由图2 可知:增施微藻和牛粪有机肥可提高土壤中的细菌丰度,并抑制青枯菌丰度的增加。烟株成熟期(8 月),NF 和MNF 处理的细菌丰度显著高于CK 处理。从烟苗移栽(CK0) 到烟叶成熟,CK 处理的土壤青枯菌丰度显著增加,但NF 和MNF 处理的土壤青枯菌丰度增幅更小;与CK 处理相比,成熟期NF 和MNF 处理的土壤青枯菌丰度分别降低37.00% 和40.06%。
2.5 土壤细菌群落的多样性和组成
增施微藻和微藻+牛粪有机肥可提高土壤细菌多样性(图3)。M 处理和MNF 处理在旺长期和成熟期的Shannon 指数均显著高于CK 处理;各处理的Shannon 指数随时间呈上升趋势,但CK处理、M 处理和NF 处理均未达到显著差异水平,而MNF 处理Shannon 指数显著增加。各时期各处理间的Simpson 指数均无显著差异。
施入微藻和牛粪有机肥可显著影响细菌群落组成(图4)。门水平上,变形菌门(Proteobacteria)为各处理中土壤细菌群落最优势的门,其在各处理中的相对丰度均大于25%。与CK 处理相比,MNF 处理酸杆菌门(Acidobacteria) 的相对丰度显著降低;烟株旺长期,NF 处理和MNF 处理放线菌门(Actinobacteria) 的相对丰度显著增加。属水平上,鞘氨醇单胞菌属(Sphingomonas) 为各处理土壤细菌群落中最优势的属,其在CK 处理中的相对丰度随时间有所增加, 而在M 处理、NF 处理和MNF 处理中的相对丰度随时间有所下降。烟株成熟期,NF 处理和MNF 处理的芽孢杆菌属(Bacillus) 相对丰度显著高于CK 处理和M处理。
2.6 土壤细菌群落与土壤化学性质间的关系
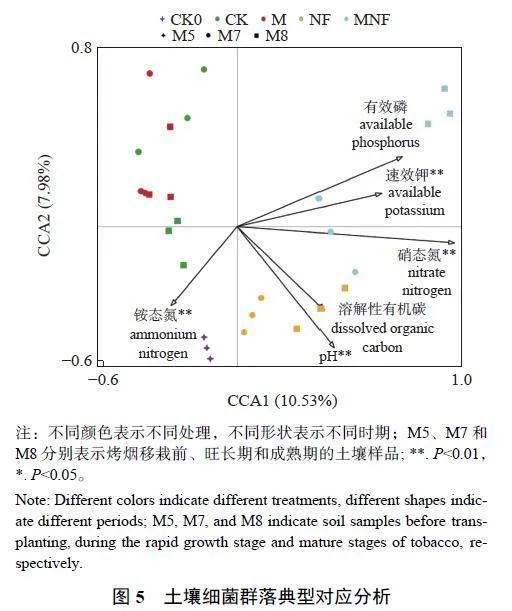
由图5 可知:增施牛粪有机肥和微藻+牛粪有机肥对土壤细菌群落结构的影响较大。M 处理与CK 处理土壤聚集在一起,而NF 处理和MNF处理分别与其他处理的土壤分离,表明差异较大。此外,土壤化学性质可显著影响土壤细菌群落结构。土壤pH 以及硝态氮和速效钾含量对土壤细菌群落结构有极显著影响(Plt;0.01),而铵态氮含量对土壤细菌群落结构有显著影响(Plt;0.05)。
3 讨论
3.1 增施微藻和牛粪有机肥对土壤性质的影响
微藻可提高土壤肥力和改善土壤微生态环境,如增加土壤有机质、氮、磷等养分含量及调节土壤pH 值,增强土壤团聚体稳定性等[22]。本研究中,与CK 相比,增施微藻对土壤氮、磷含量的改善未达到显著效果,其原因与土壤的性状和微生态环境以及微藻的施用量等因素有关。与CK 相比,增施牛粪有机肥可显著提高土壤pH、硝态氮、溶解性有机碳和速效钾含量,而铵态氮含量下降,这与郭龙等[6]的研究结果一致。增施微藻+牛粪有机肥可显著增加土壤溶解性有机碳、硝态氮、速效钾和有效磷的含量;与只增施牛粪有机肥相比,可显著增加土壤硝态氮、速效钾和有效磷的含量。其原因是牛粪有机肥施入可改善土壤质地及微生态环境,促进微藻等微生物的繁殖和活动,一方面促进微藻对土壤碳的同化和有机磷的矿化,另一方面加快牛粪有机肥养分释放和积累[9, 23]。
3.2 增施微藻和牛粪有机肥对烟株农艺性状、烤后烟叶产量和品质的影响
微藻可以合成和分泌多种活性物质,如生长素、细胞分裂素、赤霉素等,对促进植物生理代谢和生长调节发挥着重要作用[8]。已有研究表明:施用微藻可显著提高小麦和番茄的株高和产量[24],提升黄瓜可溶性总糖等营养品质[25]。本研究中,增施微藻可显著增加烟株在团棵期的叶数和茎围,提高烤后烟叶产量、总糖和还原糖含量以及糖碱比,其原因是烟株利用微藻合成和分泌的促生长活性物质刺激自身更快地代谢和发育,促进化学物质的合成和积累[26]。增施微藻+牛粪有机肥对促进烟株生长、提高烟叶产量以及协调化学成分的效果最好,其原因主要为:首先,牛粪含有丰富的氮、磷、钾等营养元素,可为烟株生长提供大量养分[5];其次,牛粪有机肥可以改善土壤质地,提高耕层土壤总孔隙度及持水能力等,优化烟株生长的微生态环境[7];第三,牛粪有机肥提供的营养元素以及对土壤微生态环境的改善也可促进微藻的繁殖和活性,不仅有利于微藻促生活性物质的分泌,也有利于牛粪有机肥养分的释放,进而促进烟株生长[27]。因此,增施微藻+牛粪有机肥能有效提高土壤有机质含量,调节土壤碳氮比值,改善土壤微生态环境,使土壤养分供应更加协调[28],更有利于烟叶对营养物质的吸收与转化,进而促进烟株生长,改善烟叶品质。
3.3 增施微藻和牛粪有机肥对土壤细菌群落的影响
土壤微生物是土壤微生态的重要组成部分,是驱动土壤养分循环的关键因子,对维持土壤质量、促进植物生长等具有重要作用。本研究表明:增施微藻+牛粪有机肥可显著提高土壤中细菌丰度,增加土壤细菌群落多样性,改变细菌群落结构,这与HU 等[29]的研究结果相似。微藻和牛粪有机肥施入土壤后,可通过调节土壤pH 值和提高土壤养分含量改善土壤团聚体结构[22],同时,微藻可释放类型多样的胞外物质(如糖类和氨基酸)[27]及自身细胞死亡后的有机物,而牛粪可影响这些代谢物的浓度[29],从而显著改善细菌栖息的土壤微生态环境和营养条件,促进细菌的生命活动,驱动土壤细菌群落的构建,促使土壤形成不同数量和种类的细菌群落[30]。在门水平上,施入微藻和牛粪有机肥可增加部分门的丰度,如芽单胞菌门、放线菌门和拟杆菌门。芽单胞菌门常见于营养丰富的土壤环境中,能将各种糖分子转化为维生素,促进烟草生长,也能产生抗菌物质,提高烟草抗逆能力[31]。放线菌门可通过分解土壤中植物有机残体、纤维素、木质素等改善土壤养分状况,有利于烟株对土壤养分的吸收利用,一些放线菌还可产生生长素促进烟株根系的生长发育,刺激根系分泌糖类、氨基酸等活性物质,为土壤细菌生长提供重要的营养及能量来源,进一步优化土壤微生态环境[32]。拟杆菌门生态适应性强,能够分泌多种胞外水解酶和碳水化合物活性酶,降解土壤中的复杂有机质,促进土壤养分的释放[33]。这些细菌门通过分泌多种酶或活性物质,提高土壤养分有效性,改善土壤性质,促进烟株对养分的吸收利用,从而促进烟草生长发育。但是,施入微藻和牛粪有机肥降低了酸杆菌门的相对丰度。酸杆菌门参与铁循环和光合作用等物质循环和生态环境构建过程,可以作为较贫瘠土壤环境的指标,其丰度越低,土壤质量越高[34],因此,增施微藻和牛粪有机肥改善了土壤质量。在属水平上,施入微藻和牛粪有机肥后增加了芽孢杆菌属的相对丰度。芽孢杆菌能通过产生胞外多聚物和有机酸等机制促进土壤矿物中钾和不溶性磷的释放,促进烟株对钾素和磷素的吸收和利用,进而提高烟叶产量[35]。土壤细菌群落结构与土壤环境因子关系密切,土壤pH、养分、水分和通气状况的改善都可能引起一些细菌群体快速繁衍成为优势群体,导致群落组成和结构发生变化[36]。在本研究中,土壤pH、硝态氮含量和速效钾含量可极显著影响土壤细菌的群落结构,是影响细菌群落的关键因子。土壤 pH 可通过影响细菌代谢酶活性及细胞膜稳定性,进而影响细菌对土壤养分的吸收利用能力,使土壤细菌群落结构发生改变[37]。烟草在生长过程中对氮素(尤其是硝态氮) 和钾素的需求较大,烟株从土壤中获取水分和养分的同时改变了土壤性质和土壤细菌群落结构,进而影响烟株自身和后续的生长[38]。本研究还发现:增施微藻和牛粪有机肥可降低青枯菌丰度,这可能是因为施用微藻和牛粪有机肥促进了拮抗青枯菌的益生菌群大量繁殖[39],如对青枯病菌具有显著抑制效果的芽孢杆菌属的相对丰度显著增加。芽孢杆菌是防控烟草青枯菌的有效拮抗菌,通过与病原体争夺营养和生存空间、分泌类植物激素和抗菌物质、诱导植物抗性等机制减少烟草青枯病发生[40]。
4 结论
增施微藻和牛粪有机肥可改善土壤pH,增加土壤硝态氮、溶解性有机碳、有效磷、速效钾等养分含量,提高土壤细菌群落多样性,有利于有益微生物如芽孢杆菌的富集,抑制土传病原菌青枯菌的数量,改善土壤微生态环境,从而促进烟株生长,提高烟叶的产量与品质。
[ 参考文献 ]
[1]肖志鹏, 刘勇军, 郭维, 等. 稻壳生物炭施用方式对土壤理化特性及烤烟产质量的影响[J]. 湖南农业科学,2023, 450(3): 40. DOI: 10.16498/j.cnki.hnnykx.2023.003.009.
[2]刘楚祺, 赵高坤, 邓小鹏, 等. 连作年限对植烟土壤养分和微生物量及胞外酶化学计量特征的影响[J]. 云南农业大学学报(自然科学), 2023, 38(3): 494. DOI: 10.12101/j.issn.1004-390X(n).202204038.
[3]肖和友, 朱伟, 王海军, 等. 连续施用不同生物质炭对植烟土壤特性和烤烟品质的影响[J]. 中国烟草科学,2021, 42(3): 19. DOI: 10.13496/j.issn.1007-5119.2021.03.004.
[4]王东飞, 肖飞, 张亚恒, 等. 不同有机肥对烤烟生长发育及产质量的影响[J]. 贵州农业科学, 2023, 51(2): 15.DOI: 10.3969/j.issn.1001-3601.2023.02.003.
[5]张涛, 刘勇鹏, 朱广权, 等. 定位化肥牛粪配施对设施蔬菜产量和土壤肥力的影响[J]. 中国土壤与肥料, 2021(1):161. DOI: 10.11838/sfsc.1673-6257.19591.
[6]郭龙, 李陈, 刘佩诗, 等. 牛粪有机肥替代化肥对茶叶产量、品质及茶园土壤肥力的影响[J]. 水土保持学报, 2021,35(6): 264. DOI: 10.13870/j.cnki.stbcxb.2021.06.036.
[7]何冬冬, 魏欣琪, 林紫婷, 等. 不同有机肥对植烟红壤真菌群落结构及功能的影响[J]. 植物营养与肥料学报,2020, 26(11): 2081. DOI: 10.11674/zwyf.20209.
[8]SONG X T, BO Y H, FENG Y Z, et al. Potential applicationsfor multifunctional microalgae in soil improvement[J].Frontiers in Environmental Science, 2022, 10: 1035332.DOI: 10.3389/fenvs.2022.1035332.
[9]SOLOMON W, MUTUM L, JANDA T, et al. Potentialbenefit of microalgae and their interaction with bacteriato sustainable crop production[J]. Plant Growth Regulation,2023, 101(1): 53. DOI: 10.1007/s10725-023-01019-8.
[10]邵继海, 陈杰锋, 胡婷. 林氏念珠藻对酸化稻田水稻产量和土壤细菌群落结构与功能的影响[J]. 河南师范大学学报(自然科学版), 2022, 50(6): 22. DOI: 10.16366/j.cnki.1000-2367.2022.06.004.
[11]ISLAM M R, JAHAN R, UDDIN S, et al. Lime and organicmanure amendment enhances crop productivity ofwheat-mungbean-T. Aman cropping pattern in acidic piedmontsoils[J]. Agronomy, 2021, 11(8): 1595. DOI: 10.3390/agronomy11081595.
[12]DINESHKUMAR R, SUBRAMANIAN J, GOPALSAMYJ, et al. The impact of using microalgae as biofertilizerin maize (Zea mays L.)[J]. Waste and Biomass Valorization,2019, 10(5): 1101. DOI: 10.1007/s12649-017-0123-7.
[13]RACHIDI F, BENHIMA R, SBABOU L, et al. Microalgaepolysaccharides bio-stimulating effect on tomato plants:growth and metabolic distribution[J]. BiotechnologyReports, 2020, 25: e00426. DOI: 10.1016/j.btre.2020.e00426.
[14]RENUKA N, PRASANNA R, SOOD A, et al. Wastewatergrown microalgal biomass as inoculants for improvingmicronutrient availability in wheat[J]. Rhizosphere,2017, 3: 150. DOI: 10.1016/j.rhisph.2017.04.005.
[15]沈银武, 刘永定, 吴国樵, 等. 蓝藻有机无机复混肥对几种作物的增效试验[J]. 水生生物学报, 2005, 29(4): 399.DOI: 10.3321/j.issn:1000-3207.2005.04.008.
[16]鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
[17] YC/T 142—2010. 烟草农艺性状调查测量方法[S].
[18] GB 2635—1992. 烤烟[S].
[19] 王瑞新. 烟草化学[M]. 北京: 中国农业出版社, 2003.
[20]WANG X F, WEI Z, YANG K M, et al. Phage combinationtherapies for bacterial wilt disease in tomato[J]. NatureBiotechnology, 2019, 37(12): 1513. DOI: 10.1038/s41587-019-0328-3.
[21]蔡刘体, 胡重怡, 罗正友. SDS-CTAB法提取烟草病圃土壤微生物总DNA[J]. 江西农业学报, 2011, 23(2): 119.DOI: 10.19386/j.cnki.jxnyxb.2011.02.038.
[22]REDMILE-GORDON M, GREGORY A S, WHITE R P,et al. Soil organic carbon, extracellular polymeric substances(EPS), and soil structural stability as affected byprevious and current land-use[J]. Geoderma, 2020, 363:114143. DOI: 10.1016/j.geoderma.2019.114143.
[23]ALVAREZ A L, WEYERS S L, GOEMANN H M, et al.Microalgae, soil and plants: a critical review of microalgaeas renewable resources for agriculture[J]. Algal Research-Biomass Biofuels and Bioproducts, 2021, 54(5):102200. DOI: 10.1016/j.algal.2021.102200.
[24]邱智超, 勾宇春, 张志鹏, 等. 藻类资源在农业种植业中的应用研究进展[J]. 农业资源与环境学报, 2023, 40(4):840. DOI: 10.13254/j.jare.2022.0563.
[25]蒋龙刚, 王丽英, 任燕利, 等. 微藻用量对滴灌日光温室番茄/黄瓜土壤质量、产量及品质的影响[J]. 北方园艺, 2022(20): 48. DOI: 10.11937/bfyy.20221328.
[26]边建文, 崔岩, 杨宋琪, 等. 微藻生物肥料的农业应用研究进展[J]. 中国土壤与肥料, 2020(5): 1. DOI: 10.11838/sfsc.1673-6257.19290.
[27]WU W Y, KE T, ZHOU X J, et al. Synergistic remediationof copper mine tailing sand by microalgae andfungi[J]. Applied Soil Ecology, 2022, 175: 104453. DOI:10.1016/j.apsoil.2022.104453.
[28]张广雨, 褚德朋, 刘元德, 等. 生物炭及海藻肥对烟草生长、土壤性状及青枯病发生的影响[J]. 中国烟草科学,2019, 40(5): 15. DOI: 10.13496/j.issn.1007-5119.2019.05.003.
[29]HU J J, GUO H C, XUE Y Y, et al. Using a mixture ofmicroalgae, biochar, and organic manure to increase the capacity of soil to act as carbon sink[J]. Journal of Soilsand Sediments, 2019, 19(11): 3718. DOI: 10.1007/s11368-019-02337-z.
[30]YODER N, DAVIS J G. Organic fertilizer comparisonon growth and nutrient content of three kale cultivars[J].HortTechnology, 2020, 30(2): 176. DOI: 10.21273/HORTTECH04483-19.
[31]LI Q J, ZHANG D Q, SONG Z X, et al. Organic fertilizeractivates soil beneficial microorganisms to promotestrawberry growth and soil health after fumigation[J]. EnvironmentalPollution, 2022, 295(7): 118653. DOI: 10.1016/j.envpol.2021.118653.
[32]ZHANG Y, SHANGGUAN Z P. Long-term N additionaccelerated organic carbon mineralization in aggregatesby shifting microbial community composition[J]. Agriculture,Ecosystems amp; Environment, 2023, 342(1): 108249.DOI: 10.1016/j.agee.2022.108249.
[33]GUO H H, GU J, WANG X J, et al. Beneficial effects ofbacterial agent/bentonite on nitrogen transformation andmicrobial community dynamics during aerobic compostingof pig manure[J]. Bioresource Technology, 2020,298(12): 122384. DOI: 10.1016/j.biortech.2019.122384.
[34]姜伟, 白红梅, 薛国萍, 等. 基于高通量测序的设施连作果类菜根际土壤细菌群落结构和多样性分析[J]. 华北农学报, 2021, 36(4): 82. DOI: 10.7668/hbnxb.20192021.
[35]林斌, 黄菊青, 官雪芳, 等. 解淀粉芽孢杆菌液体肥在茶叶上的应用研究[J]. 福建农业学报, 2019, 34(10): 1173.DOI: 10.19303/j.issn.1008-0384.2019.10.009.
[36]陈懿, 吴春, 李彩斌, 等. 炭基肥对植烟黄壤细菌、真菌群落结构和多样性的影响[J]. 微生物学报, 2020, 60(4):653. DOI: 10.13343/j.cnki.wsxb.20190258.
[37]李梦菡, 张丽平, 李鑫, 等. 茶园土壤微生物量碳的质量分数及其影响因素的研究[J]. 中国土壤与肥料, 2021(1):26. DOI: 10.11838/sfsc.1673-6257.19587.
[38]黄锦文, 李日坤, 陈志诚, 等. 不同稻草还田技术对烟—稻轮作系统土壤养分、有机碳及微生物多样性的影响[J]. 中国水稻科学, 2023, 37(4): 415. DOI: 10.16819/j.1001-7216.2023.220901.
[39]MESSIHA N A S, VAN BRUGGEN A H C, FRANZ E,et al. Effects of soil type, management type and soilamendments on the survival of the potato brown rot bacteriumRalstonia solanacearum[J]. Applied Soil Ecology,2009, 43(2/3): 206. DOI: 10.1016/j.apsoil.2009.07.008.
[40]冯印印, 李斌, 杨洋, 等. 烟草青枯病菌拮抗细菌的筛选、鉴定和抑菌机制研究[J]. 中国生物防治学报, 2021,37(2): 331. DOI: 10.16409/j.cnki.2095-039x.2021.02.008.
责任编辑:何謦成
基金项目:湖南省自然科学基金面上项目(2022JJ30647);湖南创新型省份建设专项经费(2021NK2028) ;湖南省烟草公司张家界市公司项目(202103);湖南中烟工业有限责任公司项目(KY2020JD0010)。

