铁皮石斛miR168分子进化特征及响应蓝激光表达分析
李宇晴 姚燕婷 王雅倩 孙刚 赖钟雄 李汉生


doi:10.7606/j.issn.1004-1389.2024.07.016
https://doi.org/10.7606/j.issn.1004-1389.2024.07.016
收稿日期:2022-09-12 修回日期:2023-11-06
基金项目:2020年福建省科技厅自然科学基金面上项目(2020J01377);观赏竹的规模化栽培育种(B17000208);2023年福建省科技特派员。
第一作者:李宇晴,本科生,从事植物生物技术研究。E-mail:3476155755@qq.com
通信作者:李汉生,博士,副教授,主要从事植物生物技术研究。E-mail:1456505560@qq.com
摘 要 笔者在关于铁皮石斛miRNA组学研究中发现较多响应蓝激光的miRNA,挑选关键且差异表达的miR168进行分子进化特征及其响应蓝激光表达分析。经对前体和成熟体分类统计、进化树构建、靶基因预测、启动子顺示作用元件及响应不同光质表达等进行分析,结果显示:miR168家族成员分布在40个植物物种中,前体和成熟体成员较少,其在植物中可能进化得不够完整;物种特异性是影响miR168前体进化特性的重要因素,而序列保守性是影响成熟体进化特性的主要因素;由3p臂上形成的miR168成熟体序列有较高特异性、5p臂形成的成熟体的序列保守性较高;Mfold和Rfam预测表明铁皮石斛miR168茎序列的保守性高于环序列,前体发卡结构较多,成熟体位置位于3p臂上,既包含茎序列也包含环序列;铁皮石斛miR168a的启动子主要包括光、激素、生物和非生物胁迫响应元件,可能通过这些顺式元件在其响应蓝激光中起调控作用;铁皮石斛响应蓝激光的靶基因主要包括ABC转运蛋白B家族成员、乙酰辅酶 A 乙酰转移酶等,主要参与植物生长发育和响应外界因素。实时荧光定量PCR结果表明,铁皮石斛miR168a与其靶基因gene-MA16_Dca006149、gene-MA16_Dca020995、gene-MA16_Dca017821参与蓝激光对铁皮石斛的影响。
关键词 铁皮石斛;miR168;进化特性;激光;实时荧光定量PCR
铁皮石斛(Dendrobium officinale Kimura et Migo)为兰科石斛属草本药用植物,具有生津、润肺、排毒,增强免疫力等功效[1]。现代化学和药理研究表明铁皮石斛的主要功能性代谢产物为多糖、黄酮类、联苄类和生物碱等[2]。
研究人员已通过不同方法提高铁皮石斛功能性代谢产物含量,而光调控是最有效方法之一。不同 LED 光照模式对铁皮石斛原球茎多糖积累的研究中,发现红蓝混合光对多糖积累的促进作用最为明显,其中以红光∶蓝光=1∶3 的多糖产量最髙[3]。在不同光质对铁皮石斛的研究中发现 15 d内单色蓝光有利于生物碱含量增加,30 d内单色黄光有利于生物碱含量增加,30 d后红蓝光比例为2∶3的处理更有利于生物碱含量增加[4]。
关于激光光源对植物功能性代谢产物的研究鲜有报道。激光是在发光机理上完全不同于普通光源,具有很好的单色性,不仅能有效解决普通光源存在问题,而且可能对植物生长发育具有新的作用机制。大量研究发现,激光光源预处理种子可显著提高多种植物的生长发育和代谢进程。例如,当使用 4.0×10-3J/(cm2·s)激光处理白羽扇豆和蚕豆后,120 h 后发现种子细胞中淀粉分解酶的活力值达到最大值,种子 IAA 含量提升,下胚轴伸长加快,鲜重和根长增加[5]。Gao等[6]的研究发现,He-Ne 激光能够加速植物生长发育,可能因为通过激活植物细胞内源一氧化氮(NO)信号分子和钙信号的合成和释放,进而介导胞内发生一系列信号级联反应途径而发生的。
笔者在关于铁皮石斛组培苗响应不同光质(白光、蓝光和蓝激光)的miRNA组学(PRJCA006154)研究中发现较多响应激光的miRNA,挑选关键且差异表达的miR168进行分子进化特征及其响应蓝激光表达分析。miRNA是一类内源小分子非编码单链RNA,长度在 19~25 nt。其不含开放阅读框,不能编码蛋白质,在动植物体内通过mRNA直接剪切或抑制功能蛋白翻译负调控靶基因[7-8]。miR168为植物特有的长约21 nt的miRNA家族,其在不同物种间具有高度的保守性[9]。miR168的功能在植物的生长发育调控中起到重要作用,例如,拟南芥miR168a参与AGO1转录后基因沉默,当AGO1在拟南芥中超表达时,即突变体AGO1不受 miR168a 调控,过量表达的AGO1会造成植株生长发育严重缺陷;当AGO1抑制表达时,miR168a将无法降解靶基因mRNA的功能,导致miR168a的降解[10]。miR168还能够参与诸多植物的非生物胁迫响应过程。miR168b可能参与玉米植物响应干旱胁迫反应和甜杨植株响应低温胁迫反应[11-12]。TEV (Tobacco etch virus,烟草腐蚀病毒)、CrTMV (Crucifer-infecting tobacco mosaic virus,烟草花叶病毒)等植物病毒可以诱导miR168 的表达水平升高[13]。此外,研究发现miR168与植物光周期、干旱胁迫、ABA 诱导、低氮胁迫等都密切相关[14-17]。
综上所述,植物miR168的功能具有多样性,而有关铁皮石斛miR168的研究尚未见报道。本研究通过分析铁皮石斛和miRBase数据库已登录植物miR168家族的进化特性差异,以期为铁皮石斛miR168家族功能研究提供理论基础。在此基础上还对铁皮石斛miR168和靶基因在激光的表达分析,进一步了解miR168在铁皮石斛响应蓝激光过程中的作用。
1 材料与方法
1.1 植物材料
所用组培苗为具有 3~4片真叶,叶宽约 2~3 mm,苗高约2 cm的铁皮石斛。保证蓝激光(450 nm)、蓝光(450 nm)、白光、总光强[100 μmol/(m2·s)]、光照时间(12 h/d)、湿度55%~60%和温度(25±2) ℃等相同的条件上,将铁皮石斛组培苗置于光照培养箱处理60 d。铁皮石斛继代培养基配方为1/2MS+ +30.0 g/L蔗糖+ 6 g/L琼脂+ 1 g/L活性炭+50 g/L香蕉泥(pH为5.8)。光照处理的培养基配方为1/2MS+ +30.0 g/L蔗糖+ 6 g/L琼脂+ 1 g/L活性炭(pH为5.8)。现以白光为对照组,试验组为蓝光、蓝激光。对照组和处理组的植株经液氮速冻保存于-80 ℃冰箱,用于核酸提取、高通量测序等测定。
1.2 植物miR168家族成员的物种分布
通过miRbase最新数据库(https://www.mirbase.org/)下载已登录的miR168的前体和成熟体序列,获得拟南芥(Arabidopsis thaliana)、琴叶拟南芥(Arabidopsis lyrata)、油菜(Brassica napus)、蒺藜苜蓿(Medicago truncatula)、芜菁(Brassica rapa)、水稻(Oryza sativa)、高粱(Sorghum bicolor)、玉米(Zea mays)、二穗短柄草(Brachypodium distachyon)、大豆(Glycine max)、豇豆(Vigna unguiculata)、大叶相思(Acacia auriculiformis)、木薯(Manihot esculenta)、蓖麻(Ricinus communis)、番茄(Solanum lycopersicum)等35个物种的61个miR168前体序列和48个miR168成熟体序列,了解miR168在不同物种之间的分布规律及其特征。
1.3 植物miR168家族成员进化树构建
通过MEGA 7.0软件[18]且参照李汉生等[19]的方法,构建植物miR168的前体和成熟体序列进行系统进化树。
1.4 植物miR168家族成员序列分析
通过DNAMAN 软件比对植物miR168成熟体序列。
1.5 植物miR168前体序列分析及其二级结构预测
通过Rfam 12.0在线软件[20] (http://rfam.xfam.org/)对植物miR168家族成员二级结构保守性进行分析。通过Mfold 3.5在线软件[21](http://unafold.rna.albany.edu/?q=mfold)对植物miR168预测前体二级结构及其分析成熟体 位置。
1.6 植物miR168家族成员的靶基因预测
植物miR168家族成员的靶基因预测和分析采用psRNATarget在线软件(http://plantgrn.noble.org/v1_psRNATarget/)[22]。
1.7 实时荧光定量PCR
通过TriPure试剂盒(Invitrogen,中国)对激光处理的铁皮石斛嫩叶进行总RNA的提取。选取凝胶电泳显示其完整性良好,且紫外分光光度计检测OD260/280值为1.8~2.0的RNA备用。铁皮石斛总RNA采用SYBR ExScriptTM(Takara,日本)进行逆转录。基于铁皮石斛基因组[23]和转录组数据库(PRJCA006154)的基础上,通过Li等[24]描述的方法进行相对miRNAs和靶基因的表达水平分析。miRNA的内参为5.8 s rRNA,靶基因的内参为ACTIN,相对表达水平的测定采用比较2-ΔΔCt方法。相关引物信息见 表1。
1.8 数据分析
铁皮石斛miRNA和靶基因表达量结果至少3个生物学重复。采用SPSS V 19.0单因素方差分析(ANOVA)的DTncan测试法,分析铁皮石斛响应不同光照处理的表达量。制图采用GraphPad Prism 6.0软件和Omic share在线 软件。
2 结果与分析
2.1 植物miR168家族前体和成熟体分布
植物miR168家族成员分布情况见表2。miRBase最新数据库中发现40个物种存在miR168,39个物种属于被子植物,其中包括兰科(1种)、葡萄科(1种)、茄科(2种)、蔷薇科(3种)、芸香科(3种)、豆科(5种)、十字花科(10种)等;仅1个物种为裸子植物,主要包括松科(1种);被子植物的数量远多于裸子植物。不同植物miR168家族前体和成熟体数量也存在较大差异,其中被子植物的芜菁成熟体最多为6个,被子植物的烟草前体最多为5个,以上两种为分布最多最全的物种,推测miR168在植物中可能进化得不够完整。
miRBase已登录植物miR168家族的86个前体和63个成熟体中,前体长度分布范围为86 nt~358 nt,成熟体长度分布范围在19 nt~ 24 nt,其长度具有较大差异,推测植物miR168存在复杂的形成机制,而最重要的因素之一为物种特异性。拟南芥、琴叶拟南芥、芜菁、玉米、番茄、毛果杨及鹦哥凤梨的2个miR168前体,水稻、二穗短柄草、百脉根、野草莓、大麦、节节麦、甜橙及蓝花耧斗菜的1个miR168前体都在3p和5p臂上形成成熟体;有25个miR168成熟体没有区分3p或5p臂。本研究发现已登录的植物miR168成员中有23条5p臂和24条3p臂上的成熟体 序列。
2.2 植物miR168家族成员前体及成熟体进化特性
为了解植物miR168家族成员进化特点,本研究通过MEGA 7.0软件对植物miR168家族成员的86个前体和63个成熟体序列进行系统进化树构建(图1和图2)。
大部分植物miR168家族成员前体有着科内物种聚集更近的现象,例如被子植物的十字花科、豆科、禾本科(图1)。小部分植物miR168家族成员前体比较分散,分别位于不同的小分支上 (图1)。此外,笔者还发现松科植物欧洲云杉pad-miR168b和豆科大叶相思aaT-miR168单独聚在一支,而pad-miR168a和菊科刺苞菜蓟 cca-miR168a聚在一支,禾本科水稻osa-miR168b和毛茛科蓝花耧斗菜aqc-miR168单独聚在一支,而osa-miR168a单独聚在一支,可能除物种亲缘关系外,还有其他因素影响着miR168的进化,或者这类miRNA存在不同功能(图1)。因此,物 种亲缘关系是影响植物miR168家族成员前体进化特性的重要因素之一,但是也存在其他影响 因素。
根据进化树聚集性将植物miR168成熟体划分为两大枝,来自5p臂和3p臂的miR168-5p成熟体都分布聚在不同大枝上(图2)。此外,聚类分析结果表明植物miR168家族成员的成熟体进化特性与物种特异性存在紧密联系。
2.3 铁皮石斛miR168前体和成熟体进化分析
2.3.1 铁皮石斛miR168前体进化分析 为进一步了解铁皮石斛miR168的进化特性相关规律,选取兰科、豆科、十字花科、松科、禾本科的miR168前体和成熟体序列进行系统进化树构建(图3和图4)。
从图3进化树分析可知,miR168前体序列分支较多,包括两个较大的分支,两大分支主要成员多为十字花科和豆科,但是物种聚集程度总体比较分散。铁皮石斛miR168的前体单独为一个分支,与芜菁的bra-miR168a亲缘关系最近。
2.3.2 铁皮石斛与其他4个物种miR168成熟体进化分析 从图4进化树分析可知,植物miR168进化树发现兰科、松科、禾本科、豆科、十字花科植物共计43个成熟体可分为4大分支,物种聚集程度比较集中。从上往下分别命名为第一到第四分支。不同物种的5p臂miR168主要分布于第一和第二个小分支;而3p臂miR168主要聚在第三和第四分支,铁皮石斛miR168位于第四分支,与十字花科的ath-miR168b-3p、豆科的lja-miR168-3p亲缘性很近。
2.4 铁皮石斛miR168成熟体序列分析
为了解植物miR168家族成员成熟体的分子特性,通过DNAMAN软件对植物miR168-3p成熟体、miR168-5p成熟体以及其他成熟体序列(去除3p、5p臂上的miR168成熟体)进行多序列比对分析(图5)。
从图5-A分析结果发现所有物种miR168-5p成员的序列的保守性都很高。从图5-B可以看出,多数物种miR168-3p家族成员成熟体的序列保守性较高,少数保守性较低,例如,水稻的osa-miR168-3p和hvt-miR168-3p。
从图5-C可以看出,将无区分3p和5p臂的植物miR168成熟体序列比对分析,多数植物miR168家族成员成熟体的序列保守性较高,除个别植物中若干个碱基存在差异,例如,亚麻荠cas-miR168、大叶相思aat-miR168、蓝花耧斗菜aqc-miR168等。这类少数保守性低的成员分布在不同的门、目、科,无规律性可寻,导致序列特异性原因以及序列差异引起功能差异,还有待今后深入研究。结合图2分析结果可见,序列保守性是影响成熟体进化特性的重要因素。
2.5 铁皮石斛miR168二级结构特点
通过Rfam 12.0软件进行在线分析,进一步探讨植物miR168家族成员前体序列的保守程度(图6)。铁皮石斛miR168前体3p臂与5p臂上的序列保守性较为一致;miR168家族能够形成典型的茎环结构,并且茎序列的保守性高于环 序列。
2.6 铁皮石斛miR168前体二级茎状结构及生成成熟体特征分析
通过Mfold在线软件预测植物miR168前体序列的二级茎状结构,主要包括被子植物的拟南芥、烟草、铁皮石斛及裸子植物的欧洲云杉,如图7所示。植物miR168前体可以形成典型的发卡结构,每个前体可形成8~13个不等的环状结构,其中铁皮石斛miR168发卡结构较多。其结构最小自由能(△G)分别为ath-miR168a-3p (-281.16 kJ/mol)、ath-miR168a-5p (-187.02 kJ/mol)、ath-miR168b-3p(-281.16 kJ/mol)、nta-miR168c-3p(-463.38 kJ/mol)、pab-miR168a-3p(-242.25 kJ/mol)、do-miR168a-3p(-406.64 kJ/mol)。植物miR168成熟体形成的位置在3p臂或5p臂上,成熟体序列有的只包含茎序列,有的包含部分环序列。而铁皮石斛miR168成熟体位置位于5p臂上。
2.7 植物miR168家族成员的靶基因预测与分析
为了解植物miR168家族成员的靶基因功能,挑选被子植物的铁皮石斛、大豆、甘蔗、拟南芥、玉米、水稻的miR168家族成员成熟体共15条,包括miR168、miR168a、miR168b、成员以及不同成员的miR168-5p、miR168-3p预测靶基因功能,具体见表3。
从表3分析结果看出,miR168抑制靶基因的方式主要包括裂解和翻译抑制。从靶基因的数量上来看,不同物种miR168的靶基因数在2至19个之间。同一物种不同miR168家族成员的靶基因可能完全相同,例如ath-miR168a-5p与ath-miR168b-5p、zma-miR168a-5p与zma-miR168b-5p的靶基因完全相同。此外,同物种同miR168成员不同臂上形成的成熟体的靶基因却可能完全不同,如ath-miR168a-5p与ath-miR168a-3p、ath-miR168b-5p与ath-miR168b-3p、osa-miR168a-5p与osa-miR168a-3p、zma-miR168a-5p与zma-miR168a-3p、zma-miR168b-5p与zma-miR168b-3p的靶基因完全不同。从靶基因注释来看,不同
物种miR168靶基因功能各不相同。拟南芥miR168靶基因注释主要包括多核苷酸转移酶(polyntcleotidyl transferase)、 SET 域的蛋白质赖氨酸甲基转移酶家族蛋白质(SET-domain containing protein lysine methyltransferase family protein)。水稻miR168靶基因注释主要包括含有蛋白激酶结构域的蛋白质(protein kinase domain containing protein)、反转录转座子蛋白(retrotransposon protein)。铁皮石斛miR168靶基因功能主要注释包括ABC转运蛋白B家族成员、细胞色素P450、乙酰辅酶A乙酰转移酶、DNA拓扑异构酶III等,功能分别为防御机制,次级代谢物的生物合成,脂质运输和代谢,复制、重组和修复等。
2.8 铁皮石斛miR168启动子顺式作用元件预测分析
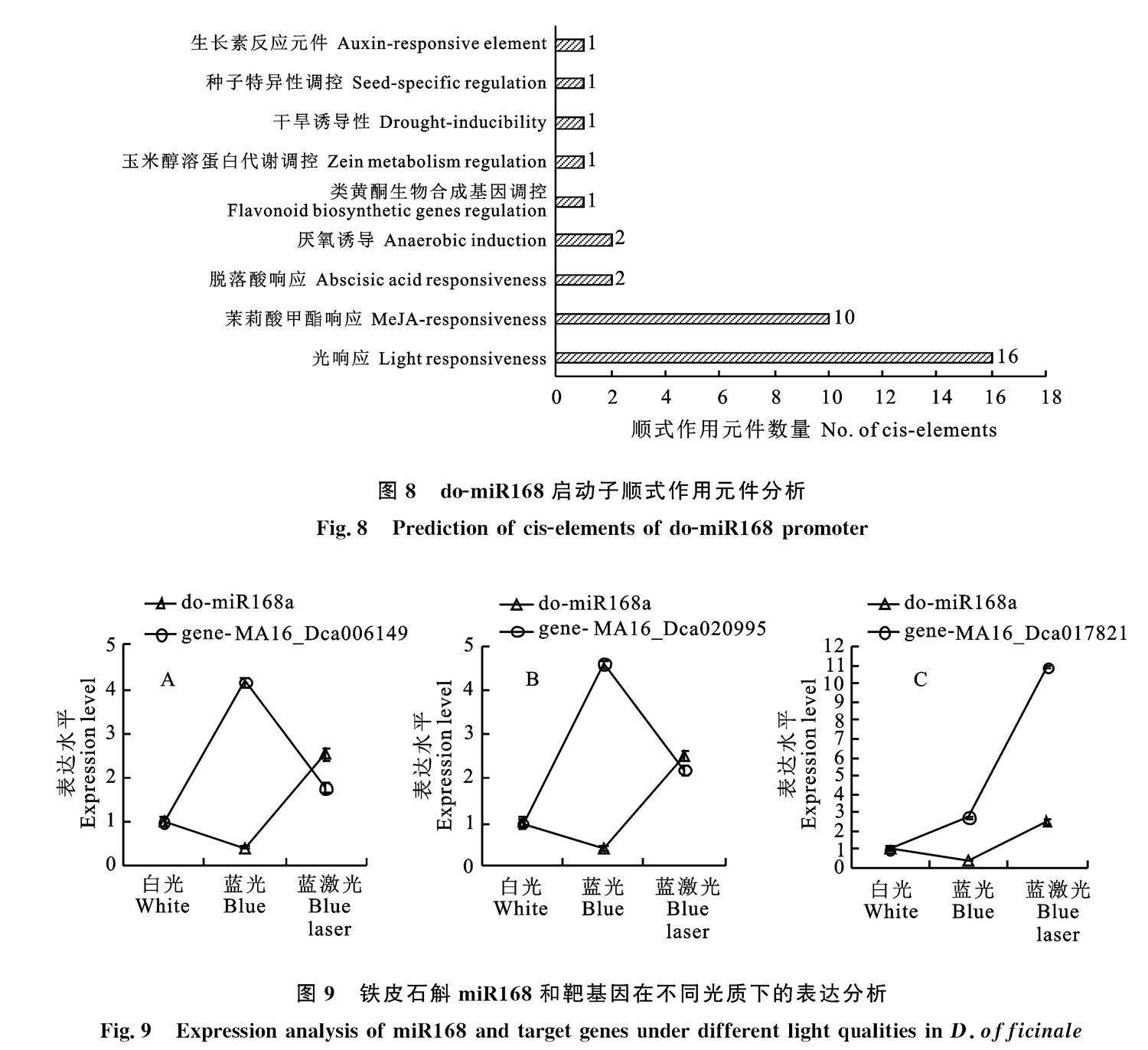
基于do-miR168a序列,结合铁皮石斛基因组数据,通过BDGP 软件预测其转录起始位点,从而确定启动子序列。通过plantcare在线软件预测其启动子顺式作用元件,结果如图8所示。
铁皮石斛do-miR168a的启动顺式作用元件中,最多为光响应元件(16个);其次激素响应元件:茉莉酸甲酯(10个)、脱落酸(2个)、生长素(1个);还含有厌氧诱导元件(2个)、类黄酮生物合成调控元件(1个)、干旱诱导元件(1个)、玉米蛋白代谢调节元件(1个)、种子特异性调控元件(1个)。推测do-miR168在植物响应光照、激素时起到重要调控作用。
2.9 铁皮石斛miR168响应激光的表达分析
铁皮石斛miR168a和靶基因在白光、蓝光、蓝激光的qPCR结果如图9所示。所选3个靶基因gene-MA16_Dca017821 (乙酰辅酶A乙酰转移酶,putative acetyl-CoA acetyltransferase)、gene-MA16_Dca006149 (ABC转运蛋白B家族,ABC transporter B family member 20)、gene-MA16_Dca020995 (细胞色素P450,cytochrome P450 89A2-like)在铁皮石斛生长和代谢中具有重要调控作用。do-miR168a与gene-MA16_Dca01782的表达量趋势在蓝激光处理未呈现负相关,推测靶基因gene-MA16_Dca017821可能存在其他miRNA同时调控,从而实现靶基因转录水平调控。do-miR168a与靶基因gene-MA16_Dca006149、gene-MA16_Dca020995的表达量趋势呈现负相关,表明do-miR168a可能通过负调控靶基因,参与到蓝激光调控铁皮石斛的生长和代谢。以上调控机制有待遗传转化进一步验证。
3 讨 论
3.1 铁皮石斛miR168家族成员的进化特点
本研究表明,植物miR168家族的40个物种中包含86个前体序列和63个成熟体序列,其多数为被子植物,少数为裸子植物。植物miR168家族成员成熟体序列比对分析结果再次证明了miR168家族在植物中的保守性。
从铁皮石斛miR168家族成员前体和成熟体的进化特性分析结果看出,其前体进化特性影响的重要因素为物种亲缘性,而物种亲缘性对成熟体进化特性影响不大[25]。从铁皮石斛miR168家族成员成熟体进化树分析看出,5p臂或3p臂形成的成熟体都分别聚在一支。本研究还发现
5P臂的成熟体序列保守性较高,这与王艳芳等[26](miR171)、刘炜婳等[27](miR172)和翟俊淼等[28](miR396)研究结果相同,表明植物miR168成熟体聚类的主要因素为序列的保守性,其次才是物种差异性。以上观点符合科内物种的miR168(图3)以及种间物种miR168(图4)家族成员的前体和成熟体的进化特性分析结果,同时植物miR168成员成熟体序列分析结果也证明该观点。此外,本研究还发现植物miR168前体进化树分支较多,可以推测miR168家族来源于古老的祖先,并且经历了串联重复、片段重复、反向重复、随机起源等进化方式的更迭以及长期复杂的进化演变过程[19,29]。
植物miR168的86个前体序列长度具有较大差异,长度范围在86 nt~358 nt,物种特异性明显。而植物miR168的63个成熟体序列长度范围为在19 nt~24 nt,具有较强的保守性,表明其在进化上特异性和保守性并存。miR168家族成员成熟体序列分析结果也进一步说明了miR168家族成员的保守性。植物miR168的63个成熟体分布在39个物种中,分别有23条来自5p臂和24条来自3p臂。二级结构保守性分析结果表明5p臂形成的成熟体的保守性高于3p臂。此外,相关研究已经表明序列差异会引起基因功能差异,而植物miR168同一物种同一成员不同臂上形成的成熟体是否会引起功能不同还需进一步研究[30]。
3.2 铁皮石斛miR168在蓝激光响应过程中的作用
通过植物miR168家族成员靶基因预测结果表明(表3),不同物种miR168的靶基因数量不同(2~19个);同物种不同miR168家族成员的靶基因完全或者部分相同;同物种相同miR168家族成员不同臂上形成的成熟体的靶基因却可能完全不同。以上结论可能是因为3p臂上的序列特异性较强,5p臂上的序列具有较高保守性,而miRNA与靶基因需要高度互补才可以对靶基因起到作用。序列特异的3p臂上形成的miR168成熟体与序列较保守的5p臂上形成的成熟体很可能引起靶基因的差异。
植物miR168具有多种生物学功能,不同物种miR168靶基因的功能不同,其靶基因注释主要包括多核苷酸转移酶、SET 域的蛋白质赖氨酸甲基转移酶家族蛋白质、蛋白激酶结构域的蛋白质等,以上基因作为miR168的保守性靶基因,已被广泛研究报道[9]。而通过psRNATarget在线软件预测铁皮石斛miR168a的靶基因,发现靶基因gene-MA16_Dca006149,gene-MA16_Dca020995,gene-MA16_Dca017821注释分别为ABC转运蛋白B家族、细胞色素P450、乙酰辅酶A乙酰转移酶。
ABC转运蛋白B家族是一类广泛存在于植物中的跨膜转运蛋白,在植物次生代谢物质的转运与积累、激素运输、脂质代谢、抵抗生物和非生物胁迫等方面起着关键作用[31]。本研究发现光照培养下,铁皮石斛miR168a与靶基因gene-MA16_Dca006149的表达量基本呈负相关,推测miR168可能通过负调控靶基因参与蓝激光对铁皮石斛细胞信号转导的影响。
细胞色素P450广泛参与植物次生代谢调控,主要涉及植物激素、苯丙素类、生物碱类、萜类、甾醇类、脂肪酸、色素等的合成及代谢[32-33]。铁皮石斛响应激光过程中,此类次生代谢产物的提升,有利于提高应对外界因素的能力。推测铁皮石斛miR168可能通过调控靶基因gene-MA16_Dca020995参与蓝激光对铁皮石斛的影响。
乙酰辅酶A乙酰转移酶主要功能为脂质运输和代谢调控,而植物角质层是形成于表皮细胞壁外表面的脂质保水层。角质层通常由角质和蜡质组成,角质是角质层的主要结构成分,其主要组分是聚酯,蜡质成分主要是黄酮类、三萜类物质以及极长链饱和脂肪酸及其衍生物。相关研究表明植物表皮蜡质对紫外线辐射和可见光都有反射作用,且蜡质对紫外线辐射的反射作用比可见光更强[34]。研究人员利用玉米的蜡质缺失突变体研究叶片表皮蜡质在抵抗紫外线的作用。与正常植株相比,表皮蜡质缺失的玉米受紫外线伤害程度明显更大,植物表型和遗传均受到显著影响。与表皮蜡质较少的叶片相比,蜡质较多的叶片能够吸收更多紫外线,降低植物体的损伤[35]。推测铁皮石斛靶基因gene-MA16_Dca017821除miR168调控外,可能还有其他miRNA共同调控,从而实现靶基因转录水平调控,参与到蓝激光对铁皮石斛的影响。
4 结 论
本研究分析了铁皮石斛与其他植物miR168家族进化特性差异,为其功能研究提供理论基础。分析了铁皮石斛miR168和靶基因在激光的表达分析,深入了解miR168在铁皮石斛响应蓝激光过程中的作用,推测铁皮石斛miR168a可能通过靶基因gene-MA16_Dca006149、gene-MA16_Dca020995参与到蓝激光对铁皮石斛的影响;而靶基因gene-MA16_Dca017821除miR168调控外,可能还有其他miRNA共同调控,从而参与到蓝激光对铁皮石斛的影响。关于这种调控机制有待遗传转化进一步验证。
参考文献 Reference:
[1] 陈晓梅,田丽霞,单婷婷,等.铁皮石斛种质资源和遗传育种研究进展[J].药学学报,2018,53(9):1493-1503.
CHEN X M,TIAN L X,SHAN T T,et al.Advances in germplasm resources and genetics and breeding of Dendrobium officinale[J].Acta Pharmaceutica Sinica,2018,53(9):1493-1503.
[2]林江波,王伟英,邹 晖,等.基于转录组测序的铁皮石斛黄酮代谢途径及相关基因解析[J].福建农业学报,2019,190(9):27-33.
LIN J B,WANG W Y,ZOU H,et al.Transcriptome analysis on pathway of and genes related to flavonoid synthesis in Dendrobium officinale[J]. Fujian Journal of Agricultural Sciences,2019,190(9):27-33.
[3]林 啸.光质诱导钙信号对铁皮石斛原球茎生长及多糖积累的影响研究[D].成都:四川农业大学,2015.
LIN X.Influence of caluim signal on the growth and polysaccharide accumulation of Dendrobium officinale protocorm under photoinduction[D].Chendu:Sichuan Agricultural University,2015.
[4]娄钰姣.光质对铁皮石斛生长及次生代谢产物的积累调控[D].成都:四川农业大学,2016.
LOU Y J.Light quality on the growth and accumulation of secondary metabolites in the regulation of Dendrobium officinale[D].Chendu:Sichuan Agricultural University,2016.
[5]李永锋.He-Ne 激光和 UV-B 辐射对小麦叶绿体超微结构及蛋白质组学的影响研究[D].太原:山西师范大学,2017.
LI Y F.Studies on effects of He-Ne laser and enhanced UV-B radiation on chloroplast ultrastructure and proteomics in wheat seedlings[D].Taiyuan:Shanxi Normal University,2017.
[6]GAO L ,LI Y ,HAN R.Cell wall reconstruction and DNA damage repair play a key role in the improved salt tolerance effects of He-Ne laser irradiation in tall fescue seedlings[J].Bioscience,Biotechnology,and Biochemistry,2016,80:682-693.
[7]卢宝伟,安凤霞,杨永建,等.药用植物miRNA与次生代谢[J].植物生理学报,2019,55(5):569-576.
LU B W,AN F X,YANG Y J,et al.MiRNA and secondary metabolism of medicinal plants[J].Plant Physiology Journal,2019,55(5):569-576.
[8]王梦蕾,赵 淼,李用芳.植物microRNA的保守性及其分布的分析[J].中国生物化学与分子生物学报,2019, 35(12):1341-1351.
WANG M L,ZHAO M,LI Y F.Conservation and distribution of micrornas in plants[J].Chinese Journal of Biochemistry and Molecular Biology,2019,35(12):1341-1351.
[9]韩 璐,栾雨时.植物miR168的研究进展[J].基因组学与应用生物学,2014(2):438-444.
HAN L,LUAN Y SH.Progress on theresearch of plant miR168[J].Genomics and Applied Biology,2014(2):438-444.
[10] VAUCHERET H,MALLORY A C,BARTEL D P.AGO1 homeostasis entails coexpression of miR168 and AGO1 and preferential stabilization of miR168 by AGO1[J].Molecular Cell,2006,22(1):129-136.
[11]LI W,CUI X,MENG Z,et al.Transcriptional regulation of Arabidopsis miR168a and ARGONAUTE1 homeostasis in abscisic acid and abiotic stress responses[J].Plant Physiology,2012,158(3):1279-1292.
[12]IKI T,ANTOINE C,BOLOGNA N,et al.Structural flexibility enables alternative maturation,ARGONAUTE sorting and activities of miR168,a global gene silencing regulator in plants[J].Molecular Plant,2018,11(8):1008-1023.
[13]VA VRALLYAY,A VLCZI,KOS GYI,et al.Plant virus-mediated induction of miR168 is associated with repression of ARGONAUTE1 accumulation[J].The EMBO Journal,2017,36:1641-1642.
[14]SUNITHA S,LOYOLA R,ALCALDE J A,et al.The role of UV-B light on small RNA activity during grapevine berry development[J].G3-Genes Genomes Genetics,2018,7:10-59.
[15]CAPITO C,PAIVA J,SANTOS D M,et al.In Medicago truncatula,water deficit modulates the transcript accumulation of components of small RNA pathways[J].BMC Plant Biology,2011,11(1):79-79.
[16]LI W,CUI X,MENG Z,et al.Transcriptional regulation of Arabidopsis miR168a and ARGONAUTE1 homeostasis in abscisic acid and abiotic stress responses[J].Plant Physiology,2012,158(3):1279-1292.
[17]NISCHAL L,MOHSIN M,KHAN I,et al.Identification and comparative analysis of MicroRNAs associated with low-N tolerance in rice genotypes[J].Plos One,2012,7(12):1-13.
[18]KUMAR S,STECHER G,TAMURA K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution,2016,33(7):1870-1874.
[19]李汉生,孙 刚,陈晓慧,等.龙眼miR396分子进化特性及响应蓝光的表达分析[J].西北植物学报,2019,39(12):2109-2122.
LI H SH,SUN G,CHEN X H,et al.Analysis on evolutionary characteristics and expression patterns responding to blue light of miR396 in Dimocarpus longan Lour[J].Acta Botanica Boreali-Occidentalia Sinica,2019,39(12):2109-2122.
[20]NAWROCKI E P,BURGE S W,BATEMAN A,et al.Rfam 12.0:updates to the RNA families database[J].Nucleic Acids Research,2015,43(1):130-137.
[21]GLAVAC D,POTOCNIK U,PODPECNIK D,et al.Correlation of MFOLD-predicted DNA secondary structures with separation patterns obtained by capillary electrophoresis single-strand conformation polymorphism (CE-SSCP) analysis[J].Human Mutation,2002,19(4):384-394.
[22]DAI X,ZHAO P X.psRNATarget:a plant small RNA target analysis server[J].Nucleic Acids Research,2011,39:155-159.
[23]ZHANG G Q,XU Q,BIAN C,et al.The Dendrobium catenatum Lindl,genome sequence provides insights into polysaccharide synthase,floral development and adaptive evolution[J].Scientific Reports,2016,6(19029):1-10.
[24]LI H,YE W,WANG Y,et al.RNA sequencing-based exploration of the effects of far-red light on lncRNAs involved in the shade-avoidance response of D.officinale[J].PeerJ,2021,9(1):e10769.
[25]徐小萍,廖 琪,陈 旭,等.龙眼miR397家族成员分子特性及其在体胚发生早期的表达分析[J].果树学报,2019,36(5):567-577.
XU X P,LIAO Q,CHEN X,et al.Molecular characteristics and expression analysis of miR397 family members during the early somatic embryogenesis in Dimocarpus longan Lour[J]. Journal of Fruit Science,2019,36(5):567-577.
[26]王艳芳,周瑞莲,赵彦宏.miR-171基因家族进化分析及靶基因预测[J].生命科学研究,2015,19(6):479-483.
WANG Y F,ZHOU R L,ZHAO Y H.Molecular evolution of miR-171 gene family and prediction of their target genes[J].Life Science Research,2015,19(6):479-483.
[27]刘炜婳,林玉玲,林争春,等.植物miR172家族成员进化与分子特性分析[J].热带作物学报,2018,39(3):525-533.
LIU W H,LIN Y L,LIN ZH CH,et al.Analysis of evolution and molecular characteristics of miR172 family members in plants[J].Chinese Journal of Tropical Crops,2018,39(3):525-533.
[28]翟俊淼,栾雨时,崔娟娟.miR396基因家族的进化及功能分析[J].植物研究,2013,33(4):421-428.
ZHAI J M,LUAN Y SH,CUI J J.Evolution and function analysis of miR396 gene family[J].Bulletin of Botanical Research,2013,33(4):421-428.
[29]HEMER Y.Applications of the crown diameter-stem diameter relationship for different species of broadleaved trees[J].Forest Ecology and Management,2005,215:285-294.
[30]蒋梦琦,苏立遥,黄倏祺,等.龙眼miR156家族及其调控靶标SPL的生物信息学和表达模式[J].应用与环境生物学报,2020,26(3):558-565.
JIANG M Q,SU L Y,HUANG SH Q,et al.Bioinformatics and expression pattern analysis of miR156 family and its regulatory target SPL in Dimocarpus longan[J].Journal of Applied and Environmental Biology,2020,26(3):558-565.
[31]阎 波,刘思思,陈 娟,等.药用植物铁皮石斛ABC转运蛋白基因的鉴定及其差异表达分析[J].药学学报,2018,53(7):1177-1189.
YAN B,LIU S S,CHEN J,et al.Identification and differential expression analysis of ABC transporter gene from medicinal plant Dendrobium officinale[J].Acta Pharmaceutica Sinica,2018,53(7):1177-1189.
[32]李永康,马雪祺,冯婧娴,等.细胞色素 P450 酶在植物次生代谢产物生物合成中的研究进展[J].分子植物育种,2024,22(7):2176-2183.
LI Y K,MA X Q,FENG J X,et al.Advances of cytochrome P450s in the biosynthesis of plant secondary metabolites[J].Molecular Plant Breeding,2024,22(7):2176-2183.
[33]BEDEWITZ M A,JONES A D,D'AURIA J C,et al.Tropinone synthesis via an atypical polyketide synthase and P450-mediated cyclization[J].Nature Communications,2018,9(1):1-13.
[34]BRUHN D,MIKKELSEN T N,ROLSTED M,et al.Leaf surface wax is a source of plant methane formation under UV radiation and in the presence of oxygen[J].Plant Biology,2014,16(2):512-516.
[35]HAN X,MAO L.Research progress on constituents,histochemical characteristics and biosynthesis of suberin[J].Chinese Bulletin of Botany,2017,52(3):358-374.
Molecular Evolution Characteristics of miR168 in Dendrobium officinale and Analysis of Its Response to Blue Laser Expression
LI Yuqing1,YAO Yanting1,WANG Yaqian1,SUN Gang1,LAI Zhongxiong2 and LI Hansheng1
(1.Fujian Provincial Key Laboratory of Bamboo Resources Development and Utilization,Sanming University,
Sanming Fujian 365004,China; 2.Institute of Horticultural Biotechnology,Fujian Agriculture
and Forestry University,Fuzhou 350002,China)
Abstract Based on the analysis of miRNAs omics in Dendrobium officinale (D.officinale),the differentially expressed miR168 were selected for further analysis and verification,as it plays a key role in regulating pathway influencing the effect of laser on D.officinale.We conducted an analysis of the distribution statistics of precursor and mature sequences,construction of phylogenetic trees,sequence alignment,prediction of the target genes,promoter sequence element,as well as expression patterns in response to laser for miR168 in this study.These results showed that the miR168 family members were widely distributed in 40 plant species,with fewer precursors and mature members,suggesting incomplete evolution in plants.Species specificity was an important factor affecting the evolution of miR168 precursors,while sequence conservation was the main factor affecting the evolution of miR168 matures.The members of miR168-3p were quite specific,whereas the members of miR168-5p were conserved.Mfold and Rfam predicted that the stem sequence of D.officinale miR168 was more conservative than the loop sequence.The precursor sequences had more hairpin structures,and the mature sequences was located on the 3p arm (contains both stem and loop sequences).Both of them contain many light-responsive elements,hormone-responsive elements,and biotic and abiotic stress responsive elements,which might play a regulatory role in the longan response to blue light through these cis-elements.In D.officinale,targets responding to laser both contain ABC transporter B family member 20 and acetyl-CoA acetyltransferase,which are involved in plant growth,and development,and response to external factors.Real-time quantitative PCR showed that miR168a and its target genes (gene-MA16_Dca006149,gene-MA16_Dca020995,gene-MA16_Dca017821) participate in the effects of blue laser on D.officinale.
Key words Dendrobium officinale Kimura et Migo; miR168; Evolution; Laser; Real-time quantitative PCR
Received 2022-09-12 Returned 2023-11-06
Foundation item The Natural Science Foundation of Fujian Province(No.2020J01377);Scale Cultivation and Breeding of Ornamental Bamboo(No.B17000208);the 2023 Special Envoy of Science and Technology of Fujian Province.
First author LI Yuqing,undergraduate student.Research area:plant biotechnology.E-mail:3476155755@qq.com
Corresponding author LI Hansheng,doctor,associate professor.Research area:plant biotechnology.E-mail:1456505560@qq.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

