普洱茶素Ⅴ~Ⅶ对4种乳腺癌细胞作用研究
杨锐 赵兴平 何明婕 刘敏 罗蓉 陈川龙 潘淑康 丁章贵
摘要:普洱茶素(Puerins)是从普洱熟茶中分离得到的儿茶素衍生物,是一类结构独特的含氮多酚化合物。开展普洱茶素Ⅴ~Ⅶ抗乳腺癌细胞作用的研究,以4种不同受体表型的乳腺癌细胞株为模型,进行噻唑蓝(MTT)比色试验、蛋白质组学检测及细胞凋亡检测等试验。结果表明,普洱茶素Ⅴ、Ⅵ和Ⅶ等3个单体化合物对4种乳腺癌细胞都有显著的抑制作用;蛋白质组学分析发现,普洱茶素干预后乳腺癌细胞表达产生差异的蛋白主要集中于代谢通路,其次是癌症通路和黏附斑信号通路;细胞凋亡检测发现3个普洱茶素化合物均可诱导MDA-MB-231细胞的凋亡。本研究报道了普洱茶素Ⅴ~Ⅶ的抗乳腺癌细胞活性及初步作用机制,为研究普洱熟茶抗癌活性物质提供基础信息。
关键词:普洱熟茶;普洱茶素;乳腺癌;蛋白质组学;细胞凋亡
中图分类号:S571.1;R737.9 文献标识码:A 文章编号:1000-369X(2024)03-501-14
Study on the Effects of Puerins Ⅴ-Ⅶ on Four Kinds of Breast Cancer Cells
YANG Rui1,2,6, ZHAO Xingping 1,2,6, HE Mingjie1,2,6, LIU Min1,2,6, LUO Rong1,2,6,
CHEN Chuanlong5,6, PAN Shukang1,2,6*, DING Zhanggui1,2,3,4,6*
1. Yunnan TAETEA Microbial Technology Co., Ltd., Kunming 650217, China; 2. Fermentation Engineering Research Center for Yunnan Pu-erh Tea, Kunming 650217, China; 3. Yunnan Institute of Microbiology, School of Life Sciences, Yunnan University, Kunming 650091, China; 4. Key Laboratory for Southwest Microbial Diversity of the Ministry of Education, Yunnan University, Kunming 650091, China;
5. Menghai Tea Industry Co., Ltd., TAETEA Group, Menghai 666200, China; 6. Key Laboratory of Pu-erh Tea Processing Technology, Ministry of Agriculture and Rural Affairs, Kunming 650217, China
Abstract: Puerins, a kind of nitrogen-containing polyphenol compound with unique structure, is a kind of catechin derivative first isolated from ripened Pu-erh tea. In this paper, the effects of puerins Ⅴ-Ⅶ on breast cancer cells were studied. Four breast cancer cell lines with different receptor phenotypes were used as models, and MTT assay, proteomics detection and apoptosis detection were carried out. The results show that all puerins Ⅴ, Ⅵ and Ⅶ had obvious inhibitory effects on the four kinds of breast cancer cells. Proteomics analysis indicates that the differentially expressed proteins were mainly concentrated in the metabolic pathway, followed by cancer pathway and adhesion spot signal pathway under the intervention of puerins Ⅴ-Ⅶ. Apoptosis detection demonstrates that all three puerins compounds could induce the apoptosis of MDA-MB-231 cells. This study first reported the anti-breast cancer activity and preliminary mechanism of puerins Ⅴ-Ⅶ, which provided basic information for studying the anti-cancer active substances of ripened Pu-erh tea.
Keywords: ripened Pu-erh tea, puerins, breast cancer, proteomics, apoptosis
普洱茶,是一种由云南大叶种晒青毛茶加工制成的茶叶,是云南的地理标志产品,根据加工工艺的不同,普洱茶可分为普洱生茶和普洱熟茶,其中普洱熟茶由晒青毛茶经微生物发酵转化而成,是一种独特的微生物发酵茶。普洱熟茶具有降脂减肥、调节肠道菌群、降糖、抗氧化、抗癌等多种保健功能,受到越来越多消费者的喜爱[1-2]。普洱熟茶的化学成分与晒青毛茶相比差异较大,除简单儿茶素、黄酮及黄酮苷、简单酚酸类、生物碱等成分外,普洱熟茶中的茶多糖、茶褐素等物质的含量较高,此外,还存在一系列特殊的转化产物,如特征儿茶素类(A环取代产物普洱茶素puerins、B环衍生产物teadenols)、奎宁酸衍生物、他汀类和酰胺类化合物等[3],这些特殊的成分是其成分复杂、结构多变的物质基础,普洱熟茶的一些特殊保健功能可能与这些特殊的转化产物有关,因而通过对这些物质成分的进一步研究,可为普洱熟茶的开发和利用提供理论依据和更多可能。
普洱茶素Ⅰ~Ⅷ(Puerins Ⅰ-Ⅷ)是普洱熟茶中一类特殊的含氮多酚化合物,由儿茶素与茶氨酸环化加合而成,是微生物作用下天然形成的儿茶素A环8位取代形成的N-乙基-2-吡咯烷酮取代的黄烷-3-醇化合物。Zhou等[4]在普洱茶中发现了一类新的8-C取代的黄烷-3醇化合物,普洱茶素A和B,证实了普洱熟茶中存在有特异的多酚类物质。东方等[5]在普洱茶的抗氧化活性成分中检测到了普洱茶素A和B,并推测这些特异多酚物质可能具有较强的抗氧化活性。Wang等[6]在普洱熟茶中发现并分离得到了普洱茶素Ⅰ~Ⅷ化合物,并且发现普洱茶素Ⅰ~Ⅳ在1 μmol·L-1(0.401 μg·mL-1)剂量时对过氧化氢诱导的人微血管内皮细胞(HMEC)损伤具有保护作用,且作用强于表没食子儿茶素没食子酸酯(EGCG)、没食子酸(GA)等儿茶素类和酚酸物质。上述研究表明,普洱茶素Ⅰ~Ⅷ作为普洱熟茶的活性成分,可能具有特殊的活性潜力。除抗氧化活性外,普洱茶素Ⅰ~Ⅲ还具有改善高脂血症小鼠的糖脂代谢紊乱[7]、改善动脉粥样硬化[8]和降脂[9]等作用,且浓度为500 μmol·L-1(200.5 μg·mL-1)普洱茶素Ⅲ对HepG2细胞的存活率没有明显影响,以50 mg·kg-1·d-1剂量连续给药6周未见小鼠的明显毒副反应[9]。而普洱茶素Ⅴ~Ⅷ作为普洱熟茶中的特征性物质之一,其活性研究尚未见报道。
乳腺癌是女性常见的恶性肿瘤,发病率不断升高,据报道,2020年,全球约有230万新发乳腺癌病例,预计到2040年,每年将有超过300万例乳腺癌新病例,每年死亡人数将超过100万[10],乳腺癌的新发病例在女性癌症中占31%,尽管增加了筛查并改进了治疗方法,但乳腺癌仍是导致女性死亡的第二大癌症原因[11]。乳腺癌并不是单一的疾病,根据其细胞雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子受体(HER2)表型特征的不同,可分为Luminal A型、Luminal B型、HER-2阳性型及三阴性4种亚型[12-13],其中,三阴性乳腺癌侵袭性强,对常规治疗不敏感且容易产生耐药性,是目前临床治疗预后最差的一类乳腺癌[14]。Xie等[15]研究表明,普洱熟茶水提物具有抑制三阴性乳腺癌细胞MDA-MB-231增殖和诱导其凋亡的作用,但其中的功能物质尚不清楚。为探究普洱茶素Ⅴ~Ⅶ(化合物结构式见图1)在抗乳腺癌方面的作用,选用4种受体表型特征不同的乳腺癌细胞系MDA-MB-231、MDA-MB-453、MCF-7
和BT474为研究对象,分析普洱茶素Ⅴ、Ⅵ和Ⅶ对乳腺癌的抑制作用,以期为乳腺癌治疗药物的研发提供更多可能。
1 材料与方法
1.1 试剂
普洱茶素Ⅴ~Ⅶ从普洱熟茶中分离制备得到(云南大益微生物技术有限公司,纯度≥98%),PBS缓冲液购自天津灏洋华科生物科技有限公司,L-15培养液、MEM培养液、RPMI 1640培养液均购自杭州吉诺生物医药技术有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,0.25%胰蛋白酶购自上海朗顿生物技术有限公司,胰岛素购自上海阿拉丁试剂公司,噻唑蓝(MTT)购自武汉科瑞生物技术有限公司;二甲基亚砜(DMSO)购自国药集团化学试剂有限公司,他莫昔芬(TAM)购于Sigma-Aldrich公司,乙腈(ACN)和蒸馏水购自上海安谱实验科技股份有限公司,增强型BCA蛋白检测试剂盒购自上海碧云天生物技术有限公司,膜联蛋白V-荧光素异硫氰酸酯/碘化丙啶(Annexin V-FITC/PI)荧光双染细胞凋亡检测试剂盒购自武汉普诺赛生物科技有限公司。
1.2 仪器
酶标仪,美国Bioteck EON;Nano-UPLC EASY-nLC1200与UltiMate 3000联用设备,美国Thermo Scientific;流式细胞仪,美国贝克曼公司。
1.3 细胞株及细胞培养
MDA-MB-231、BT474和MCF-7细胞购自广州赛库生物技术有限公司;MDA-MB-453细胞购自武汉贝茵莱生物科技有限公司。MDA-MB-231和MDA-MB-453细胞培养于含10%胎牛血清的有酚红L-15培养基,在37 ℃培养箱中培养;MCF-7细胞培养于含10%胎牛血清、10 μg·mL-1胰岛素的有酚红MEM培养基,在37 ℃和CO2体积分数为5%的培养箱中培养;BT474细胞培养于含10%胎牛血清、10 ?g·mL-1胰岛素的含酚红RPMI 1640培养基,在37 ℃和CO2体积分数为5%的培养箱中培养。
1.4 MTT试验
MTT试验测试普洱茶素Ⅴ~Ⅶ对MDA-MB-231、MDA-MB-453、MCF-7和BT474等4种乳腺癌细胞的抑制作用。分别收集4种对数期乳腺癌细胞接种于96孔板,每孔加入100 μL,细胞密度为每孔8 000个。CO2体积分数为5%、37 ℃培养至细胞单层铺满孔底,换用无酚红RPMI 1640培养液,分别加入普洱茶素Ⅴ~Ⅶ(浓度梯度为0、1、10、20、50、100、150、200 ?g·mL-1)和TAM(浓度梯度为0、1.8、3.7、5.6、7.4、9.3、11.1 ?g·mL-1)进行处理,CO2体积分数为5%、37 ℃条件下培养24 h。每孔加入10 μL MTT溶液(5 mg·mL-1),继续培养4 h。培养结束后,弃去培养液,用PBS冲洗2遍后,每孔加入150 μL DMSO,轻轻振荡,使甲瓒结晶物充分溶解。置于酶标仪上,测定570 nm处各孔的吸光度值,同时设置空白调零孔和对照孔,每组5个重复。
1.5 蛋白样品制备
培养瓶中的细胞用0.25%的胰酶消化后,在6孔板中按照每毫升5×105个细胞加入2 mL细胞悬液,继续培养,待细胞汇合度达到80%后,加入30 ?g·mL-1普洱茶素Ⅴ~Ⅶ进行处理,每种细胞均设置普洱茶素处理组与溶剂对照组,普洱茶素处理组每孔添加2 mL处理液,溶剂对照组每孔添加2 mL溶剂对照液,37 ℃、CO2体积分数为5%条件下培养1 h后,去掉培养液,用预冷的PBS(4 ℃)溶液洗涤细胞,将培养皿置于冰上,加入200 ?L预冷的PBS溶液并用细胞刮刀将细胞刮下,将细胞液转至离心管,4 ℃,1 000 g离心1 min,去除上清液,液氮速冻后存于﹣80 ℃备用。
1.6 蛋白质组学检测及数据处理
取冻存的蛋白样品,加入适量RIPA裂解液进行裂解,离心得到蛋白样品,用BCA试剂盒测定蛋白含量并将样品调整至相同蛋白浓度。蛋白样品经胰蛋白酶酶解后进行Nano LC-MS/MS检测,进样量2 ?g,反相色谱柱Reprosil-Pur 120 C18-AQ(100 μm ID×15 cm),流动相为乙腈-水体系,A相为2%乙腈(含0.1%甲酸),B相为80%乙腈(含0.1%甲酸),流速300 nL·min-1。洗脱梯度:流动相B 2%~5%持续2 min,5%~22%持续88 min,22%~45%持续26 min,45%~95%持续2 min,95%持续2 min。质谱原始文件使用MaxQuant软件(版本1.6.5.0)在SwissProt蛋白数据库中进行检索分析,采用IBAQ(基于强度的绝对蛋白质定量)算法进行定量分析,对比不同处理组以确定具有相似差异的蛋白质,差异蛋白利用Proteome Discoverer软件(2.4.0.305版本,Thermo Fisher Scientific公司)及京都基因与基因组百科全书通路(KEGG Pathway)数据库(www.kegg.jp/kegg/pathway.html)进行KEGG通路富集分析。
1.7 细胞凋亡检测
取MDA-MB-231对数期细胞接种于6孔板,每孔加入2 mL,细胞密度为每孔5×107个,37 ℃、CO2体积分数为5%条件下培养至细胞单层铺满孔底,换用无酚红的RPMI 1640培养液,添加2 mL普洱茶素Ⅴ(质量浓度为20、40 ?g·mL-1)、普洱茶素Ⅵ(质量浓度为15、30 ?g·mL-1)和普洱茶素Ⅶ溶液(质量浓度为20、40 ?g·mL-1),分别培养6、12、24 h,进行凋亡诱导。样品处理结束后,收集培养基上清液中的细胞,并用不含EDTA的胰酶将细胞从6孔板上消化下来,300 g离心5 min,与上清液中的细胞合并,取1×106个重悬的细胞,PBS洗涤后置于500 ?L稀释的1×Annexin V-FITC缓冲液(含1%的Annexin V-FITC和PI染液)中重悬,轻柔涡旋混匀后,室温避光孵育20 min,样品置于冰上,使用流式细胞仪检测。
1.8 数据统计与分析
试验数据用平均值±标准差表示,用t检验对数据进行差异显著性检验。
2 结果与分析
2.1 普洱茶素Ⅴ~Ⅶ对4种乳腺癌细胞的抑制作用
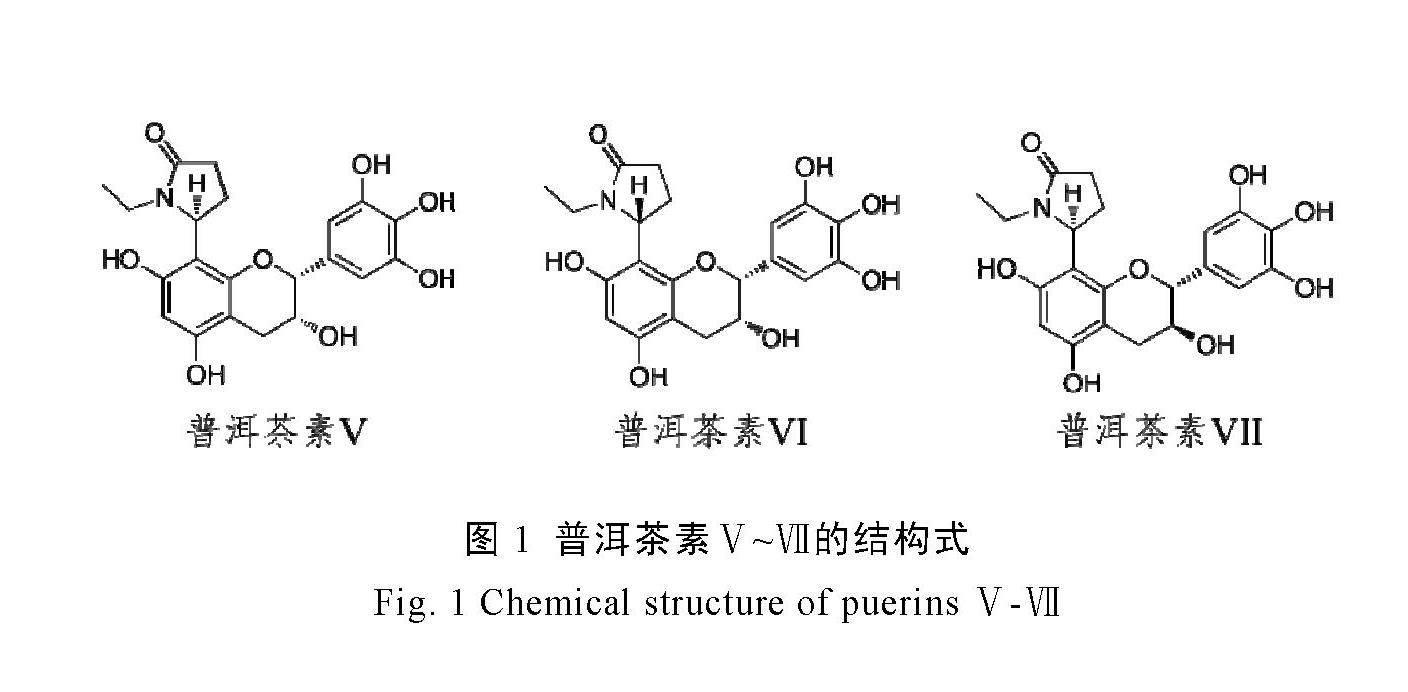
普洱茶素Ⅴ对4种乳腺癌细胞的作用如图2所示,与对照组(不添加普洱茶素)相比,当普洱茶素Ⅴ质量浓度≥10 μg·mL-1后,MDA-MB-231和MDA-MB-453细胞存活率显著下降;当质量浓度≥20 μg·mL-1后,MCF-7细胞存活率显著下降;当质量浓度≥50 μg·mL-1后,BT474细胞存活率显著下降。
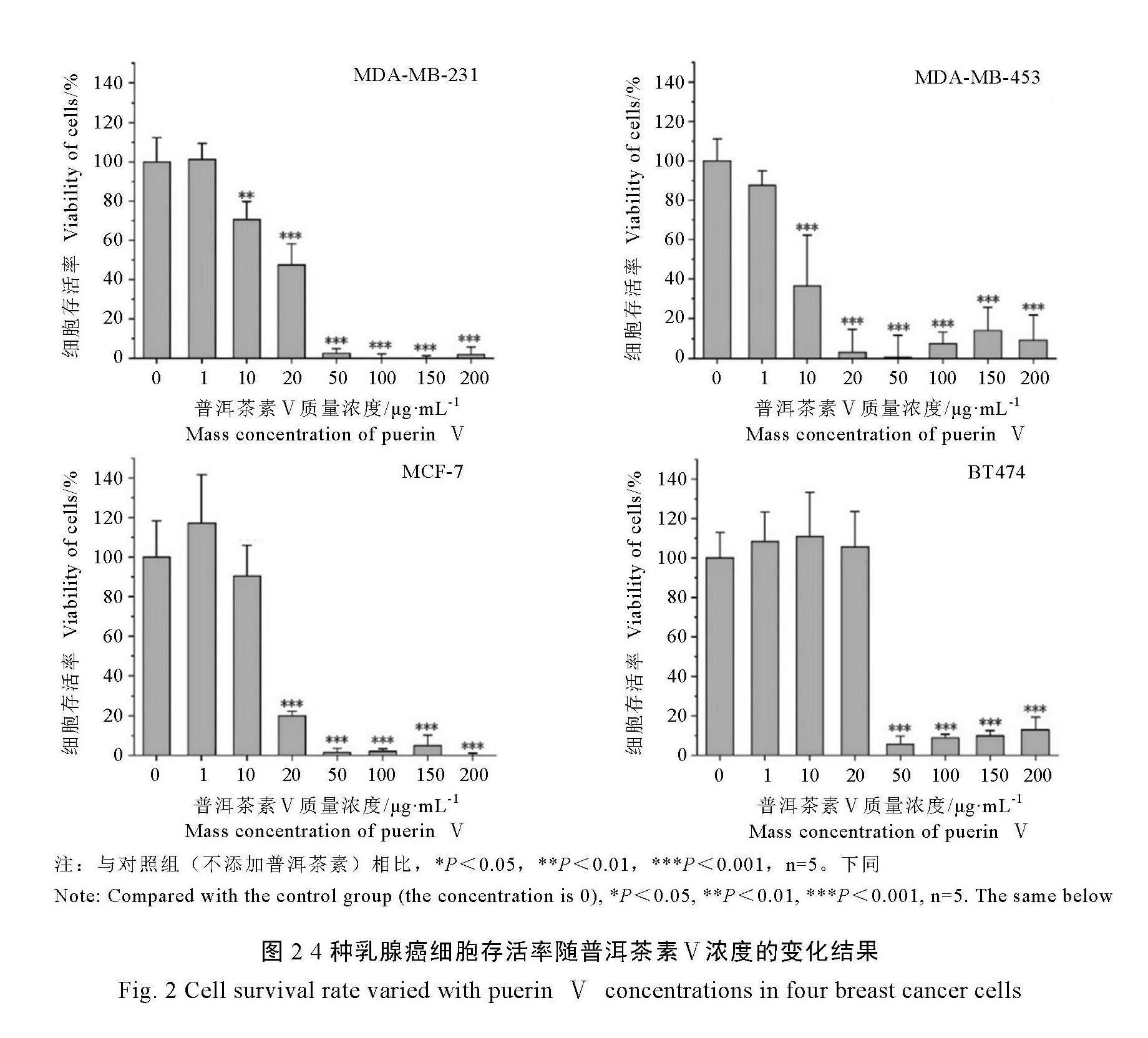
普洱茶素Ⅵ对4种乳腺癌细胞的作用如图3所示,与对照组(不添加普洱茶素)相比,当普洱茶素Ⅵ质量浓度≥1 μg·mL-1,MDA-
MB-453细胞存活率显著下降;当质量浓度≥10 μg·mL-1,MDA-MB-453细胞存活率急剧下降,而MCF-7细胞存活率显著下降;当质量浓度≥20 μg·mL-1,MDA-MB-231细胞存活率显著下降;当质量浓度≥50 μg·mL-1,BT474细胞存活率显著下降。
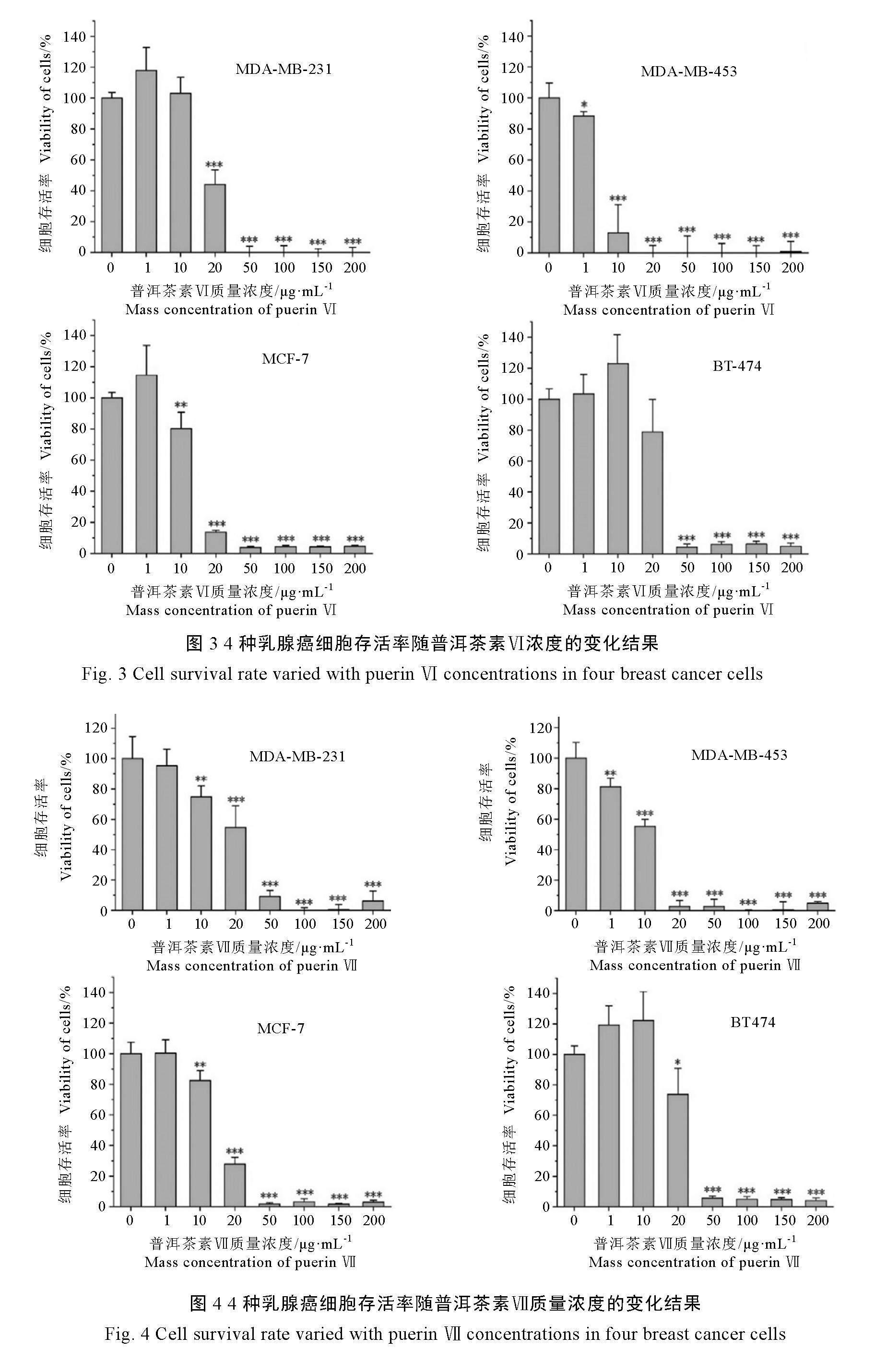
普洱茶素Ⅶ对4种乳腺癌细胞的作用如图4所示,与对照组(不添加普洱茶素)相比,当普洱茶素Ⅶ质量浓度≥1 μg·mL-1,MDA-MB-453细胞存活率显著下降;当质量浓度≥10 μg·mL-1,MDA-MB-231和MCF-7细胞存活率显著下降;当质量浓度≥20 μg·mL-1,BT474细胞存活率显著降低,而MDA-MB-453和MCF-7细胞存活率急剧下降;当质量浓度≥50 μg·mL-1,MDA-MB-231和BT474细胞存活率急剧下降。
阳性药TAM对4种乳腺癌细胞的作用如图5所示,与对照组(不添加TAM)相比,当TAM质量浓度≥1.8 μg·mL-1,MDA-MB-453细胞存活率显著下降;当质量浓度≥3.7 μg·mL-1,MDA-MB-231和BT474细胞存活率显著下降;当质量浓度增加到5.6 μg·mL-1,MCF-7细胞存活率显著下降,且MDA-MB-453、MCF-7和BT474细胞存活率急剧下降。
由上述结果可知,普洱茶素Ⅴ、Ⅵ和Ⅶ对4种乳腺癌细胞均表现出显著的抑制作用,普洱茶素Ⅴ、Ⅵ、Ⅶ及TAM对4种乳腺癌细胞的半数抑制浓度(IC50)如表1所示。普洱茶素Ⅴ~Ⅶ对于上述4种乳腺癌细胞的IC50均在较低范围内(5 ~30 μg·mL-1),特别是对MDA-MB-231、
MDA-MB-453和MCF-7细胞的IC50低至5~
20 μg·mL-1。阳性对照TAM对4种乳腺癌细胞的IC50在5~7 μg·mL-1。整体来看,普洱茶素Ⅴ和Ⅵ对MDA-MB-453细胞的抑制作用与阳性对照TAM相当。
2.2 普洱茶素Ⅴ~Ⅶ抗乳腺癌潜在作用靶点的筛选
2.2.1 差异表达蛋白筛选
以FLOD CHANGE(FC)≤0.5或FC≥2,且蛋白有对应基因名称为标准,筛选出普洱茶素Ⅴ~Ⅶ处理组相较于溶剂对照组的差异蛋白,所有差异蛋白汇总如表2所示。
2.2.2 KEGG富集分析
对差异表达蛋白进行KEGG通路分析以研究普洱茶素Ⅴ~Ⅶ对4种乳腺癌细胞发挥干预作用的生物学途径,根据Fisher精确检验,蛋白表达差异前十的KEGG通路富集分析结果如图6~图8。
普洱茶素Ⅴ干预4种乳腺癌细胞的代谢通路分析结果如图6所示。普洱茶素Ⅴ干预后,4种乳腺癌细胞中差异蛋白主要富集于代谢通路(Metabolic pathways,hsa01100),MDA-MB-231和MCF-7细胞映射到此通路中的蛋白差异最显著,而MDA-MB-453和BT474细胞中富集差异蛋白最显著的通路分别为肝细胞癌信号通路(Hepatocellular carcinoma,hsa05225)和黏附斑信号通路(Focal adhesion,hsa04510)。此外,普洱茶素Ⅴ干预后筛选得到的差异蛋白还与癌症中蛋白聚糖信号通路(Proteoglycans in cancer,hsa05205)、癌症信号通路(Pathways in cancer,hsa05200)、MAPK信号通路(MAPK signaling pathway,hsa04010)、人乳头瘤病毒感染通路(Human papillomavirus infection,hsa05165)、人巨细胞病毒感染通路(Human cytomegalovirus infection,hsa05163)、神经退行性病变通路(Pathways of neurodegeneration,hsa05022)、胞吞作用通路(Endocytosis,hsa04144)、阿尔茨海默病信号通路(Alzheimer disease,hsa05010)等相关。
普洱茶素Ⅵ干预4种乳腺癌细胞的代谢通路分析结果如图7所示。普洱茶素Ⅵ干预后,4种乳腺癌细胞中表达产生显著差异的蛋白也主要富集于代谢通路,BT474细胞中富集于代谢通路的差异蛋白差异最显著,而MDA-MB-231、MDA-MB-453和MCF-7细胞中差异蛋白富集差异最显著的通路依次为脊髓小脑性共济失调信号通路(Spinocerebellar ataxia,hsa05017)、癌症信号通路和小细胞肺癌信号通路(Small cell lung cancer,hsa05222)。此外,普洱茶素Ⅵ干预后的差异蛋白还与肝细胞癌信号通路、泛素介导的蛋白水解通路(Ubiquitin mediated proteolysis,hsa04120)、癌症中蛋白聚糖信号通路、病毒致癌作用通路(Viral carcinogenesis,hsa05203)、化学致癌作用通路(Chemical carcinogenesis,hsa05204)、癌症中MicroRNA通路(MicroRNAs in cancer,hsa05206)、人乳头瘤病毒感染通路、人巨细胞病毒感染通路、神经退行性病变通路等相关。
普洱茶素Ⅶ干预4种乳腺癌细胞的代谢通路分析结果如图8所示。与普洱茶素Ⅴ和Ⅵ类似,普洱茶素Ⅶ干预后,4种乳腺癌细胞中表达产生显著差异的蛋白主要富集于代谢通路,且MDA-MB-231细胞富集于代谢通路的差异蛋白差异最显著;而MDA-MB-453、MCF-7和BT474细胞差异蛋白差异最显著的通路依次为志贺菌病信号通路(Shigellosis,hsa05131)、癌症中蛋白聚糖信号通路、黏附斑信号通路。此外,普洱茶素Ⅶ干预后的差异蛋白还与肝细胞癌信号通路、病毒致癌作用通路、癌症信号通路、胞吞作用通路、人乳头瘤病毒感染通路、人巨细胞病毒感染通路、神经退行性病变通路等相关。
综上所述,普洱茶素Ⅴ~Ⅶ对4种乳腺癌细胞的干预作用比较一致,主要集中于代谢通路,对小细胞肺癌信号通路以及黏附斑信号通路的干预作用也比较明显,表明这3条通路与普洱茶素Ⅴ~Ⅶ的乳腺癌抑制作用机制直接相关,而其他与癌症相关的通路如癌症中蛋白聚糖信号通路等也可能与其抗乳腺癌作用有关。
2.3 普洱茶素Ⅴ~Ⅶ诱导MDA-MB-231细胞凋亡的效果及机制结果分析
Annexin V是一种钙离子依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力。当细胞发生凋亡时,膜内侧的磷脂酰丝氨酸外翻到膜表面,被荧光染料FITC标记的Annexin V结合,可通过流式细胞仪或荧光显微镜进行检测。由于凋亡晚期或坏死细胞膜丧失完整性,而PI可与双链DNA特异性结合并产生强烈的荧光,与Annexin V搭配使用,可区分处于不同凋亡时期的细胞。
流式细胞仪检测结果显示,普洱茶素Ⅴ~Ⅶ诱导了MDA-MB-231细胞凋亡(图9~图11和表3)。MDA-MB-231细胞在添加普洱茶素Ⅴ~Ⅶ分别培养6、12 h和24 h后,凋亡细胞数量明显增加。培养6、12 h和24 h后,20 g·mL-1普洱茶素Ⅴ组细胞凋亡率分别为8.53%、14.96%和21.68%,40 g·mL-1普洱茶素Ⅴ组细胞凋亡率分别为10.25%、14.22%和27.21%,随着作用时间和作用浓度增加,细胞凋亡数量和细胞凋亡率增加;15 g·mL-1普洱茶素Ⅵ组细胞凋亡率分别为8.47%、19.43%和24.03%,30 g·mL-1普洱茶素Ⅵ组细胞凋亡率分别为24.18%、22.75%和22.44%,低剂量作用24 h的诱导凋亡效果略强于高剂量,且低剂量时普洱茶素Ⅵ的诱导凋亡效果与普洱茶素Ⅴ相当;20 g·mL-1普洱茶素Ⅶ组细胞凋亡率分别为8.29%、11.32%和32.36%,40 g·mL-1普洱茶素Ⅶ组细胞凋亡率分别为14.10%、18.83%和40.10%,随着作用时间和作用浓度增加,细胞凋亡数量和细胞凋亡率增加,且相同剂量下诱导凋亡效果强于普洱茶素Ⅴ。
综合来看,普洱茶素Ⅴ~Ⅶ对乳腺癌细胞MDA-MB-231的凋亡都表现出了明显的诱导作用,诱导程度及诱导机制基本一致,普洱茶素Ⅴ处理后,MDA-MB-231细胞的早期凋亡和晚期凋亡细胞数均增加,40 g·mL-1作用24 h时早期细胞凋亡率和晚期细胞凋亡率分别为15.49%和11.72%,差异不大,说明普洱茶素Ⅴ可以通过诱导MDA-MB-231细胞的正常程序性死亡和非正常程序性死亡这两条途径抑制乳腺癌细胞的生长。同样,普洱茶素Ⅵ和Ⅶ处理后,MDA-MB-231细胞的早期凋亡和晚期凋亡细胞数均增加,且早期凋亡数增加更明显,30 g·mL-1普洱茶素Ⅵ作用24 h时早期细胞凋亡率和晚期细胞凋亡率分别为16.86%和5.58%,40 g·mL-1普洱茶素Ⅶ作用24 h时早期细胞凋亡率和晚期细胞凋亡率分别为29.65%、10.45%,说明普洱茶素Ⅵ和Ⅶ主要通过诱导MDA-MB-231细胞的正常程序性死亡来抑制癌细胞的生长,细胞膜基本保持其完整性。
3 讨论
随着科技的发展,乳腺癌的治疗方法不断进步,从乳腺癌根治术、放疗和化疗方法的辅助应用到靶向治疗和内分泌药物的发展,乳腺癌患者的生存率不断提升[16-17],但不同亚型的乳腺癌治疗效果和生存情况不尽相同,随着新诊断人群的增加,死亡人数仍呈增加趋势。因此,开发一种能够用于乳腺癌安全防治的新型药物显得尤为必要。普洱茶作为一种日常饮品,具有多种保健功效,受到众多消费者喜爱。现有研究报道,普洱茶能抑制多种肿瘤细胞的增殖[18],具有抗胃癌[19]、肝癌[20]、宫颈癌[21]、口腔癌[22]等多种抗癌活性,也具有抑制三阴性乳腺癌细胞生长和诱导凋亡的作用[15]。普洱熟茶经微生物发酵后化学成分多样,这些复杂的化学成分是其功能发挥的物质基础。目前,普洱茶素系列化合物的活性研究报道较少,除普洱茶素Ⅰ~Ⅳ被报道具有抗过氧化氢诱导HMEC损伤的保护作用、改善高糖高脂摄入引起的糖脂紊乱和高脂血症外,尚未见普洱茶素Ⅴ~Ⅶ化合物的活性研究报道。
本研究首次报道了普洱茶素Ⅴ~Ⅶ的抗乳腺癌作用,研究结果显示,在MTT试验中普洱茶素Ⅴ~Ⅶ都表现出对4种不同受体表型乳腺癌细胞的显著抑制作用,其中,普洱茶素Ⅴ和Ⅵ对MDA-MB-453细胞的抑制作用更强,与阳性对照药物TAM作用相当;在4种细胞中,普洱茶素Ⅴ~Ⅶ均对BT474细胞的抑制作用较弱,这可能与其受体表型不同有关。采用蛋白质组学研究方法进一步分析普洱茶素Ⅴ~Ⅶ的抗乳腺癌潜在作用机制,发现普洱茶素Ⅴ~Ⅶ对4种乳腺癌细胞的干预作用比较一致,作用后差异最显著的细胞信号途径主要集中于代谢通路,其次是小细胞肺癌信号通路和黏附斑信号通路,表明普洱茶素Ⅴ~Ⅶ的乳腺癌抑制作用机制可能与这3条通路直接相关,这可为后续开展其抗癌机制研究提供一定的信息基础。基于三阴性乳腺癌MDA-MB-231细胞临床预后最差,本研究进行了普洱茶素Ⅴ~Ⅶ对MDA-MB-231细胞凋亡的影响测试,结果显示,普洱茶素Ⅴ~Ⅶ均能诱导MDA-MB-231细胞的凋亡,普洱茶素Ⅴ可能通过诱导细胞的正常程序性死亡和非正常程序性死亡这两条途径抑制MDA-MB-231细胞的生长,而普洱茶素Ⅵ和Ⅶ可能通过诱导细胞的正常程序性死亡来抑制MDA-MB-231细胞的生长。据此推测,普洱茶素Ⅴ~Ⅶ极有可能是普洱熟茶抗乳腺癌活性的功能成分之一,其抗乳腺癌作用机制可能是通过诱导细胞凋亡抑制乳腺癌细胞的生长。
本研究初步证明了普洱茶素Ⅴ~Ⅶ对4种乳腺癌细胞的抗癌活性以及对MDA-MB-231乳腺癌细胞的生长抑制作用,但其发挥抗乳腺癌活性的作用机制还有待进一步研究。此外,不同类型的乳腺癌细胞的敏感性不尽相同,普洱茶素Ⅴ~Ⅶ对不同类型乳腺癌的治疗价值仍需进一步探讨。本研究拓展了普洱茶素系列化合物的活性范围,为乳腺癌防治药物的研究在细胞水平上提供了新的理论依据。
参考文献
[124]顾睿, 李瑞明, 张兰兰, 等. 普洱茶化学成分及药理研究进展[J]. 天津药学, 2011, 23(1): 47-51.
Gu R, Li R M, Zhang L L, et al. Advances in study on chemical composition and pharmacological properties of pu-erh tea [J]. Tianjin Pharmacy, 2011, 23(1): 47-51.
[125]顾小盼, 潘勃, 吴臻, 等. 普洱茶药理作用研究进展[J]. 中国中药杂志, 2017, 42(11): 2038-2041.
Gu X P, Pan B, Wu Z, et al. Progress in research for pharmacological effects of pu-erh tea [J]. China Journal of Chinese Materia Medica, 2017, 42(11): 2038-2041.
[126]孟宪钰, 付亚轩, 李明超, 等. 普洱熟茶化学成分研究进展[J]. 食品与发酵工业, 2019, 45(12): 289-294.
Meng X Y, Fu Y X, Li M C, et al. Advance in the study on the chemical composition of pu-erh tea [J]. Food and Fermentation Industries, 2019, 45(12): 289-294.
[127]Zhou Z H, Zhang Y J, Xu M, et al. Puerins A and B, two new 8-C substituted flavan-3-ols from pu-er tea [J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8614-8617.
[128]东方, 杨子银, 何普明, 等. 普洱茶抗氧化活性成分的LC-MS分析[J]. 中国食品学报, 2008, 8(2): 133-141.
Dong F, Yang Z Y, He P M, et al. Liquid chromatographic-mass spectrometric analysis of antioxidant compounds from pu-erh tea [J]. Journal of Chinese Institute of Food Science and Technology, 2008, 8(2): 133-141.
[129]Wang W, Zhang L, Wang S, et al. 8-C N-ethyl-2-pyrrolidinone substituted flavan-3-ols as the marker compounds of Chinese dark teas formed in the post-fermentation process provide significant antioxidative activity [J]. Food Chemistry, 2014, 152: 539-545.
[130]顾小盼, 吴臻, 靳凤玉, 等. 普洱茶素Ⅰ改善糖脂代谢紊乱的药效评价及作用机制研究[J]. 中国中药杂志, 2018, 43(11): 2339-2344.
Gu X P, Wu Z, Jin F Y, et al. Efficacy and mechanism of puerin Ⅰ in improving disorder of glycolipid metabolism in ApoE-/- mice [J]. China Journal of Chinese Materia Medica, 2018, 43(11): 2339-2344.
[131]王鑫玉, 赵一慕, 高云, 等. 普洱茶素Ⅱ改善高脂血症ApoE-/-小鼠动脉粥样硬化作用机制研究[J]. 中草药, 2023, 54(4): 1157-1163.
Wang X Y, Zhao Y M, Gao Y, et al. Mechanism of puerin Ⅱ on improving atherosclerosis in ApoE-/- mice with hyperlipidemia [J]. Chinese Traditional and Herbal Drugs, 2023, 54(4): 1157-1163.
[132]Gu X P, Meng Y X, Jin F Y, et al. Puerin III alleviates glucose and lipid metabolism disorders in high-fat high-sucrose diet-induced hyperlipidemic and hyperglycemic ApoE-/-mice [J]. Journal of Functional Foods, 2022, 93: 105085. doi: 10.1016/j.jff.2022.105085.
[133]Ye F, Dewanjee S, Li Y H, et al. Advancements in clinical aspects of targeted therapy and immunotherapy in breast cancer [J]. Molecular Cancer, 2023, 22(1): 105. doi: 10.1186/s12943-023-01805-y.
[134]Siegel R L, Miller K D, Wagle N S, et al. Cancer statistics, 2023 [J]. CA: A Cancer Journal for Clinicians, 2023, 73(1): 17-48.
[135]Feng Y X, Spezia M, Huang S F, et al. Breast cancer development and progression: risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis [J]. Genes & Diseases, 2018, 5(2): 77-106.
[136]Sviderskiy V O, Blumenberg L, Gorodetsky E, et al. Hyperactive CDK2 activity in basal-like breast cancer imposes a genome integrity liability that can be exploited by targeting DNA polymerase ε [J]. Molecular Cell, 2020, 80(4): 682-698.
[137]陈安莉, 沈浩元, 舒王. 三阴性乳腺癌新辅助治疗的临床研究进展[J]. 现代肿瘤医学, 2023, 31(3): 566-571.
Chen A L, Shen H Y, Shu W. Neoadjuvant therapy for triple negative breast cancer: clinical progress [J]. Modern Oncology, 2023, 31(3): 566-571.
[138]Xie J, Yu H S, Song S, et al. Pu-erh tea water extract mediates cell cycle arrest and apoptosis in MDA-MB-231 human breast cancer cells [J]. Frontiers in Pharmacology, 2017, 8: 190. doi: 10.3389/fphar.2017.00190.
[139]杨潇, 龙汉安, 肖秀丽. 不同分子亚型乳腺癌临床特征及治疗策略研究进展[J]. 牡丹江医学院学报, 2013, 34(2): 76-78.
Yang X, Long H A, Xiao X L. Research progress on clinical characteristics and treatment strategies of different molecular subtypes of breast cancer [J]. Journal of Mudanjing Medical University, 2013, 34(2): 76-78.
[140]王烈, 黎成金. 乳腺癌治疗方法的变迁[J]. 中国临床医生, 2011, 39(7): 12-14.
Wang L, Li C J. Changes of treatment methods for breast cancer [J]. Chinese Journal for Clinicians, 2011, 39(7): 12-14.
[141]Zhao L J, Jia S T, Tang W R, et al. Pu-erh tea inhibits tumor cell growth by down-regulating mutant p53 [J]. International Journal of Molecular Sciences, 2011, 12(11): 7581-7593.
[142]Zhao H, Zhang M, Zhao L, et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea [J]. International Journal of Molecular Sciences, 2011, 12(3): 1862-1875.
[143]韩莎莎, 高雄, 林晓蓉, 等. 普洱茶挥发性组分的抗癌、抗炎功能特性[J]. 食品工业科技, 2019, 40(3): 97-105.
Han S S, Gao X, Lin X R, et al. Anti-cancer and anti-inflammatory activities of volatile components from pu-erh tea [J]. Science and Technology of Food Industry. 2019, 40(3): 97-105.
260赵航, 盛婧雪, 李洪广, 等. 普洱茶提取物对宫颈癌hela细胞的诱导凋亡作用[J]. 中国生物制品学杂志, 2011, 24(2): 137-140.
Zhao H, Sheng J X, Li H G, et al. Induction of apoptosis of hela cells with pu-erh tea extracts [J]. Chinese Journal of Biologicals, 2011, 24(2): 137-140.
261Zhao X, Qian Y, Zou Y L, et al. Pu-erh tea has in vitro anticancer activity in TCA8113 cells and preventive effects on buccal mucosa cancer in U14 cells injected mice in vivo [J]. Nutrition and Cancer, 2014, 66(6): 1059-1069.

