贝莱斯芽孢杆菌YJK1鉴定及其对茶炭疽病的拮抗效果
唐朝阳 孔丽娅 胡骞 宋秋瑾 何鲁钱 楼骏 王占旗 何艳 张立钦 闵莉静
摘要:茶树炭疽病的发生严重威胁着茶产业的可持续发展,传统的化学农药防治方法存在农药残留和环境污染等问题。以筛选到的贝莱斯芽孢杆菌(Bacillus velezensis)YJK1生防新菌株为研究对象,探究了YJK1菌株对茶树病害的生物防治效果。平板拮抗试验发现YJK1菌株对茶树炭疽菌(Colletotrichum camelliae)、果生炭疽菌(Colletotrichum fructicola)、藤黑镰刀菌(Fusarium fujikuroi)等多种茶树真菌病害具有明显的抑制效果。YJK1发酵稀释液对茶树炭疽菌和果生炭疽菌孢子具有明显的抑制作用。喷施贝莱斯芽孢杆菌YJK1发酵液对白叶1号和黄金芽离体叶片的炭疽病病菌生长抑制效果明显,先喷施YJK1菌株发酵液再接种茶树炭疽菌,病菌生长抑制率为78.1%,同时喷施发酵液和接种炭疽菌,抑制率为61.8%。结果表明,YJK1菌株对茶树炭疽病“防”和“治”效果均显著。YJK1发酵液对多种真菌具有广谱性,稳定性测试结果说明发酵液中活性物质在80 ℃以下保持稳定;紫外处理60 min后抑制率仍高于50%;经不同pH处理后,当pH为5~11时,抑制率无显著区别。综上,贝莱斯芽孢杆菌YJK1在茶树绿色农业生产领域具有较好的应用潜力。
关键词:贝莱斯芽孢杆菌;茶炭疽病;拮抗菌;生物防治;稳定性
中图分类号:S571.1;S435.711 文献标识码:A 文章编号:1000-369X(2024)03-443-10
Antagonistic Activity and Utilization of Bacillus velezensis Strain YJK1 as A Biocontrol Agent Against Anthracnose on Camellia sinensis
TANG Zhaoyang1, KONG Liya1, HU Qian1, SONG Qiujin2, HE Luqian1, LOU Jun1, WANG Zhanqi1, HE Yan3, ZHANG Liqin1*, MIN Lijing1*
1. Key Laboratory of Vector Biology and Pathogen Control of Zhejiang Province, College of Life Sciences, Huzhou University, Huzhou 313000, China; 2. Zhejiang Zhongyi Testing Institute Co., Ltd., Hangzhou 310000, China; 3. Institute of Soil and Water Resources and Environmental Science, College of Environmental and Resource Sciences, Zhejiang University, Hangzhou 310000, China
Abstract: The tea industry is one of China's important agricultural economic resources. However, widespread outbreaks of anthracnose on Camellia sinensis pose a significant threat to the sustainability of the tea industry. Conventional approaches based on chemical pesticides face inherent challenges, including pesticide residue accumulation and environmental pollution. In this study, the biological control effect of Bacillus velezensis YJK1 on tea tree diseases was evaluated. The results demonstrat that the YJK1 isolate exhibited robust antagonistic activity against fungal diseases affecting tea trees, particularly against pathogens such as Colletotrichum camelliae, Colletotrichum fructicola and Fusarium fujikuroi. YJK1 fermentation diluent has a significant inhibitory effect on the spores of C. camelliae and C. fructicola. The inhibitory effects of YJK1 fermented liquid on the diameter of C. camelliae were evaluated with the detached tea leaves. YJK1 fermented liquid effectively prevented tea tree anthracnose with 78.1% control when applied 24 h before C. camelliae inoculation and 61.8% during simultaneous inoculation. However, its efficacy was limited (post-inoculation). The YJK1 fermentation broth has a broad-spectrum of activity against various fungi. The antagonistic activity of the fermented liquid was stable below 80 ℃. After 60 min of UV treatment, the inhibition rate was still above 50%. And after treatment with different pH values, there was no significant difference in the inhibition rate within the pH range of 5-11. These findings suggest that B. velezensis YJK1 is a promising biocontrol agent for the management of tea plant diseases.
Keywords: Bacillus velezensis, tea anthracnose, antagonistic bacteria, biological control, stability
茶树(Camellia sinensis)是一种重要的经济作物,茶产业已成为我国脱贫攻坚和乡村振兴的支柱产业[1-2]。然而茶树因喜湿喜温的生活习性,加上栽培技术的局限以及抗病品种的匮乏等因素,使得茶树真菌病害频繁发生[3]。其中以茶树炭疽病的发生最为普遍,据报道该病害的主要致病菌为茶树炭疽菌(Colletotrichum camelliae)和果生炭疽菌(Colletotrichum fructicola)[3]。这两种炭疽菌侵染茶树后,会干扰茶树的生理代谢过程,导致茶叶产量与品质下降[4-5]。
在炭疽病防治方面,生物防治因能够克服化学农药的缺陷,更符合绿色低碳的现代工农业发展理念,因此在农业生产中具有较高的经济价值和环境效益。贝莱斯芽孢杆菌在自然界中广泛分布,具有产酶能力强、次生代谢产物丰富、抗逆性强、抗菌活性高、抗菌谱广等特点[6-9],被用于多种植物病原菌例如烟草赤星病菌(Alternaria alternata)、尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)、番茄灰霉病菌(Botrytis cinerea)等防治[7-10]。但是,目前关于贝莱斯芽孢杆菌防治茶树病害的研究还未见报道。因此,从多种来源筛选新的贝莱斯芽孢杆菌菌株,发掘其抗茶树炭疽病等植物病原菌,并将其开发为生物防治剂是一个极具应用意义的研究方向[11-12]。本研究前期在植物叶片分离得到一株具有生防功能的细菌,经形态学观察和基因序列发育树进化分析确定该细菌为贝莱斯芽孢杆菌(Bacillus velezensis),并将其命名为YJK1。接着通过对该菌株与茶树炭疽菌等多种病原菌的拮抗作用来明确其抗菌谱,进一步探究该菌株发酵液对病原菌菌丝生长的影响,测试该菌株发酵液的抑菌活性物质的稳定性,最后对茶树叶片进行了离体叶片防治试验,通过不同时间点接种病原菌来检测YJK1菌株对茶树叶片病变的“防”和“治”的效果。旨在明确贝莱斯芽孢杆菌YJK1的特性,探索茶树炭疽病的生物防治,为保障我国的茶产业健康发展奠定理论基础。
1 材料与方法
1.1 供试菌种
本试验供试茶树炭疽菌(C. camelliae)、果生炭疽菌(C. fructicola)、藤黑镰刀菌(Fusarium fujikuroi)、Cytospora myrtagena、茄病镰刀菌(Fusarium solani)、尖孢镰刀菌(F. oxysporum)和禾谷镰孢(Fusarium graminearum),菌株保存于﹣80 ℃冰箱50%甘油溶液中。大豆疫霉(Phytophthora sojae)和瓜果腐霉(Pythium aphanidermatum)存放于V8固体斜面培养基。YJK1是从浙江台州采集的健康樱桃叶片中分离得到的内生细菌,通过平板对峙法筛选获得。
1.2 供试培养基
LB液体培养基:胰蛋白胨10.0 g、酵母提取物5.0 g、氯化钠10.0 g,定容至1 000 mL。PDA培养基(货号CM0139)购置于Oxoid公司。PDB液体培养基(货号P9240)购置于北京索莱宝科技有限公司。V8培养基:进口V8蔬菜汁加入1%(m/V)碳酸钙,充分搅拌,稀释10倍后分装于锥形瓶,固体V8培养基加入1.5%琼脂粉,121 ℃高温蒸汽灭菌20 min。
1.3 细菌形态学鉴定和细菌保守基因序列测定
按照《常见细菌系统鉴定手册》[13]和《伯杰氏细菌鉴定手册》[14]的方法对拮抗菌的形态进行鉴定。提取待测菌株的基因组,用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTTT-3′)扩增16 S rRNA基因序列;gyrA_F(42F:5′-CA
GTCAGGAAATGCGTACGTCTT-3′)和gyrA_R(1066R:5′-CAAGGTAATGCTCCAGGCATT
GCT-3′)扩增gyrA基因序列。PCR扩增产物经1%琼脂糖凝胶电泳检测后,将目的条带所在胶块切割并送至生物工程(上海)有限公司进行测序。利用NCBI网站的BLAST功能对所测的16 S rRNA基因和gyrA基因序列进行同源性分析,确定亲缘关系,使用MEGA 11软件[15]的Neighbor-Joining(NJ)法[16]构建系统发育树。
1.4 YJK1抗菌谱的测定
1.4.1 平板对峙试验
将待测病原菌接种于PDA培养基中央,25 ℃培养2~7 d备用。挑取YJK1菌株单菌落于LB液体培养基,37 ℃摇床180 r·min-1振荡培养24 h。使用打孔器(d=5 mm)在病原菌平板外周打孔,将其接种于平板中心,在距病原菌2.5 cm处接种10 μL YJK1菌夜作为处理组;同时以接种10 μL LB液体培养基作为空白对照组,置于28 ℃培养,每组3个重复。观察测量病原菌菌丝生长直径,计算菌丝生长抑制率。
菌丝生长抑制率=(对照菌丝直径-处理菌丝直径)/对照菌丝直径×100%
1.4.2 YJK1发酵液抑菌率测定
将YJK1菌株单菌落接种于LB液体培养基中,37 ℃摇床180 r·min-1培养18 h,得到种子液。将种子液以2%的接种量接种于LB液体发酵培养基,在30 ℃摇床180 r·min-1条件培养72 h,得到YJK1发酵液。分装于50 mL离心管中,12 000 r·min-1离心20 min,上清液用0.22 μm无菌过滤器过滤,制得YJK1无菌发酵液。
将YJK1无菌发酵液与PDA固体培养基按照10%(V/V)混合均匀后倒板作为处理组;同时以含10%(V/V)LB液体培养的PDA固体培养基作为空白对照组,分别将病原菌接种于上述两组PDA固体培养基的中央,每组设置3个重复,置于28 ℃观察测量病原菌生长直径,计算抑制率。
1.5 YJK1对炭疽菌分生孢子萌发率抑制测定
制备炭疽菌孢子悬浮液:将茶树炭疽菌与果生炭疽菌菌株置于PDA固体培养基25 ℃培养6 d,将菌丝块转移至PDB液体培养基,25 ℃摇床180 r·min-1,培养3 d。之后用两层纱布过滤菌液,液体部分经8 000 r·min-1离心10 min后,弃上清液,沉淀用灭菌超纯水重悬,最后用血球计数板将分生孢子浓度调节至每毫升1×108个。
将YJK1发酵液分别稀释5倍和10倍后与炭疽菌分生孢子混合作为处理组;同时以LB液体培养基与炭疽菌分生孢子混合作为空白对照组。25 ℃摇床180 r·min-1振荡培养6 h,显微镜观察孢子萌发状态,测量孢子萌发长度,每组处理重复3次。
1.6 YJK1发酵液抑菌活性物质稳定性测定
1.6.1 热稳定性
将YJK1无菌发酵液分别于40、80、100 ℃的水浴锅热处理60 min,自然冷却备用,以在25 ℃室温中未处理的发酵液为对照,测定不同温度对其发酵液抑菌率的影响。
1.6.2 紫外稳定性
将YJK1无菌发酵液置于距30 W紫外灯20 cm处,分别照射30、45、60 min,以未照射紫外灯发酵液为对照(0 min),测定不同紫外时间处理对其发酵液抑菌活性的影响。
1.6.3 酸碱稳定性
将YJK1无菌发酵液pH=8.65作为对照,分别用1 mol·L-1 HCl和1 mol·L-1 NaOH分别调至pH为3、5、7、9、11,静置6 h后,调回原始pH,测定发酵液经酸碱处理后的抑菌率的变化。
最后将上述3种处理后的发酵液按20%的比例混入PDA培养基,每组3个重复,置于25 ℃恒温培养箱培养。每隔48 h,十字交叉法测量真菌生长直径,拍照记录。
1.7 YJK1菌株对离体茶树叶片病斑抑制测定
分别取白叶1号和黄金芽茶树品种新鲜健康叶片,以无菌牙签制造伤口,将YJK1发酵液均匀喷洒,设置3个喷施处理:分别为接
种茶树炭疽菌前24 h(“防”,用YJK1-Cc表示)、接种茶树炭疽菌时(同时处理,用Cc&YJK1表示)和接种茶树炭疽菌后24 h(“治”,用Cc-YJK1表示),以喷施LB液体培养基作为对照。置于25 ℃培养箱培养,每隔24 h拍照观察记录病斑大小变化。每组重复3次。
茶树病斑防治效果=(对照病斑直径-处理病斑直径)/对照病斑直径×100%
2 结果与分析
2.1 YJK1菌株的鉴定
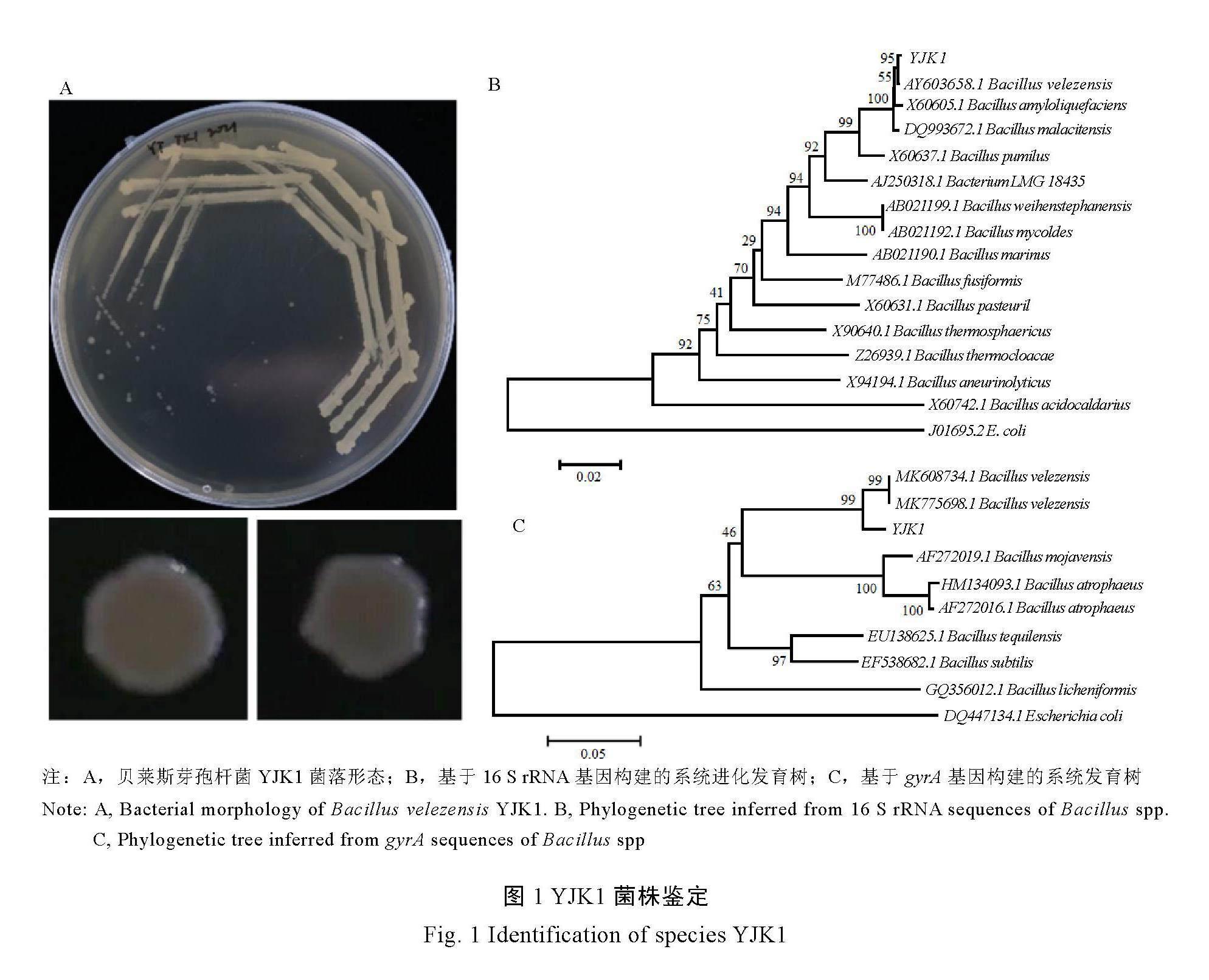
对生防菌YJK1菌落形态特征进行观察,发现YJK1菌落初期呈淡乳白色、脓状、圆形、边缘整齐、隆起成馒头状;后期菌落呈淡黄色,边缘不整齐,表面干燥有褶皱(图1)。与《常
见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》中描述的芽孢杆菌属形态特征基本一致。
将YJK1的16 S rRNA和gyrA基因序列在NCBI数据库中进行BLAST序列比对分析,结果显示YJK1菌株序列与贝莱斯芽孢杆菌Bacillus velezensis的序列同源性达到100%。同时利用MAGA 11软件基于16 S rRNA和gyrA基因构建的NJ系统发育树发现YJK1菌株与贝莱斯芽孢杆菌聚为一支(图1B和图1C)。结合菌落形态特征,将YJK1菌株鉴定为贝莱斯芽孢杆菌。
2.2 YJK1对茶炭疽病防效
2.2.1 YJK1抗菌谱的探究
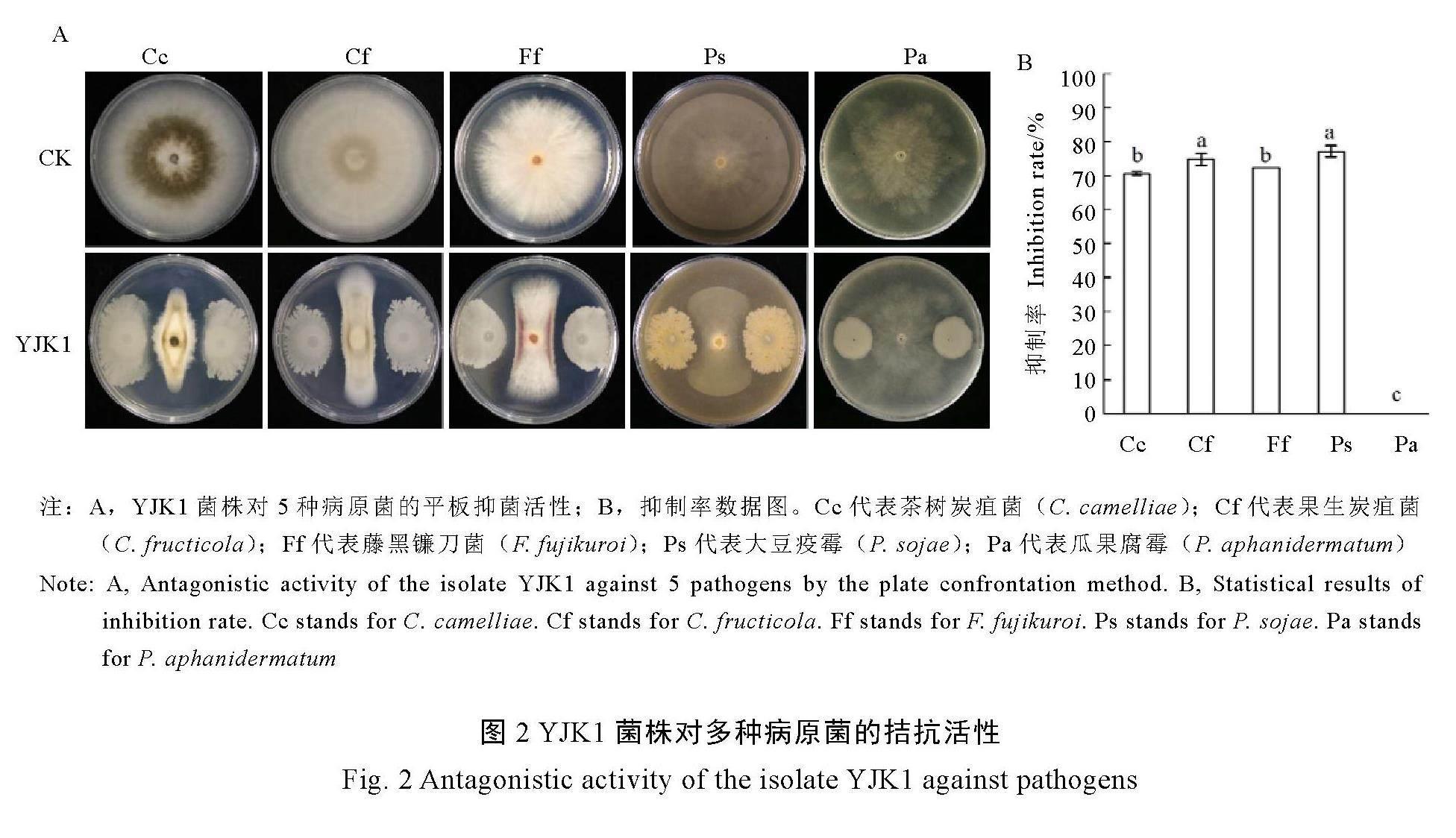
YJK1菌株与多种病原菌的平板对峙试验结果如图2所示,该菌株对茶树炭疽菌、果生炭疽菌和藤黑镰刀菌的抑菌率分别为70.7%、75.0%和72.5%,对大豆疫霉的抑菌率达77.3%,但对瓜果腐霉的抑菌率为0。因此,贝莱斯芽孢杆菌YJK1对腐霉无抑制作用,但对多种真菌和疫霉菌具有较好的抑制效果,YJK1对真菌具有广泛的抗菌作用。
2.2.2 YJK1发酵液对炭疽菌分生孢子的抑制作用
YJK1发酵液对分生孢子萌发的抑制结果
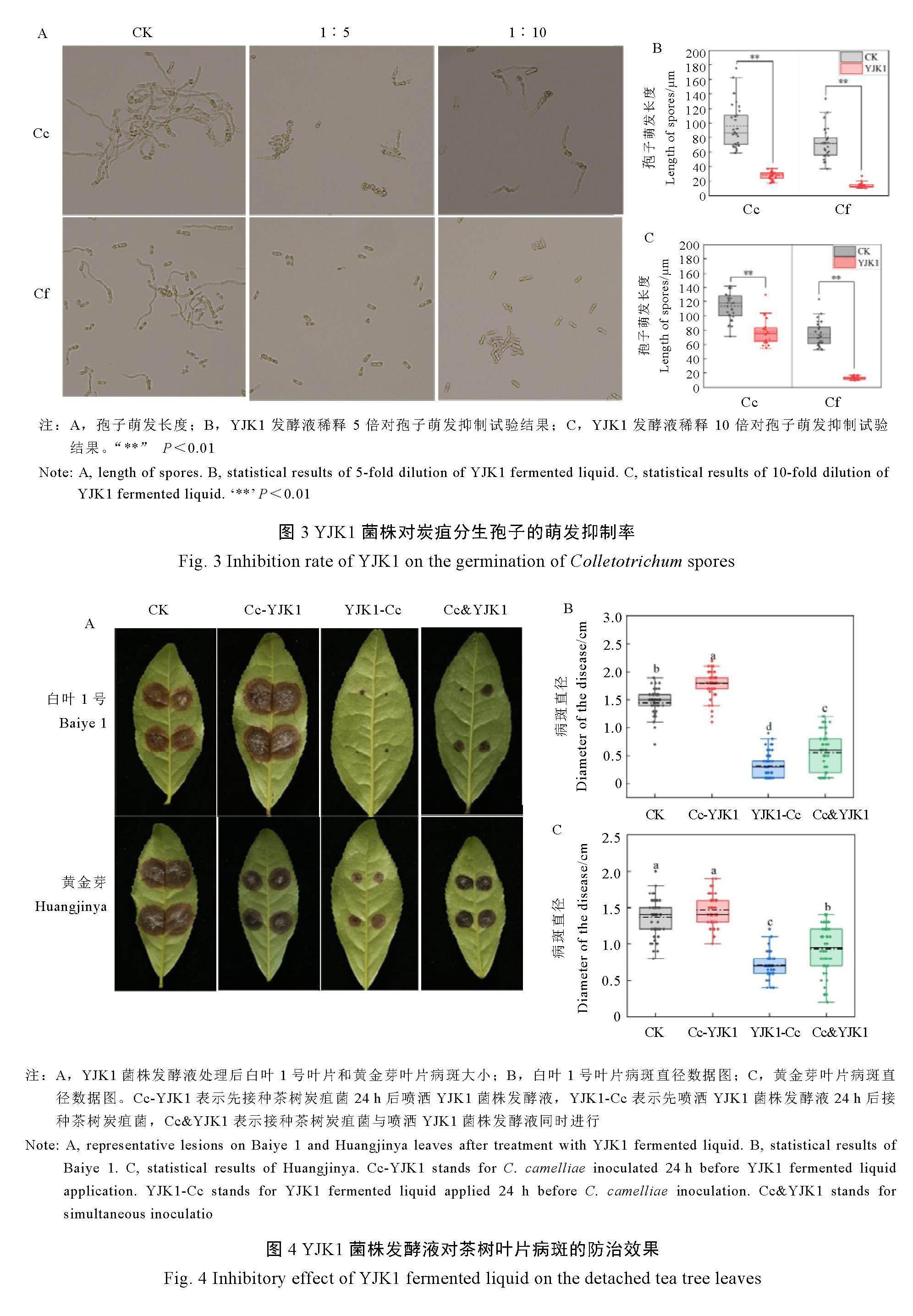
如图3所示,与对照组相比,YJK1菌株发酵液稀释5倍对茶树炭疽菌萌发长度抑制率为71.0%,对果生炭疽菌萌发长度抑制率为80.7%;发酵液稀释10倍对茶树炭疽菌萌发长度抑制率为28.9%;对果生炭疽菌萌发长度抑制率为82.5%。说明YJK1发酵液对炭疽菌分生孢子存在抑制作用。
2.2.3 YJK1发酵液对茶树炭疽病的防治效果
利用离体白叶1号叶片测定贝莱斯芽孢杆菌YJK1发酵液对茶树炭疽病防治效果,结果如图4所示。与对照组相比,先接种茶树炭疽菌24 h后喷洒YJK1菌株发酵液(Cc-YJK1),茶树病斑无明显变化,抑制效果不明显;而先喷洒YJK1菌株发酵液24 h后接种茶树炭疽菌时(YJK1-Cc)抑菌效果明显,防效达到78.1%;接种茶树炭疽菌与喷洒YJK1菌株发酵液同时进行时(Cc&YJK1)防效为61.8%。
利用离体黄金芽叶片测定贝莱斯芽孢杆菌YJK1发酵液对茶树炭疽病防治效果,结果表明,与对照组相比,先接种茶树炭疽菌再喷洒YJK1菌株发酵液时,抑制效果不明显;而无论是先喷洒YJK1菌株发酵液后接种茶树炭疽菌,还是同时接种,均表现为病斑直径显著减小,其防效分别为48.1%和34.2%。
2.3 YJK1发酵液的抑菌广谱性与稳定性
2.3.1 抑菌广谱性
YJK1菌株发酵液抑制试验结果(图5)显示,YJK1菌株发酵液对瓜果腐霉无明显抑制作用,抑制率仅为6.1%;对藤黑镰刀菌、茄病镰刀菌和禾谷镰孢菌均表现出较好的抑制效果,抑制率分别为51.8%、62.8%和64.8%;对茶树炭疽菌、果生炭疽菌和C. myrtagena表现出抑制作用,抑制率分别为79.7%、84.2%和94.1%;对尖孢镰刀菌的抑制率较差,为23.4%。由此可见,YJK1发酵液具有抑菌广谱性。
2.3.2 稳定性
热稳定性:发酵液热处理结果表明,经40 ℃、80 ℃处理后的抑制率与25 ℃室温处理的相比差异不显著,100 ℃处理后菌丝生长抑制作用虽然有所下降,但抑制率仍有41.9%(图6D)。综上,YJK1菌株发酵液中的活性物质具有较强的热稳定性。
紫外稳定性:紫外稳定性试验结果显示,虽然紫外照射后的抑制率与不照射的相比在统计学上显著降低,但紫外照射处理间抑制率不显著,且照射后对茶树炭疽菌菌丝生长抑制率仍能保持在50%以上。可见,经紫外线处理YJK1菌株发酵液后,对茶树炭疽菌菌丝生长
抑制活性影响较小,对紫外条件不敏感,紫外稳定性较好。
酸碱稳定性:酸碱稳定性结果显示,YJK1菌株发酵液经酸、碱性处理后,对茶树炭疽菌的抑制率均高于50%;在pH处于5~11,发酵液抑制率无显著区别,显著高于pH3的抑制率(图6F)。可见,YJK1菌株发酵液pH最适范围为5~11。
3 讨论
使用传统的化学农药不仅存在残留问题,还会对作物产生药害等影响,生物防治很大程度不仅能避免这些问题的发生,而且在防效上也表现突出。本研究中YJK1菌株发酵液对茶树炭疽病病防效可达78.1%。此外藤黑镰刀菌是鉴定到的茶树根腐病新病原,可以造成茶树死亡[17],YJK1对藤黑镰刀菌对峙抑制率达72.5%,发酵液抑制率达51.8%,说明YJK1不仅可用于叶部病害的防治,也可用于茶树根部病害的防治。病原菌分生孢子萌发能力在病害循环周期中十分重要,本研究表面YJK1发酵液对于茶树炭疽菌和果生炭疽菌的分生孢子萌发都具有明显的抑制作用,在同样发酵液浓度下,果生炭疽菌的抑制效果更为明显。其他研究表明,贝莱斯芽孢杆菌稀释5倍和10倍的发酵液喷洒到樱桃树上,其对樱桃穿孔病的防治效果分别达78.4%和70.0%[17]。
芽孢杆菌对病原微生物的拮抗作用主要是通过分泌抑制活性的次生代谢物起作用[18]。研究表明,贝莱斯芽孢杆菌主要通过分泌脂肽类抗生素、聚酮类化合物和抗菌蛋白等产生抑菌作用[19],Trinh等[21]从黑胡椒根际中分离出的RB.DS29菌株能产生具有蛋白酶、几丁质酶和β-葡聚糖酶活性的抑菌物质,能破坏疫霉菌等真菌的细胞壁,从而对病原真菌具有良好的拮抗效果。除了贝莱斯芽孢杆菌可以产生抑菌物质,Chowdhury等[22]明确代谢产物脂肽类和聚酮类物质如Surfactin、Fengycin和Bacillomycin D还能够介导莴苣的防御性免疫反应。本研究中的YJK1菌株发酵液抑菌效果明显,但菌株发酵液中成分复杂,目前尚未明确具体是哪些代谢产物对茶树炭疽菌有拮抗效果,还需要更深入分析其抗菌物质以及相关抑菌机制。本研究还表明YJK1菌株的抑菌活性物质具有较强的稳定性,在高温、紫外线、酸碱条件处理后对炭疽菌菌丝的抑制率无明显影响。这些特征为其有效成分的分离奠定了基础。
本研究的离体叶片试验结果表明,YJK1菌株发酵液能够降低茶树炭疽病的发病率,在预防茶树病害方面有显著效果,且与黄金芽相比,其对白叶1号病斑的抑制效果更显著。而在白叶1号接种病原菌24 h后再喷施YJK1菌株发酵液,病斑直径稍有增大,说明菌株对离体茶树炭疽病的治疗效果较差,还需进行田间试验进一步验证。未来仍需要深入研究该菌株的拮抗机理及最佳发酵条件,对其发酵液中抑菌活性物质进行分离纯化、结构鉴定来提高生防制剂的实效性,并通过田间试验检验其生防效果,使其能进一步开发为生物农药,为生态友好型茶业实践提供可行范本。
参考文献
169王玉春, 刘守安, 卢秦华, 等. 中国茶树炭疽菌属病害研究进展及展望[J]. 植物保护学报, 2019, 46(5): 954-963.
Wang Y C, Liu S A, Lu Q H, et al. Research progress and prospects of Colletotrichum species causing tea plant diseases in China [J]. Journal of Plant Protection, 2019, 46(5): 954-963.
170李欣, 黄月玲, 韦俊峰. 布央侗寨茶产业助推乡村振兴的路径与模式[J]. 茶叶通讯, 2019, 46(1): 125-128.
Li X, Huang Y L, Wei J F. The path and model of Buyangs tea industry promoting rural revitalization [J]. Journal of Tea Communication, 2019, 46(1): 125-128.
171贡长怡, 刘姣姣, 邓强, 等. 茶树炭疽病病原菌鉴定及其致病性分析[J]. 园艺学报, 2022, 49(5): 1092-1101.
Gong C Y, Liu J J, Deng Q, et al. Identification and pathogenicity of Colletotrichum species causing anthracnose on Camellia sinensis [J]. Acta Horticulturae Sinica, 2022, 49(5): 1092-1101.
172徐小文, 王义勋, 张子一, 等. 山茶炭疽菌CcSnf1基因参与调控山茶炭疽菌的生长发育和致病力[J]. 植物病理学报, 2022, 52(6): 927-939.
Xu X W, Wang Y X, Zhang Z Y, et al. CcSnf1 is involved in regulating development and pathogenicity in Colletotrichum camelliae [J]. Acta Phytopathologica Sinica, 2022, 52(6): 927-939.
173Cannon P F, Damm U, Johnston P R, et al. Colletotrichum: current status and future directions [J]. Studies in Mycology, 2012, 73(1): 181-213.
174徐淑琴, 贺曦, 龚紫凤, 等. 贝莱斯芽孢杆菌的生物学特性及其农业应用现状[J]. 饲料研究, 2022, 45(9): 143-147.
Xu S Q, He X, Gong Z F, et al. Biological characteristics of Bacillus velezensis and its agricultural application [J]. Feed Research, 2022, 45(9): 143-147.
175Baptista J P, Teixeira G M, De Jesus M L, et al. Antifungal activity and genomic characterization of the biocontrol agent Bacillus velezensis CMRP 4489 [J]. Scientific Reports, 2022, 12(1): 17401. doi: 10.1038/s41598-022-22380-0.
176Tang T, Wang F, Huang H, et al. Antipathogenic activities of volatile organic compounds produced by Bacillus velezensis LT1 against Sclerotium rolfsii LC1, the pathogen of southern blight in Coptis chinensis [J]. Journal of Agricultural and Food Chemistry, 2024, 72(18): 10282-10294.
177沙月霞, 隋书婷, 曾庆超, 等. 贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力[J]. 中国农业科学, 2019, 52(11): 1908-1917.
Sha Y X, Sui S T, Zeng Q C, et al. Biocontrol potential of Bacillus velezensis strain E69 against rice blast and other fungal diseases [J]. Scientia Agricultura Sinica, 2019, 52(11): 1908-1917.
178Martínez-Raudales I, De La Cruz-Rodríguez Y, Vega-Arreguín J, et al. Draft genome sequence of Bacillus velezensis 3a-25b, a strain with biocontrol activity against fungal and oomycete root plant phytopathogens, isolated from grassland soil [J]. Genome Announcements, 2017, 5(39): e01021-17. doi: 10.1128/genomea.01021-17.
179张玉丹, 谭琳, 刘仲华, 等. 茶树炭疽病菌拮抗链霉菌的筛选及其抑菌特性研究[J]. 茶叶科学, 2024, 44(2): 283-298.
Zhang Y D, Tan L, Liu Z H, et al. Identification of antagonistic Streptomycetes against anthracnose pathogen of tea plants and determination of their inhibitory properties [J]. Journal of Tea Science, 2024, 44(2): 283-298.
180尉婧, 王碧香, 李诗瑶, 等. 贝莱斯芽孢杆菌(Bacillus velezensis)的研究进展[J]. 天津农学院学报, 2022, 29(4): 86-91.
Wei J, Wang B X, Li S Y, et al. Advances in the study of Bacillus velezensis [J]. Journal of Tianjin Agricultural College, 2022, 29(4): 86-91.
181东秀株, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 162.
Dong X Z, Cai M Y. Manual of determinative bacteriology [M]. Beijing: Science Press, 2001: 162.
182Holt J G. Bergeys manual of determinative bacteriology [M]. 9th ed. Baltimore: Lippincott Williams & Wilkins, 1994.
183Tamura K, Stecher G, Kumar S. MEGA11: molecular evolutionary genetics analysis version 11 [J]. Molecular Biology and Evolution, 2021, 38(7): 3022-3027.
184Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees [J]. Molecular Biology and Evolution, 1987, 4(4): 406-425.
185Tang Z Y, Zhu J, Song Q J, et al. Identification and pathogenicity of Fusarium spp. associated with tea wilt in Zhejiang Province, China [J]. BMC Microbiology, 2024, 24(1): 38. doi: 10.1186/s12866-023-03174-4.
186赵金, 高子晴, 丛丽娜. 贝莱斯芽孢杆菌BA-300的鉴定、发酵条件优化及应用[J]. 大连工业大学学报, 2023, 42(3): 176-180.
Zhao J, Gao Z Q, Cong L N. Identification, optimal fermentation conditions and application of Bacillus velezensis BA-300 [J]. Journal of Dalian Polytechnic University, 2023, 42(3): 176-180.
187SunY, Yang N, Li S, et al. Mechanism of oxalate decarboxylase Oxd_S12 from Bacillus velezensis BvZ45-1 in defense against cotton verticillium wilt [J]. Journal of Experimental Botany, 2024, 75(11): 3500-3520.
188陶永梅, 潘洪吉, 黄健, 等. 新型生防微生物因子贝莱斯芽孢杆菌(Bacillus velezensis)的研究与应用[J]. 中国植保导刊, 2019, 39(9): 26-33.
Tao Y M, Pan H J, Huang J, et al. Research and application of a novel bio-control microbial factor Bacillus velezensis [J]. China Plant Protection, 2019, 39(9): 26-33.
189Trinh T H T, Wang S L, Nguyen V B, et al. A potent antifungal rhizobacteria Bacillus velezensis RB.DS29 isolated from black pepper (Piper nigrum L.) [J]. Research on Chemical Intermediates, 2019, 45(11): 5309-5323.
190Chowdhury S P, Uhl J, Grosch R, et al. Cyclic lipopeptides of Bacillus amyloliquefaciens subsp. plantarum colonizing the lettuce rhizosphere enhance plant defense responses toward the bottom rot pathogen Rhizoctonia solani [J]. Molecular Plant-Microbe Interactions, 2015, 28(9): 984-995.

