茶叶中手性农药残留分析与风险评估研究进展
胡月 宁亚婷 黎洪霞 罗逢健 尹荣秀 张新忠
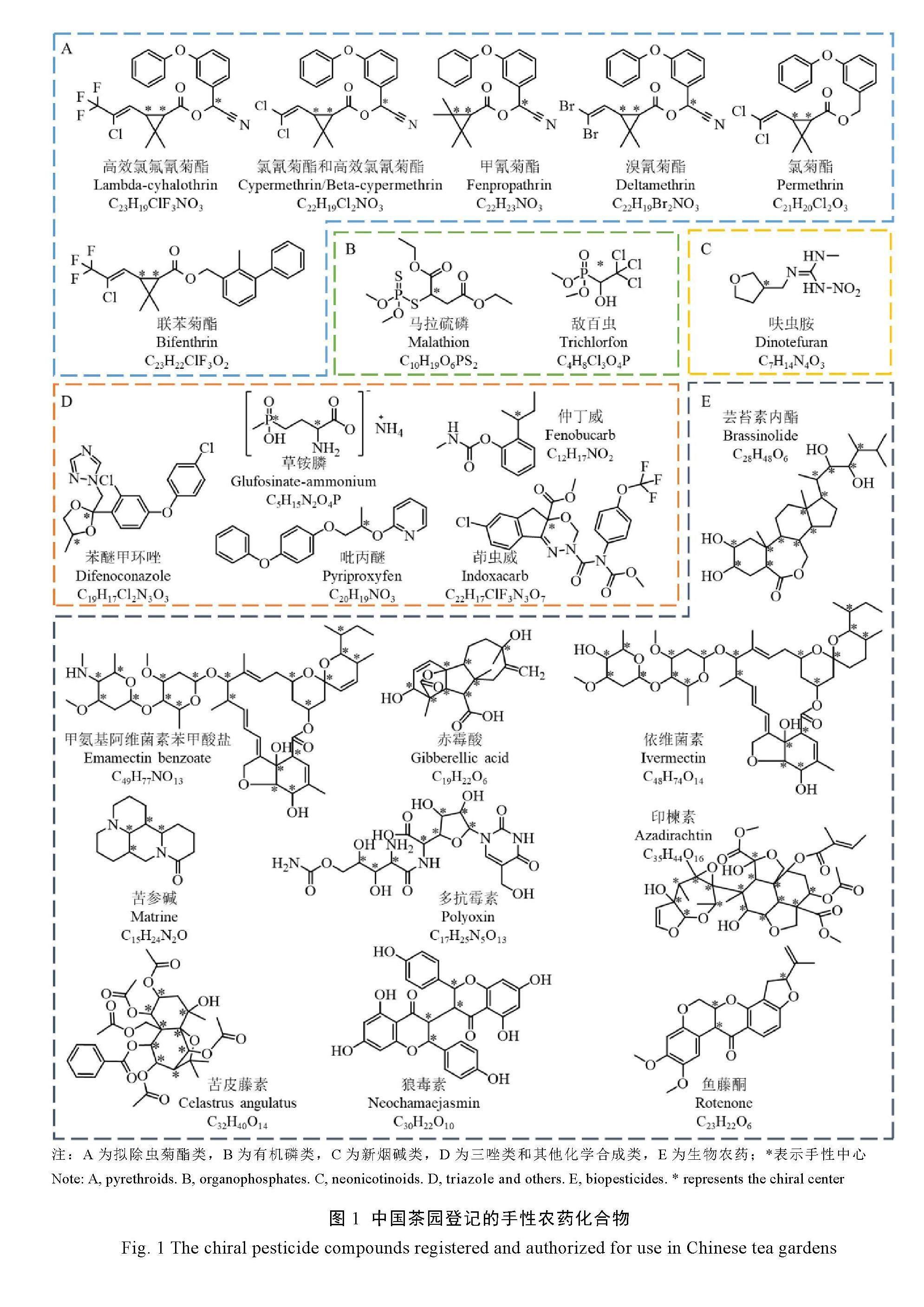
摘要:手性农药存在一个或多个对映体,其对映体在生物活性、毒性、环境行为、降解代谢等方面可能存在差异。茶叶作为三大无酒精饮品之一,其质量安全问题备受关注。虽然目前更关注手性农药外消旋体残留总量,但随着分析技术的发展,同时为了更好地发挥药效、减少残留及对非靶标物危害,充分了解茶叶中手性农药对映体的立体选择性行为,分析在茶叶中的残留降解规律,建立对映体的残留限量标准显得尤为重要。综述了茶叶中手性农药对映体残留检测技术现状,如液相色谱法、气相色谱法和超临界流体色谱法等方法,并对手性农药对映体在茶叶中的残留降解行为和风险评估进行归纳和展望,为后续深入开展茶叶中手性农药对映体的相关研究提供借鉴。
关键词:茶叶;手性农药;对映体;残留分析;风险评估
中图分类号:S571.1;S482 文献标识码:A 文章编号:1000-369X(2024)03-363-23
Research Progress in the Residue Analysis and Risk Assessment of Chiral Pesticides in Tea
HU Yue1,2, NING Yating1,2, LI Hongxia2, LUO Fengjian1, YIN Rongxiu3*, ZHANG Xinzhong1*
1. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China;
2. Graduate School of Chinese Academy of Agriculture Sciences, Beijing 100081, China;
3. Tea Research Institute, Guizhou Provincial Academy of Agricultural Sciences, Guiyang 550006, China
Abstract: Chiral pesticides have one or more enantiomers, and their biological activity, toxicity, environmental behavior, degradation and metabolism may be different. Tea, as one of the three major beverages, has attracted much attention in terms of quality and safety. However, more attention is currently paid to the total amount of pesticide racemate residues. With the development of analytical techniques, it is particularly crucial to fully understand the stereoselective behavior of the chiral pesticide enantiomer in tea, as well as to examine residue degradation in tea and to set the maximum residue limits for enantiomers. This would help to improve the efficacies of chiral pesticides and reduce their residues and toxicities to non-target organisms. In this paper, the current status of chiral pesticide separation and residue detection technology in tea were reviewed, such as liquid chromatography, gas chromatography and supercritical fluid chromatography. In addition, it provided a summary of the residue degradation behaviors and risk assessment of chiral pesticide enantiomers in tea, which would be useful as a guide for further in-depth studies on chiral pesticide enantiomers in tea.
Keywords: tea, chiralpesticide, enantiomer, residue analysis, risk assessment
手性是指自然界存在的、物质本身与其镜像分子呈左右手对称,但又不能重叠的现象。一个原子连有4个不同原子或官能团,则被称为手性中心,碳(C)、氮(N)、磷(P)、硫(S)等都可作为手性中心。手性对映体是彼此成镜像、又不能重叠的一对立体异构体,有左旋、右旋之分,二者互为1︰1的混合物称为外消旋体。手性农药(Chiral pesticides)是指含一个或多个手性中心化合物的农药。目前全球市场上手性农药约占25%,我国农药市场上含手性结构的农药占40%左右,大部分以外消旋体形式销售使用,只有约7%以单一或富含一种对映异构体形式销售[1]。
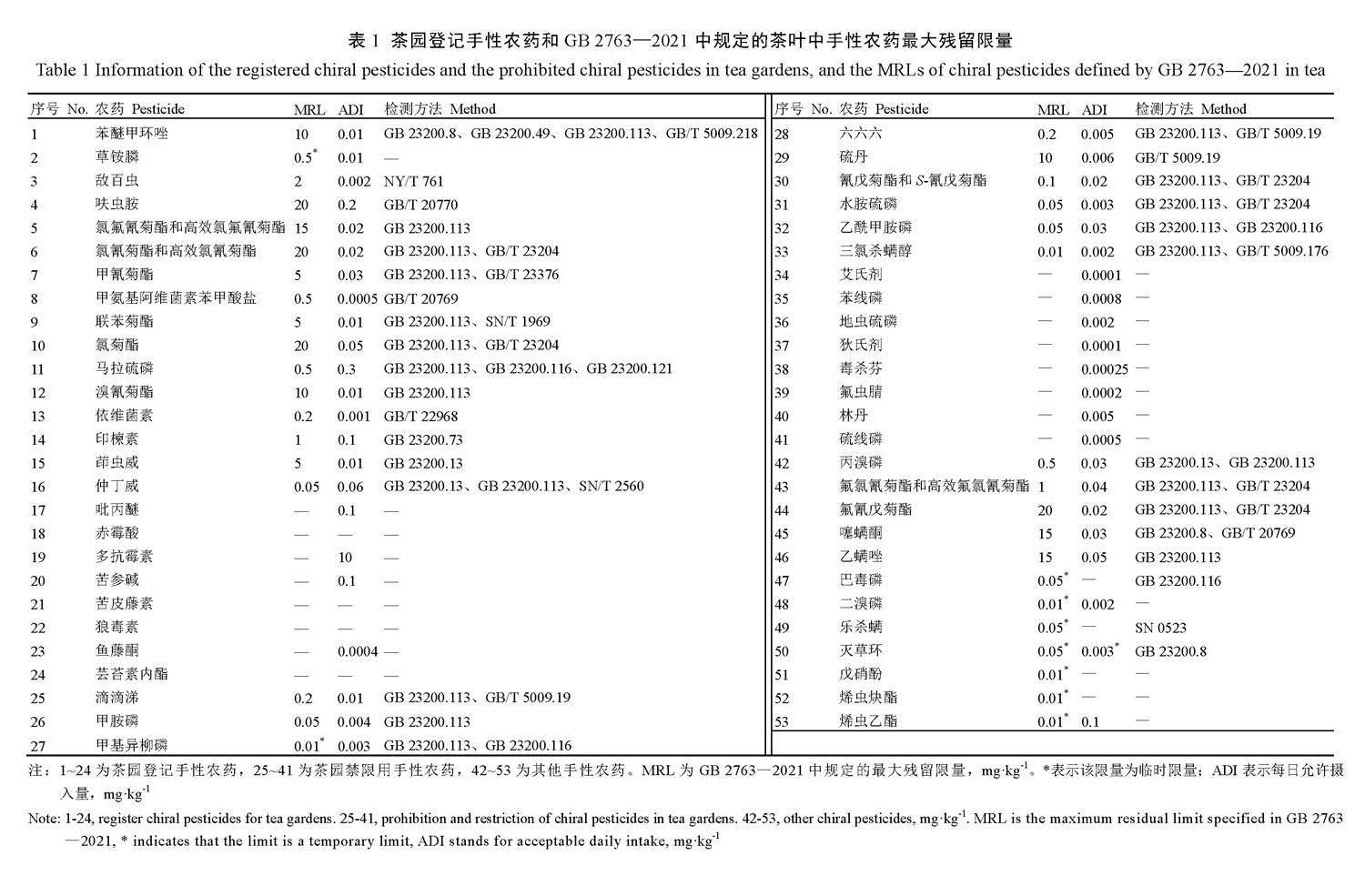
茶树易发生病虫害,从而影响产量和质量。近年来,虽然茶树病虫害绿色防控发展良好,但施用化学农药仍然是防治茶树病虫害最快捷有效的方式。截至目前,我国茶园登记允许使用的81种农药化合物有效成分中有24种具有手性结构(图1),占比约30%,受合成、制备技术水平和成本等影响,绝大部分手性结构化合物农药仍以外消旋体产品为主进行销售,在茶叶和环境土壤水中的残留物大部分也是外消旋体;我国茶园禁限用农药化合物共63种,其中17种具有手性结构,占比达27%;GB 2763—2021规定茶叶及饮料类食品中农药最大残留限量(Maximum residue limit,MRL)标准110项,其中37种化合物具有手性结构,占比达34%(表1)。随着研究的深入,关于手性农药对映体残留降解、毒理及其代谢转化研究越来越多,发现手性农药对映体的生物活性和环境毒理存在较大差异,左旋和右旋异构体表现出不同的生物活性和立体选择性,如S-茚虫威具有较高的杀虫活性,而R-茚虫威杀虫活性较低甚至没有,S-茚虫威对蜜蜂和茶尺蠖的毒性远大于R-茚虫威[2];(-)-戊菌唑在葡萄和土壤中优先降解[3]。使用生物活性高的对映单体农药可以提高药效并减少环境污染。
过去将外消旋体视作同一化合物可能会导致错误的判断,不能更深入、更科学地评价手性结构化合物农药,因此必须从对映体水平开展活性、毒性、环境安全等评价。本文对茶叶中手性农药残留分析和风险评估进行总结,归纳、综述其检测方法、残留降解行为等,并对未来科研发展和应用进行展望。
1 茶叶中手性农药种类及其毒性
茶叶中涉及的手性农药,根据化合物结构不同可大致分为有机氯类、有机磷类、拟除虫菊酯类、三唑类及其他类。
1.1 有机氯类农药
有机氯类农药(Organochlorine pesticides,OCPs)是一类结构中含有氯元素,用于防治植物病虫害的有机化合物农药。OCPs主要分为两大类,一类是以苯为原料的氯苯类,一类是以环戊二烯为原料的氯化亚甲基萘类,前者包括α-六六六、滴滴涕、三氯杀螨醇、百菌清等,后者包括氯丹、七氯、艾氏剂等。OCPs主要通过氯基干扰和抑制目标生物体中神经系统的生理过程发挥作用,如和各类激素受体特异性结合激活通路产生各种毒性作用[4]。超过50%的OCPs有手性结构。OCPs具有持久性、高毒性、生物蓄积性和半挥发性的特点[5],严重污染环境,很多已被列为持久性有机污染物(Persistent organic pollutants,POPs),如艾氏剂、狄氏剂、异狄氏剂、滴滴涕、氯丹、六氯苯等;截至2022年9月,我国农业部发布禁限用48种农药中有10种是有机氯农药(六六六、滴滴涕、毒杀芬、氯丹、灭蚁灵、艾氏剂、狄氏剂、三氯杀螨醇、硫丹和林丹)[6],大部分具有手性结构。由于部分OCPs具有持久残留性,通过食物链富集对健康产生危害,已逐渐被其他高效低毒类农药替代,这类农药目前在茶叶中的残留量很低,除特殊生长环境的茶园外,几乎可以忽略不计。目前GB 2763—2021对茶叶及饮料中7种OCPs规定了MRLs,均未对手性对映体进行区分(表1)。
1.2 有机磷类农药
有机磷类农药(Organophosphate pesticides,OPPs)是一类结构中含有磷元素的有机化合物农药,广泛用于植物病虫害防治。OPPs通过磷酰基与酶的活性部位结合来抑制乙酰胆碱酯酶(AChE)的活性,导致乙酰胆碱堆积刺激动物神经过度兴奋而产生中毒现象。OPPs具有急性毒性、易降解、残留期短的特点,逐渐替代有机氯类农药,但是残留的OPPs进入人体后仍会产生潜在危害[7]。常见的50余种OPPs中有一半化合物具有手性结构,主要是含有P=S或P=O键的正四面体结构。手性有机磷农药对映体之间也存在不同的生物活性,包括毒性、酶抑制活性和生物降解能力等,如(-)-甲胺磷对乙酰胆碱酯酶的活性抑制是(+)-甲胺磷的8~12.4倍,而(+)-甲胺磷对大型溞的急性毒性是(-)-甲胺磷的7倍[8];敌百虫对映体对乙酰胆碱酯酶的抑制差异为(-)-敌百虫>(+)-敌百虫>Rac-敌百虫[9];水胺硫磷对藻类和大型溞的氧化应激和毒性具有明显的对映选择性,表现为(+)-水胺硫磷>Rac-水胺硫磷>(-)-水胺硫磷[10]。目前,我国茶园登记许可使用的OPPs共10种,如草甘膦、哒嗪硫磷和敌百虫等,其中具有手性中心结构的有马拉硫磷和敌百虫(图1)。由于OPPs的高毒性,水胺硫磷、甲胺磷和硫线磷等23种高毒农药被列入茶园禁限用农药名单,GB 2763—2021对茶叶及饮料中32种有机磷农药制定了MRLs,如敌百虫为2 mg·kg-1、马拉硫磷为0.5 mg·kg-1、水胺硫磷为0.05 mg·kg-1等(表1)。
1.3 拟除虫菊酯类农药
拟除虫菊酯类农药(Synthetic pyrethroid pesticides,SPPs)是一类由人工合成的模拟天然除虫菊素的有机化合物杀虫剂。SPPs通过改变钠通道门控电压的动力学干扰神经膜中钠离子通道,导致钠离子通道打开时间过长,影响神经信号的传递[11],具有高效、低毒、广谱的特点。相比OCPs和OPPs,其生物活性和环境相容性较好,被广泛用于农作物的种植和生产中。但SPPs对光、热较稳定,自然环境下降解较慢,更容易导致残留问题,从而对健康产生危害。绝大多数SPPs具有手性结构,含有一个或多个手性中心,具有多个对映体,但其杀虫活性往往只存在一个或几个异构体上。如溴氰菊酯有3个手性中心8个对映体,其中只有(R,R,S)-溴氰菊酯和(R,S,S)-溴氰菊酯具有杀虫活性[12];氰戊菊酯有4个对映体,其中(S,S)-氰戊菊酯的杀虫活性最高,约为外消旋体的4倍[13];崔璇[14]研究发现,(+)-高效氯氟氰菊酯对茶尺蠖的半致死浓度(LC50)远大于10 000 mg·L-1,为无效体,(-)-高效氯氟氰菊酯对茶尺蠖的杀虫活性是外消旋体的9倍。目前,我国茶园登记许可使用的拟除虫菊酯类农药有8种,如高效氯氟氰菊酯、高效氯氰菊酯、甲氰菊酯、溴氰菊酯、联苯菊酯和氯菊酯等,几乎均具有手性中心结构(图1)。氰戊菊酯被列入茶园禁限用名单,GB 2763—2021对茶叶及饮料中10种拟除虫菊酯类农药制定了MRLs,如溴氰菊酯为10 mg·kg-1、甲氰菊酯为5 mg·kg-1、氰戊菊酯和S-氰戊菊酯为0.1 mg·kg-1等(表1)。
1.4 三唑类农药
三唑类农药(Triazole pesticides,TPs)是一类化学结构主链上含有羟基(或酮基)、取代苯基和1,2,4-三唑基团的有机化合物农药,通过抑制麦角甾醇的合成,抑制病菌的附着胞形成,使菌丝生长和孢子形成受阻,从而抑制真菌性病害[15-16]。TPs具有药效高、持效期长、内吸性好、杀菌谱广等特点[17]。目前,商品化的三唑类农药有30余种,其中80%具有手性结构[18],如多效唑有2个手性中心共4个立体异构体,杀菌活性为(2R,3R)-多效唑>(2S,3R)-多效唑>(2R,2S)-多效唑>(2S,3S)-多效唑,而(2S,3S)-多效唑则具有较强植物生长调节作用[19];R-烯唑醇杀菌活性远高于S-烯唑醇,S-烯唑醇的植物生长调节活性高于R-烯唑醇;苯醚甲环唑对水稻4种致病菌(稻瘟病菌、稻恶苗病菌、稻立枯病菌和稻曲病菌)的生物活性差异表现为(2S,4R)-苯醚甲环唑>(2R,4R)-苯醚甲环唑>(2R,4S)-苯醚甲环唑>(2S,4S)-苯醚甲环唑[20]。目前,我国茶园登记许可使用的三唑类杀菌剂农药仅有苯醚甲环唑,具有两个手性中心(图1),GB 2763—2021中对茶叶及饮料中三唑类农药苯醚甲环唑的MRL为10 mg·kg-1。
1.5 其他化学合成类农药
除有机氯类、有机磷类、拟除虫菊酯类杀虫剂和三唑类杀菌剂外,常见农药还有酰胺类除草剂、苯氧羧酸类除草剂以及一些杂原子农药等,其部分化合物也具有手性结构,如苯氧羧酸类除草剂2,4-滴丙酸(DCPP)、喹禾灵、吡氟氯禾灵等,由于丙酸酯α位被芳氧基取代而具有手性,其生物活性多集中表现在R-体上,S-体几乎没有活性。另外,噁二嗪类化合物茚虫威具有杀虫谱广、见效快等特点,最初上市亦为外消旋体产品,随后研究发现主要杀虫活性为S-茚虫威,逐渐被高比例的S-茚虫威富集产品或S-茚虫威单体产品代替[2]。新烟碱类农药是当前农业上很多农药的替代品种,这类农药在茶汤冲泡中浸出率高,不建议在茶园中施用。呋虫胺是最早商品化的新一代手性新烟碱类杀虫剂,有1个手性碳中心2个对映体,其中S-呋虫胺既是高活体也是高毒体,对蚯蚓和蜜蜂的毒性远高于R-呋虫胺,而R-呋虫胺也表现出较好的杀虫活性且在作物中优先降解,因此开发高比例的R-呋虫胺农药有利于保持杀虫活性,同时降低对非靶标生物和生态环境的负效应[21]。绳慧珊[22]研究发现,呋虫胺对茶尺蠖的触杀活性大小为S-呋虫胺>Rac-呋虫胺>R-呋虫胺。目前,我国茶园登记许可使用的有呋虫胺、吡丙醚和茚虫威等(图1),溴甲烷、克百威和灭多威等被列入茶园禁限用名单,GB 2763—2021对茶叶及饮料中其他类农药制定MRLs的有呋虫胺(20 mg·kg-1)、仲丁威(0.05 mg·kg-1)和克百威(0.02 mg·kg-1)等,后续要注意高浸出率农药施用风险。
不同手性农药对映体的生物活性、毒性和环境效应等都可能存在较大差异,造成了在茶叶等农产品中的残留差异。因此,对茶园手性农药,如果只从外消旋体层面开展研究可能会引起错误判断,无法有效保障茶叶质量和饮用安全,有必要全方位对手性农药对映体进行活性、毒性、残留降解代谢等评价,而在评价之前,建立合适的手性农药对映体分析方法是研究的基础。
2 茶叶中手性农药对映体拆分检测方法
2.1 手性农药对映体拆分方法
手性化合物对映单体可以通过化学直接不对称合成和外消旋体拆分获得。相比于化学直接合成法,手性拆分随着手性色谱柱填料等技术发展,其成本更低、操作更简单方便。目前常用手性对映体拆分方法包括结晶拆分法、化学拆分法、微生物酶拆分法和色谱拆分法,其中色谱拆分法简单快速、分离效果好、应用最广泛[23],主要有液相色谱法、气相色谱法和超临界流体法等。
液相色谱法有正相和反相色谱模式,正相色谱主要以正己烷、异丙醇等为流动相,通过氢键、π-π和偶极-偶极作用力使对映体分离,反相色谱通常以水或含水缓冲液与有机溶剂改性剂(如甲醇或乙腈)为流动相,强极性流动相更容易和手性固定相形成氢键和疏水作用等成为手性识别的关键因素。如王鹏等[24]以正己烷-异丙醇为流动相,用CDMPC手性固定相成功拆分戊唑醇和三唑酮对映异构体,并比较了流动相中异丙醇的含量对拆分的影响,发现减少异丙醇含量有利于增加两种农药对映体的分离度,该课题组后续以甲醇-水为流动相,在反相液相色谱条件下对己唑醇、烯唑醇、粉唑醇、三唑酮和戊唑醇对映体实现了拆分[25]。
气相色谱更适合非极性、热稳定性良好、易于挥发的物质。如Kuang等[26]用BGB-172柱成功分离氯氰菊酯和联苯菊酯对映体,建立了GC-ECD方法检测茶叶中两种农药对映体。Wang等[27]采用气质联用方法、BGB-176柱分离乙酰甲胺磷与甲胺磷对映体。宁亚婷等[28]比较了液相色谱和气相色谱条件下不同色谱柱分离cis-联苯菊酯和高效氯氟氰菊酯对映体的效果,发现用气相色谱法、BGB-172柱能很好实现两种农药手性对映体的分离。
超临界流体技术具有分离效率高、有机溶剂耗费少、绿色环保等优点。如冯硕立等[29]采用超临界流体色谱技术,在Chiralpak IB柱上对三唑酮、己唑醇、戊唑醇、烯效唑、腈菌唑和恶醚唑6种三唑类杀菌剂实现了手性拆分。缪叶隆[30]以超临界CO2为流动相,在Chiralpak AD-3柱上对甲基异柳磷、异硫磷、水胺硫磷、丁烯氟虫腈、氟虫腈和乙虫腈6种手性农药实现对映体分离。
在色谱拆分中,手性固定相是识别和分离手性化合物对映体的关键,如多糖类衍生物型、Pirkle型和环糊精等,其中多糖类衍生物手性固定相因其广泛的手性识别能力、较好的稳定性和耐用性等优点而得到广泛的应用[23]。张天赐等[31]采用自制的含苯甲酰胺连接臂的β-环糊精手性固定相(TCDP),以乙腈-水作为流动相,实现了反相液相色谱下腈菌唑对映体完全分离;张文华等[32]利用多糖类手性色谱柱Acquity Trefoil AMY1结合超高效合相色谱法成功实现6种三唑类农药16种对映体的拆分;周励等[33]采用多糖衍生物耐溶剂型手性色谱柱Chiralpak IH,以乙腈-水为流动相,在反相色谱条件下同时拆分了多效唑、己唑醇、糠菌唑3种手性农药对映异构体,取得了较好的效果。除手性固定相之外,拆分条件的改变,如色谱柱和流动相的温度、流动相的组成及比例、流速和改性剂等都会对对映体的分离度产生较大影响[34]。如齐艳丽等[35]考察了合相色谱拆分时手性固定相、改性剂种类及比例、系统备压、流动相流速和色谱柱温度等因素对三唑类手性农药对映体分离的影响,发现改性剂对化合物的洗脱能力大小顺序为甲醇>乙醇>异丙醇>乙腈;以异丙醇为改性剂时,化合物保留因子随着异丙醇比例的升高而降低,分离因子及分离度也逐渐减小,分离度随着流速的增加而减小,温度变化无显著影响。色谱法在手性农药对映体拆分上应用广泛,但该方法需要借助仪器设备,操作复杂,需要专业技术人员和大量的时间成本等。所以,近年来也有研究者开发出基于抗原抗体特异性反应的免疫分析法[36]、基于分子印迹聚合物的分子印迹技术[37]等方法用于手性化合物拆分。
2.2 茶叶基质中手性农药对映体残留检测方法
2.2.1 液相色谱法
液相色谱(Liquid chromatography,LC)是以液体为流动相,选择不同类型填料作为固定相,利用不同化合物在固液之间的吸附交换分配实现分离的技术,适用于极性大、不耐热、不易挥发的物质,具有分离速度快、分离效率高、操作简便、选择性好、灵敏度高等特点[38]。和对映体色谱拆分方法相同,液相色谱残留检测分为正相液相色谱模式和反相液相色谱模式,其中正相液相色谱多以正己烷、异丙醇等为流动相,由于正己烷等不适合质谱离子化,因此正相色谱常与紫外检测器等联用进行分析,在农药残留检测中应用较少;反相液相色谱一般以水相和/或有机相(如甲醇、乙腈等)混合作为流动相,因为流动相适合离子化,具有背景信号强度低、样品制备过程简单等优点,常与紫外检测器、质谱等多种检测器联用分析不同性质的化合物,在手性农药化合物对映体分离和残留分析应用中迅速发展。通常根据化合物的不同性质选择不同的色谱类型和检测器进行检测。
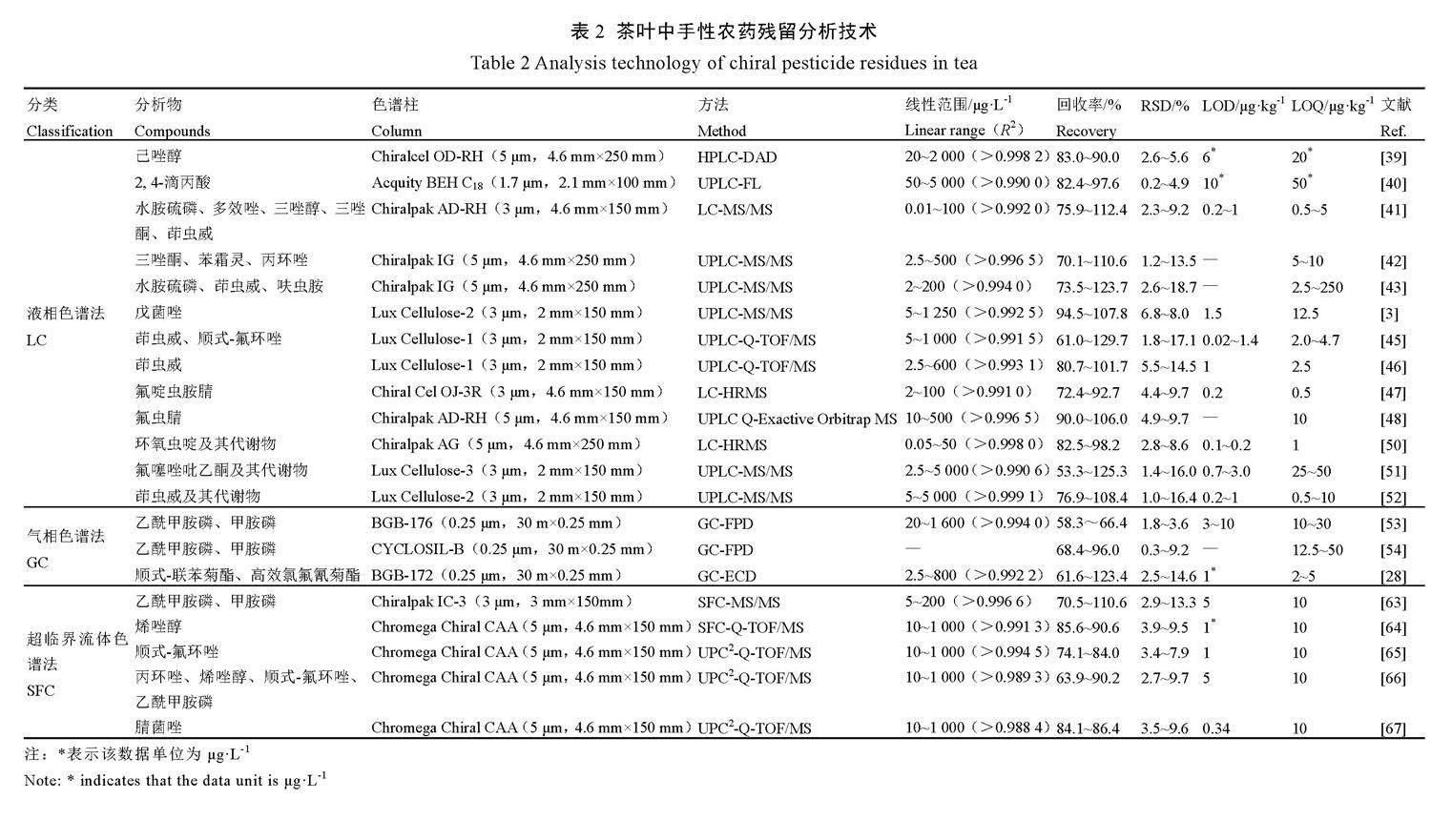
紫外检测器和荧光检测器是液相色谱仪常见的选择型检测器,前者基于溶质分子吸收紫外光的原理设计,后者适用于本身能发射或衍生化后能产生荧光的化合物。大多数有机磷和有机氯农药都有紫外特征吸收,因此,紫外检测器在早期农药检测研究中应用广泛。如Zheng等[39]用分散液液微萃取(DLLME)提取净化结合液相色谱紫外检测(HPLC-UV),选择紫外波长220 nm对茶叶中手性农药己唑醇对映体进行分离检测,在20~2 000 μg·L-1内线性良好,平均回收率为83.0%~90.0%,相对标准偏差(RSD)为2.6%~5.6%,检测限(LOD)为6 μg·L-1,定量限(LOQ)为20 μg·L-1。手性衍生化法是指将对映体与手性衍生化试剂反应生成非对映体复合物的方法,具有发色团或荧光等结构的衍生化试剂可用荧光检测器检测,可提高检测能力,例如,Inoue等[40]采用手性衍生化,以Acquity BEH C18柱分离,超高效液相色谱-荧光检测法测定绿茶、红茶、茉莉花茶和乌龙茶中的2,4-滴丙酸,结果显示对映异构体在50~5 000 μg·L-1内线性良好,平均回收率为82.4%~97.6%。
高效液相色谱法(High performance liquid chromatography,HPLC)和超高效液相色谱法(Ultra performance liquid chromatography,UPLC)的出现使得液相色谱法得到进一步发展,提高了分析通量、分离速度和检测灵敏度,同时质谱技术能高效快速地分离和鉴定各类物质,提高了分析能力,目前在农药残留分析领域多采用超高效液相色谱和单极/多极质量分析器串联使用。Liu等[41]采用QuEChERS方法净化,Chiralpak AD-RH柱分离,液相色谱串联线性离子阱质谱法(LC-MS/MS-Qtrap)测定,建立了茶叶中水胺硫磷、多效唑、茚虫威、三唑醇和三唑酮5种手性农药残留分析方法,结果显示,对映体的平均回收率为75.9%~
112.4%,RSD小于10%,LOD为0.2~1.0 μg·kg-1,LOQ为0.5~5.0 μg·kg-1。蒋明明等[42]采用Chiralpak IG柱分离,超高效液相色谱-串联质谱法(UPLC-MS/MS)检测普洱生茶和熟茶中三唑酮、苯霜灵和丙环唑3种农药8种对映体,结果显示,对映体在2.5~500.0 μg·L-1内线性良好,平均回收率为70.1%~110.6%,RSD为1.2%~13.5%,LOQ为5~10 μg·kg-1;曾小娟等[43]采用Chiralpak IG柱分离测定晒青毛茶和普洱茶中的水胺硫磷、茚虫威和呋虫胺3种农药6个对映体,结果显示,对映体在2~200 μg·L-1内线性良好,平均回收率为73.57%~123.7%,RSD为2.6%~18.7%,LOQ为2.5~250.0 μg·kg-1。Zhang等[3]建立了Lux Cellulose-2柱分离,UPLC-MS/MS检测茶叶中戊菌唑对映体的方法,平均回收率为94.5%~107.8%,RSD小于8.0%,LOQ为12.5 μg·kg-1。
此外,液相色谱与质谱联用检测方面高分辨质谱的应用,如飞行时间(TOF)和轨道阱(Orbitrap)等,可快速准确获得化合物的精确质量,因其高通量、分析速度快、灵敏度高、分辨率高和定性准确等特点,通常和四极杆串联进行定性定量分析[44],近年来被广泛应用于茶叶等复杂基质农药残留检测。本课题组[45-46]采用Lux Cellulose-1柱分离,UPLC-Q-TOF/MS测定,建立了茶鲜叶、红茶、绿茶、普洱茶及红茶茶汤中茚虫威和顺式-氟环唑对映体残留分析方法,方法回收率为61.0%~129.7%,RSD小于17.1%,不同茶叶的LOQ为2.0~4.7 μg·kg-1,茶汤中LOQ小于0.17 μg·L-1。Liu等[47]用Chiral Cel OJ-3R柱分离,LC-HRMS测定普洱茶、红茶中氟啶虫胺腈对映体降解残留,结果显示,各对映体在2~100 μg·L-1内线性良好,平均回收率为72.4%~92.7%,RSD小于10%,LOD为0.2 μg·kg-1,LOQ为0.5 μg·kg-1;Chen等[48]采用AD-RH柱分离,UPLC-Q-Exactive Orbitrap MS定量分析茶鲜叶和绿茶中氟虫腈对映体,平均回收率为90%~106%,RSD小于10%,LOQ为10 μg·kg-1。
大部分农药母体化合物和代谢物之间存在毒性差异。如吡丙醚的大多数代谢物对大鼠肝细胞的48 h急性毒性均大于母体,对大鼠肝细胞会造成一定的凋亡并产生2~3级损伤[49]。随着社会大众对食品安全的重视,农药降解代谢产物备受关注,其对环境和人类的潜在风险不容忽视。Liu等[50]用Chiralpak AG分离,UPLC-HRMS分析普洱生茶和熟茶加工过程中环氧虫啶对映体和代谢物的残留,母体和代谢物分别在0.2~50 μg·L-1和0.05~10 μg·L-1内线性良好,平均回收率为82.5%~98.2%,RSD小于8.6%,LOD分别为0.2 μg·kg-1和0.1 μg·kg-1,LOQ为1 μg·kg-1。Zhang等[51]用Lux Cellulose-3柱分离氟噻唑吡乙酮对映体及其代谢物IN-E8S72,UPLC-MS/MS分析,母体和代谢物分别在2.5~2 500 μg·L-1和10~5 000 μg·L-1内线性良好,LOD分别为0.7 μg·L-1和3.0 μg·L-1,平均回收率为53.3%~125.3%,RSD为1.4%~
16.0%。钟青等[52]用Lux Cellulose-2柱分离茚虫威对映体及其7种降解产物,UPLC-MS/MS测定,在5~5 000 μg·L-1内线性良好,平均回收率为76.9%~108.4%,RSD小于16.4%,母体的LOQ在鲜叶、绿茶和红茶中为5 μg·kg-1,在绿茶茶汤和红茶茶汤中为0.5 μg·L-1,代谢物分别小于10 μg·kg-1和1 μg·L-1。
2.2.2 气相色谱法
气相色谱法(Gas chromatography,GC)是以气体为流动相,利用样品组分在固定相中的吸附能力和溶解度,以及在气相和固定相之间不同的分配系数来实现分离。GC对于LC更适合非极性、热稳定性好、易挥发物质的分析,具有载气成本低、进样量小、灵敏度高和检测限低等优点,一般根据化合物结构性质不同串接不同类型检测器,如电子捕获检测器(ECD)、火焰光度检测器(FPD)、质谱检测器(MSD)等。
潘蓉等[53]用BGB-176柱分离,建立了GC-FPD法分析茶叶中乙酰甲胺磷及代谢物甲胺磷对映体残留,平均回收率为50.8%~
66.4%,RSD小于7%,LOD为3~10 μg·kg-1,LOQ为10~30 μg·kg-1。Jiao等[54]采用CycloSil-B柱分离,GC-FPD法分析比较乙酰甲胺磷及甲胺磷在茶树细胞悬浮液和离体带叶茶枝中对映体降解代谢行为,在茶枝中平均回收率为68.4%~94.0%,RSD为3.4%~9.2%;在细胞悬浮液中平均回收率为86.0%~96.0%,RSD为0.3%~3.2%,两种基质中的LOQ为12.5~50 μg·kg-1。宁亚婷等[28]用BGB-172柱分离,GC-ECD法检测茶叶中顺式-联苯菊酯和高效氯氟氰菊酯对映体残留,结果显示,两组对映体分别在2.5~800.0 μg·L-1和2.5~200.0 μg·L-1内线性良好,平均回收率分别为68.2%~123.4%和61.6%~102.6%,RSD小于14.6%,LOD低于1 μg·L-1,LOQ为2~5 μg·kg-1。气相色谱法虽然适于低沸点、易气化的手性农药对映体残留分析,但高温下可能导致化合物降解或异构化,存在一定的局限性。
2.2.3 毛细管电泳法
毛细管电泳(Capillary electrophoresis,CE)也称为高效毛细血管电泳(HPCE),是一类以高压直流电场为驱动力、毛细管为分离通道的分离分析技术,利用样品中各组分的淌度与分配行为存在的差异实现分离。CE技术用于手性拆分检测时,通常依靠添加手性选择剂构建手性分离环境,使对映体呈现不同的质荷比或淌度,从而实现对映体分离检测,具有使用方便、分离效率高、操作简单、自动化程度高等特点[55]。国内外关于CE在手性农药残留方面的研究主要集中在水[56]和土壤[57-58],不同的手性农药对映体如甲霜灵、联苯菊酯、育畜磷、抑霉唑、马拉硫磷等均得到了较好的分离[59],为后续应用于茶叶手性农药残留分析提供新的思路。
Jarman等[57]使用CE技术,以γ-CD为手性添加剂分离了土壤中5种手性农药(甲霜灵、咪唑喹啉酸、地虫硫磷、育畜磷和2,4-滴丙酸)对映异构体;Pérez-Fernández等[60]将CD和手性表面活性剂胆汁酸盐合用,采用胶束毛细管电泳在10 min内拆分顺式-联苯菊酯对映体,分离度为2.8;李佳等[61]用毛细管区带电泳分离,以5 332 mg·L-1乙酸钠缓冲液(pH=5.8,内含15 976 mg·L-1 DM-β-CD)为分离电解液,在234 nm波长下对精喹禾灵和S-对映体进行手性分离,分离度为2.7,用于精喹禾灵对映体的定性定量分析;Yi等[62]在50 mmol·L-1磷酸氢钠(内含30 mmol·L-1 HP-β-CD,pH=10.1)、20 kV电压、15 ℃分离温度和214 nm条件下,开发了一种快速简单的咪唑喹啉酸对映异构体的CE分离检测方法,研究发现咪唑喹啉酸对映异构体在降解速率上存在差异。
2.2.4 超临界流体色谱法
超临界流体色谱法(Supercritical fluid chromatography,SFC)是以超临界流体(如二氧化碳)为流动相的色谱方法。SFC综合GC和LC的优点,充分利用超临界流体良好萃取剂的特性,是一种绿色环保、高效经济的色谱分离技术,目前在手性化合物对映体分析上得到广泛应用。王丽[63]利用QuEChERS方法提取净化,以Chiralpak IC-3手性柱分离,异丙醇为流动相改性剂,SFC-MS/MS法测定,建立了茶叶中甲胺磷、乙酰甲胺磷对映体分析方法并用于实际样品测定,结果表明,对映体在5~200 μg·L-1内线性良好,平均回收率为70.53%~110.61%,RSD为2.92%~13.30%,LOD为5 μg·kg-1,LOQ为10 μg·kg-1。Zhang[64]等采用乙腈/水(V乙腈∶V水=2∶1)提取,Cleanert TPT固相萃取柱净化,Chromega Chiral CCA手性柱分离,建立了SFC-Q-TOF/MS法检测茶叶中烯唑醇对映体残留,流动相为CO2/异丙醇(V二氧化碳∶V异丙醇=96∶4),结果表明,对映体在10~1 000 μg·L-1内线性良好,在红茶中平均回收率为85.6%~90.6%,RSD小于9.5%,LOD为1 μg·L-1,LOQ为10 μg·kg-1,方法在检测速度、准确度及环境友好度上具有优势。
近年来,基于SFC原理发展的超高效合相色谱法(Ultra performance convergence chromatography,UPC2),结合了UPLC和SFC的优点,具有传质性好、分离效果佳、峰形窄和绿色环保等特点,常用于残留分析研究。赵悦臣等[65-66]用Chromega Chrial CCA柱分离,以CO2/异丙醇((V二氧化碳∶V异丙醇=95∶5)为流动相,利用超高效合相色谱-四极杆飞行时间质谱(UPC2-Q-TOF/MS)分析测定,建立了茶叶中丙环唑、烯唑醇、顺式-氟环唑和乙酰甲胺磷对映体残留分析方法,结果表明,茶叶中各对映体在10~1 000 μg·L-1内线性良好,回收率为63.9%~101.9%,RSD为2.7%~9.7%,LOQ为10 μg·kg-1。张新忠等[67]将该方法应用于红茶中腈菌唑对映体的残留分析,结果表明,对映体在10~1 000 μg·L-1内线性良好,回收率为84.1%~86.4%,RSD小于9.6%,LOQ为10 μg·kg-1,方法准确可靠,满足残留分析要求。更多的茶叶中手性农药对映体残留分析应用见表2。
3 茶树生长和茶叶加工过程中手性农药对映体降解代谢研究
环境中的手性农药因环境作用可能会导致对映体在吸收、降解和转化方面存在差异,从而产生不同的环境行为,表现出立体选择性。茶叶作为一种健康饮品,其农药残留问题引起广泛关注。目前已有研究开展了吡虫啉、啶虫脒[68]、高效氟氯氰菊酯[69]、己唑醇[70]、联苯菊酯、茚虫威和虫螨腈[71]等农药在茶树生长及茶叶加工和冲泡过程的迁移转化规律研究,但对具有手性结构的农药对映体残留降解的研究较少。研究手性农药对映体从茶园到茶杯的残留降解行为,对评估茶园中手性农药应用具有重要意义,可为减施增效、开发高效低毒的新型农药提供科学依据。
3.1 手性农药对映体在茶树鲜叶生长过程中的降解
农药喷施到茶叶后,由于其理化性质、外界条件以及茶芽的生长稀释作用共同影响农药的消解速度[72]。茶叶加工通常采摘茶树新梢幼嫩部位,通过不同加工工艺制成不同的茶类,研究不同农药在茶叶生长过程中的消解速率可获得生产实践中的安全间隔期。
研究表明,乙酰甲胺磷对映体的消解呈现先快后慢的趋势,(+)-乙酰甲胺磷消解速率略快于(-)-乙酰甲胺磷,半衰期分别为1.8 d和1.9 d,而甲胺磷残留量先增加后降低,5 d时,(+)-甲胺磷和(-)-甲胺磷残留量达到最大,分别为1.25 mg·kg-1和0.67 mg·kg-1,对映体分数(EF值)随时间从0.516增加到0.734,表现出选择性降解[72-73]。Jiao等[54]建立了体外代谢模型,研究乙酰甲胺磷在茶树细胞悬浮液和离体带叶茶枝上降解代谢行为,发现带叶片的离体茶枝上手性农药代谢更接近完整植株,(±)-乙酰甲胺磷易被茎叶的切口处吸收,并在叶片和茎段内部转化为(±)-甲胺磷,乙酰甲胺磷未表现出选择性差异,而其代谢物甲胺磷在叶片中表现出差异,离体叶片中(+)-甲胺磷残留量是(-)-甲胺磷的1.5倍,这一结果与田间试验结果类似。黎洪霞[74]研究发现,吡丙醚在茶鲜叶上发生选择性降解,(+)-吡丙醚降解速率比(-)-吡丙醚快,半衰期分别是2.37 d和2.66 d。Zhang等[45]研究发现,在茶鲜叶上(+)-茚虫威降解比(-)-茚虫威快,半衰期分别是5.9 d和8.0 d。Zhong等[2]研究发现,在茶树种植过程中存在(-)-茚虫威向(+)-茚虫威转化的现象。此外,Zhang等[75]研究发现,茚虫威对映体的降解速率受剂型的影响,施用乳油制剂后茚虫威的降解速率比施用悬浮剂快,可能由于乳油制剂中的茚虫威会从茶叶表面蜡质层快速渗透。另外,研究表明,呋虫胺[22]、高效氯氟氰菊酯、顺式-联苯菊酯[28]、顺式-氟环唑[45]、氟虫腈[48]、烯唑醇[64]和氟噻唑吡乙酮[76]在茶树鲜叶生长过程中的降解无显著对映体选择性差异。手性农药对映体在茶树鲜叶生长过程中的消解动态研究概况如表3所示。
3.2 手性农药对映体在茶叶加工过程的降解
农药理化性质和农产品加工条件的不同,影响其在农产品加工过程中的变化,清洗、去皮等过程可以降低农药残留,而发酵、干燥等加工方式可能会使农药转化代谢[77]。随着茶叶加工工艺水平不断提升,新型加工方式应用越来越广泛,对农药残留影响也愈发复杂,如干燥过程中茶叶水分降低,会使残留的农药富集浓缩,而高温、光照等又可促进农药挥发或分解,最终可能使茶产品中农药残留量降低。
Gupta等[68]研究指出,茶叶加工过程中萎凋和干燥对农药残留影响较大,揉捻和发酵对农药残留无显著影响。Wang等[76]研究发现,在红茶和绿茶加工过程中,(+)-氟噻唑吡乙酮更易降解,干燥对选择性降解的影响最大。乙酰甲胺磷在茶叶加工过程中降解也具有类似规律[53],其在红茶加工中的降解率明显高于绿茶加工,除了揉捻和发酵过程对对映体降解有影响外,干燥对乙酰甲胺磷降解的影响最大,这可能与其为强极性农药有关。Zhang等[45]对顺式-氟环唑、茚虫威对映体在绿茶加工中的降解研究发现,从鲜叶到成茶的加工过程中,两种农药的EF值逐渐上升,(+)-顺式-氟环唑向(-)-顺式-氟环唑转化,而R-茚虫威向S-茚虫威转化,表现出和茶树鲜叶生长中一致的趋势。此外,红茶的发酵和普洱茶的萎凋工序对农药的降解也产生一定影响[64]。Zhang等[64]研究发现,红绿茶的揉捻以及红茶的发酵过程是降解的关键工序,EF值表明加工过程中无对映体选择性降解;Liu等[47]研究发现,红茶的萎凋、揉捻和干燥过程以及普洱茶的萎凋和干燥过程是导致氟啶虫胺腈降解的关键工序,但两种茶叶加工中均未发现对映体选择性降解,而环氧虫啶对映体表现出对映体选择性降解,其EF值随着加工进程逐渐下降,1R,2S-环氧虫啶降解速率更快[50]。
农药在茶叶加工过程中受到光、热等处理更易发生降解代谢,产生代谢产物。如Chen等[48]对氟虫腈在绿茶加工过程中的降解研究发现,经过摊晾、杀青和干燥等步骤后,绿茶中氟虫腈及其代谢物的残留量升高,施药5 d后采摘的鲜叶加工中S-氟虫腈优先降解,导致R-氟虫腈的富集。Zhong等[2]研究茶叶加工中茚虫威降解发现,IN-KG433是其主要代谢产物,其次是IN-JT333-1,且在红茶、绿茶加工中表现出不同的行为,在绿茶加工过程中逐渐增加,在红茶中逐渐减少,而R-茚虫威在绿茶加工过程中不断减少且会转化为S-茚虫威,干燥过程中的高温又导致S-茚虫威降解引起EF值快速上升,红茶加工中萎凋和揉捻对茚虫威对映体降解影响较大,进一步验证了Zhang等[45]的研究结果。黎洪霞[74]发现在茶叶加工中,吡丙醚的EF值变化主要受干燥、杀青和萎凋的影响,(+)-吡丙醚降解速度较快,残留以(-)-吡丙醚为主,代谢物4'-OH-Pyr残留量较高,加工中代谢物变化规律和母体一致,表现出选择性降解且随着加工过程,EF值先降低后升高再降低。
3.3 手性农药对映体在茶汤冲泡过程中的迁移转化
茶叶主要通过冲泡后饮用茶汤,干茶中残留的农药会通过冲泡迁移到茶汤中,从而可能对人体产生影响。农药在茶汤中的浸出率与茶叶冲泡方式(如冲泡温度、冲泡时间)以及农药的性质存在一定关系,其中主要因素是水溶性和辛醇-水分配系数。例如,乙酰甲胺磷及甲胺磷有较高的水溶性和较低的辛醇-水分配系数,因此在茶汤中表现出极高的浸出率,且干茶和茶渣中对映体EF值存在显著差异,表明在茶叶冲泡过程中乙酰甲胺磷和甲胺磷均存在立体选择性[53]。Wang等[76]研究氟噻唑吡乙酮对映体在茶汤中的浸出规律发现,绿茶茶汤中(-)-氟噻唑吡乙酮和(+)-氟噻唑吡乙酮的残留量及浸出率均大于红茶,其中红茶中浸出率为35.6%~55.7%,绿茶中浸出率为51.4%~65.6%,但对映体之间的浸出率无显著差异。
饮茶时的冲泡温度较高,有些冲泡方法需要长时间加热,而茶叶中残留的农药化合物在高温下可能转化生成某些降解产物从而带来潜在的健康风险,因此有必要明确农药在冲泡过程中产生的降解代谢物,进行全面的安全性评价。如吡丙醚几乎不溶于水,冲泡后吡丙醚在茶汤中的残留量远低于茶渣,(±)-吡丙醚在茶汤中的总浸出率均不超过10.4%,且表现出对映体选择性,残留以(-)-吡丙醚为主,吡丙醚的3种代谢物(4'-OH-Pyr、5''-OH-Pyr和DPH-Pyr)在茶汤中浸出率高于母体,主要代谢物4'-OH-Pyr表现出对映选择性,以(-)-4'-OH-Pyr为主,茶汤冲泡次数对吡丙醚及其代谢物对映体的EF值影响较小[74]。Zhong等[2]研究发现,茚虫威在茶汤中的浸出率较低,而其代谢物IN-MK638和IN-MF014的浸出率可达到89.9%和83.9%,因此饮茶时需要注意某些代谢物的残留风险。
4 手性农药对映体在茶园土壤环境中的选择性行为
茶树是喜酸性土壤的植物,其外在生长与内在代谢物积累都和土壤环境有着密切的关联。茶树生长过程中喷施的农药中未被利用的部分会流失进入土壤环境生态系统中,这部分残留在土壤中的农药可能会对土壤生态安全造成威胁,导致土壤酸化、理化性质变化、生物多样性减少等。同样,生态环境中的手性农药在不同的环境介质作用下,其对映体可能会产生吸收、降解代谢和迁移扩散等差异,表现出不同的环境行为,在对映体水平开展土壤中手性农药行为研究有助于科学评估土壤农药残留风险,降低对茶园生态影响。
已有研究表明,手性农药对映体在土壤中表现出不同的选择性降解行为。李晓刚等[78]研究发现,茚虫威对映体在4种土壤中降解速率差异显著,在酸性土壤中降解速率较慢,在有机质含量较高的土壤中对映体降解立体选择性更明显,土壤中EF值始终大于0.5。R-呋虫胺在中性的砂质土壤中优先降解,而在酸性和碱性的粉质土壤中表现相反,S-呋虫胺优先降解导致R-呋虫胺富集[79],S-呋虫胺既是高活体也是高毒体,在实际生产中可通过生产高比例R-呋虫胺来降低对非靶标生物的风险。手性农药进入土壤后可能会对土壤微生物产生影响,薛鹏飞等[80]研究发现,氟环唑对映体在土壤中的降解无显著差异,但(+)-氟环唑和外消旋体对土壤微生物的干扰作用比(-)-氟环唑更显著。Zhang等[3]研究了戊唑醇对映体在土壤中的降解行为,发现施药7 d后表现为(+)-戊唑醇富集。Zhang等[45]研究发现,(-)-顺式-氟环唑和(+)-顺式-氟环唑在土壤中的半衰期无显著差异,而(-)-茚虫威和(+)-茚虫威在土壤中的半衰期差异显著,(+)-茚虫威降解更快。此外,还有一些关于高效氯氟氰菊酯[81]、炔螨特[82]、硫丹[83]等茶园土壤中手性农药外消旋体的残留降解研究,这些对后续茶园茶叶-土壤系统中研究手性农药对映体的归趋、全面评价环境风险具有重要参考意义。
5 茶叶中手性农药风险评估
茶叶是日常生活中的必需品和重要的国际贸易产品,农药残留问题影响着茶叶质量安全和进出口国际贸易[84],进行茶叶中农药残留安全风险评估是保障茶叶质量安全的重要环节。我国根据《中华人民共和国食品安全法》等制定了《食品中农药残留风险评估指南》[85],通过分析农药毒理学和残留化学试验结果,对因膳食摄入农药残留产生健康风险的可能性及程度进行评价,包括毒理学评估、残留化学评估和膳食摄入评估。
5.1 毒理学评估
农药毒理学评估通过在实验动物体上开展一系列毒理学研究获得包括急性、慢性、长期、致癌性、遗传和生殖毒性等数据。手性农药作为一类特殊化学结构的农药,其对映体通常会表现出不同的生物活性和毒性,存在高效体、低效体和无效体。目前,少量手性农药以高活性的光学单体形式进行生产和销售,如精喹禾灵、精甲霜灵等。手性农药进入环境中可能会对非靶标生物产生影响,包括急性毒性、氧化应激和内分泌干扰等[86]。石琳琳等[87]研究丁氟螨酯对土壤中蚯蚓的毒性影响发现,(+)-丁氟螨酯更容易在蚯蚓体内富集且其急性毒性更大,表现出更高的生态毒理风险。刘思宏[88]研究发现,R-呋虫胺对蜜蜂的毒性大于外消旋体和S-呋虫胺,同时R-呋虫胺对蜜蜂学习记忆的亚致死效应较低。但Liu等[89]研究发现,S-呋虫胺可诱导蚯蚓产生更强的氧化应激反应,显著引起蚯蚓体内丙二醛含量升高以及严重的DNA损伤,从而抑制了蚯蚓生长和繁殖。夏玮彤[90]研究了仲丁威对映体对3种非靶标生物蛋白核小球藻、斑马鱼胚胎和HepG2细胞急性毒性影响,发现S-仲丁威的毒性是R-仲丁威的1.3~1.7倍。李玲等[10]研究发现,水胺硫磷对大型溞的毒性远高于对水华微囊藻的毒性,均表现为(+)-水胺硫磷>Rac-水胺硫磷>(-)-水胺硫磷,(+)-水胺硫磷会引起超氧化物歧化酶活性显著下降。
研究农药降解代谢产物也是关注手性农药毒性的关键。如丁氟螨酯在溶解度范围内对大型溞无明显的急性毒性和慢性毒性,但其代谢物A-2、AB-1 dimer、AB-1和AB-11会明显增强急性毒性从而抑制大型溞活动,其环境风险不容忽视,在评价丁氟螨酯安全性时不可忽视对其代谢物的残留[91]。张召贤[92]研究发现,丙硫菌唑的代谢物脱硫丙硫菌唑比母体具有更好的杀菌活性,R-丙硫菌唑的活性是S-丙硫菌唑的9~639倍,母体和代谢物均具有明显的类甲状腺激素和雌激素效应,代谢物的激素活性高于母体,表明代谢过程是增毒过程,S-丙硫菌唑具有更高的类激素活性。姚国君[93]研究顺式-氯氰菊酯及其主要代谢物顺式-菊酸和3-苯氧基苯甲酸对蚯蚓的毒性发现,两种代谢物的毒性均高于母体,顺式-菊酸+3-苯氧基苯甲酸和顺式-菊酸+3-苯氧基苯甲酸+顺式-氯氰菊酯的联合毒性显示为拮抗作用。以上研究表明,进行手性农药风险评估时,要充分考虑代谢物对环境及非靶标生物的影响。
5.2 残留化学评估
残留化学评估是对农药及其有毒代谢物在食品和环境中残留行为的评价。通过动植物代谢试验、田间残留试验、加工过程和环境行为试验等获得的试验结果,推荐规范残留试验中值(STMR)和最高残留值(HR),必要时包括对后茬作物农药残留评价。进行全方位完整的代谢过程评估,可以保证所取得的数据能够支持膳食暴露评估和风险管理决策。
对手性农药进行残留化学评估时,除了需要对外消旋体进行评估,还要考虑手性对映体可能存在毒性、活性不同,以及对映体之间相互转化的情况,有必要进行单一对映体残留风险评估。如Zhang等[75]研究茚虫威在茶鲜叶中的残留降解,发现茚虫威对映体存在选择性降解,喷施茚虫威悬浮剂(S/R: 70/30)发现(+)-S-茚虫威降解速率比(-)-R-茚虫威快,田间喷施单一构型(+)-S-茚虫威、(-)-R-茚虫威和外消旋体制剂发现,(+)-S-茚虫威构型稳定,在降解过程中未发生构型转化;但(-)-R-茚虫威喷施后,检出(+)-S-茚虫威,表明(-)-R-茚虫威会向(+)-S-茚虫威转化。潘蓉[72]在茶园喷施乙酰甲胺磷,发现(+)-乙酰甲胺磷和(-)-乙酰甲胺磷的半衰期分别为1.8 d和1.9 d,高浓度喷施的情况下,乙酰甲胺磷的EF值在0~14 d逐渐降低,14 d后大幅增加,施药35 d后鲜叶中未检测出两种对映体。Li等[94]通过研究吡丙醚在茶叶中的残留降解行为明确其半衰期为2.74 d,施药3 d后消解率达到82.5%,建议施用后采收安全间隔设为5 d,茶叶中吡丙醚的推荐最大残留限量值设为5 mg·kg-1。秦立新等[95]研究发现,吡丙醚在安徽和重庆两地茶鲜叶上的半衰期分别为1.26 d和5.48 d,末次施药后14 d采收的茶鲜叶及制成的干茶中的吡丙醚残留量为0.01~1.13 mg·kg-1和0.04~0.37 mg·kg-1,膳食风险评估表明,对成年人群的残留风险处于安全水平。不同剂型的农药会影响农药对映体在作物上的残留降解,Zhang等[75]研究发现,悬浮剂中的茚虫威对映体降解速度慢于乳油中的,喷施悬浮剂后的茶叶中残留量高。在其他作物上的研究对茶叶研究同样具有借鉴意义,如Liu等[96]研究灭菌唑在小麦上的选择性行为和风险评估发现,S-灭菌唑、R-灭菌唑和Rac-灭菌唑的STMRs值分别为5.65、6.93、2.62 μg·kg-1,R-灭菌唑和Rac-灭菌唑的生物活性高于S-灭菌唑,但S-灭菌唑在植物和环境中的残留更久,对人体健康产生的风险更大。
5.3 膳食摄入评估
膳食摄入评估是指在毒理学和残留化学评估的基础上,根据我国居民膳食消费量,估算农药的膳食摄入量,包括长期膳食摄入和短期膳食摄入评估,结合残留化学评估结果,计算国家估算每日摄入量(NEDI)和国家估算短期摄入量(NESTI)。根据国际及我国的实践经验,目前农药残留膳食暴露评估主要关注:一般人群(一般指1岁以上人群)、儿童(多为1~6岁)和特殊人群(育龄妇女、老年人)等。
手性农药残留污染会通过呼吸、饮食等途径进入人体,对于非职业群体,其主要来源于饮食暴露,通过食物、水体蓄积手性农药。孙彦[97]研究了9种手性农药(联苯三唑醇、苯霜灵、己唑醇、戊唑醇、粉唑醇、三唑酮、多效唑、腈菌唑和甲霜灵)在人体的饮食暴露途径,结果发现,人体尿样中仅三唑酮未检出,其余检出农药的残留水平表现为女性高于男性、成人高于儿童,蔬菜类和谷物类是膳食暴露主要来源,农药膳食暴露呈现为女孩>男孩>成年女性>成年男性,己唑醇和甲霜灵的风险最高。姚小珊[98]对土壤、人体尿液中3种手性农药残留进行分析发现,灭菌唑和甲霜灵在土壤中表现出选择性残留,R-体残留量高,敌草胺无选择性,在人体尿液中同样是R-甲霜灵残留量较高,而敌草胺无明显规律,残留浓度与采样者性别、年龄无明显的线性相关性。顾元琳[99]研究4种水果中烯唑醇风险评估发现,外消旋体在梨、桃、枣、苹果的NEDI值分别是0.011 1~0.037 3、0.023 3~0.078 5、0.004 81~0.016 20、0.000 78~0.002 63 μg·kg-1·d-1,风险小于1.57%,是可接受的;在不同消费人群中,烯唑醇的HQ值随着年龄增长而降低,膳食风险儿童高于成人,R-烯唑醇高于S-烯唑醇。
茶叶主要以冲泡饮用茶汤为主,因此进行茶叶农药残留风险评估主要根据农药在茶叶上的最终残留和茶汤冲泡数据,为合理使用农药和安全饮茶提供科学依据,未来需要更深一步对单一对映体进行风险评估。黎洪霞[74]研究得到吡丙醚在绿茶茶汤和红茶茶汤中的最大浸出率为13.8%,饮茶时实际摄入吡丙醚最大每日摄入量为0.117 μg·kg-1,仅为ADI值的0.12%,表明人体饮茶摄入吡丙醚的风险较低,不会影响人体健康。秦立新等[95]对吡丙醚的急性和慢性膳食摄入风险评估发现,吡丙醚的急性膳食暴露风险均为0.01%,慢性膳食暴露风险为0.13%(男)、0.15%(女),均为风险可接受。王微等[100]对黔东南州茶叶农药残留膳食摄入风险评估发现,22种农药中仅克百威的慢性摄入风险为1.178%,其余风险均小于1%,急性摄入风险在0.03%~41.42%,表明黔东南州茶叶的农药残留慢性和急性摄入风险都在可接受范围内。聂敏等[101]对贵州省茶叶中3种拟除虫菊酯类农药进行残留降解研究及膳食风险评估发现,溴氰菊酯、联苯菊酯和高效氯氟氰菊酯农药的慢性膳食风险分别是0.12%、0.19%、0.03%,急性膳食风险范围为1.50%~18.00%,NESTI值分别为1.5、1.8、0.3 μg·kg-1·d-1,采用危害指数法HI值计算得到累积摄入风险小于100%,表明风险较小,在一般人群中可接受,不会危害人体健康。朱盼等[102]采用危害指数法HI值对广东省茶叶中8种拟除虫菊酯类农药(联苯菊酯、甲氰菊酯、氯氟氰菊酯、氯菊酯、氯氰菊酯、氟氰戊菊酯、氰戊菊酯和溴氰菊酯)进行风险评估发现,慢性和急性累积摄入量分别为4.87×10-5、4.79×10-3 mg·kg-1·d-1,摄入量研究表明,男性高于女性、城市居民高于农村居民,所有检出农药的慢性和急性累积摄入HI分别为3.69×10-3和4.66×10-1,表明摄入风险较低。
6 总结与展望
茶叶是我国重要的传统农产品,其质量安全问题一直备受关注,农药残留问题是其中一个重要因素,而手性农药因其结构不同产生的不同药效和毒性成为茶叶科研关注的焦点之一。为了更好发挥手性农药作用,减少对环境污染和非靶标生物危害,进行手性农药对映体拆分检测并分析其在茶叶中残留及暴露风险评估具有重要意义。随着人们对农药残留研究不断深入,为了保障饮茶安全和茶产业安全,未来茶叶中农药管理和研究应侧重以下方面:(1)科学合理开展茶园新农药登记。农药生产企业应充分利用现有政策优势,加快推进多类别、多剂型、毒性低、浸出率低和抗性低的新型农药或生物农药研发和登记,政府部门要加强对农药合理使用的管理,以减少茶产品中农药残留问题。(2)完善农药残留限量标准。我国是茶叶出口大国,绿色贸易壁垒严重阻碍了我国茶叶出口贸易的发展,需要持续完善我国农药残留限量标准,提高茶叶上登记农药及其限量标准的匹配性,保障标准的科学性和合理性,与国际接轨,突破贸易壁垒。(3)开发残留检测新方法。目前已有多种检测技术在农药残留方面广泛应用,如高效液相色谱法、超高效液相色谱串联质谱法等,但由于茶叶基质复杂,目前仅关注单一手性农药拆分和检测,未来应注重多种手性农药对映体的多残留分析和手性农药对映体与非手性农药混合多残留分析,开发多种手性农药同时拆分技术,加强快速检测研究,准确、便捷和高效定量手性农药多残留将是未来手性农药残留检测的关键,有助于保障饮茶安全,促进茶产业可持续发展。
参考文献
1Carrao D B, Perovani I S, De Albuquerque N C P, et al. Enantioseparation of pesticides: acritical review [J]. Trac-Trends in Analytical Chemistry, 2020, 122: 115719. doi: 10.1016/j.trac.2019.115719.
2Zhong Q, Li H X, Wang M, et al. Enantioselectivity of indoxacarb during the growing, processing, and brewing of tea: degradation, metabolites, and toxicities [J]. Science of the Total Environment, 2022, 823: 153763. doi: 10.1016/j.scitotenv.2022.153763.
3Zhang X Z, Wang X R, Luo F J, et al. Application and enantioselective residue determination of chiral pesticide penconazole in grape, tea, aquatic vegetables and soil by ultra performance liquid chromatography-tandem mass spectrometry [J]. Ecotoxicology and Environmental Safety, 2019, 172: 530-537.
4李子璇, 杨雪葳, 任利翔, 等. 有机氯农药介导的内分泌干扰相关不良结局通路(AOP)的研究进展[J]. 农药, 2021, 60(10): 703-711.
Li Z X, Yang X W, Ren L X, et al. Advances in studies on endocrine disruption-related adverse outcome pathways (AOP) mediated by organochlorine pesticides [J]. Agrochemicals, 2021, 60(10): 703-711.
5席北斗, 虞敏达, 张媛, 等. 华北典型污灌区有机氯农药残留特征及健康风险评价[J]. 生态毒理学报, 2016, 11(2): 453-464.
Xi B D, Yu M D, Zhang Y, et al. Residues and health risk assessments of organochlorine pesticides in a typical wastewater irrigation area of North China [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 453-464.
6农药信息网. 禁限用农药名录[EB/OL]. (2022-09-01) [2024-03-08]. http://www.chinapesticide.org.cn/zgnyxxw/
zwb/detail/13081.
China Pesticide Information Network. List of banned and restricted pesticides [EB/OL]. (2022-09-01) [2024-03-08]. http://www.chinapesticide.org.cn/zgnyxxw/zwb/detail/13081.
7Tsai Y, Lein P J. Mechanisms of organophosphate neurotoxicity [J]. Current Opinion in Toxicology, 2021, 26: 49-60.
8Lin K D, Zhou S S, Xu C, et al. Enantiomeric resolution and biotoxicity of methamidophos [J]. Journal of Agricultural and Food Chemistry, 2006, 54(21): 8134-8138.
9李雪妍. 两种拟除虫菊酯类手性农药对大型蚤的对映体选择性毒理研究[D]. 泉州: 华侨大学, 2019.
Li X Y. Study on selective enantiomeric toxicology of two chiral pesticides of pyrethroids on Daphnia magna [D]. Quanzhou: Huaqiao University, 2019.
10李玲, 李俊杰, 王俊英, 等. 手性农药水胺硫磷对浮游生物氧化应激的对映体选择性影响[J]. 生态毒理学报, 2021, 16(3): 264-272.
Li L, Li J J, Wang J Y, et al. Enantiomeric selectivity of chiral pesticide isocarbophos on oxidative stress in plankton [J]. Asian Journal of Ecotoxicology, 2021, 16(3): 264-272.
[1]Coats J R. Mechanisms of toxic action and structure-activity relationships for organochlorine and synthetic pyrethroid insecticides [J]. Environmental Health Perspectives, 1990, 87: 255-262.
[2]王鹏, 周志强. 手性农药手册[M]. 北京: 化学工业出版社, 2021.
Wang P, Zhou Z Q. Book of chiral pesticides [M]. Beijing: Chemical Industry Press, 2021.
[3]熊康. 溴敌隆、氰戊菊酯和哌虫啶三种农药对蚯蚓的毒性和生物富集研究[D]. 杭州: 浙江大学, 2015.
Xiong K. Toxicity and bioaccumulation of bromadiolone, fenvalerate and paichongding to earthworm Eisenia fetida [D]. Hangzhou: Zhejing University, 2015.
[4]崔璇. 在线SPE-UPLC-MS/MS建立茶叶中4种拟除虫菊酯类农药检测方法及高效氯氟氰菊酯对茶尺蠖的活性差异[D]. 天津: 天津农学院, 2019.
Cui X. Online SPE-UPLC-MS/MS to establish four pyrethroid pesticides in tea and lambda-cyhalothrin activity differences of Ectropis oblique hypulina Wehrli [D]. Tianjin: Tianjin Agricultural University, 2019.
[5]Zhou C H, Wang Y. Recent researches in triazole compounds as medicinal drugs [J]. Current Medicinal Chemistry, 2012, 19(2): 239-280.
[6]杨森. 三唑类杀菌剂作用机理和残留检测技术分析研究[J]. 农药科学与管理, 2020, 41(6): 27-32.
Yang S. Study on the mechanism and residue detection technology of triazole fungicides [J]. Pesticide Science and Administration, 2020, 41(6): 27-32.
[7]Vieira A C, Santos M G, Figueiredo E C. Solid-phase extraction of triazole fungicides from water samples using disks impregnated with carbon nanotubes followed by GC-MS analysis [J]. International Journal of Environmental Analytical Chemistry, 2017, 97(1): 29-41.
[8]陈茜茜. 戊唑醇手性杀菌剂在拟南芥中的选择性降解及其机制研究[D]. 北京: 中国农业科学院, 2016.
Chen Q Q. Studies on the stereoselectivity degradation and its mechanism of chiral fungicide tebuconazole in Arabidopsis thaliana [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
[9]Zhang A P, Xie X M, Liu W P. Enantioselective separation and phytotoxicity on rice seedlings of paclobutrazol [J]. Journal of Agricultural and Food Chemistry, 2011, 59(8): 4300-4305.
[10]贺敏. 苯醚甲环唑手性异构体活性差异及其在稻田的立体环境行为[D]. 北京: 中国农业科学院, 2017.
He M. Bioactivity difference of difenoconazole stereoisomers and their stereooselective environmental behavior in paddy field [D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[11]刘子琪, 呼啸, 李莉, 等. 新烟碱类农药呋虫胺对映体选择性研究进展[J]. 中国环境科学, 2021, 41(10): 4811-4819.
Liu Z Q, Hu X, Li L, et al. Research progress on the enantioselectivity of a neonicotinoid pesticide dinotefuran [J]. China Environmental Science, 2021, 41(10): 4811-4819.
[12]绳慧珊. 呋虫胺对映体在茶叶中的残留降解行为及对茶尺蠖的活性差异研究[D]. 天津: 天津农学院, 2018.
Sheng H S. The residue of dinotefuran enantiomers in tea and their activity differences of tea geometrid [D]. Tianjin: Tianjin Agricultural University, 2018.
[13]周佳, 梁水连, 相坛坛, 等. 手性农药研究进展[J]. 江西农业学报, 2021, 33(7): 75-80.
Zhou J, Liang S L, Xiang T T, et al. Research progress in chiral pesticides [J]. Acta Agriculturae Jiangxi, 2021, 33(7): 75-80.
[14]王鹏, 江树人, 张宏军, 等. 戊唑醇和三唑酮对映体的手性拆分[J]. 分析化学, 2004, 32(5): 625-627.
Wang P, Jiang S R, Zhang H J, et al. The enantiomeric separation of tebuconazole and triadimefon [J]. Chinese Journal of Analytical Chemistry, 2004, 32(5): 625-627.
[15]田芹, 任丽萍, 吕春光, 等. 反相色谱条件下三唑类手性农药对映异构体的拆分[J]. 分析化学, 2010, 38(5): 688-692.
Tian Q, Ren L P, Lü C G, et al. Chiral resolution of eight triazole pestioioles by high performance liquid chromatography under reversed phase conditions [J]. Chinese Journal of Analytical Chemistry, 2010, 38(5): 688-692.
[16]Kuang H, Miao H, Hou X L, et al. Determination of enantiomeric fractions of cypermethrin and cis-bifenthrin in Chinese teas by GC/ECD [J]. Journal of the Science of Food and Agriculture, 2010, 90(8): 1374-1379.
[17]Wang X Y, Zhang H, Xu H, et al. Direct chiral determination of acephate and its metabolite methamidophos in vegetables using QuEChERS by gas chromatography-tandem mass spectrometry [J]. Food Analytical Methods, 2013, 6(1): 133-140.
[18]宁亚婷, 王新茹, 罗逢健, 等. 茶叶和土壤中cis-联苯菊酯、高效氯氟氰菊酯手性对映体残留分析[J]. 核农学报, 2023, 37(11): 2243-2251.
Ning Y T, Wang X R, Luo F J, et al. Enantioseparation and residue analysis of cis-bifenthrin and lambda-cyhalothrin in tea and soil [J]. Journal of Nuclear Agricultural Sciences, 2023, 37(11): 2243-2251.
[19]冯硕立, 徐明仙, 高伟亮, 等. 超临界色谱拆分6种唑类手性农药[J]. 浙江工业大学学报, 2011, 39(4): 424-428.
Feng S L, Xu M X, Gao W L, et al. Enantiomer resolution of six triazole with supercritical fluid chromatography [J]. Journal of Zhejiang University of Technology, 2011, 39(4): 424-428.
[20]缪叶隆. 含硫/磷农药的超临界流体色谱手性分离及体外降解研究[D]. 杭州: 浙江工业大学, 2020.
Miao Y L. Eenantiomer separation and stereoselective metabolism in vitro of chiral pesticides containing S/P [D]. Hangzhou: Zhejiang University of Technology, 2020.
[21]张天赐, 钟慧, 双亚洲, 等. 高效液相色谱法测定苹果和西红柿中腈菌唑对映体含量[J]. 分析科学学报, 2021, 37(3): 273-278.
Zhang T C, Zhong H, Shuang Y Z, et al. Determination of myclobutanil rnantiomers in apples and tomatoes by high performance liquid chromatography [J]. Journal of Analytical Science, 2021, 37(3): 273-278.
[22]张文华, 谢文, 侯建波, 等. 超高效合相色谱法对6种三唑类农药对映体的拆分及其在黄瓜中的残留分析[J]. 色谱, 2019, 37(12): 1356-1362.
Zhang W H, Xie W, Hou J B, et al. Chiral separation of six triazole pesticide enantiomers by ultra-performance convergence chromatography and residue determination in cucumber [J]. Chinese Journal of Chromatography, 2019, 37(12): 1356-1362.
[23]周励, 唐婧, 范荣华, 等. 反相高效液相色谱法同时拆分3种手性杀菌剂[J/OL]. 分析试验室, 2023[2024-03-08]. https://doi.org/10.13595/j.cnki.issn1000-0720.2023.041301.
Zhou L, Tang J, Fan R H, et al. Simultaneous enantiomeric separation of three triazole fungicides by reversed-phase high performance liquid chromatography [J/OL]. Chinese Journal of Analysis Laboratory, 2023 [2024-03-08]. https://doi.org/10.13595/j.cnki.issn1000-0720.2023.041301.
[24]胡建华, 姚华珍, 周珊珊, 等. 高效液相色谱法拆分手性农药及其热力学研究[J]. 农药, 2008, 47(8): 590-592.
Hu J H, Yao H Z, Zhou S S, et al. Enantioseparation and study of thermodynamical property of chiral pesticdes by HPLC [J]. Agrochemicals, 2008, 47(8): 590-592.
[25]齐艳丽, 李晋栋, 吕莹, 等. 超高效合相色谱法对9种三唑类手性农药对映体的分离分析[J]. 农药, 2023, 62(6): 422-427.
Qi Y L, Li J D, Lü Y, et al. Enantiomer separation and analysis of 9 chiral pesticides by ultra performance convergence chromatography [J]. Agrochemicals, 2023, 62(6): 422-427.
[26]曾皓鹏, 雷红涛, 张炽坚, 等. 手性农药兽药免疫分析研究进展[J]. 食品科学, 2014, 35(21): 315-321.
Zeng H P, Lei H T, Zhang C J, et al. Advances in immunoassay of chiral pesticides and veterinary drugs [J]. Food Science, 2014, 35(21): 315-321.
[27]郑依柳, 邵华, 金芬, 等. 分子印迹材料在手性拆分中的应用研究进展[J]. 化学试剂, 2024, 46(2): 47-54.
Zheng Y L, Shao H, Jin F, et al. Research progress on applications of molecularly imprinted materials in chiral discrimination [J]. Chemical Reagents, 2024, 46(2): 47-54.
[28]陈丹丹, 万建春, 郭平, 等. 植物源性食品中手性农药残留检测技术的研究进展[J]. 江西农业学报, 2021, 33(9): 100-108.
Chen D D, Wan J C, Guo P, et al. Research progress in detection of chiral pesticide residues in plant-derived food [J]. Acta Agriculturae Jiangxi, 2021, 33(9): 100-108.
[29]Zheng X J, Ma W W, Wang Q H, et al. Development of self-dispersion ferrofluid-based dispersive liquid-liquid microextraction for determining chiral fungicide hexaconazole in water, tea, and juice using high-performance liquid chromatography [J]. Microchemical Journal, 2024, 196: 109593. doi: 10.1016/j.microc.2023.109593.
[30]Inoue K, Prayoonhan N, Tsutsui H, et al. Use of chiral derivatization for the determination of dichlorprop in tea samples by ultra performance LC with fluorescence detection: liquid chromatography [J]. Journal of Separation Science, 2013, 36(8): 1356-1361.
[31]Liu H C, Lin T, Li Q W. Development and validation of multiclass chiral pesticide residues analysis method in tea by quechers combined liquid chromatography quadruple-linear ion trap mass spectrometry [J]. Journal of Aoac International, 2020, 103(3): 865-871.
[32]蒋明明, 曾小娟, 宋红坤, 等. 多壁碳纳米管/N-丙基乙二胺混合吸附-超高效液相色谱-串联质谱法测定普洱茶中3种手性杀菌剂农药残留[J]. 食品安全质量检测学报, 2020, 11(6): 1702-1708.
Jiang M M, Zeng X J, Song H K, et al. Determination of 3 chiral fungicide pesticide residues in Pu-erh tea by multiwalled carbon nanotubes/primary secondary amine mixed adsorption-ultra performance liquid chromatography-tandem mass spectrometry [J]. Journal of Food Safety and Quality, 2020, 11(6): 1702-1708.
[33]曾小娟, 林涛, 王莉丽, 等. QuEChERS-超高效液相色谱-串联质谱法测定茶叶中3种杀虫剂手性农药[J]. 食品安全质量检测学报, 2021, 12(2): 602-608.
Zeng X J, Lin T, Wang L L, et al. Determination of 3 kinds of chiral pesticides in tea by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry [J]. Journal of Food Safety and Quality, 2021, 12(2): 602-608.
[34]武杨柳, 李栋, 康露, 等. 质谱技术在农药残留分析中的研究进展[J]. 质谱学报, 2021, 42(5): 691-708.
Wu Y L, Li D, Kang L, et al. Research progress of mass spectrometry in pesticide residue analysis [J]. Journal of Chinese Mass Spectrometry Society, 2021, 42(5): 691-708.
[35]Zhang X Z, Luo F J, Lou Z Y, et al. Simultaneous and enantioselective determination of cis-epoxiconazole and indoxacarb residues in various teas, tea infusion and soil samples by chiral high performance liquid chromatography coupled with tandem quadrupole-time-of-flight mass spectrometry [J]. Journal of Chromatography A, 2014, 1359: 212-223.
[36]张新忠, 罗逢健, 陈宗懋, 等. 超高效液相色谱-四极杆飞行时间质谱测定茶叶中手性农药茚虫威对映体残留[J]. 质谱学报, 2012, 33(6): 321-326.
Zhang X Z, Luo F J, Chen Z M, et al. Enantioseparation and quantification of chiral pesticide indoxacarb residues in tea by UHPLC-Q-TOF/MS [J]. Journal of Chinese Mass Spectrometry Society, 2012, 33(6): 321-326.
[37]Liu H C, Jiang M M, Li Q W. Determination of neonicotinoid sulfoxaflor residues and stereoselective degradation in Pu-erh tea and black tea by liquid chromatography-high-resolution mass spectrometry [J]. Journal of Food Processing and Preservation, 2020, 44(8): e14589. doi: 10.1111/jfpp.14589.
[38]Chen H P, Gao G W, Yin P, et al. Enantioselectivity and residue analysis of fipronil in tea (Camellia sinensis) by ultra-performance liquid chromatography orbitrap mass spectrometry [J]. Food Additives & Contaminants: Part A, 2018, 35(10): 2000-2010.
[39]Liu H, Li P Z, Wang P, et al. Toxicity risk assessment of pyriproxyfen and metabolites in the rat liver: a vitro study [J]. Journal of Hazardous Materials, 2020, 389: 121835. doi: 10.1016/j.jhazmat.2019.121835.
11Liu H C, Tian H, Jiang M M, et al. Enantioselectivity and residue analysis of cycloxaprid and its metabolite in the pile and fermentation processing of Puer tea by ultraperformance liquid chromatography-high-resolution mass spectrometry [J]. Food Science & Nutrition, 2022, 10(9): 3043-3051.
[40]Zhang X Z, Sun H Z, Wang X R, et al. Enantioselective residue analysis of oxathiapiprolin and its metabolite in tea and other crops by ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Separation Science, 2020, 43(20): 3856-3867.
[41]钟青, 黎洪霞, 罗逢健, 等. 超高效液相色谱-串联质谱法测定茶叶和茶汤中茚虫威对映体及7种降解产物[J]. 质谱学报, 2021, 42(2): 140-153.
Zhong Q, Li H X, Luo F J, et al. Analysis of indoxacarb enantiomers and its seven metabolites in tea and tea infusion by ultra performance liquid chromatography tandem triple quadrupole mass spectrometry [J]. Journal of Chinese Mass Spectrometry Society, 2021, 42(2): 140-153.
[42]潘蓉, 陈红平, 尹鹏, 等. 茶叶中乙酰甲胺磷及甲胺磷对映体的气相色谱法分离与测定[J]. 分析测试学报, 2014, 33(7): 766-772.
Pan R, Chen H P, Yin P, et al. Direct isolation and determination of acephate and methamidophos enantiomers in tea by gas chromatography [J]. Journal of Instrumental Analysis, 2014, 33(7): 766-772.
[43]Jiao W T, Hou R Y, Li J C, et al. Enantiomer metabolism of acephate and its metabolite methamidophos in in vitro tea (Camellia sinensis L.) systems: comparison between cell suspensions and excised tissues [J]. Science of the Total Environment, 2022, 806: 150863. doi: 10.1016/j.scitotenv.
2021.150863.
[44]刘培培, 杨继远, 郭全海. 毛细管电泳和毛细管电色谱技术在农药残留检测中的应用[J]. 农业技术与装备, 2022(3): 70-72.
Liu P P, Yang J Y, Guo Q H. Application of capillary electrophoresis and capillary electrochromatography in the detection of pesticide residues [J]. Agricultural Technology & Equipment, 2022(3): 70-72.
[45]García-Ruiz C, ?lvarez-Llamas G, Puerta ?, et al. Enantiomeric separation of organophosphorus pesticides by capillary electrophoresis [J]. Analytica Chimica Acta, 2005, 543(1/2): 77-83.
[46]Jarman J L, Jones W J, Howell L A, et al. Application of capillary electrophoresis to study the enantioselective transformation of five chiral pesticides in aerobic soil slurries [J]. Journal of Agricultural and Food Chemistry, 2005, 53(16): 6175-6182.
[47]Lewis D L, Garrison A W, Wommack K E, et al. Influence of environmental changes on degradation of chiral pollutants in soils [J]. Nature, 1999, 401(6756): 898-901.
[48]Gogolashvili A, Tatunashvili E, Chankvetadze L, et al. Separation of enilconazole enantiomers in capillary electrophoresis with cyclodextrin-type chiral selectors and investigation of structure of selector-selectand complexes by using nuclear magnetic resonance spectroscopy [J]. Electrophoresis, 2017, 38(15): 1851-1859.
[49]Pérez-Fernández V, García M ?, Marina M L. Enantiomeric separation of cis-bifenthrin by CD-MEKC: quantitative analysis in a commercial insecticide formulation [J]. Electrophoresis, 2010, 31(9): 1533-1539.
[50]李佳, 任晓慧, 冯涛, 等. 精喹禾灵与其S-对映体的高效毛细管电泳手性分离方法[J]. 农药, 2014, 53(3): 189-190.
Li J, Ren X H, Feng T, et al. Separation and analysis of quizalofop-p-ethyl and S-enantiomer by high performance capillary electrophoresis [J]. Agrochemicals, 2014, 53(3): 189-190.
[51]Yi F, Guo B Y, Peng Z L, et al. Study of the enantioseparation of imazaquin and enantioselective degradation in field soils by CZE [J]. Electrophoresis, 2007, 28(15): 2710-2716.
[52]王丽. 基于QuEChERS-超临界流体色谱-串联质谱法的茶叶中甲胺磷及乙酰甲胺磷对映体拆分及定量[J]. 安徽农业科学, 2023, 51(11): 156-162.
Wang L. Separation and quantification of methamidophos and acephate enantiomer in tea based on QuEChERS-supercritical fluid chromatography-tandem mass spectrometry [J]. Journal of Anhui Agricultural Sciences, 2023, 51(11): 156-162.
[53]Zhang X Z, Zhao Y C, Cui X Y, et al. Application and enantiomeric residue determination of diniconazole in tea and grape and apple by supercritical fluid chromatography coupled with quadrupole-time-of-flight mass spectrometry [J]. Journal of Chromatography A, 2018, 1581/1582: 144-155.
[54]赵悦臣, 张新忠, 罗逢健, 等. 超高效合相色谱-四极杆飞行时间质谱法测定水果和茶叶中手性农药顺式-氟环唑对映体残留[J]. 分析化学, 2016, 44(8): 1200-1208.
Zhao Y C, Zhang X Z, Luo F J, et al. Residue determination of cis-epoxiconazole enantiomers in fruit and tea by ultra performance convergence chromatography combined with quadrupole time-of-flight mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2016, 44(8): 1200-1208.
[55]赵悦臣. 水果和茶叶中四种手性农药对映体多残留分析方法研究[D]. 天津: 天津农学院, 2016.
Zhao Y C. The research of multiple residue analysis of four chiral pesticides in fruit and tea [D]. Tianjin: Tianjin Agricultural University, 2016.
[56]张新忠, 赵悦臣, 罗逢健, 等. 水果和红茶中腈菌唑对映体残留的超高效合相色谱四极杆飞行时间质谱分析[J]. 分析测试学报, 2016, 35(11): 1376-1383.
Zhang X Z, Zhao Y C, Luo F J, et al. Determination of myclobutanil enantiomers residues in fruit and black tea samples by ultra performance convergence chromatography quadrupole time-of-flight mass spectrometry [J]. Journal of Instrumental Analysis, 2016, 35(11): 1376-1383.
[57]Gupta M, Shanker A. Fate of imidacloprid and acetamiprid residues during black tea manufacture and transfer into tea infusion [J]. Food Additives & Contaminants: Part A, 2009, 26(2): 157-163.
[58]Paramasivam M, Deepa M, Selvi C, et al. Dissipation kinetics of beta-cyfluthrin and imidacloprid in tea and their transfer from processed tea to infusion [J]. Ecotoxicology and Environmental Safety, 2017, 144: 531-536.
[59]Kumar V, Ravindranath S D, Shanker A. Fate of hexaconazole residues in tea and its behavior during brewing process [J]. Chemical Health & Safety, 2004, 11(1): 21-25.
[60]李红莉, 毛宇骁, 敖存, 等. 不同覆盖条件下3种农药在抹茶中的消解动态比较[J]. 现代农药, 2022, 21(1): 53-56.
Li H L, Mao Y X, Ao C, et al. Degradation dynamics comparison of three pesticides applied to matcha under different coverage conditions [J]. Modern Agrochemicals, 2022, 21(1): 53-56.
[61]潘蓉. 三种农药在茶叶种植-加工过程中的消解动态及其在茶汤中的浸出率[D]. 北京: 中国农业科学院, 2015.
Pan R. Dissipation behavior of three pesticides during tea cultivation and manufacturing, and their transfer in tea brewing [D]. Beijing: Chinese Academy of Agricultural Sciences, 2015.
[62]Pan R, Chen H P, Wang C, et al. Enantioselective dissipation of acephate and its metabolite, methamidophos, during tea cultivation, manufacturing, and infusion [J]. Journal of Agricultural and Food Chemistry, 2015, 63(4): 1300-1308.
[63]黎洪霞. 吡丙醚在茶叶中的残留降解研究[D]. 北京: 中国农业科学院, 2021.
Li H X. Study on residue degradation of pyriproxyfen in tea [D]. Beijing: Chinese Academy of Agricultural Sciences, 2021.
[64]Zhang Y P, Hu D Y, Meng X G, et al. Enantioselective degradation of indoxacarb from different commercial formulations applied to tea [J]. Chirality, 2015, 27(3): 262-267.
[65]Wang M, Li Y J, Wang X R, et al. Enantioselective residue dissipation of oxathiapiprolin during tea growing, processing, and brewing [J]. Acs Agricultural Science & Technology, 2022, 2(5): 969-979.
[66]杨佳洁, 李敏敏, 肖欧丽, 等. 果蔬加工过程农药残留行为研究及加工因子在风险评估中的应用[J]. 食品安全质量检测学报, 2022, 13(22): 7255-7263.
Yang J J, Li M M, Xiao O L, et al. Study on pesticide residue behavior during fruit and vegetable processing and application of processing factors in risk assessment [J]. Journal of Food Safety and Quality, 2022, 13(22): 7255-7263.
[67]李晓刚, 刘一平, 刘双清, 等. 茚虫威对映体在土壤中的选择性降解[J]. 环境化学, 2012, 31(8): 1262-1267.
Li X G, Liu Y P, Liu S Q, et al. Enantioselective degradation of indoxacarb enantiomers in soils [J]. Environmental Chemistry, 2012, 31(8): 1262-1267.
[68]陈增龙. 呋虫胺对映体选择性环境行为与毒性差异分子机制[D]. 北京: 中国农业科学院, 2017.
Chen Z L. Enantionselective environmental fate and chiralspecific molecular toxicology of finotefuran [D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[69]薛鹏飞, 刘潇威, 赵刘清, 等. 手性三唑类杀菌剂氟环唑对土壤微生物的立体选择性影响[J]. 农业环境科学学报, 2022, 41(6): 1284-1295.
Xue P F, Liu X W, Zhao L Q, et al. Study on pesticide residue behavior during fruit and vegetable processing and application of processing factors in risk assessment [J]. Journal of Agro-Environment Science, 2022, 41(6): 1284-1295.
[70]张芬, 张新忠, 罗逢健, 等. QuEChERS净化GC/ECD测定茶叶与土壤中噻虫嗪、虫螨腈及高效氯氟氰菊酯残留[J]. 分析测试学报, 2013, 32(4): 393-400.
Zhang F, Zhang X Z, Luo F J, et al. Residue analysis of thiamethoxam, chlorfenapyr and lambda-cyhalothrin in tea and soil by GC/ECD after QuEChERS clean-up [J]. Journal of Instrumental Analysis, 2013, 32(4): 393-400.
[71]Kumar V, Sood C, Jaggi S, et al. Dissipation behavior of propargite: an acaricide residues in soil, apple (Malus pumila) and tea (Camellia sinensis) [J]. Chemosphere, 2005, 58(6): 837-843.
[72]Bishnu A, Saha T, Mazumdar D, et al. Assessment of the impact of pesticide residues on microbiological and biochemical parameters of tea garden soils in India [J]. Journal of Environmental Science and Health, Part B, 2008, 43(8): 723-731.
[73]刘新, 陈红平, 王国庆. 中国茶叶质量安全40年[J]. 中国茶叶, 2019, 41(12): 1-9.
Liu X, Chen H P, Wang G Q. 40 years of tea quality and safety in China [J]. China Tea, 2019, 41(12): 1-9.
[74]佚名. 食品中农药残留风险评估指南[J]. 农村实用技术, 2016(2): 10-11.
Anon. Guidelines for risk assessment of pesticide residues in food [J]. Journal of Rural Practical Technology, 2016(2): 10-11.
[75]郭浩铭, 魏一木, 刘雪科, 等. 手性农药选择性生物活性与毒性效应研究进展[J]. 农药学学报, 2022, 24(5): 1108-1124.
Guo H M, Wei Y M, Liu X K, et al. Research progress on the stereoselective bioactivity and toxicity of chiral pesticides [J]. Chinese Journal of Pesticide Science, 2022, 24(5): 1108-1124.
[76]石琳琳, 杨灿灿, 陈琪, 等. 丁氟螨酯在蚯蚓体内的富集及其急性毒性[J]. 农药学学报, 2022, 24(1): 177-181.
Shi L L, Yang C C, Chen Q, et al. Accumulation and acute toxicity of cyflumetofen in earthworms [J]. Chinese Journal of Pesticide Science, 2022, 24(1): 177-181.
[77]刘思宏. 呋虫胺对映体对蜜蜂的亚致死效应研究[D]. 南宁: 广西大学, 2018.
Liu S H. Sublethal effects of dinotefuran enantiosmers on honeybees Apis mellifera L. [D]. Nanning: Guangxi University, 2018.
[78]Liu T, Chen D, Li Y Q, et al. Enantioselective bioaccumulation and toxicity of the neonicotinoid insecticide dinotefuran in earthworms ( Eisenia fetida ) [J]. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4531-4540.
[79]夏玮彤. 仲丁威对映体立体选择性生物效应和降解研究[D]. 南京: 南京农业大学, 2019.
Xai W T. Studies on enantioselective biological effect and degradation of fenobucarb enantiomers [D]. Nanjing: Nanjing Agricultural University, 2019.
[80]安雪花, 李冬雪, 代德茂, 等. 丁氟螨酯及其代谢物对大型溞的毒性效应[J]. 浙江农业学报, 2022, 34(3): 557-565.
An X H, Li D X, Dai D M, et al. Acute toxicity of cyflumetofen and its metabolites to Daphnia magna Straus [J]. Acta Agriculturae Zhejiangensis, 2022, 34(3): 557-565.
[81]张召贤. 手性杀菌剂丙硫菌唑及其代谢物立体选择性研究[D]. 南京: 南京农业大学, 2020.
Zhang Z X. Study on the enantioselectivity of chiral fungicide prothioconazole and its metabolite [D]. Nanjing: Nanjing Agricultural University, 2020.
[82]姚国君. 顺式氯氰菊酯及其代谢物的环境行为、生物毒性及其污染修复[D]. 北京: 中国农业大学, 2017.
Yao G J. Study on environmental behavior, biotoxicity and pollution remediation of alpha-cypermethrin and its metabolites [D]. Beijing: China Agricultural University, 2017.
[83]Li H X, Zhong Q, Wang M, et al. Residue degradation, transfer and risk assessment of pyriproxyfen and its metabolites from tea garden to cup by ultra performance liquid chromatography tandem mass spectrometry [J]. Journal of the Science of Food and Agriculture, 2022, 102(10): 3983-3993.
[84]秦立新, 黄文源, 张盈, 等. 啶虫脒和吡丙醚在茶叶中的残留行为与膳食风险评估[J]. 农药, 2023, 62(3): 200-205.
Qin L X, Huang W Y, Zhang Y, et al. Residue behavior and dietary risk assessment of acetamiprid and pyriproxyfen in tea [J]. Agrochemicals, 2023, 62(3): 200-205.
[85]Liu R, Deng Y, Zhang W G, et al. Risk assessment of the chiral fungicide triticonazole: enantioselective effects, toxicity, and fate [J]. Journal of Agricultural and Food Chemistry, 2022, 70(8): 2712-2721.
[86]孙彦. 9种手性农药的人体饮食暴露途径与残留特征研究[D]. 杭州: 浙江大学, 2019.
Sun Y. Study on dietary dietary exposure and residual characteristics of 9 chiral pesticides in human body [D]. Hangzhou: Zhejiang University, 2019.
[87]姚小珊. 四种典型手性农药在全国土壤及人体尿液中对映体残留分析[D]. 武汉: 中南民族大学, 2019.
Yao X S. Enantiomer-specific residues of four typical chiral pesticides in agricultural soil across China and urine in human [D]. Wuhan: South-Central University for Nationalities, 2019.
[88]顾元琳. 手性烯唑醇在四种水果中的对映体选择性降解、残留及风险评估[D]. 哈尔滨: 东北农业大学, 2022.
Gu Y L. Enantioselective degradation, residue, and risk assessment of chiral diniconazole in four kinds of fruits [D]. Haerbin: Northeast Agricultural University, 2022.
12王微, 鄢人雨, 兰吉玉, 等. 黔东南州茶叶农药残留膳食摄入风险评估[J]. 茶叶科学, 2019, 39(5): 567-575.
Wang W, Yan R Y, Lan J Y, et al. Dietary intake risk assessment of pesticide residues in tea in Qiandongnan Prefecture [J]. Journal of Tea Science, 2019, 39(5): 567-575.
[89]聂敏, 黄文源, 张盈, 等. 贵州省茶叶中3种拟除虫菊酯类农药残留及膳食风险评估[J]. 农药, 2023, 62(4): 272-276.
Nie M, Huang W Y, Zhang Y, et al. Residues and dietary risk assessment of 3 pyrethroid pesticides in tea in Guizhou Province [J]. Agrochemicals, 2023, 62(4): 272-276.
13朱盼, 万欢, 黄芮, 等. 广东省本地产茶叶农药多残留累积风险评估[J]. 中国食品卫生杂志, 2022, 34(2): 308-314.
Zhu P, Wan H, Huang R, et al. Cumulative intake risk assessment of multi-pesicidies in local tea samples in Guangdong Province [J]. Chinese Journal of Food Hygiene, 2022, 34(2): 308-314.

