顶空固相微萃取法萃取茯砖茶挥发性成分条件的优化
赵静 王滨 张静 周天山 余有本 徐清山
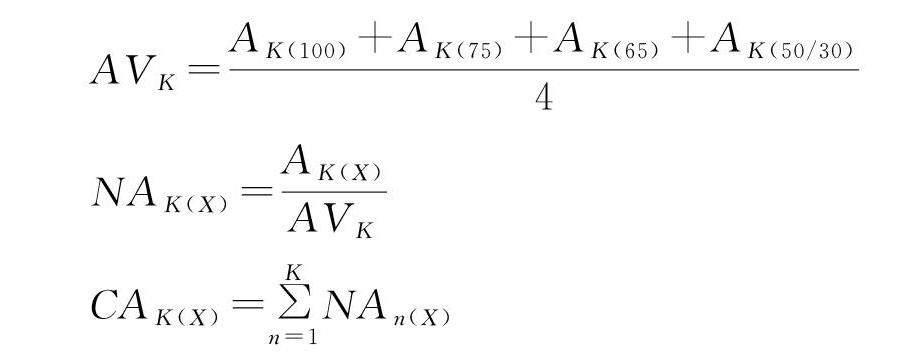

摘 要 为更好地分析茯砖茶挥发性成分组成特征,应用气相色谱-质谱联用(GC-MS)检测平台,探讨萃取头涂层、茶水冲泡比例、萃取温度和萃取时间对萃取结果的影响。结果表明:DVB/CAR/PDMS(50/30 μm)更适合萃取茯砖茶的挥发性成分;茯砖茶挥发性成分的最优萃取方法为:茶水比1∶0、萃取时间70 min、萃取温度80 ℃。在此试验条件下,利用顶空固相微萃取从试验用的茯砖茶中检测到75种挥发性成分,包括碳氢类20种,醛类16种,酮类13种,醇类12种,甲氧基酚类9种,酯类4种,酚类1种。本研究明确了陕西代表性茯砖茶挥发性成分的萃取方法,为全面解析茯砖的香气品质提供可靠技术支撑。
关键词 茯砖茶;挥发性成分;固相微萃取;气相色谱-质谱联用
茶叶香气是决定茶叶品质优劣的重要指标之一,也是吸引消费者和提高市场竞争力的重要因子[1-2]。挥发性有机化合物作为茶叶香气的基本物质,在茶叶中的含量很少,占干质量的0.01%,但其对茶叶的感官品质具有重要意义[3]。目前,研究人员已经在茶叶中提取并分离出近800种挥发性化合物,包括烷烃、醇、醛、酮、酸、酯、酚及其衍生物、氮氧硫杂环化合物等11类[4-5],按其结构特点大致可分为脂肪类、萜烯类、芳香族、含氮氧硫杂环类化合物及其他类[6]。茶叶挥发性有机化合物不稳定,在光、热、氧气、潮湿等环境下易发生改变,因而在分离制备过程中易挥发损失并可能发生化学反应而改变原有香气特征。选择合适的分离方法,从而获得完整的、能够反应茶叶真实香气特征的提取物,对茶叶挥发性组分的分析结果至关重要。
茶叶挥发性成分的提取方法多种多样,主要包括同时蒸馏萃取(Simultaneous Distillation and Extraction,SDE)、固相微萃取(Solid-phase Microextraction,SPME)和溶剂萃取(Solvent Extraction,SE)等[7]。同时蒸馏萃取制备方法温度较高,可能导致热不稳定组分的变化[8-9]。溶剂萃取不需要复杂的仪器设备,可以有效地从水相中提取极性较低的成分,但一些非挥发性成分也会进入有机溶剂相[10-11]。固相微萃取常用来富集干茶或冲泡茶的挥发性化合物,是一种相对简单的方法。但萃取头涂层的类型决定了SPME的吸附选择性[12],不同萃取头的最适萃取条件一般会有差异,而同一萃取头在不同萃取条件下所萃取到的成分也会有较大的差异,因此,合适的萃取和分析条件对后期的研究至关重要。
目前,针对绿茶、普洱茶和白茶等挥发性成分萃取效果的研究已有报道[13-15]。茯砖茶是一类紧压黑茶,由于加工过程中有特殊的发花工艺,在香气方面形成了其独特的“菌花香”。为了更真实、更高效地反映茯砖茶香气组分,本试验研究萃取头类型、茶水冲泡比例、萃取温度、萃取时间以及最佳因子组合等对茯砖茶挥发性物质萃取效果的影响,以期为快速高效地分析茯砖茶挥发性物质奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
材料:茯砖茶为咸阳泾渭茯茶有限公司2018年生产,产品批号GB/T9833.3。粉碎过40目筛(孔径0.425 mm)后备用。
癸酸乙酯,美国Sigma-Aldrich试剂公司;C8-C40正构烷烃标准品,美国Organic Standards Solutions International公司;氯化钠(分析纯),四川西陇科学有限公司。
萃取头套装含75 μm CAR/PDMS(碳分子筛/聚二甲基硅氧烷)、65 μm PDMS/DVB(聚二甲基硅氧烷/二乙烯基苯)、50/30 μm DVB/CAR/PDMS(二乙烯基苯/碳分子筛/聚二甲基硅氧烷)和100 μm PDMS(聚二甲基硅氧烷)各1支(美国Supelco公司)以及SPME手动进样器(美国Supelco公司);30 mL玻璃顶空瓶(上海安谱科学仪器有限公司);KQ5200DV超声波清洗机(昆山市超声仪器有限公司);气相色谱-质联用仪(ISQ GC/MS,美国Thermo Fisher Scientific公司)。
1.2 顶空固相微萃取(HS-SPME)
1.2.1 挥发性化合物的提取 将1 g粉碎茶叶样品、1 g NaCl、20 mL煮沸的蒸馏水、5 μL浓度为8 μg/L 的癸酸乙酯(内标)以及两粒磁转子加入30 mL顶空萃取瓶,拧紧硅胶垫瓶盖。置70 ℃、400 r/min的磁力加热搅拌器上平衡15 min后,插入固相微萃取头萃取60 min。然后将萃取头插入进样口250 ℃下热解析5 min,进行数据采集分析。所有样品重复3次[14]。
1.2.2 萃取头灵敏性和重复性评价 萃取头的选择对于挥发性物质的检测尤为重要,本研究选取63种挥发性物质(表1)的累计峰面积归一化值[16]对75 μm CAR/PDMS、65 μm PDMS/DVB、50/30 μm DVB/CAR/PDMS和100 μm PDMS的灵敏性进行评估。试验重复6次以评价萃取头的灵敏性[14]。计算公式如下:
AVK=AK(100)+AK(75)+AK(65)+AK(50/30)4
NAK(X)=AK(X)AVK
CAK(X)=∑Kn=1NAn(X)
式中,K为萃取到的一类挥发性化合物数量;X为4种萃取头之一(75 μm CAR/PDMS、65 μm PDMS/DVB、50/30 μm DVB/CAR/PDMS和100 μm PDMS);AVK为用4种纤维测定一类挥发性化合物的平均面积;AK(X)为用纤维X确定一类挥发性化合物的绝对面积;NAK(X)为用纤维X确定一类挥发性化合物面积的标准化值;CAK(X)为用纤维X测定的挥发性化合物面积的累积标准化值之和。
本研究选取至少能被两种萃取头共同检测到的40种挥发性物质分析萃取头的重复性。计算每个挥发性物质峰面积的相对标准偏差(RSD),将相对标准偏差(RSD)的平均值和标准偏差作为评价萃取头重复性的指标[14]。
挥发性化合物的丰度是影响重复性的重要因素。只有高丰度和低丰度挥发性化合物表现出优异重复性的纤维才能用于进一步测试。因此,笔者根据峰面积百分比将检测到的化合物分为两组:峰面积高于1%的化合物归为A组,而峰面积低于1%的化合物归为B组。试验重复6次,以评价萃取头的重复性。
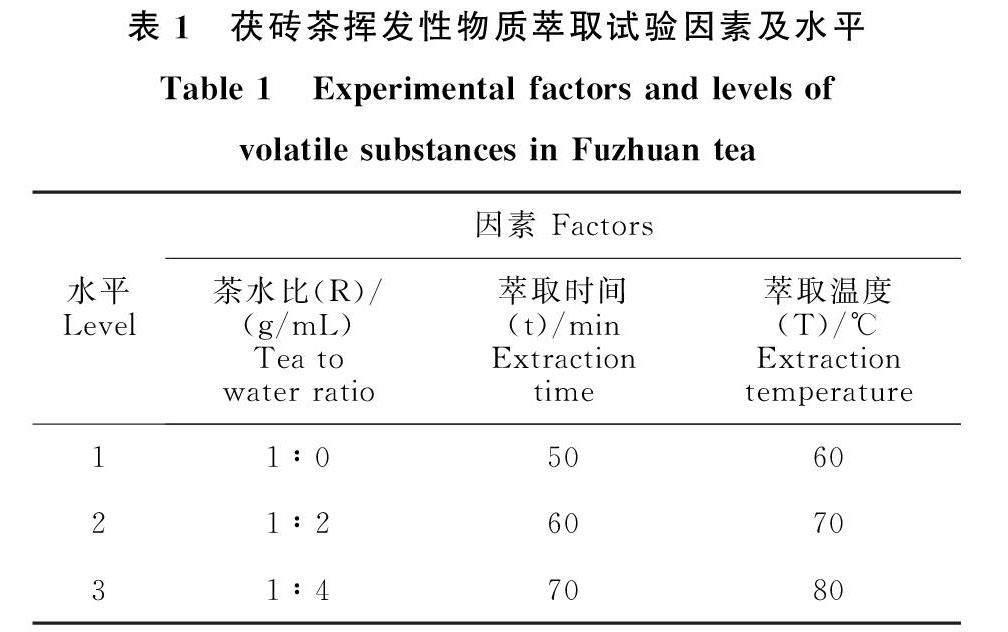
1.2.3 顶空固相微萃取流程优化 为了提高挥发性化合物的提取效率,本研究对试验参数包括茶的冲泡比例(1∶0、1∶2、1∶3、1∶4、1∶5、 1∶10、1∶15、1∶20和1∶50)萃取温度(40、50、60、70和80 ℃)和萃取时间(40、50、60、70和80 min)进行优化。
确定最适单因素(茶水比、萃取温度、萃取时间)后,按照3×3×3全面试验进行茯砖茶挥发性物质的萃取试验。试验因素及水平见表1。
1.3 GC-MS分析
使用气相色谱-质联用仪对SPME获得的挥发性化合物进行检测[17]。色谱柱为DB-5MS毛细管柱(30 m × 0.25 mm × 0.25 μm),载气为氦气(纯度>99.999%),流速为1 mL/min。在250 ℃不分流解析5 min。GC柱箱温度梯度为:最初60 ℃保持4 min。以4 ℃/min升温至230 ℃,保持10 min。
离子源为EI,离子源温度为230 ℃;接口温度250 ℃;MS在35~400扫描范围以70 eV扫描。
1.4 数据分析
定性分析:基于GC-MS 质谱图分析结果,使用NIST2017标准谱库进行搜索比对,参考相关资料和物质鉴定网站,匹配度大于80%作为物质鉴定标准。
定量分析:采用内标法进行定量,得到各物质组分的含量,计算方法如公式所示:
Ci=Cis×Ai/Ais
式中,Ci为某个组分的质量浓度(μg/L);Cis为内标的质量浓度(μg/L);Ai 为某个组分的色谱峰面积;Ais为内标的色谱峰面积(组分峰面积占总峰面积的百分比)。
2 结果与分析
2.1 萃取头灵敏性和重复性评价
根据文献[14],首先选取茶水比1∶20、萃取时间60 min和萃取温度70 ℃来萃取茯砖茶的挥发性成分。并选取检测到的63种化合物对4种萃取头的灵敏性和重复性进行评估。如图1所示,每类挥发性化合物的累计峰面积标准化值(CANV)因萃取头型号不同而异。DVB/CAR/PDMS对几乎所有类别化合物表现出较高CANV值,表明其对各类挥发性化合物具有更强的吸附能力。与DVB/CAR/PDMS纤维相比,CAR/PDMS、PDMS/DVB和PDMS纤维对挥发性化合物的灵敏性都相对较低。其中CAR/PDMS在醇类和醛类中表现出的CANV略低于DVB/CAR/PDMS。PDMS/DVB在酯类、碳氢化合物、酮类、甲氧基酚类化合物中表现出的CANV几乎与DVB/CAR/PDMS相当;醇类和醛类中低于DVB/CAR/PDMS和CAR/PDMS。PDMS纤维对不同类别的挥发性化合物表现出的灵敏性最低,因而没有对其进行后续分析。
为了评估DVB/CAR/PDMS、CAR/PDMS和PDMS/DVB 3种纤维的重复性,将40种可被3种萃取头共同检测到的挥发性化合物分为两类:A组峰面积占比大于1%,B组峰面积占比小于1%。通过对这些化合物峰面积的相对标准偏差(RSD)取平均值和标准偏差,来判断萃取头的重复性(图 2)。对于A组挥发性化合物,DVB/CAR/PDMS表现出最好的重复性,因为RSD的平均值和标准偏差最低,而CAR/PDMS光纤表现出最差的重复性。对于B组挥发性化合物,PDMS/DVB和CAR/PDMS纤维RSD的标准偏差较低,而DVB/CAR/PDMS纤维RSD的平均值较低。
因此,根据灵敏度和重复性的结果,DVB/CAR/PDMS纤维比较适合萃取茯砖茶挥发性化合物。
2.2 茯砖茶挥发性成分萃取的最佳冲泡茶水 比例
在本研究中,将1 g 茶和蒸馏水按以下比例 (g/mL) 混合制备茯砖茶样品:1∶0、1∶2、1∶3、1∶4、1∶5、1∶10、1∶15、1∶20和1∶50。如图3所示,茶水冲泡比例在挥发性化合物的提取中起着至关重要的作用。醇类、醛类、酚类和酯类化合物在茶水比为1∶2和1∶4时萃取效率较高,而对于酮类和烃类,在不加水时峰面积达到最大,其次是加入2或者4 mL水时萃取效果较佳。加水量过多可能会影响挥发性化合物从样品中转移到顶空瓶顶部,从而导致萃取效率降低。由此可见,茶水冲泡比例可能影响挥发物在基质和顶空之间的分配。
2.3 茯砖茶挥发性成分萃取的最佳时间
萃取时间是影响萃取效率的关键因素。萃取时间太短,萃取头不能充分吸收顶空中的挥发性成分。萃取时间太长,不仅会影响试验效率,还会导致水蒸气凝结过多影响吸附。为平衡萃取时间和萃取效果,选取40 min、50 min、60 min、70 min、80 min,探究最适萃取时间。如图4所示,醇类化合物的峰面积在提取时间为40和70 min时显著高于其他提取时间。在60 min之内,酮类、烃类化合物的峰面积随着提取时间的增加而显著增加,而当提取时间超过60 min时,挥发性成分的峰面积有下降的趋势。醛类和甲氧基酚类化合物的峰面积随着提取时间的增加而显著增加,直至70 min达到最高值。酚类和酯类化合物的峰面积似乎受时间变化的影响很小,这可能与它们的物理和化学特性有关。综合考虑,60~70 min是最佳萃取时间。
2.4 茯砖茶挥发性成分萃取的最佳温度
根据不同类别挥发性化合物的总峰面积,评价不同萃取温度(40 ℃、50 ℃、60 ℃、70 ℃、 80 ℃)对萃取效果的影响。结果如图5所示,不同类别挥发性化合物的峰面积因萃取温度不同而异。其中,醇类化合物的峰面积随着温度升高急剧增加,在50 ℃达到最高值,平缓下降到60 ℃,然后峰面积随着温度的升高急剧下降。相比之下,酮类和烃类的峰面积随着萃取温度的升高不断增加。醛类、酯类、酚类和甲氧基酚类化合物的峰面积随着温度升高而增加,并且在60 ℃或者70 ℃时到达最高值,然后下降。较高的温度会加快挥发物从样品到顶空的扩散速率。同时,SPME是一个放热过程,高温会降低分配系数,降低物质的萃取率[18]。作为折衷方案,最终选择 70 ℃进行进一步试验。
2.5 茯砖茶挥发性成分萃取因子的交互作用 分析
茶水冲泡比例、萃取时间和萃取温度影响茯砖茶挥发性成分的萃取效果。本试验对不同因子进行全面试验处理(表1),探索茯砖茶挥发性成分的最佳萃取条件。按照试验设计因子组合萃取茯砖茶挥发性成分,对其进行GC-MS分析。结果如图6所示,茯砖茶挥发性成分在R1t2T3(茶水比1∶0、萃取时间60 min、萃取温度80 ℃)和R1t3T3(茶水比1∶0、萃取时间70 min、萃取温度80 ℃)条件下萃取的总峰面积较高。其中,酮类和烃类的萃取效率远大于其他组合。此外,茯砖茶挥发性成分在R2t3T2(茶水比1∶2、萃取时间70 min、萃取温度70 ℃)条件下萃取的总峰面积也保持在较高的水平,其中醇类、醛类、酯类和甲氧基酚类化合物所表现出来的萃取效果优于其他组合。以上结果表明,不同类别的挥发性成分的萃取条件不同。
2.6 茯砖茶挥发性成分分析
茶叶香气主要是由茶叶挥发性物质组成的,是决定茶叶品质与风味的重要因子之一,包括醇类、醛类、酮类、酸类、酚类、酯类、内酯类、杂环化合物等。前期研究结果表明茯砖茶的香气成分以烷、烯等碳氢化合物以及醇类和酯类物质为主,因此本试验最终选择R1t3T3(茶水比1∶0、萃取时间70 min、萃取温度80 ℃)条件来萃取茯砖茶的挥发性成分。使用R1t3T3鉴定到茯砖茶挥发性成分75种,其中碳氢类20种(7.81%),醛类15种(10.74%),醇类13种(38.79),酮类13种 (18.98),甲氧基酚类9种(10.09%),酯类4种(11.87%),酚类1种(1.73%)(表2)。
3 讨论与结论
萃取头涂层是决定挥发性成分萃取效果的核心因素,为萃取目标挥发性成分选择合适的萃取头尤为重要[19]。PDMS是一种专门用于非极性化合物的吸附纤维,而CAR/PDMS和PDMS/DVB是具有两极性的吸附纤维。DVB/CAR/PDMS由第一层CAR/PDMS 和第二层PDMS/DVB组成,是挥发性成分广泛分析的最佳选择,同时与较厚的单一吸附剂相比,它可以减少保留的分析物量[20]。目前,有关不同萃取头提取茶叶挥发性成分的研究已有报道。陈林等[21]考察了75 μm CAR/PDMS、65 μm PDMS/DVB和100 μm PDMS对乌龙茶铁观音、肉桂和水仙香气成分的萃取效果,结果表明65 μm PDMS/DVB萃取头进行检测分析可相对较好地反映3种供试茶样香气化学组成特征。Du等[14]比较4种不同纤维涂层萃取头对普洱茶挥发性成分的萃取效果,通过重复性和灵敏性试验证明75 μm CAR/PDMS可以更好地满足普洱茶挥发性成分的萃取。陈熠敏等[15]选取3种型号的萃取纤维头对白茶香味物质进行萃取,GC-MS结果表明50/30 μm DVB/CAR/PDMS萃取纤维头对香味物质具有较强的吸附和富集能力。本试验以陕西茯砖茶为供试样品,评价了4种不同纤维涂层萃取头对其挥发性成分的萃取效果。灵敏性和重复性试验结果表明,50/30 μm DVB/CAR/PDMS更能满足茯砖茶挥发性成分的萃取。
除了萃取头涂层,茶冲泡比例、萃取温度和萃取时间等也会影响茶叶挥发性成分的萃取效果。温度是控制挥发性化合物释放的主要影响因素,不同的挥发性化合物在不同的温度下具有不同的蒸气压[22]。特别是在使用SPME时,温度会显著影响密封小瓶中挥发性化合物的组成。为了获得茶叶香气的整体信息,专业的茶叶香气评估师通常在高温(约75 ℃)、中(约45 ℃)和低温下(大约室温)对茶叶香气进行评估。茶叶状态同样是影响挥发性化合物释放的另一个重要因素[23]。与咖啡、葡萄酒或其他饮料不同,茶的香气可以通过从干茶、茶汤或泡茶后的湿茶中嗅闻来评估。陈熠敏等[15]比较分析了萃取温度、平衡时间、萃取时间以及取样量对靖安白茶和安吉白茶香气成分提取的影响,结果表明,样品选取1 g,85 ℃条件下平衡30 min,萃取30 min可获得最佳萃取结果。Tao等[24]基于SPME-GC-MS检测平台,考察了超声雾化提取、冲泡温度和基质对绿茶香气释放和感官品质的影响。本试验基于选取的最优萃取头,对茯砖茶的冲泡比例、萃取温度、萃取时间等单因素也进行了优化,并对多因子组合进行研究,分析各因子间的交互作用,从而得出最佳的因子水平优化组合。确定最佳茶水比1∶0、萃取温度70 ℃、萃取时间80 min。使用优化后萃取条件对陕西茯砖茶进行香气萃取,共检测出75种香气物质。
各类茶叶的香气有一定共性的同时,也各自拥有着独特的风味特征。不同茶类均有其适宜的提取方式,不同挥发性化合物在不同提取方法下的提取率也有所不同。采用合适的茶叶香气提取方法,有助于茶叶香气的成分鉴定和分析,能够准确客观地反映茶叶真实香气。本试验优化了陕西茯砖茶挥发性成分的HS-SPME萃取条件,明确了最佳萃取头涂层、茶水冲泡比例、萃取温度、萃取时间以及最佳因子组合,并使用优化条件对陕西茯砖茶的挥发性成分进行鉴定。
参考文献 Reference:
[1] OHGAMI S,ONO E,HORIKAWA M,et al.Volatile glycosylation in tea plants:sequential glycosylations for the biosynthesis of aroma β-primeverosides are catalyzed by two camellia sinensis glycosyltransferases[J].Plant Physiology,2015,168:464-477.
[2] YANG Z,BALDERMANN S,WATANABE N,et al.Recent studies of the volatile compounds in tea[J].Food Research International,2013,53(2):585-599.
[3] 宛晓春.茶叶生物化学[M].3版.北京:中国农业出版社,2003.
WAN X CH.Tea Biochemistry [M].3rd ed.Beijing:China Agriculture Press,2003.
[4] TEI Y.Flavor of Tea[J].Food Reviews International,1995,11(3):477-525.
[5] SUN L T,DONG X,REN Y L,et al.Profiling real-time aroma from green tea infusion during brewing[J].Foods,2022,11(5):684.
[6] 袁海波,尹军峰,叶国柱,等.茶叶香型及特征物质研究进展[J].中国茶叶,2009,31(8):14-15.
YUAN H B,YIN J F,YE G ZH,et al.Research advances on aromatic components of tea[J].China Tea, 2009, 31(8):14-15.
[7] 郭向阳,宛晓春.茶叶香气提取方法[J].食品安全质量检测学报,2019(15):4869-4876.
GUO X Y,WAN X CH.Extraction methods of tea aroma[J].Journal of Food Safety & Quality,2019(15):4869-4876.
[8] ALAIN C.Simultaneous distillation-extraction:from birth to maturity review[J].Flavour & Fragrance Journal,2001,16(2):136-148.
[9] 朱 旗,施兆鹏,任春梅.绿茶香气不同提取方法的研究[J].茶叶科学,2001,21(1):38-43.
ZHU Q,SHI ZH P,REN CH M.Studies on the different aroma making methods of green tea aroma[J].Journal of Tea Science,2001,21(1):38-43.
[10] BOATRIGHT J.Understanding in vivo benzenoid metabolism in petunia petal tissue[J].Plant Physiology,2004,135(4):1993-2011.
[11] VONIQUE B,CAISSARD J C,FRDRIC J,et al.Both the adaxial and abaxial epidermal layers of the rose petal emit volatile scent compounds[J].Planta,2007,226(4):853-866.
[12] WANG L F,LEE J Y,CHUNG J O,et al.Discrimination of teas with different degrees of fermentation by SPME-GC analysis of the characteristic volatile flavour compounds[J].Food Chemistry,2008,109(1):196-206.
[13] TAO M,LIU Z.Influence of ultrasonic nebulization extraction,infusion temperatures,and matrices on aroma release and perception of green tea[J].LWT,2019,115:108216.
[14] DU L,LI J,WEI L,et al.Characterization of volatile compounds of pu-erh tea using solid-phase microextraction and simultaneous distillation-extraction coupled with gas chromatography-mass spectrometry[J].Food Research International,2014,57(3):61-70.
[15] 陈熠敏,何 洪,王远兴.靖安白茶与安吉白茶特征香气成分的比较[J].南昌大学学报,2015,39(6):573-578.
CHEN Y M,HE H,WANG Y X.Comparisons of characteristic aroma components of Jingan white tea and Anji white tea[J].Journal of Nanchang University,2015, 39(6):573-578.
[16] TAT L,COMUZZO P,STOLFO I,et al.Optimization of wine headspace analysis by solid-phase microextraction capillary gas chromatography with mass spectrometric and flame ionization detection[J].Food Chemistry,2005, 93(2):361-369.
[17] 张 静,罗敏蓉,王西芳,等.固相微萃取气质联用测定番茄香气成分条件优化[J].北方园艺,2017(13):7.
ZHANG J,LUO M R,WANG X F,et al.Optimization of SPME-GC/MS to determine tomato flavoring components[J].Northern Horticulture,2017(13):7.
[18] VERZERA A,ZIINO M,CONDURSO C,et al.Solid-phase microextraction and gas chromatography-mass spectrometry for rapid characterisation of semi-hard cheeses[J].Analytical and Bioanalytical Chemistry,2004,380:930-936.
[19] BIANCO G,NOVARIO G,ZIANNI R,et al.Comparison of two SPME fibers for the extraction of some off-flavor cork-taint compounds in bottled wines investigated by GC-HRMS[J].Analytical and Bioanalytical Chemistry,2009,393:2019-2027.
[20] TORRENS J,RIU-AUMATELL M,LPEZ-TAMAMES E,et al.Volatile compounds of red and white wines by headspace--solid-phase microextraction using different fibers[J]. Journal of Chromatographic Science,2004,42:310-316.
[21] 陈 林,余文权,张应根,等.基于SDE和HS-SPME/GC-MS的乌龙茶香气组成特征分析[J].茶叶科学,2019, 39(6):13.
CHEN L,YU W Q,ZHANG Y G,et al.Aroma profiling of oolong tea by sde and hs-spme in combination with GC-MS[J].Journal of Tea Science,2019,39(6):13.
[22] WRIGHT J,WULFERT F,HORT J,et al.Effect of preparation conditions on release of selected volatiles in tea headspace[J].Journal of Agricultural and Food Chemistry,2007,55:1445-1453.
[23] MAGAGNA F,CORDERO C,CAGLIERO C,et al.Black tea volatiles fingerprinting by comprehensive two-dimensional gas chromatography - Mass spectrometry combined with high concentration capacity sample preparation techniques:Toward a fully automated sensomic assessment-science direct[J].Food Chemistry,2017,225:276-287.
[24] TAO M,LIU Z.Influence of ultrasonic nebulization extraction,infusion temperatures,and matrices on aroma release and perception of green tea[J].LWT,2019,115:108216.
Optimization for Extraction of Volatile Compounds of Fuzhuan Tea by Headspace Solid-phase Microextraction
ZHAO Jing,WANG Bin,ZHANG Jing,ZHOU Tianshan,YU Youben and XU Qingshan
(College of Horticulture,Northwest A&F University,Yangling Shaanxi 712100,China)
Abstract To better analyze the volatile compounds characteristics of Fuzhuan tea,the effects of different fiber coatings,tea to water ratio,extraction temperature and extraction time on extraction results were studied by gas chromatography-mass spectrometry (GC-MS). The results showed that DVB/CAR/PDMS (50/30 μm) was the most suitable for extracting the volatile components of Fuzhuan tea; the optimal combination of experimental parameters was:tea to water ratio (g/mL) 1∶2,the extraction time 70 min,and the extraction temperature 80 ℃. As a result,75 volatile components were identified from Fuzhuan tea,which include 20 hydrocarbons,16 aldehydes,13 ketones,12 alcohols,9 methoxyphenols,4 esters,and 1 phenols. The volatile extraction method for Shaanxi Fuzhuan tea was clarified in this study,which provided a technical support for analyzing the aroma quality of Fuzhuan tea comprehensively.
Key words Fuzhuan tea;Volatile compounds;SPME; GC-MS
Received 2022-11-08 Returned 2023-02-13
Foundation item National Natural Science Foundation of China(No.31902072); Experimental Technology Research and Laboratory Management Innovation Project of Northwest A&F University (No.SY20210226);Special Fund for Tea Industry of Shaanxi Province-Development(No.20200803000003).
First author ZHAO Jing,female,master,assistant experimentalist.Research area:plant metabolic physiology. E-mail: jingzhao123@nwafu.edu.cn
Corresponding author XU Qingshan,male,Ph.D,associate professor.Research area:metabolism of aroma compounds and germplasm innovation of tea plant. E-mail:xuqingshan@nwafu.edu.cn
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)

