驴SCD1基因克隆及组织表达规律研究
黄飞 祁业辉 刘桂芹 王长法 周苗苗

摘 要 旨在克隆驴硬脂酰辅酶A去饱和酶(Stearoyl-CoA desaturase-1, SCD1)基因并进行生物信息学分析、检测其在驴不同组织中的表达。设计 SCD1基因引物,PCR克隆得到其CDS序列,然后对 SCD1基因编码产物进行生物信息学预测,同时使用qRT- PCR检测驴心、肝、脾、肺、肾、肌肉、脂肪、乳腺内 SCD1基因mRNA相对表达量。结果显示,驴 SCD1基因CDS长1 080 bp,可编码359个氨基酸,SCD1蛋白质分子质量为41.61 ku,等电点为9.32,不稳定指数为44.16,疏水性总平均值为-0.157,属于不稳定碱性亲水蛋白;SCD1蛋白二级结构主要由α-螺旋(51.25%)和无规则卷曲(42.62%)构成。 SCD1基因在所检测驴组织中均有表达,其中在肝脏中表达量最高,脂肪、乳腺和肺脏中次之,心脏和肌肉中最低(P<0.05),提示 SCD1在驴肝脏、脂肪和乳腺等组织不饱和脂肪酸的合成过程中发挥重要作用。
关键词 SCD1 ;驴;基因克隆;生物信息学分析;组织表达
硬脂酰辅酶A去饱和酶(Stearoyl-CoA desaturase-1,SCD1)是催化单不饱和脂肪酸合成的限速酶,参与细胞的新陈代谢和前体脂肪细胞的分化,广泛存在于动物各种组织细胞中。SCD1可将细胞中的饱和脂肪酸转变为不饱和脂肪酸,在动物体内脂肪合成和代谢调节过程中发挥着重要的生理作用[1]。Rincon等[2]研究发现SCD基因的表达及其产物的活性决定了脂肪细胞单不饱和脂肪酸的合成及细胞膜磷脂和甘油三酯的组成, SCD1基因可通过胆固醇调节元件结合蛋白(Sterol-regulatory element binding proteins,SREBP)通路来调控乳脂的合成。另有研究发现SCD1可以介导还原型辅酶Ⅰ(NADH)-泛素氧化还原酶亚基A9(Ndufb9)通路对脂肪合成的调控,用阿氨酚抑制SCD1活性可抑制Ndufb9通路,进而阻断脂肪的合成[3]。此外,SCD1亦可介导Ndufa6对成脂分化的调控作用[4]。
SCD1蛋白由大约359个氨基酸残基组成,有4个跨膜区,种间高度保守,参与脂肪的代谢调节[5]。周秀敏等[6]研究发现,牛 SCD1基因可编码359个氨基酸残基组成的蛋白质,其平均分子质量为41.71 ku,是一种不稳定的水溶性蛋白。石恒波等[7]研究发现山羊SCD基因CDS序列全长为1 080 bp,进一步研究发现乳腺中SCD可通过调控脂肪酸合成酶(FASN)、心型脂肪酸结合蛋白(H-FABP)、瘦素受体蛋白(LEPR)、过氧化物酶体增殖物激活受体(PPARγ)等基因的表达影响乳脂中脂肪酸的组成。Zhang等[8]研究发现,牛血管基质组分(SVF)细胞中过表达 SCD1可增强PPARγ受体活性,进而增加脂滴积累(12 μg/mg)。Burchat等[9]研究发现,小鼠肠道SCD1不仅可以调节肠道组织脂质含量,亦可调节血浆和肝脏的脂质代谢。Jin等[10]对山羊基因的研究表明, SCD1基因对山羊脂肪酸代谢有重要作用。另有研究发现驴脂肪和乳脂具有不饱和脂肪酸高的特点[11-12],研究SCD1在驴不饱和脂肪酸合成过程中的调控作用具有重要意义。然而,目前关于驴 SCD1基因的研究鲜见报道。因此,本试验研究驴 SCD1基因的克隆及组织表达规律,为进一步研究SCD1调控驴脂肪和乳脂中不饱和脂肪酸的合成以及改善驴奶和驴肉品质提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样本采集 驴组织样品来自于山东东阿天龙食品有限公司。选取4头健康的德州母驴,屠宰后采集心脏、肝脏、脾脏、肺脏、肾脏、肌肉、乳腺和皮下脂肪,液氮速冻,-80 ℃冷冻保存。
1.1.2 主要试剂 pGM-T Fast克隆试剂盒、 E. coli DH5α感受态细胞、DNA凝胶回收试剂盒均购于天根生化有限公司;反转录试剂盒(M5 Super qPCR RT kit with Gdna remover)和荧光定量试剂盒(2×Real- time PCR Super mix SYBRgreen,with anti-Taq)均购于北京聚合美有限公司 ;2×Es Taq Master- Mix(Dye)购自康为世纪公司;DNA Marker购自中科瑞泰有限公司。
1.2 方法
1.2.1 总RNA的提取与全长cDNA克隆 Trizol法提取驴肝脏总RNA。Fermentas反转录试剂盒合成cDNA。使用高保真酶以 SCD1基因的cDNA为模板进行PCR扩增:引物见表1;反应体系总体积为50 μL,5×buffer 10 μL、脱氧核糖核苷三磷酸(2.5 mmol/L) 4 μL、上游引物(10 μmol/L) 1.5 μL、下游引物(10 μmol/L) 1.5 μL、酶(2.5 U/μL) 0.5 μL、模板 2.0 μL、双蒸水 30.5 μL;反应条件为98 ℃ 10 s→ 55 ℃ 5 s→ 72 ℃ 1.75 min(扩增35个循环)→ 72 ℃ 5 min。PCR产物在电泳检测后,用胶回收试剂盒(Magen)回收并纯化目的产物。胶回收产物连接克隆载体pTOPO - Blunt vector(Azbio - chem)转化DH5α感受态细胞,涂布于含100 μg/mL氨苄青霉素LB(Luria - Bertani)的平板于37 ℃培养过夜后,挑取阳性菌落PCR鉴定,并交由生工生物工程(上海)股份有限公司测序。
1.2.2 SCD1生物信息学及系统发育树分析 通过ORF Finder推导氨基酸序列;利用计算机pI/Mw工具(ExPASy Proteomics Server)、NetNglyc、NetPhos等在线预测SCD1蛋白的分子质量、理论等电点、二级结构、跨膜区等(表2);利用MEGA 7构建系统进化树[13]。
1.2.3 SCD1基因组织表达分析(qRT-PCR) Trizol法分别提取各组织的总RNA。取1 mg RNA,用Prime Script○RRT试剂盒(TaKaRa)合成cDNA。然后用SYBR○RTrimeScriptTM试剂盒(TaKaRa)在ABI 7500(Applied Biosystems,Singapore)上测定 SCD1基因相对表达量。实时荧光定量PCR反应体系为20 μL。PCR引物序列见表1。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate,GAPDH)为内参,采用2-△△Ct的方法计算 SCD1基因相对表达量[14-15]。每个样品重复3次,超纯水替代样品做阴性对照。
1.2.4 统计与分析 所有数据用SAS 9.2进行分析,多组数据间采用单因素方差分析,数据用柱状图表示,误差线为标准差。当P<0.05时认为差异显著。
2 结果与分析
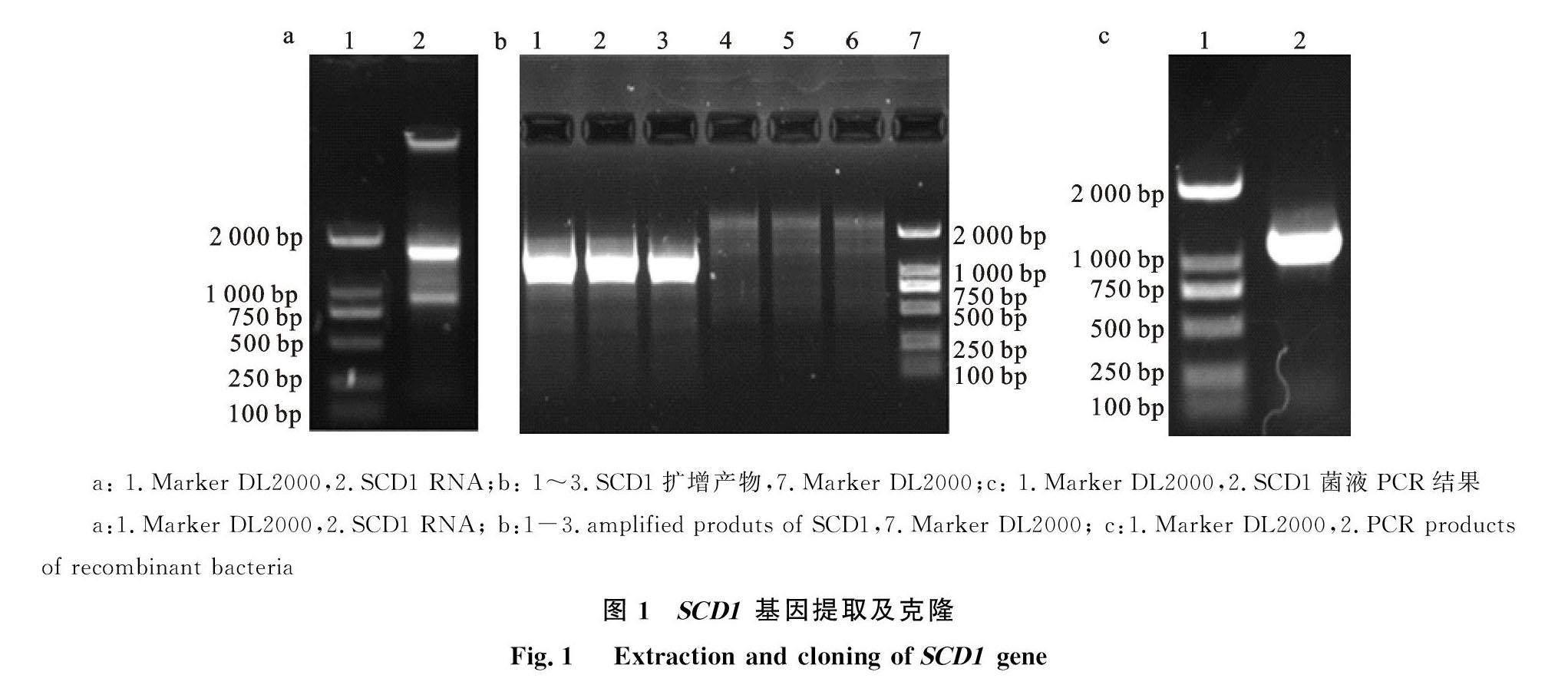
2.1 SCD1的基因提取及克隆
Trizol法提取驴肝脏组织总RNA(图1-a)。将RNA反转录后,以cDNA为模板,PCR特异性扩增 SCD1基因。PCR扩增产物进行电泳检测发现一条约1 000 bp大小的条带(图1-b)。重组后菌液PCR产物电泳结果如图1-c,电泳条带大小约为1 000 bp,与目的基因大小一致。
2.2 SCD1的基因序列及系统进化树分析
经测序验证成功扩增 SCD1基因。序列比对分析表明 SCD1的开放阅读框为1 080 bp,可编码359个氨基酸残基组成的多肽链(图2)。根据不同动物 SCD1基因的序列构建的系统进化树如图3所示,驴和平原斑马、马的 SCD1基因相似度最高, 亲缘关系最近。
2.3 生物信息学分析
2.3.1 SCD1蛋白理化性质及亲/疏水性表达分析 利用ProtParam软件对SCD1蛋白进行预测得出其分子式为C1937H2919N501O506S9;分子质量为41.61 ku;脂肪族指数为88.86;带负电荷残基总数(色氨酸、谷氨酸)为32个;带正电荷残基(精氨酸、赖氨酸)总数为43个;等电点为9.32,属于碱性蛋白;不稳定指数44.16,基因编码产物不稳定指数大于40 [16],属于不稳定蛋白。氨基酸组成分析结果显示,SCD1蛋白含有20种氨基酸,其中占比最高的是亮氨酸(Leu),占11.7%;其次是丙氨酸(Ala),占7.8%;最低的是半胱氨酸(Cys),仅占0.8%。
利用ProScale分析驴SCD1亲/疏水性,发现225处Leu存在最大疏水值3.2;在64处组氨酸(His)存在最小疏水值-3.0;疏水性平均值为 -0.157,属于亲水性蛋白(图4)。
2.3.2 SCD1蛋白二级结构及二硫键预测 通过NovoPro在线工具预测SCD1蛋白二级结构,发现SCD1蛋白二级结构中有184个α-螺旋(Hh)、22个β-折叠(Ee)和153个无规则卷曲(Cc),占比分别为51.25%、6.13%和42.62%(图5)。利用SCRATCH Protein Predictor在线工具预测,SCD1蛋白存在两个Cys和一个二硫键。二硫键的位置可能在蛋白质的226和326个氨基酸残基之间,可推出两个Cys也分别位于肽链的226和326位置。
2.3.3 SCD1蛋白信号肽及跨膜结构预测 运用SignalIP-5.0分析SCD1信号肽,发现SCD1中信号肽存在的可能为0.095%;利用TMHMM 2.0分析跨膜结构,发现SCD1有4个跨膜区。
2.3.4 SCD1蛋白修饰位点预测 通过NetNGlyc 1.0、NetPhos 3.1预测驴SCD1蛋白糖基化修饰位点和磷酸化位点。发现在第259和318位氨基酸处存在N-糖基化位点;预测SCD1蛋白磷酸化位点结果显示SCD1蛋白有10个丝氨酸(Ser)、9个苏氨酸(Thr)和5个酪氨酸(Tyr)磷酸化位点,共24个。
2.3.5 SCD1基因组织表达分析 通过qRT-PCR技术检测驴8个组织中 SCD1基因的mRNA表达量,发现在所有组织中都检测到 SCD1基因,表达量从高到底依次为肝脏、脂肪、乳腺、肺脏、肾脏、脾脏、肌肉和心脏(P<0.05,图6)。
3 讨 论
SCD1是单不饱和脂肪酸生成过程中的关键酶[17-18]。已有研究表明,SCD1在癌细胞、脂肪组织以及乳腺组织脂肪酸代谢中发挥重要的调控作用。Mason等[11]研究发现,多种癌症细胞的生存依赖于单不饱和脂肪酸的合成,SCD1等的缺失会引起不可逆的细胞毒性,并最终导致癌细胞死亡。另有研究表明,人体游离脂肪酸水平与其SCD1的表达量相关[12]。Duchemin等[19]研究发现奶牛 SCD1基因型可影响乳中不饱和脂肪酸含量。王小龙等[20]研究则发现 SCD1基因型可影响奶牛乳蛋白率、乳脂率。Li等[21]研究发现水牛乳腺中SCD1可通过调控脂代谢主控转录因子( SREBP1)、过氧化物酶体增生激活受体γ(PPARG)、磷酸甘油脂酰基转移酶(GPAT)和酰基甘油3磷酸酰基转移酶(AGPAT)等基因表达来调控乳腺脂肪代谢。此外,Zou等[22]研究发现,SCD1可介导冷刺激引起的三酰甘油的分解,SCD1主要通过促进C3H10T1/2白色脂肪细胞的脂解来产生热量供机体保暖。
目前,关于其他家养动物脂肪代谢的研究较多,而驴脂肪代谢调节相关研究较少[23-24]。驴肉和驴奶有不饱和脂肪酸含量高的特点[25-26],研究SCD1在驴脂肪代谢中的作用,可为进一步改善肉质、进行乳成分的合成调控提供基础[1]。本研究结果表明,驴 SCD1基因CDS长1 080 bp,可编码359个氨基酸残基构成的不稳定的亲水蛋白;驴SCD1蛋白氨基酸残基的数目与牛[6]、羊[7]和猪[27]相同;驴SCD1蛋白的不稳定系数大于40,与牛[6]、猪[27] SCD蛋白相同,为不稳定蛋白;据驴SCD1蛋白二级结构推测,其三级结构主要以α-螺旋和无规则卷曲为主,含有少量的β-片层结构,而牛SCD1蛋白完全不含β-片层结构[6]。此外,驴 SCD1基因组织表达研究结果发现在所有检测组织中均有SCD1的表达,其中肝脏中表达量最高,其次为脂肪、乳腺和肺脏,心脏和肌肉表达最低。以上结果提示 SCD1在驴肝脏、脂肪和乳腺等组织中发挥重要作用,为进一步研究驴脂肪和乳脂中不饱和脂肪酸的合成调控提供理论 依据。
4 结 论
成功扩增出驴 SCD1基因,序列分析表明 SCD1基因的开放阅读框为1 080 bp,可编码359个氨基酸残基组成的多肽链。
研究证实 SCD1基因在驴组织中普遍表达,且在肝脏、脂肪、乳腺和肺脏中高表达。
参考文献 Reference:
[1] 张宜辉,张 蕊,张 军,等.鹅 SCD1基因真核表达载体构建及在肝细胞中的表达[J].上海交通大学学报(农业科学版),2014,32(2):5-9.
ZHANG Y H,ZHANG R,ZHANG J,et al. Construction and expression of goose SCD1 genein primary hepatocyte[J].Journal of Shanghai Jiaotong University (Agricultural Science),2014,32(2):5-9.
[2] RINCON G,ISLAS-TREJO A,CASTILLO A R,et al. Polymorphisms in genes in the SREBP1 signalling pathway and SCD are associated with milk fatty acid composition in holstein cattle[J].Journal of Dairy Research,2012, 79(1):66-75.
[3] ZHU S L,ZHANG J W,WANG W,et al. Blockage of NDUFB9-SCD1 pathway inhibits adipogenesis [J].Journal of Physiology and Biochemistry,2022,78(2):377-388.
[4] ZHANG J W,WANG W,FENG N H,et al. Ndufa6 regulates adipogenic differentiation via Scd1[J].Adipocyte,2021,10(1):646-657.
[5] DAI S,YAN Y L,XU Z J,et al. SCD1 confers temozolomide resistance to human glioma cells via the Akt/GSK3 β/β-catenin signaling axis [J].Frontiers in Pharmacology,2018,960(8):1-12.
[6] 周秀敏,李强子,毕英杰,等.牛 SCD1基因的生物信息学分析[J].现代畜牧兽医,2016 (12):30-34.
ZHOU X M,LI Q Z,BI Y J,et al. Bioinformatics analysis of cattle SCD1 gene [J].Modern Journal of Animal Husbandry and Veterinary Medicine,2016 (12):30-34.
[7] 石恒波,罗 军,朱 越,等.奶山羊SCD基因CDS区的克隆、序列分析及过表达[J].中国农业科学,2012,45(24):5091-5101.
SHI H B,LUO J,ZHU Y,et al. Cloning,sequence analysis and over-expression of SCD gene of dairy goat [J].Scientia Agricultura Sinica,2012,45(24):5091-5101.
[8] ZHANG Y,ZHENG Y,WANG X Y,et al. Bovine stearoyl-CoA desaturase 1 promotes adipogenesis by activating the PPARγ gamma receptor[J].Journal of Agricultural and Food Chemistry,2020,68(43):12058-12066.
[9] BURCHAT N,AKAL T,NTAMBI J M,et al. SCD1 is nutritionally and spatially regulated in the intestine and influences systemic postprandial lipid homeostasis and gut-liver crosstalk[J].Biochimica et Biophysica Acat-Molecular and Cell Biology of Lipids,2022,1867(9):1-17.
[10] JIN K,CHEN C,SUN X Y,et al. Identification and generation of transgenic mice and goats with capra hircus SCD1 gene[J].Pakistan Journal of Zoology,2021,53(6):2217-2225.
[11] MASON P,LIANG B R,LI L Y,et al. SCD1 Inhibition causes cancer cell death by depleting mono-unsaturated fatty acids[J].Plos One,2012,7(3):1-8.
[12] EDUARDO G,SARA G,GRACIA M,et al. SCD1 expression is associated to free fatty acid levels,but not to SCD1 gene promoter methylation levels in morbid obese patients[R]:85th Congress of the European-Atherosclerosis-Society,Prague,Czech Republic,2017.
[13] MUSLIJI Z S,POLLOZHANI A K,LISICHKOV K, et al. Comparative analysis of genes associated with obesity in humans using bioinformatic data and tools[J].Balkan Journal of Medical Genetics,2021,24(1):35-39.
[14] HARSHITHA R,ARUNRAJ D R. Real-time quantitative PCR:a tool for absolute and relative quantification[J].Biochemistry and Molecular Biology Education,2021, 49(5):800-812.
[15] AGGARWAL K. Weyl bound for GL(2) in t-aspect via a simple delta method[J].Journal of Number Theory,2020,208:72-100.
[16] ABBASI W A,ABBAS S A,ANDLEEB S. PANDA:predicting the change in proteins binding affinity upon mutations using sequence information[J].Journal of Bionformatics and Computational Biology,2021,19(4):1-15.
[17] CHEN M,XU J,WANG Y,et al. Arctium lappa L. polysaccharide can regulate lipid metabolism in type 2 diabetic rats through the SREBP-1/SCD-1 axis[J].Carbohydrate Research,2020,494:108055.
[18] 张 蕊,张宜辉,邵 丹,等.硬脂酰辅酶A去饱和酶基因的功能与调控[J].生命科学,2013,25(4):378-382.
ZHANG R,ZHANG Y H,SHAO D,et al. The function and regulation of stearoyl-CoA desaturase gene[J].Science of Life,2013,25(4):378-382.
[19] DUCHEMIN S,BOVENHUIS H,STOOP W M,et al. Genetic correlation between composition of bovine milk fat in winter and summer,and DGAT1 and SCD1 by season interactions[J].Chinese Bulletin of Life Sciences,2013,96(1):592-604.
[20] 王小龙,陈仁金,杨章平,等.中国荷斯坦牛 SCD1基因多态性与泌乳性状的关联分析[J].畜牧兽医学报,2011, 42(7):1022-1026.
WANG X L,CHEN R J,YANG ZH P,et al. Gnetic polymorphism of the SCD1 gene and its associations with milking traits in chinese holstein[J].Act Veterinaria et Zootechnica Sinica,2011,42(7):1022-1026.
[21] LI Z P,LU S Y,CUI K Q,et al. Fatty acid biosynthesis and transcriptional regulation of stearoyl-CoA desaturase 1 (SCD1) in buffalo milk[J].BMC Genetics,2020,21(1):1-10.
[22] ZOU Y,WANG Y,MA H,et al. SCD1 promotes lipid mobilization in subcutaneous white adipose tissue[J].Journal of Lipid Research,2020,61(12):1589-1604.
[23] 张德荣,孙渭博,曹 忻,等.兰州大尾羊脂联素及其受体基因全长cDNA克隆与表达模式分析[J].西北农业学报,2022,31(11):1-12.
ZHANG D R,SUN W B,CAO X. et al. Full-length cDNA cloning of lanzhou fat-tailed sheep adiponectin,receptor genes and its expression pattern analysis[J].Agriculturae Boreali-occidentalis Sinica,2022,31(11):1-12.
[24] 杨 静,梁 琪,宋雪梅,等.夏季高原牧草脂肪酸与牦牛乳脂脂肪酸特征及相关性研究[J].西北农业学报,2022,31(4):506-516.
YANG J,LIANG Q,SONG X M,et al. Summer forage grass fatty acids and yak milk fatty acids and its correlation in qinghai-tibet plateau[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(4):506-516.
[25] SALGADO M,SILVA A R,DE SOUZA C O,et al. Days in milk alters the milk fatty acid profile of grazing donkeys:a preliminary study[J].Journal of Animal Physiology and Animal Nutrition,2021,105(6):1173-1178.
[26] WANG F G,CHEN M Q,LUO R B,et al. Fatty acid profiles of milk from holstein cows,Jersey cows,buffalos,yaks,humans,goats,camels,and donkeys based on gas chromatography-mass spectrometry[J].Journal of Dairy Science,2022,105(2):1687-1700.
[27] 曹威荣.猪硬脂酰辅酶A去饱和酶蛋白生物信息学分析[J].畜牧与饲料科学,2014,35(11):5-7.
CAO W R. Bioinformatics analysis of the SCD protein in pig[J].Animal Husbandry and Feed Science,2014, 35(11):5-7.
Cloning and Tissue Expression of SCD1 Gene in Donkey
HUANG Fei,QI Yehui,LIU Guiqin,WANG Changfa and ZHOU Miaomiao
(Liaocheng Research Institute of Donkey High-Efficiency Breeding and Ecological Feeding, College of Agriculture of Liaocheng University,Liaocheng Shandong 252000,China)
Abstract In this study,the full-length cDNA cloning,bioinformatics analysis and tissues expression of donkey stearoyl-CoA desaturase-1 (SCD1) gene was carried out. The CDS sequence of donkey SCD1 gene was obtained by the PCR method first,and then the bioinformatic prediction of the SCD1 genes coding product was done. Additionally,the relative mRNA expression of the SCD1 gene in different tissues of donkey (heart,liver,spleen,lung,kidney,muscle,fat,and mammary gland) was determined by qRT-PCR. The results showed that the donkey SCD1 genes CDS was 1 080 bp,which could encode a peptide with 359 amino acid residues; the molecular mass,isoelectric point,instability index,and hydrophobicity average value of SCD1 protein were 41.61,9.32,44.16,and -0.157,respectively,which was a basic hydrophilic protein with an unstable secondary structure. The secondary structure of SCD1 protein was mainly composed of α-helix (51.25%) and random coil (42.62%). The mRNA of SCD1 gene were expressed in all tested donkey tissues,and the relative mRNA level was highest in liver,followed by fat,mammary gland and lung,and lowest in heart and muscle (P< 0.05). These results indicated that SCD1 may play an important role in unsaturated fatty acids synthesis of donkey fat and mammary gland tissues. This study is helpful to investigate the synthesis mechanism of high unsaturated fatty acids in donkey fat and donkey milk.
Key words SCD1 ; Donkey; Gene cloning; Bioinformatics analysis; Tissue expression
Received 2022-12-07 Returned 2023-02-08
Foundation item National Key R&D Plan of China (No.2022YFD1600103); Open Project for Animal Husbandry Research of Liaocheng University(No.319312101-09);the Open Project of Liaocheng University Animal Husbandry Discipline(No.319462207-9).
First author HUANG Fei,male,master student. Research area:herbivore lactation physiology. E-mail: 2470303187@qq.com
Corresponding author ZHOU Miaomiao,female,associate professor.Research area:herbivore lactation physiology. E-mail:zhoumm0329@163.com
(责任编辑:顾玉兰 Responsible editor:GU Yulan)

