西瓜食酸菌CusB蛋白的生物信息学分析
刘星++胡金凤++王希东

摘要:为了解西瓜食酸菌耐药结节细胞分化(RND)家族外排转运体中膜融合蛋白CusB生物信息学信息,利用相关软件对西瓜食酸菌和其他革兰氏阴性细菌的CusB蛋白进行理化性质分析,同时对西瓜食酸菌CusB蛋白的疏水性、跨膜结构域、磷酸化位点、信号肽及分泌蛋白亚细胞定位、蛋白质二级结构进行预测。结果表明:西瓜食酸菌CusB蛋白理化性质及进化树分析结果与大肠杆菌较为接近,梨火疫病菌、荧光假单胞菌与其他5种细菌遗传距离较远,预测西瓜食酸菌CusB蛋白有1个区域疏水性较高,存在1个近N端的跨膜结构域,且还有多个磷酸化位点,前1~36个氨基酸残基组成了信号肽,分泌蛋白位于周质空间,二级结构含有较多的α-螺旋、无规则卷曲。对CusB蛋白进行生物信息学分析,既丰富了信息学信息,又有助于在其分子水平的研究,同时也为西瓜食酸菌的抗铜性机理研究提供了依据。
关键词:瓜类细菌性果斑病;西瓜食酸菌;RND外排转运体;CusB蛋白;生物信息学分析
中图分类号: S182文献标志码: A文章编号:1002-1302(2016)05-0034-04
瓜类细菌性果斑病(bacterial fruit bloteh,BFB)是一种严重危害葫芦科植物的世界性种传细菌性病害,其病原菌为西瓜食酸菌(Acidovorax citrulli)[1]。自从1965年在美国首次发现西瓜食酸菌以来,世界多国已相继报道该病害的发生[2]。目前在我国主要分布于新疆、内蒙古、山东、陕西、河北、福建、云南、吉林、海南、黑龙江、辽宁、台湾等15个省(市)的西甜瓜种植区[3],该病害严重影响了葫芦科植物的产量和商品销量,是我国葫芦科作物产业的主要危害因子[4]。
由于西瓜食酸菌属于革兰氏阴性菌,因此其细胞质膜由细胞外膜、周质空间、细胞内膜构成[5],并且其细胞膜上存在着革兰氏阴性细菌特有的耐药结节细胞分化(RND)外排转运体[6],该转运体由3个部分构成:外膜蛋白(outer membrane protein,OMP)、内膜蛋白(inner membrane efflux proteins,IMP)、膜融合蛋白(membrane fusion proteins,MFP),主要负责细菌细胞内重金属离子、色素分子、糖类、抗生素等由胞内向胞外的转运[7]。已有报道指出,大肠杆菌(Escherichia coli)中编码CusB蛋白的基因突变会导致铜离子、银离子无法正常转运至胞外,最终导致大肠杆菌死亡[8]。在铜绿假单胞菌(Pseudomonas aeruginosa)中RND外排转运体任一组分缺失都会影响外排转运体的正常工作[9]。目前,在西瓜食酸菌中还未见关于RND外排转运体中膜融合蛋白的报道。本研究运用生物信息学分析的方法,对A.citrulli的膜融合蛋白基因cusB基因和CusB蛋白的理化性质、进化分析、疏水性、跨膜结构域、磷酸化、信号肽、分泌蛋白亚细胞定位和蛋白质二级、三级结构进行了预测分析,以期为瓜类细菌性果斑病菌的抗铜分子机理的研究奠定基础。
1材料与方法
1.1试验材料
1.1.1数据来源本研究所用的西瓜食酸菌膜融合蛋白的氨基酸序列为笔者所在实验室测序获得的膜融合蛋白序列,在本试验中命名为CusB。选择梨火疫病菌(Erwinia amylovory,NC_005246)、茄科雷尔氏菌(Ralstonia solanacearum,NC_001399)、大肠杆菌(Escherichia coli,NC_007779)、铜绿假单胞菌(Pseudomonas aeruginosa,NC_022361)、荧光假单胞菌(Pseudomonas fluorescens,NC_012674)、地毯草黄单胞菌柑橘致病变种(Xanthomonas axonopodis pv. citri,NC_005240)中编码膜融合蛋白的基因进行研究。
1.1.2相关软件和在线工具本研究中所用相关软件和在线工具主要有:ClustalX、MEGA 4.0、ProtParam、DNAMAN、
NETPHOBAC(www.cbs.dtu/)、SignalP、TargetP、TatP1.0、PSIPREDv3.0(http://bioinf.cs.ucl.ac.uk/)、SWISS-MODEL。
1.2试验方法
1.2.1cusB基因基本信息登陆NCBI网站,搜索西瓜食酸菌全基因组序列同源的膜融合蛋白基因Aave_4663,了解该基因的基本信息。
1.2.2西瓜食酸菌及其他常见病原菌膜融合蛋白的理化性质比较利用分析软件ProtParam对以上细菌膜融合蛋白CusB的理化性质进行分析。
1.2.3西瓜食酸菌与其他常见病菌膜融合蛋白氨基酸序列比对及系统发育树构建以上述菌株为待测材料,对膜融合蛋白序列进行聚类分析,以CusB蛋白为标记,进行A.citrulli的CusB系统进化分析。蛋白质序列比对使用Clustal X方法[10],系统发育分析使用MEGA4[11]。采用邻接法,自展 1 000 次以评估树的可靠性。
1.2.4CusB蛋白疏水性、跨膜结构域及磷酸化位点预测利用在线分析软件ProtScale(www.expasy.org/)对西瓜食酸菌CusB蛋白进行疏水性分析;利用TMHMM软件对西瓜食酸菌CusB蛋白跨膜结构域进行分析;利用在线软件NETPHOBAC(www.cbs.dtu/)分析CusB蛋白磷酸化。
1.2.5CusB序列信号肽预测及蛋白质亚细胞定位利用SignalP、TargetP预测西瓜食酸菌CusB序列信号肽与蛋白质到达的亚细胞位点。
1.2.6CusB蛋白二级结构、三级结构的预测利用在线软件PSIPREDv3.0(http://bioinf.cs.ucl.ac.uk/)对西瓜食酸菌CusB蛋白二级结构进行预测,利用在线软件SWISS-Model(http://swissmodel.expasy.org/)对其进行三级结构预测。
2结果与分析
2.1西瓜食酸菌cusB基因的基本信息
测序发现,西瓜食酸菌cusB基因长度为1 185 bp,编码394个氨基酸序列。通过登陆NCBI网站,对西瓜食酸菌Aave_4663基因进行查阅发现:在UniProt中对膜融合蛋白的解释为转运体。其功能包含吖啶黄抗性、重金属外排和多药抗性蛋白,大多数该家族蛋白存在于革兰氏阴性菌中,其膜融合蛋白使内膜蛋白和外膜蛋白结合在一起,形成一种转运通道,使得胞内物质运输到胞外。
2.2西瓜食酸菌及其他革兰氏阴性菌膜融合蛋白的理化性质比较
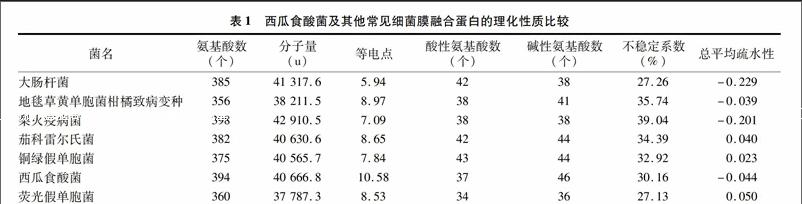
用在线软件ProtParam(http://web.expasy.org/)分析包含西瓜食酸菌在内的7种病菌膜融合蛋白的氨基酸序列,详见表1。由该蛋白氨基酸序列可知,分子式为C174 1H290 3N555O556S5,相对分子量为40.666 8 ku,具有394个氨基酸残基,含量较多的有丙氨酸(A,20.8%)、缬氨酸(V,9.9%)、亮氨酸(L,8.9%),含量较少的有半胱氨酸(C,0.3%)、色氨酸(W,0.5%)、酪氨酸(Y,0.5%),pI值为10.58,不含有以终止密码编码的吡咯赖氨酸(Pyl)、硒半胱氨酸(Sec),半衰期在哺乳动物网织红细胞离体培养为30 h,在酵母菌体内培养大于20 h,大肠杆菌内大于10 h,脂溶系数90.10,不稳定系数30.16,说明该蛋白稳定且耐热。由表1可知,7种细菌的膜融合蛋白氨基酸残基数在350~400个之间,其中西瓜食酸菌的膜融合蛋白残基数位于第2,与梨火疫病菌、大肠杆菌的膜融合蛋白氨基酸残基数较为接近,与地毯草黄单胞菌柑橘致病变种氨基酸残基数相差较大。在相对分子量上,西瓜食酸菌排第3,茄科雷尔氏菌、铜绿假单胞菌较为接近,荧光假单胞菌分子量最低。
西瓜食酸菌的膜融合蛋白中酸性氨基酸的数量少于碱性氨基酸,理论等电点偏碱性,大部分理化性质与大肠杆菌相似。西瓜食酸菌不稳定系数较低,说明稳定性较好。2.3西瓜食酸菌及其他常见病菌膜融合蛋白氨基酸序列比对及系统发育树构建
Clustal X软件分析蛋白质一级序列见图1。比对7种细菌CusB蛋白的氨基酸序列后用MEGA 4.0建立进化树,结果见图2,可见西瓜食酸菌与大肠杆菌聚类分析结果落在同一分支上,而与梨火疫病菌、荧光假单胞菌距离较远。由此可知:序列比对和进化树构建分析证实了CusB蛋白是1个RND外排转运体的膜融合蛋白亚基。系统进化分析发现:西瓜食酸菌的CusB蛋白也与铜绿假单胞菌的膜融合蛋白和地毯草黄单胞菌柑橘致病变种及茄科雷尔氏菌属于同类蛋白质。
2.4西瓜食酸菌CusB蛋白疏水性、跨膜结构域及磷酸化位点预测
维持蛋白质三级结构最重要的作用力就是疏水相互作用,在天然蛋白质中,疏水键是疏水侧链为了避开水相而群聚在一起的一种相互作用。疏水作用对蛋白质的稳定性、构象、功能具有重要意义。利用PROTSCALE软件对西瓜食酸菌的CusB蛋白进行疏水性分析,图3结果表明,前30个氨基酸疏水性比较高。跨膜结构域通常由20个左右的疏水性氨基酸残基组成,主要形成α-螺旋。利用TNHMM软件对西瓜食酸菌CusB蛋白分析表明,该蛋白存在1段从第9至第31个氨基酸残基组成的跨膜结构区,定位于细胞质膜上,这与疏水性分析结果一致(图4)。利用软件NETPHOSBAC1.0对西瓜食酸菌CusB蛋白进行磷酸化位点预测分析可知:在氨基酸全序列中,共有17个磷酸化位点。
2.5西瓜食酸菌CusB序列信号肽预测及蛋白质到达的亚细胞位点
利用SignalP-NN、SignalP-HMM对西瓜食酸菌CusB序列信号肽进行预测。结果表明:西瓜食酸菌CusB序列存在信号肽序列,其大小为1~36 bp;经过图5的TargetP分析可知,信号肽类型为信号肽酶I(SPI),其所分泌的蛋白质所到达的亚细胞位点为S(即分泌到周质空间)。
2.6西瓜食酸菌CusB蛋白二级、三级结构预测
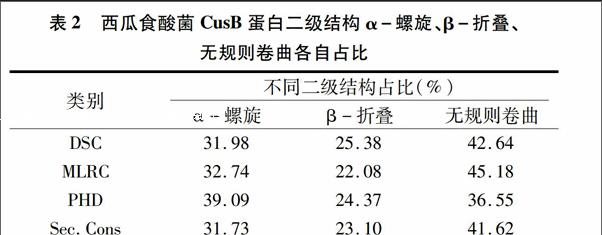
利用在线软件PSIPREDv3.0(http://bioinf.cs.ucl.ac.uk/)对西瓜食酸菌CusB蛋白二级结构进行预测,通过不同的算法[蛋白质二级结构分类判别预测(OSC)、多变量线性回归组合预测(MLRC)、神经网络预测(PHD)、综合预测(Sec·Cons)]计算α-螺旋、β-折叠、无规则卷曲各自占比得出更确切的参考值。由表2可知,CusB蛋白是α-螺旋、β-折叠、无规则卷曲同时存在的一种蛋白,且α-螺旋和无规则卷曲含量较多。利用Swiss-Model对西瓜食酸菌的cusB基因编码蛋白质的三级结构进行同源建模,结果表明:CusB蛋白质的三维结构以无规则卷曲为主要结构元件,α-螺旋集中在一侧,延伸链贯穿整条肽链(图6)。
3讨论与结论
RND外排转运体是革兰氏阴性菌细胞膜上所特有的一类转运体,其中CusB蛋白是关键组分之一。西瓜食酸菌中的RND外排转运体主要成分与大肠杆菌一样,包括CusA、CusB、CusC 3个部分。
本研究主要对西瓜食酸菌的CusB蛋白进行生物信息学分析,结果发现:西瓜食酸菌cusB基因由1 185 bp核苷酸组成,翻译产物为394个氨基酸残基;CusB蛋白位于周质空间内,起着连接外膜蛋白和内膜蛋白并稳定RND外排转运体以及运输物质的作用。CusB蛋白的理化性质与大肠杆菌相似,由进化树分析可知:西瓜食酸菌与大肠杆菌CusB蛋白为同一类蛋白,而梨火疫病菌、荧光假单胞菌与其他细菌遗传距离较远,同属假单胞菌属的铜绿假单胞菌、荧光假单胞菌在CusB蛋白进化上也存在明显差异,这说明由1个蛋白或基因来判定二者的进化关系是不精准的。蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制,一般发生在翻译后修饰,同时也是原核生物最重要的调控修饰之一,由于氨基酸侧链加入了1个带强负电荷的磷酸基团,发生酯化作用,从而改变了蛋白质的构象、活性、与其他分子相互作用的能力,CusB蛋白存在多个磷酸化位点,这可能与膜融合蛋白通过改变自身构象来转运重金属离子并转运至外膜蛋白有关,也可能与细胞信号转导有关,磷酸化在该蛋白上的具体功能还有待进一步验证。
信号肽在蛋白质分泌过程中起着重要的作用,一般由 10~60个氨基酸残基组成,通过在线软件分析预测可知:该蛋白存在1段大小为1~36个氨基酸残基组成的信号肽序列,并且信号肽分泌蛋白亚细胞器分布表明:分泌蛋白的分泌途径所到达的位点为S型,即分泌在周质空间占88.6%;M型途径,即定位于线粒体中占43.7%,未确定型占0.3%。S型所占比例较大,这再次体现了Ma在研究茄科雷尔氏菌时发现的革兰氏阴性菌分泌蛋白通常位于周质空间和质膜外的结论[12]。西瓜食酸菌CusB蛋白的疏水性预测与跨膜结构域预测结果一致,在多肽链上近N端存在疏水性较高的部位及相应的跨膜结构域。目前,对于大肠杆菌的Cus系统研究比较深入,有报道指出,cus基因的突变会降低大肠杆菌对于铜离子、银离子的外排[13],因此对西瓜食酸菌的CusB蛋白进行生物信息学的分析能够为分子水平的研究提供依据,对于揭示西瓜食酸菌的抗铜机理以及新型药物的研发有重要意义。
参考文献:
[1]Bahar O,Burdman S. Bacterial fruit blotch:A threat to the cucurbit industry[J]. Israel Journal of Plant Sciences,2010,58(1):19-31.
[2]Schaad N W,Postnikova E,Sechler A,et al. Reclassification of subspecies of Acidovorax avenae as A. avenae (Manns 1905) emend.,A. cattleyae (Pavarino,1911) comb. nov.,A. citrulli Schaad et al.,1978) comb. nov.,and proposal of A. oryzae sp. nov[J]. Systematic and Applied Microbiology,2008,31(6/7/8):434-446.
[3]金岩,张俊杰,吴燕华,等. 西瓜细菌性果斑病的发生与病原菌鉴定[J]. 吉林农业大学学报,2004,26(3):263-266.
[4]赵文龙,杨玉文,王铁霖,等. 瓜类细菌性果斑病菌对硫酸铜的敏感性检测与分析[J]. 植物保护,2013,39(6):100-105.
[5]Stefan P,Ma A T,Derek S,et al. Identification of a conserved bacterial protein secretion system in Vibro cholerae using the Dictyostelium host model system[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(5):1528-1533.
[6]Nikaido H,Pagès J M. Broad-specificity efflux pumps and their role in multidrug resistance of gram-negative bacteria[J]. FEMS Microbiology Reviews,2012,36(2):340-363.
[7]Eun-Hae K,Nies D H,Mcevoy M M,et al. Switch or funnel:hoe RND-type transport systems control periplasmic metal homeostasis[J]. Journal of Bacteriology,2011,193(10):2381-2387.
[8]Tanabe M,Szakonyi G,Brown K A,et al. The multidrug resistance efflux complex,EmrAB from Escherichia coli forms a dimer in vitro[J]. Biochemical and Biophysical Research Communications,2009,380(2):338-342.
[9]姚明晓,苑广盈,闻新棉. 主动外排系统介导细菌多重耐药的研究进展[J]. 现代预防医学,2014,41(1):118-121.
[10]Larkin M A,Blackshields G,Brown N P,et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics,2007,23(21):2947-2948.
[11]Tamura K,Dudley J,Nei M,et al. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution,2007,24(8):1596-1599.
[12]Ma S. Control of virulence and pathogenicity genes of Ralstonia solanacearum by an elaborate sensory network[J]. Annual Review of Phytopathology,2000,38(4):263-292.
[13]Franke S,Grass G,Rensing C,et al. Molecular analysis of the copper-transporting efflux system CusCFBA of Escherichia coli[J]. Journal of Bacteriology,2003,185(13):3804-3812.魏彦辉,周荣艳,张军杰,等. c-KIT在不同毛色山羊皮肤中的表达[J]. 江苏农业科学,2016,44(5):38-41.

