绞股蓝多糖提高小鼠腹腔巨噬细胞免疫功能
王欣雨 金鑫 杜倩笙 唐非台 刘可可 董胤余 王晓丽

摘要:研究不同浓度(12.5、25.0、50.0、100.0、200.0 μg/mL)绞股蓝[Gynostemma pentaphyllum(Thunb.)Makino]多糖(GPP)对小鼠腹腔巨噬细胞的影响,探讨GPP对机体免疫功能的调节作用及其可能的作用机制。采用中性红法、Griess法、CCK8法、ELISA法和荧光定量PCR法检测小鼠腹腔巨噬细胞的吞噬能力、增殖、细胞因子(NO、LDH、TNF-α、IL-1β)的分泌量、CaM和GSα基因的表达水平。结果表明,GPP激活小鼠腹腔巨噬细胞,随着GPP浓度的增加小鼠腹腔巨噬细胞增殖能力增强,当GPP浓度为50.0、100.0、200.0 μg/mL时,吸光度与空白对照处理相比差异显著;GPP刺激小鼠腹腔巨噬细胞后,吞噬能力强于空白对照处理,GPP浓度为200.0 μg/mL时,小鼠腹腔巨噬细胞的吞噬能力最强;GPP促进小鼠腹腔巨噬细胞NO、LDH、TNF-α和IL-1β的分泌;GPP上调CaM和GSα基因的表达,GPP浓度为100.0、25.0 μg/mL时CaM、GSα基因表达量分别达到最高。
关键词:绞股蓝[Gynostemma pentaphyllum(Thunb.)Makino]多糖(GPP);巨噬细胞;吞噬作用;免疫功能;小鼠;腹腔
中图分类号:S852.1;S859.7 文献标识码:A
文章编号:0439-8114(2024)06-0151-05
DOI:10.14088/j.cnki.issn0439-8114.2024.06.024 开放科学(资源服务)标识码(OSID):
Gynostemma pentaphyllum polysaccharides enhance the immunologic function of mouse peritoneal macrophages
WANG Xin-yu, JIN Xin, DU Qian-sheng, TANG Fei-tai, LIU Ke-ke, DONG Yin-yu, WANG Xiao-li
(College of Animal Science and Technology, Guangxi University, Nanning 530005, China)
Abstract: In order to investigate the effects of different concentrations (12.5, 25.0, 50.0, 100.0, 200.0 μg/mL) of Gynostemma pentaphyllum polysaccharides (GPP) on mouse peritoneal macrophages, and to explore the regulatory effect of GPP on immunologic function and its possible mechanisms, the neutral red method, Griess method, CCK8 method, ELISA method, and fluorescence quantitative PCR method to detect the phagocytic ability, proliferation, the secretion of cytokines(NO,LDH,TNF-α,IL-1β), and CaM, and GSα gene expression level of mouse peritoneal macrophages. The results showed that GPP activated mouse peritoneal macrophages, and the proliferation ability of mouse peritoneal macrophages increased with the increase of GPP concentration. When the GPP concentration was 50.0, 100.0, and 200.0 μg/mL, the absorbance showed significant differences compared to the blank control treatment;after GPP stimulation, the phagocytic ability of mouse peritoneal macrophages was stronger than that of the blank control treatment. When the GPP concentration was 200.0 μg/mL, the phagocytic ability of mouse peritoneal macrophages was the strongest;GPP promoted the secretion of NO,LDH,TNF-α, and IL-1β in mouse peritoneal macrophages; GPP upregulated CaM and GSα gene expressions. When the GPP concentration was 100.0 and 25.0 μg/mL, CaM and GSα gene expression levels had reached their highest levels respectively.
Key words: Gynostemma pentaphyllum polysaccharides (GPP); macrophages; phagocytosis; immunologic function;mouse;peritoneum
绞股蓝[Gynostemma pentaphyllum(Thunb.)Makino] 是一种多年生药用草本植物,葫芦科,又称七叶胆、七叶参、甘茶蔓[1]。绞股蓝是一种传统的名贵中药,具有降低胆固醇和甘油三酯水平、生津、调节血压、增强免疫力、治疗胃炎、减轻慢性支气管炎和哮喘等功效[2,3]。绞股蓝含有多种生物活性成分,绞股蓝多糖(Gynostemma pentaphyllum polysaccharides,GPP)就是其中之一。近年来,已经有越来越多的证据表明绞股蓝多糖有降低患心血管疾病的风险,具有降低血糖、抗炎、抗癌、保护肝脏、低毒、抗胃溃疡、免疫调节、抗氧化活性和治疗高脂血症的作用[4,5]。
巨噬细胞是机体免疫系统的一种重要免疫细胞,它存在于机体的几乎所有组织中,是宿主防御外来病原体入侵和抵抗癌细胞生长的第一道防线,具有很强的吞噬功能及抗原提呈作用,在特异性免疫和非特异免疫中都发挥作用[6]。已有大量研究证实,从自然资源中分离出来的多种多糖物质对免疫系统调节作用的一个重要机制就是它们影响了巨噬细胞的免疫功能[7,8],然而关于绞股蓝多糖对于巨噬细胞的免疫调节作用及其作用机制还鲜有报道。本研究为探索不同浓度绞股蓝多糖(GPP)对小鼠腹腔巨噬细胞的影响,观察了GPP对小鼠腹腔巨噬细胞吞噬、增殖能力的影响,以及对细胞因子(NO、LDH、TNF-α、IL-1β)分泌量和CaM、GSα基因表达的影响,为绞股蓝多糖的新型抗炎及免疫调节的药物开发提供试验依据。
1 材料与方法
1.1 试验动物与腹腔巨噬细胞的制备
SPF级健康昆明系小白鼠(许可证编号:SYXK桂2014-0001)70只,4~5周龄,体重(18±1)g,雌雄各占50%,购于广西医科大学动物实验中心。适应性饲养3 d后将小鼠处死,使用75%乙醇浸泡消毒,腹腔注入5 mL PBS缓冲液,轻揉腹部1~2 min后收集腹腔液,1 000 r/min离心 5 min,弃上清液收集巨噬细胞,台盼蓝染色活细胞数>95%,用含10%的胎牛血清DMEM培养液调整细胞浓度至2×109个/L。以每孔100 μL加样于96孔板中,放置于37 ℃、5% CO2培养箱中培养,4 h后用PBS洗去未贴壁的细胞,即得纯化的小鼠腹腔巨噬细胞。
1.2 试验分组
1)空白对照组:培养基为含10%胎牛血清的DMEM完全培养基,不加脂多糖(Lipopolysaccharide, LPS)和GPP。
2)LPS处理(阳性对照):以含10.0 μg/mL LPS的DMEM完全培养基培养小鼠腹腔巨噬细胞。
3)GPP处理:分成5个梯度组,GPP浓度分别为12.5、25.0、50.0、100.0、200.0 μg/mL。
1.3 巨噬细胞吞噬功能检测
每组细胞设6个复孔,置于5% CO2培养箱中37 ℃培养24 h,每孔加入0.1%中性红溶液100 μL后继续培养2 h,弃上清液,用PBS洗3次,每孔加入100 μL细胞溶解液,4 ℃冰箱过夜,待细胞溶解后在酶标仪492 nm处测定吸光度(A)[9]。
1.4 巨噬细胞增殖检测
每组细胞6复孔,置于37 ℃、5% CO2的培养箱中培养72 h后取出培养板,每孔加入10 μL CCK8,于37 ℃ 5% CO2培养箱中培养2 h后取出培养板,在酶标仪492 nm处测定吸光度[10]。
1.5 巨噬细胞NO含量检测
每组细胞设6个复孔,按照Griess法绘制亚硝酸盐与吸光度的标准曲线,吸取上清液检测NO分泌情况,在酶标仪540 nm波长处测吸光度,通过标准曲线计算各处理组培养液中上清液的NO含量[11]。
1.6 巨噬细胞LDH、TNF-α、IL-1β含量检测
每组细胞设6个复孔,于37 ℃ 5% CO2培养箱中培养48 h,吸取上清液,以双抗夹心ELISA法测定培养上清液中LDH、TNF-α和IL-1β的含量,操作步骤按检测试剂盒的说明书进行。
1.7 巨噬细胞CaM、GSα基因的表达
根据TransZol说明书提取巨噬细胞总RNA。通过吸光度比(260 nm/280 nm)评估RNA的数量和质量。使用反转录试剂盒(南京诺唯赞生物科技股份有限公司)合成互补DNA的反转录产物。使用CFX96TM实时系统(美国BIO-RAD)通过定量实时PCR(qPCR)评估基因表达。qPCR引物参照Davis等[12]、郭文瑞等[13]的文献,由生工生物工程(上海)股份有限公司合成,β-肌动蛋白管家基因被用作qPCR反应的内部对照,如表1所示。采用以2-△△ct分析法进行目的基因相对表达量的计算。
1.8 统计学分析
试验数据均以平均数±标准差(x±s)表示,各组间均数比较采用单因素方差分析法(ANOVA),应用SPSS 21.0软件进行统计分析,P<0.05认为差异有统计学意义。
2 结果与分析
2.1 GPP对小鼠腹腔巨噬细胞吞噬功能的影响
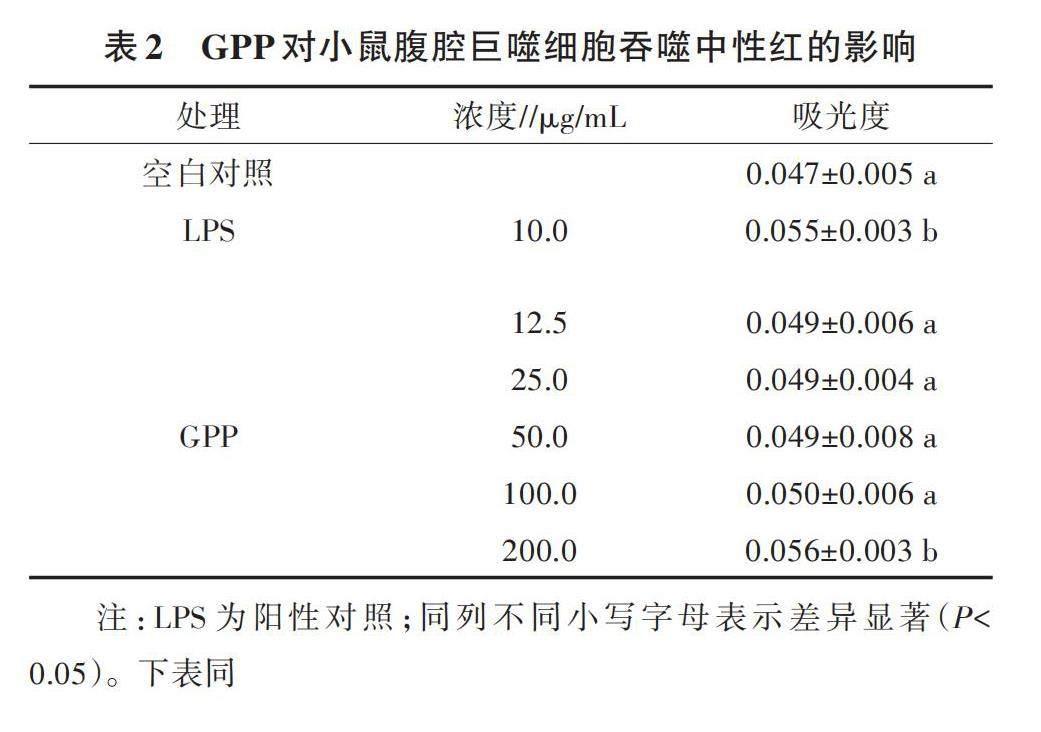
采用中性红吞噬法对不同浓度GPP处理的小鼠腹腔巨噬细胞吞噬功能进行检测,结果如表2所示。LPS处理和GPP处理的腹腔巨噬细胞吞噬能力均有所增加,LPS处理与空白对照处理相比吸光度差异显著(P<0.05)。GPP浓度为200.0 μg/mL时,小鼠腹腔巨噬细胞的吞噬能力最强,其吸光度与空白对照处理及其他GPP处理相比差异显著(P<0.05),浓度为12.5、25.0、50.0、100.0 μg/mL的GPP处理间吸光度无显著差异,且不同浓度的GPP对小鼠腹腔巨噬细胞吞噬能力无明显的量效关系。
2.2 GPP对小鼠腹腔巨噬细胞增殖的影响
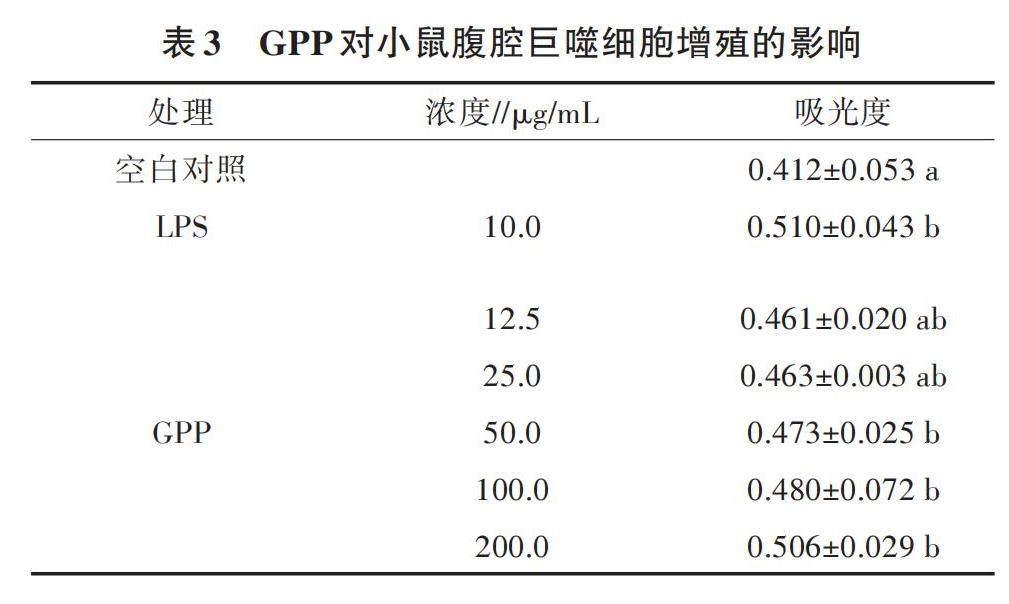
为了探究不同浓度GPP对小鼠腹腔巨噬细胞增殖的影响,本研究用CCK8测定巨噬细胞的增殖能力,结果如表3所示。LPS处理和不同浓度的GPP处理均可以促进小鼠腹腔巨噬细胞的增殖,且随着GPP浓度的增加,小鼠腹腔巨噬细胞增殖能力增强。其中LPS处理与空白对照处理相比吸光度差异显著(P<0.05);当GPP的浓度为50.0、100.0、200.0 μg/mL时,吸光度与空白对照处理相比差异显著(P<0.05),但这3个处理间差异不显著。
2.3 GPP对小鼠腹腔巨噬细胞产生细胞因子的影响
巨噬细胞在LPS和GPP处理培养48 h后,取细胞培养上清液,测定NO、LDH、TNF-α和IL-1β的含量,结果如图1所示。GPP促进巨噬细胞NO、LDH、TNF-α和IL-1β的分泌。GPP处理的NO含量均显著低于LPS处理(P<0.05),GPP处理的NO含量均显著高于空白对照处理(P<0.05),且NO含量随着GPP浓度的增加而增加。当GPP浓度达25.0 μg/mL时,巨噬细胞分泌的LDH趋于稳定,GPP浓度为50.0、100.0 μg/mL时,LDH含量均显著高于空白对照处理(P<0.05)。当GPP浓度为25.0、50.0、100.0、200.0 μg/mL时,巨噬细胞TNF-α、IL-1β的含量均显著高于空白对照处理(P<0.05),且TNF-α、IL-1β含量随着GPP浓度的增加而增加,当浓度达100.0 μg/mL时达到最大值,此时与LPS处理的TNF-α、IL-1β含量相当,当GPP浓度继续增加时,TNF-α、IL-1β含量下降。
2.4 GPP对小鼠腹腔巨噬细胞CaM、GSα基因表达的影响
为探究不同浓度GPP对小鼠腹腔巨噬细胞CaM、GSα基因mRNA表达的影响,将巨噬细胞在不同浓度GPP或LPS中培养48 h,提取细胞RNA,反转录后采用荧光定量PCR法检测CaM、GSα基因的表达量,结果如图2所示。GPP和LPS处理均可以显著提高小鼠腹腔巨噬细胞CaM基因的表达,GPP处理(25.0、50.0、100.0、200.0 μg/mL)的CaM基因表达量显著高于空白对照处理(P<0.05),其中GPP浓度为100.0 μg/mL时CaM基因表达量达到最大值,随着GPP浓度的增加,CaM基因表达量降低。GPP和LPS处理均可以显著提高小鼠腹腔巨噬细胞GSα基因的表达(P<0.05),GPP浓度在25.0 μg/mL时小鼠腹腔巨噬细胞GSα基因的表达量最高。
3 讨论
已有研究表明多糖具有促进机体免疫器官生长、激活免疫细胞和补体系统、释放免疫功能因子等免疫调节活性,是天然的免疫调节剂[14]。巨噬细胞是免疫系统的重要效应细胞,在宿主免疫应答和抵抗多种病原体感染中发挥着重要作用[15]。一方面,它具有抗原提呈、吞噬病原体、分泌多种细胞因子、激活免疫应答等生物活性;另一方面,它会释放多种炎症因子、参与炎症反应、加重炎症。
多糖主要通过影响巨噬细胞活性氧和细胞因子的产生来调节免疫系统[16,17]。细胞因子是众所周知的免疫因子,一旦被诱导,可以触发免疫系统的疾病反应,并有助于增强免疫反应。已有研究表明,茶多糖可促进小鼠腹腔巨噬细胞的吞噬功能,提高腹腔巨噬细胞上调iNOS、TNF-α和IL-1β的mRNA表达水平[18];胀果甘草多糖能增强RAW 264.7巨噬细胞增殖率和吞噬能力,促进TNF-α、IL-1β、NO及NOS释放,上调iNOS、TNF-α、IL-1β的mRNA水平,从而增强RAW 264.7巨噬细胞的免疫功能[19];荆芥多糖可以增强巨噬细胞的胞饮和吞噬活性,促进炎症因子(ROS、PTGS2、iNOS、IL-6、IL-10和TNF-α)和趋化因子(CCL2和CXCL10)的表达和分泌[20];玉米须多糖能抑制LPS诱导的ROS和NO积累,减少促炎细胞因子(TNF-α、IL-1β和IL-18)的产生和炎性介质(iNOS)的表达,具有改善炎症反应的作用[21]。此外,浒苔多糖[22]、防风多糖[23]、霍山石斛多糖[24]及松花粉硫酸多糖[25]均可显著促进巨噬细胞分泌炎性细胞因子TNF-α、IL-6和IL-12。而本研究结果也表明,GPP可提高小鼠腹腔巨噬细胞的吞噬功能和增殖能力,促进NO、IL-1β、TNF-α和LDH的分泌,从而增强巨噬细胞的免疫功能。GPP可以激活巨噬细胞并产生生物活性物质,但其激活巨噬细胞的具体机制有待进一步研究。
CaM和GSα的生理功能已被广泛研究,CaM参与的生理过程包括酶活性调节、细胞分裂和分化、细胞骨架和细胞运动、细胞核内酶系统和基因表达等[26]。细胞内CaM含量的变化及其结构和功能的异常与某些疾病的发生发展密切相关[27]。G蛋白信号通路是介导炎症反应许多信号的关键“网关”[13],从细胞外到细胞内的免疫反应、炎症介质和蛋白酶合成。郭文瑞等[28]发现牛磺胆酸显著促进小鼠腹腔巨噬细胞中CaM和GSα基因的表达。本研究结果表明,不同浓度GPP作用于小鼠腹腔巨噬细胞后,CaM和GSα mRNA水平显著升高,提示GPP可能通过上调CaM和GSα的mRNA水平来影响巨噬细胞增殖和细胞因子分泌。本研究结果为进一步研究GPP抗炎和免疫调节作用机制奠定了良好的试验基础。
综上所述,GPP可刺激小鼠腹腔巨噬细胞增殖,从而提高小鼠腹腔巨噬细胞的吞噬能力,GPP促进巨噬细胞NO、LDH、TNF-α和IL-1β的分泌,可上调CaM和GSα基因的表达,从而增强巨噬细胞的免疫功能。
参考文献:
[1] 吴亚辉. 绞股蓝对广西三黄鸡胸腺增龄性变化的影响[D]. 南宁:广西大学, 2016.
[2] LI B, ZHANG X, WANG M, et al. Characterization and antioxidant activities of acidic polysaccharides from Gynostemma pentaphyllum (Thunb.) Markino[J]. Carbohydrate polymers, 2015,127(1):209-214.
[3] KEILHOFF G, LUDWIG C, PINKERNELLE J, et al. Effects of Gynostemma pentaphyllum on spinal cord motor neurons and microglial cells in vitro[J]. Acta histochemica,2021,123(6): 151759.
[4] 白 熙, 刘新勇, 黎木兰, 等. 绞股蓝多糖对断乳雌性小鼠卵巢发育的影响[J]. 中国兽医科学, 2021, 51(4): 518-527.
[5] LIU J, ZHANG L, REN Y, et al. Anticancer and immunoregulatory activity of Gynostemma pentaphyllum polysaccharides in H22 tumor-bearing mice.[J]. International journal of biological macromolecules, 2014 ,69(6): 1-4.
[6] LEIRO J M, CASTRO R, ARRANZ J A, et al. Immunomodulating activities of acidic sulphated polysaccharides obtained from the seaweed Ulva rigida C. Agardh [J]. International immunopharmacology, 2007, 7:879-888.
[7] 王翔岩,齐 云,蔡润兰,等. 肉苁蓉多糖的巨噬细胞活化作用[J]. 中国药理学通报, 2009, 25(6): 787-790.
[8] 罗晶晶,王旭溟,计 坚, 等. 黄芪多糖对巨噬细胞活化及其吞噬功能的影响[J].中国畜牧杂志,2022,58(4):236-241.
[9] 郭志廷, 王 玲, 衣云鹏, 等. 常山碱对小鼠巨噬细胞功能的影响[J]. 中兽医医药杂志, 2016, 35(4): 34-36.
[10] 王 璐, 邱培勇, 王亚莉, 等. 玉屏风散提取液对小鼠腹腔巨噬细胞活化及增殖的影响[J]. 新乡医学院学报, 2010, 27(3): 244-247.
[11] 张思哲, 严亚锋. 杨梅素对小鼠脾淋巴细胞和腹腔巨噬细胞增殖的影响[J]. 中医药导报, 2017, 23(6): 37-40.
[12] DAVIS M J,TSANG T M, QIU Y, et al. Macrophage M1/M2 polarization dynamically adapts to changes in cytokine microenvironments in Cryptococcus neoformans infection[J]. MBio,2013,4(3):e264.
[13] 郭文瑞,毛 伟, 关 红, 等. 牛磺胆酸对小鼠腹腔巨噬细胞钙调素基因表达的影响[J]. 内蒙古农业大学学报(自然科学版),2012, 33(3): 1-4.
[14] TENG Z L, QIAN L, ZHOU Y. Hypolipidemic activity of the polysaccharides from Enteromorpha prolifera[J]. International journal of biological macromolecules, 2013, 62(11): 254-256.
[15] WYNN T A, CHAWLA A, POLLARD J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455.
[16] 刘聪秀, 宋佳佳, 王洪伟, 等. 发酵乳杆菌LFQ153胞外多糖对RAW264.7巨噬细胞氧化损伤的保护作用[J]. 食品与发酵工业,2022,48(8):1-8.
[17] 王 莹,金红宇,李耀磊,等.不同分子量枸杞多糖对RAW264.7巨噬细胞的免疫调节作用[J]. 中国新药杂志, 2021,30(12): 1079-1086.
[18] 冯燕玲. 茶多糖对免疫抑制小鼠腹腔巨噬细胞与脾淋巴细胞免疫功能的影响[D]. 南昌:南昌大学, 2015.
[19] 丛媛媛, 热米拉·米吉提, 帕丽达·阿不力孜, 等. 胀果甘草多糖对RAW264.7巨噬细胞免疫功能的影响[J]. 中华中医药学刊, 2018, 36(5): 1043-1047.
[20] XU W,ZHAO M,FY X Y, et al. Molecular mechanisms underlying macrophage immunomodulatory activity of Rubus chingii Hu polysaccharides[J]. International journal of biological macromolecules, 2021, 185(8): 907-916.
[21] XU J J,GONG L L,LI Y Y, et al. Anti-inflammatory effect of a polysaccharide fraction from Craterellus cornucopioides in LPS-stimulated macrophages[J]. Journal of food biochemistry, 2021, 45(8): e13842.
[22] 陈榕芳. 浒苔多糖粗提物对巨噬细胞RAW264.7免疫调节作用及可能机制研究[D]. 福州:福建医科大学, 2012.
[23] 杨 淳,田维毅. 防风多糖对巨噬细胞分泌细胞因子的影响[J]. 贵阳中医学院学报, 2011, 33(4):31-33.
[24] 袁晨琳. 霍山石斛多糖对巨噬细胞的免疫调节活性及其与结构特征的关系[D]. 合肥:合肥工业大学, 2013.
[25] GENG Y,XING L,SUN M, et al. Immunomodulatory effects of sulfated polysaccharides of pine pollen on mouse macrophages.[J]. International journal of biological macromolecules, 2016,91:846-855.
[26] 王旭东, 毛 伟, 关 红, 等. TCDCA对大鼠肺泡巨噬细胞钙调素基因表达的影响[J]. 内蒙古农业大学学报(自然科学版), 2015(5):1-4.
[27] 邱云志, 甘 露, 王 红, 等. 钙调素及其对细胞增殖的影响研究现状[J]. 解放军医药杂志, 2006,18(3):214-216.
[28] 郭文瑞, 毛 伟, 关 红, 等. 牛磺胆酸对小鼠腹腔巨噬细胞Gsα基因表达的影响[J]. 中国畜牧兽医, 2013, 40(4): 10-13.

