美罗培南在成人脓毒症或脓毒性休克患者中的群体药动学研究综述
姚露 罗敏 龚磊


摘要:目的 本综述旨在提供已报道的美罗培南在成人脓毒症或脓毒性休克患者中的群体药动学(population pharmacokinetics,PopPK)模型,并确定使这类患者药动学变化的协变量因素,以发现美罗培南在该类患者PopPK研究中的新靶点。方法 在PubMed和Medline数据库中检索了2012年1月至2023年3月期间发表的美罗培南在脓毒症或脓毒性休克患者中的PopPK研究,并对相关参考文献进行了筛查。结果 该检索共产生12项符合纳入条件的研究,一室和二室模型分别在3项和8项研究中被报道为能最好地描述美罗培南的PopPK。40多个协变量被纳入筛选,最常见的协变量因素是肌酐清除率和体重,年龄是次要协变量因素。美罗培南清除率和总表观分布容积的估计值分别在1.5~14.1 L/h和11.3~39.7 L范围内变化较大。半数以上研究均采用指数模型作为基础模型。结论 首先,本文强调了对该类患者估计的PopPK参数的宽泛性和可变性,并提供影响该类患者清除率和表观分布容积的协变量因素;其次,正如大多数研究报道那样,延长输注时间以及应用治疗药物监测似乎是多数研究报道的维持有效浓度在抑菌浓度之上较好的方法,但还需进一步研究以得到可靠结论。这些信息均有助于指导该类患者的给药。
关键词:美罗培南;脓毒症;脓毒性休克;群体药动学
中图分类号:R969.1文献标志码:A
Population pharmacokinetics of meropenem: A review in adult patients with sepsis or septic shock
Yao Lu1, Luo Min1, and Gong Lei1,2
(1 Affiliated Hospital of Zunyi Medical University, Zunyi 563000;
2 Department of Pharmaceutics, Kweichow Moutai Hospital, Huairen 563003)
Abstract Objective This study developed a population pharmacokinetic (PopPK) model of meropenem in adult patients with sepsis or septic shock. It identified the factors that influence changes in the drug's pharmacokinetics in these individuals. The aim was to explore a new target for meropenem in PopPK studies including this patient group. Methods PopPK studies of meropenem in patients with sepsis or septic shock published from January 2012 to March 2023 were found in the PubMed and Medline databases, and relevant references were screened. Results In total, 12 studies were deemed eligible for this review, and the one- and two-compartment models were reported to best describe the PopPK of meropenem in three and eight studies, respectively. More than 40 covariates were screened; the most common covariates were creatinine clearance and body weight, with age acting as a secondary factor. The estimated values of the clearance rate and total apparent distribution volume of meropenem varied greatly in the range of 1.5~14.1 L/h and 11.3~39.7 L, respectively. More than 50% of the studies applied the exponential model. Conclusion This review emphasized the extensiveness and variability of PopPK parameters estimated for this population and provided covariates that affected clearance and the apparent volume of distribution in this patient group. Second, prolonged infusion time and therapeutic drug monitoring seemed more suited for maintaining effective inhibitory concentrations, as widely reported, although further studies were warranted to draw reliable conclusions. The cumulative information obtained from this review could guide the drug administration system in this population.
Key words Meropenem; Sepsis; Septic shock; Population pharmacokinetics
脓毒症和脓毒性休克是危及生命的一种临床疾病,是危重患者死亡的主要原因[1-2]。脓毒症和脓毒性休克的第三个国际共识将脓毒症定义为“机体感染后由失控的宿主反应引起的危及生命的器官功能障碍”[3]。据报道,每年大约有4.9万人受到脓毒症的危害,其死亡人数占全球死亡人数的19.7%[2],以北美和欧洲的死亡率最高,达40%[4],严重影响人们的生活质量。脓毒性休克是一种以深度循环、细胞和代谢异常为主要特征的脓毒症亚型,研究表明医院内脓毒性休克的死亡率接近60%[2]。此外,脓毒症是一种时间依赖性疾病[5],对其治疗的关键因素之一是掌握正确诊断和治疗的时间以及开始启动辅助和支持治疗的时间,但当前对于脓毒症或脓毒性休克的治疗方案有限。因此,提高对脓毒症或脓毒性休克的认识将有助于脓毒症患者的预后。
一项研究调查了88个国家和地区的1.5万名ICU患者流行病学结果,发现脓毒症患者中最常见的致病菌多为革兰阴性菌,如:大肠埃希菌、克雷伯菌属、铜绿假单胞菌属等,少数患者中会检出革兰阳性菌,如肠球菌、金黄色葡萄球菌等[6]。而腹部和肺部细菌感染则是引起脓毒症的主要危险因素,控制其感染部位的发展可提高脓毒症患者的预后[7]。对于脓毒症或脓毒性休克患者的感染治疗,指南及研究均表明应早期及时使用可覆盖革兰阴性菌和革兰阳性菌的广谱抗生素[8-9]。美罗培南属于β-内酰胺类抗生素,对革兰阳性和阴性菌具有广谱抗菌活性,通常用于ICU中严重脓毒症或脓毒性休克患者的经验性治疗[10-11],其治疗效果已在多数研究中得以明确[12-14]。
对于危重症患者,合理的抗感染治疗可显著改善其临床预后,但由于自身疾病和其他潜在危险因素的影响,危重症患者常具有显著的个体间和个体内药动学差异,临床上常规抗菌药物种类以及剂量的选择可能并不适用于此类患者[15]。有研究表明,与脓毒症或脓毒性休克患者相关的病理生理变化可能影响美罗培南的表观分布容积(apparent volume of distribution,Vd)和药物清除率(clearance,CL),导致药物浓度增高或降低,使得常规的经验性给药方案难以达到治疗目标[1]。如在使用持续肾脏替代治疗(continuous renal replacement therapy,CRRT)的脓毒症患者中,初始治疗需提高美罗培南剂量至负荷剂量,而第二天开始则需根据每日的CRRT设置调整给药剂量[16];在接受持续低效透析(sustained low-efficiency dialysis,SLED)的脓毒症患者中,美罗培南浓度达到足够的药效学靶点的剂量差异较大[17]。表明该类患者在使用美罗培南时,需借助治疗药物监测(therapeutic drug monitoring,TDM)来调整给药方案,提高治疗疗效,减少耐药性的产生[18]。所以,临床上需要结合患者的疾病特点,分析药物在体内的代谢和排泄过程,优化给药方案。
基于群体药动学(population pharmacokinetics,PopPK)模型并结合TDM来优化给药策略,从而实现个体化给药的研究[19]。了解美罗培南治疗的脓毒症或脓毒性休克患者的药动学(pharmacokinetics,PK)变化,对于该类患者群体抗菌药物的剂量选择及个体化治疗方案的制定非常重要。遗憾的是,目前对于美罗培南在脓毒症或脓毒性休克中的PopPK研究并不多,此领域的综述也鲜见报道。因此,本文就美罗培南在成人脓毒症或脓毒性休克患者中的PopPK做一综述。
1 数据来源
1.1 检索策略
在PubMed和Medline数据库中检索美罗培南在成人脓毒症或脓毒性休克患者中的群体药动学相关研究,时间限制在2012年1月—2023年3月期间。PubMed数据库中使用的检索词为:(美罗培南) AND (脓毒性休克OR脓毒症) AND (群体药动学OR非线性混合效应)NOT(儿童)。运用相同的检索词在Medline数据库中进行检索,检索条件限制为不包含相关词汇,时间限制为2012—2023年。另外,还对所有相关参考文献进行详细排查,以确定是否有任何其他的相关资料。
1.2 纳入标准
根据预先定义的标准纳入符合研究的文献:①研究人群:≥18岁且不包含其他危重症的脓毒症或脓毒性休克患者;②治疗:应用美罗培南进行治疗;③建模方法:非线性混合效应法建模;④语言:所用语言为英语;⑤PopPK研究;⑥参数或非参数方法。
1.3 排除标准
排除不符合研究的文献:①动物及体外实验;②荟萃分析、综述;③孕妇、儿童及婴幼儿患者。
1.4 提取信息
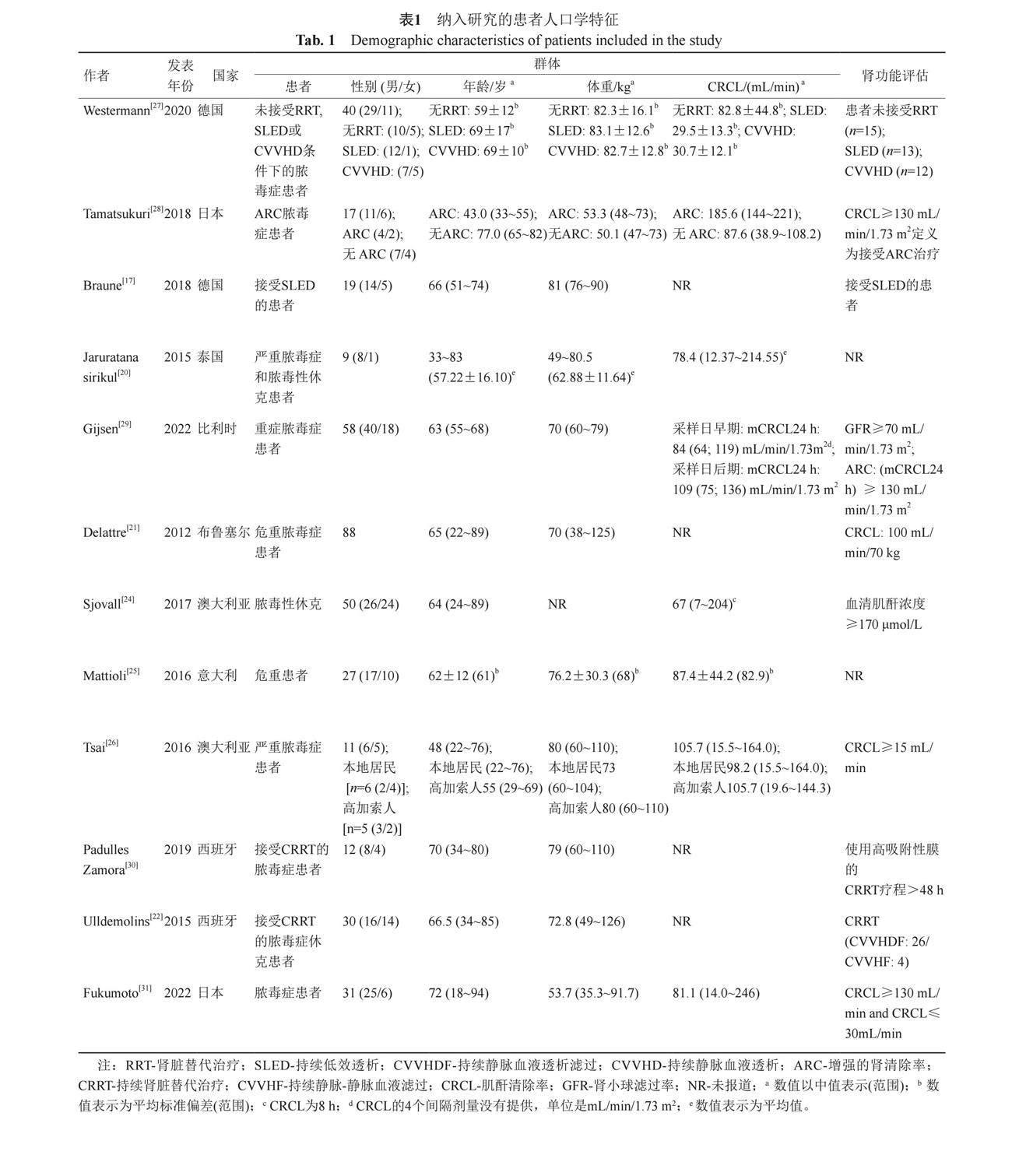
从纳入的文献中提取关键信息至Excel表中。提取的信息包括第一作者,年份,国家或地级市、区,患者特征[年龄、性别、体重和肌酐清除率(creatinine clearance,CRCL)],患者类型,肾功能评估,研究类型(前瞻性或回顾性研究),给药方案和剂量,采样频率和性质,患者血药浓度采集量,美罗培南定量方法(血药浓度测定方法、定量下限、线性范围),建模方法(主要建模软件、协变量选择依据),模型类型(一室、二室和三室),PopPK结构模型和模型相关公式和参数值,协变量的检验和保留(显著和不显著)。
2 文献检索结果
2.1 文献筛选结果
经检索,PubMed和Medline数据库分别检索出34项和807项研究,应用Endnote X9软件以及人工去重后剩余752项研究,在经纳入和排除标准分析后,12项研究被纳入本次分析。在对相关参考文献进行筛选后,未有额外研究纳入。表1总结了纳入的12项研究的人群特征,患者数量最低为9名[20],最高88名[21]。所有研究仅一项不超过10名患者[20],且所有研究都明确诊断为脓毒症或脓毒性休克,另外,5项研究未纳入需肾CRRT、体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)和SLED的患者[22-26]。
2.2 临床方案和设计
纳入的研究中,10项[17,21-27,30-31]属于前瞻性研究,2项[20,28]未说明研究性质,其中,Tamatsukuri等[28]的研究是基于3项已有的PopPK模型进行探讨。美罗培南使用剂量均由各医院的医生根据推荐剂量方案自行决定,其给药途径为间歇静脉输注(11项)以及持续静脉输注(1项)。此外,Ulldemolins等[22]的研究中同时应用延长输注和间歇输注两种方式。Westermann等[27]报道4种β-内酰类药物(其中包括美罗培南)在接受阿米卡星治疗期间在重症脓毒症患者中的首剂PK特征,并以此探索阿米卡星暴露量与β-内酰类药物暴露之间的关系。所有研究中美罗培南样本均为血液样本,样本采集最低为34个,最高为345个,1项研究[30]未给出总样本量。3项研究[27,30-31]报告了在稳态状态下采集血样,8项[17,20-26]研究未说明是否是稳态状态,1项研究[28]不属于稳态状态采样。详细信息见表2所示。所有研究均采用超高效/高效液相色谱-串联质谱法(UPLC/HPLC - MS/MS)或高效液相质谱-紫外检测法(HPLC-UV)法对美罗培南血液样本进行定量分析。所有研究中定量下限范围为0.064~2 μg/mL,最低定量限范围为1~10 mg/L,线性范围最低为0.1 mg/L,最高为300 mg/L。
2.3 PopPK分析
7项研究[20-23,25,27,30]采用NONMEM实施PopPK建模以及相关参数分析,3项研究[17,24,26]采用R软件中Pmetrics软件包的非参数自适应网格算法建立一室及二室模型,1项研究[28]采用SAS软件对连续变量进行统计分析,1项研究[31]采用Phoenix?NLME扩展最小二乘法建立二室模型。8项研究[20-25,27,31] 采用Bootstrap作为模型的内部评估,其中一项研究[22]进行了外部评估,两项研究[17,24]运用Bootstrap结合归一化预测分布误差进行模型评估。另外,两项研究[26,28]未说明评估方法。然而,所有研究都采用其他方式进行模型评估,如:模型诊断图、拟合优度图、视觉预测检查和后验预测检查等。对于协变量纳入标准,多数研究均采用逐步协变量建模。在4项研究[20,22,25,27]中,美罗培南的PK符合一室模型,在8项研究[17,21,23-24,26,28,30-31]中,美罗培南的PK符合二室模型,此外,Tamatsukuri等[28]的研究对3项已报告的模型进行探讨,分别涉及Jaruratanasirikul等[20]建立的一室模型和Cradon[32]和Roberts[33]等建立的二室模型。未有研究发现美罗培南在脓毒症或脓毒性休克的PK符合三室模型。在纳入研究中,Jaruratanasirikul等[20]将数据拟合为一室二室及三室模型,通过对比得出美罗培南的PK符合一室模型,因为两室模型在目标函数上降幅不明显,而对于该研究中的数据来说,三室模型似乎被过度参数化。以上数据统计见表3。
2.3.1 估计的清除率(CL)
除Tamatsukuri等[28]对已报道的3项研究未给出CL值外,其余研究均评估了美罗培南CL的典型值,范围为1.5 L/h (以平均值表示)至14.1 L/h (以中位数表示),这些统计数据均是来自美罗培南血药浓度测定后得到的CL值。在以下病例中观察到较高的CL值:严重脓毒症和感染性休克早期、肾功能保留或增强的危重脓毒症患者、接受高吸附膜连续静脉血液透析的患者。相对较低的CL值的病例有:肾脏替代治疗(renal replacement therapy,RRT)的患者、感染性休克合并CRRT治疗的危重患者。此外,Braune等[17]的研究中,含SLED的总体CL值较高,为7.9 L/h,而不含SLED的总体参数估计的CL值最低,为1.5 L/h。
2.3.2 估计的表观分布容积(V)
纳入研究中的Vd差异并不大,对于单室模型,最低估计值为11.3 L,适用于肾功能较差的患者群体。而最高V估计值为33.0 L,是根据患者入院时的总体重计算的。在两室模型的情况下,对中央(VC/V1)和外周(VP/V2)分表观分布容积的估计值差异较大,且仅5项研究[21,23,28,30-31]同时估计中央室以及外周室,但1项研究[30]外周室V估计值不准确,所以仅考虑中央室V。当考虑到全身总容量的分布时(即Vtotal=V1+V2),最低为22.7 L,最高为39.7 L,前者来自对肾功能保留或增强的脓毒症患者的估计,后者来自于使用测定的肌酐清除率对脓毒症患者构建PopPK模型的估计。此外,包括一室、二室模型在内的所有估计总体积的范围为11.3~39.7 L。
2.3.3 随机效应建模
8项研究[17,20-23,25,27,30]采用指数模型进行建模,并采用加性误差和/或比例误差模型,加性误差与比例误差模型的组合来解释剩余个体的变异性。其中,Delattre和Gijsen等[21,23]分别采用异速生长体重模型和异速缩放法衡量PK参数值。3项研究[17,24,26]采用非参数自适应网格算法对模型进行测试,此外,1项研究[28]是基于对已报道的模型的探讨。1项研究[31]采用比例误差模型描述最终残差模型。由于纳入的研究中均未给出受试者间变异性(between-subject variability,BSV),因此不做介绍。具体参数及公式见表4~5。
2.3.4 协变量测试
除2项研究[28,31]外,7项研究[17,20,22,24-27]将所有符合研究的人口学信息均作为协变量纳入测试,1项研究[30]未列出纳入的协变量特征,1项研究[23]的协变量是在以前报道的美罗培南PopPK研究以及专家共识中所选择的,1项研究[21]除了使用肾功能探讨患者间PK变异性的可信协变量贡献外,未纳入其他相关协变量。协变量筛选的方法多数是对数似然法和逐步协变量建模法。所有研究中,6项研究[20,21,23-24,26,28]发现肾功能或CRCL是影响美罗培南CL的重要协变量,不同的是,Jaruratanasirikul等[20]的研究中CRCL是通过Cockcroft-Gault方程和肾病饮食改良(modification of diet in renal disease,MDRD)公式计算的,Tamatsukuri等[28]研究中报告的3项研究则是采用不同的方式对CRCL进行计算,包括通过Cockcroft-Gault方程用估计的理想体重计算,通过Cockcroft-Gault方程用实际体重计算以及通过MDRD方式计算。同时,Gijsen等[23]也将患者实际体重作为协变量,但该研究中种族并未作为协变量被纳入。1项研究[31]则是使用测定的CRCL构建脓毒症患者的美罗培南PopPK模型,并基于CRCL优化美罗培南给药方案。在使用CRRT和SLED的3项研究中,两项研究[17,22]把残余尿量作为唯一使模型显著改善的协变量,但其临床结果均不能外推到其他患者群体中;另一项研究[27]则将血清肌酐、RRT时间和残余尿量作为协变量成功运用到模型中,且该研究还评估了CRRT类型(SLED、CVVHD)、非RRT和RRT的纳入对模型改善的影响,结果均不相关。然而,在两项研究[25,30]中,CRCL未能使模型得到显著改善,其中,Mattioli等[25]首次提出脓毒症严重程度(脓毒症与严重脓毒症/脓毒性休克)能使模型得到显著改善,另外,该研究还测试了(血清白蛋白、患者年龄)和(性别、脓毒症)分别对V和CL的影响,发现药物在男性中的CL和V要比女性小,但这种现象并不常见,并无统计学意义,需要在更多、更大的群体中去证实此发现。另一项研究只保留了体外循环对美罗培南CL的贡献,没有其他协变量改善模型。详情见表6。
3 讨论
碳青霉烯类药物是ICU中治疗由多重耐药革兰阴性菌引起的危及生命的感染中使用最广泛的抗菌药[34]。大量研究表明,美罗培南的剂量优化一直是临床上的热点问题,因为它在危重患者体内的变异性较大,不稳定性是造成药物浓度达不到最小抑菌浓度(minimum inhibitory concentration,MIC)范围的原因。有研究表明,在患有脓毒症和AKI的成人患者中,美罗培南的患者间和患者内的浓度存在很高的变异性,达到100%fT>MIC和50%fT>4×MIC的目标分别为48.4%和20.6%[35]。事实上,自2012年以来,关于美罗培南以在脓毒症或脓毒性休克方面的PopPK研究已被大量报道,旨在分析美罗培南在成人和儿童中的PopPK,但对于这方面的回顾性综述却未见报道,因此,认为有必要对此做一个综述。
这应该是对美罗培南在脓毒症以及脓毒性休克患者中PopPK研究做的首次综述。包括在不同国家进行的12项PopPK分析,时间自2012—2023年。不同研究中估算的CL和Vd/Vtotal差异较大,分别为:CL=1.5~14.1 L/h,Vd=11.3~39.7 L。然而,这些统计数据的一个局限是V和CL计算方式存在差异(即3项研究报告体重调整后的美罗培南CL和V,而其余研究报告的是正常体重)。另外,考虑到所有研究的PopPK设计方案不同,包括样本量大小、采样时段、采样量、协变量建模方法和参数差异等,这些差异可能会导致模型之间的概括不准确,应谨慎看待。
除一项研究[21]外,所有研究都基于各自建立的模型进行蒙特卡洛模拟,借以优化美罗培南在脓毒症或脓毒性休克患者中的给药方案。目前临床上脓毒症或脓毒症休克患者多数需CRRT或ECMO支持治疗,在这种情况下会导致标准剂量的美罗培南血药浓度低于治疗水平,且美罗培南属于时间依赖性抗菌药,须在一定的时间间隔内保持游离部分的血药浓度在最小抑菌浓度(%fT>MIC)以上才具有最佳杀菌效果[36]。然而,对于脓毒症患者来说,可能需要更高的(%fT>MIC)。因此,延长美罗培南输注时间是多数研究得出的一致结论。但这一讨论超出本综述的范围,在此不做详细描述。
本综述中10项研究属于前瞻性PopPK研究,而且多数研究均存在样本量小的局限,所以参数估计以及协变量检测的准确度还需开发大样本量的前瞻性研究去证实。40多个协变量分别被纳入研究,年龄、体重、性别几乎在所有研究中被测试,肾功能是评估美罗培南CL最重要的影响因素。但也有少数研究未将CRCL作为显著的协变量,而是使用其他协变量描述CL,如:残余尿量、血清白蛋白、血肌酐以及脓毒症的严重程度等。CRRT强度及类型、血液/透析液和超滤流量被纳入协变量测试,但并不显著。NONMEM软件建模和逐步协变量建模是报道最多的方法。
本综述也存在一定的局限性:首先,没有检索Pubmed和Medline以外的英文数据库,而对于美罗培南在脓毒症或脓毒性休克患者中的群体药动学研究在中国较为缺乏,因此未考虑纳入中文数据库;其次,纳入文献的时间限制是2012—2023年3月,未纳入2012年以前的研究,可能缺乏对之前研究的总结和思考;第三,纳入综述中的研究仅12项,虽具有一定的代表性,但严格来说并不能很好地解释该类患者使用美罗培南时产生的群体药动学特征;最后也是最重要的一点是本文纳入的文献中均未给出受试者变异参数,这让我们不能得出全面的结论,只能做出对已有资料的分析。
4 结论
本综述一共包括12项针对美罗培南在脓毒症或脓毒性休克方面的PopPK研究,所有研究均成功建立一室或二室模型,未有三室模型被报道,均有相应的PK参数,这些参数为优化美罗培南的给药方案提供参考。此外,40多个协变量对PK参数的影响评估显示CRCL是多数研究的显著协变量,体重作为重要协变量被纳入,而年龄则作为次要影响因素被纳入。本综述纳入的研究报告的CL和V差异变化较大,分别为1.5~14.1 L/h和11.3~37.9 L。指数模型建模,前项包含后项是多数研究采用的建模方法和协变量筛选方法,几乎在所有研究中都采用蒙特卡洛模拟给药方案,且多数研究得出延长输注美罗培南可提高患者治疗效果,能维持有效浓度在抑菌浓度之上。因多数研究未给出受试者间变异参数,因此无法对其做出评估。本综述汇集了来自同一脓毒症或脓毒性休克患者群体的PopPK参数,可为后续在此类患者中调整美罗培南剂量方案提供可靠的依据。
5 展望
美罗培南对脓毒症或脓毒性休克患者的治疗具有重要作用,从纳入的12项研究中可以看出,目前该方面的研究比较稀缺,且因脓毒症或脓毒性休克自身疾病的复杂性,小样本量的研究还未能完全解释药物在受试者间的变异性,还需开展大样本前瞻性的研究去探索受试者间的变异性。而这一条件的实现是基于TDM的开展,TDM能反映该药物是否达到或超过有效血药浓度,能及时调整药物剂量使其达到有效浓度。各医疗机构应组织开展对部分抗菌药物的TDM,通过优化抗菌药物的使用来推动抗感染管理是未来不可避免的实践。此外,本综述文献中报道的被纳入但不显著的协变量应在未来研究中进行深入讨论。
参 考 文 献
Zhao H Y, Gu J, Lyu J, et al. Pharmacokinetic and pharmacodynamic efficacies of continuous versus intermittent administration of meropenem in patients with severe sepsis and septic shock: A prospective randomized pilot study[J]. Chin Med J (Engl), 2017, 130(10): 1139-1145.
Jarczak D, Kluge S, Nierhaus A, et al. Sepsis-pathophysiology and therapeutic concepts[J]. Front Med (Lausanne), 2021, 8: 628302.
Singer M, Deutschman C S, Seymour C W, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810.
Gavelli F, Castello L M, Avanzi G C, et al. Management of sepsis and septic shock in the emergency department[J]. Intern Emerg Med, 2021, 16(6): 1649-1661.
Martin-Fernandez M, Tamayo-Velasco A, Aller R, et al. Endothelial dysfunction and neutrophil degranulation as central events in sepsis physiopathology[J]. Int J Mol Sci, 2021, 22(12): 2-15.
Niederman M S, Baron R M, Bouadma L, et al. Initial antimicrobial management of sepsis[J]. Crit Care, 2021, 25(1): 307.
Thompson K, Venkatesh B, Finfer S, et al. Sepsis and septic shock: Current approaches to management[J]. Intern Med J, 2019, 49(2): 160-170.
Rhodes A, Evans L E, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377.
Ling L, Joynt G M, Lipman J, et al. A narrative review on antimicrobial therapy in septic shock: Updates and controversies[J]. Curr Opin Anaesthesiol, 2021, 34(2): 92-98.
Kothekar A T, Divatia J V, Myatra S N, et al. Clinical pharmacokinetics of 3-h extended infusion of meropenem in adult patients with severe sepsis and septic shock: implications for empirical therapy against Gram-negative bacteria[J]. Ann Intensive Care, 2020, 10(1): 2-9.
Lu C, Zhang Y, Chen M, et al. Population pharmacokinetics and dosing regimen optimization of meropenem in cerebrospinal fluid and plasma in patients with meningitis after neurosurgery[J]. Antimicrob Agents Chemother, 2016, 60(11): 6619-6625.
Ye X, Wang F, Zeng W, et al. Comparison of empirical high-dose and low-dose of meropenem in critically ill patients with sepsis and septic shock: A randomized controlled study protocol[J]. Medicine (Baltimore), 2020, 99(51): e22829.
Chen P, Chen F, Lei J, et al. Clinical outcomes of continuous vs intermittent meropenem infusion for the treatment of sepsis: A systematic review and meta-analysis[J]. Adv Clin Exp Med, 2020, 29(8): 993-1000.
Sun Y, Liu Y, Wang J, et al. The effect of meropenem versus piperacillin-tazobactam in critically ill patients with sepsis and septic shock[J]. Heliyon, 2023, 9(6): e16542.
Lechtig-Wasserman S, Liebisch-Rey H, Diaz-Pinilla N, et al. Carbapenem therapeutic drug monitoring in critically Ill adult patients and clinical outcomes: A systematic review with meta-analysis[J]. Antibiotics (Basel), 2021, 10(2): 3-17.
Ulldemolins M, Vaquer S, Llauradó-Serra M, et al. Beta-lactam dosing in critically ill patients with septic shock and continuous renal replacement therapy[J]. Crit Care, 2014, 18(3): 227.
Braune S, Konig C, Roberts J A, et al. Pharmacokinetics of meropenem in septic patients on sustained low-efficiency dialysis: A population pharmacokinetic study[J]. Crit Care, 2018, 22(1): 2-10.
Osmon D R, Berbari E F, Berendt A R, et al. Diagnosis and management of prosthetic joint infection: Clinical practice guidelines by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2013, 56(1): e1-e25.
de Velde F, de Winter B C M, Neely M N, et al. Population pharmacokinetics of imipenem in critically Ill patients: A parametric and nonparametric model converge on CKD-EPI estimated glomerular filtration rate as an impactful covariate[J]. Clin Pharmacokinet, 2020, 59(7): 885-898.
Jaruratanasirikul S, Thengyai S, Wongpoowarak W, et al. Population pharmacokinetics and Monte Carlo dosing simulations of meropenem during the early phase of severe sepsis and septic shock in critically ill patients in intensive care units[J]. Antimicrob Agents Chemother, 2015, 59(6): 2995-3001.
Delattre I K, Musuamba F T, Jacqmin P, et al. Population pharmacokinetics of four beta-lactams in critically ill septic patients comedicated with amikacin[J]. Clin Biochem, 2012, 45(10-11): 780-786.
Ulldemolins M, Soy D, Llaurado-Serra M, et al. Meropenem population pharmacokinetics in critically ill patients with septic shock and continuous renal replacement therapy: Influence of residual diuresis on dose requirements[J]. Antimicrob Agents Chemother, 2015, 59(9): 5520-5528.
Gijsen M, Elkayal O, Annaert P, et al. Meropenem target attainment and population pharmacokinetics in critically Ill septic patients with preserved or increased renal function[J]. Infect Drug Resist, 2022, 15: 53-62.
Sjovall F, Alobaid A S, Wallis S C, et al. Maximally effective dosing regimens of meropenem in patients with septic shock[J]. J Antimicrob Chemother, 2018, 73(1): 191-198.
Mattioli F, Fucile C, Del Bono V, et al. Population pharmacokinetics and probability of target attainment of meropenem in critically ill patients[J]. Eur J Clin Pharmacol, 2016, 72(7): 839-848.
Tsai D, Stewart P, Goud R, et al. Optimising meropenem dosing in critically ill Australian indigenous patients with severe sepsis[J]. Int J Antimicrob Agents, 2016, 48(5): 542-546.
Westermann I, Gastine S, Muller C, et al. Population pharmacokinetics and probability of target attainment in patients with sepsis under renal replacement therapy receiving continuous infusion of meropenem: Sustained low-efficiency dialysis and continuous veno-venous haemodialysis[J]. Br J Clin Pharmacol, 2021, 87(11): 4293-4303.
Tamatsukuri T, Ohbayashi M, Kohyama N, et al. The exploration of population pharmacokinetic model for meropenem in augmented renal clearance and investigation of optimum setting of dose[J]. J Infect Chemother, 2018, 24(10): 834-840.
Gijsen M, Elkayal O, Annaert P, et al. Meropenem target attainment and population pharmacokinetics in critically ill septic patients with preserved or increased renal function[J]. Infect Drug Resist, 2022, 15: 53-62.
Padulles Zamora A, Juvany Roig R, Leiva Badosa E, et al. Optimized meropenem dosage regimens using a pharmacokinetic/pharmacodynamic population approach in patients undergoing continuous venovenous haemodiafiltration with high-adsorbent membrane[J]. J Antimicrob Chemother, 2019, 74(10): 2979-2983.
Fukumoto S, Ohbayashi M, Okada A, et al. Population pharmacokinetic model and dosing simulation of meropenem using measured creatinine clearance for patients with sepsis[J]. Ther Drug Monit, 2023, 45(3): 392-399.
Crandon J L, Ariano R E, Zelenitsky S A, et al. Optimization of meropenem dosage in the critically ill population based on renal function[J]. Intensive Care Med, 2011, 37(4): 632-638.
Roberts J A, Kirkpatrick C M, Roberts M S, et al. Meropenem dosing in critically ill patients with sepsis and without renal dysfunction: intermittent bolus versus continuous administration? Monte Carlo dosing simulations and subcutaneous tissue distribution[J]. J Antimicrob Chemother, 2009, 64(1): 142-150.
Onichimowski D, Bedzkowska A, Ziolkowski H, et al. Population pharmacokinetics of standard-dose meropenem in critically ill patients on continuous renal replacement therapy: A prospective observational trial[J]. Pharmacol Rep, 2020, 72(3): 719-729.
Wang Y, Chen W, Huang Y, et al. Optimized dosing regimens of meropenem in septic children receiving extracorporeal life support[J]. Front Pharmacol, 2021, 12: 699191.
Jumpei S, Kensuke S, Yusuke O, et al. Population pharmacokinetics and pharmacodynamics of meropenem in critically ill pediatric patients[J]. Antimicrob Agents Chemother, 2021, 65(2): e01909-01920.

