井冈山地区苔藓来源内生真菌多样性和抗菌活性研究
刘文杰 张俊峰 何梦凡 唐佳慧 姜淑玲 郭文强


摘要: 目的 了解井冈山地区苔藓内生真菌多样性及其群落结构特点,为特殊生境来源内生真菌抗生素研究打下基础。方法 本文采用可培养方法分离内生真菌,结合形态学特征和ITS-rDNA分子生物学数据对所分离的菌株进行鉴定,利用纸片扩散法进行抗菌活性筛选与分析。结果 从4种苔藓样品中共分离纯化232株可培养内生真菌,其分离频率和定殖率分别在1.84~2.88和95.65%~100%之间。分子生物学特征显示内生真菌归于38个分类属,其中青霉属是4种苔藓植物的优势内生真菌属,但各类苔藓的优势种存在差异,部分内生真菌显示出宿主专一性。生物活性筛选结果显示其中50株内生真菌的静置发酵产物具有抗菌活性,综合活性率为21.55%。结论 本研究表明井冈山地区苔藓内生真菌具有丰富的多样性,其次级代谢产物良好的抗菌活性,预示着潜在的抗生素类天然产物研究价值。
关键词:井冈山地区;苔藓植物;内生真菌;多样性;抗菌活性
中图分类号:R915文献标志码:A
Diversity and antibacterial activity of endophytic fungi
from bryophyte species in Jinggangshan area
Liu Wenjie1, 2, Zhang Junfeng1, He Mengfan1, Tang Jiahui1, Jiang Shuling1, and Guo Wenqiang1
(1 Department of Medicine, Jinggangshan University, Ji'an 343009; 2 Office of Academic Research, Jinggangshan University, Ji'an 343009)
Abstract Objective To understand the diversity and community structure characteristics of endophytic fungi in mosses in the Jinggangshan area, and lay a foundation for the study of antibiotics for endophytic fungi from special habitat sources. Methods Culturable methods were used to isolate endophytic fungi. The isolated strains were identified based on morphological characteristics and ITS-rDNA, and the paper diffusion method was applied for antibacterial activity screening. Results A total of 232 cultivable endophytic fungi were purified from four bryophyte species, with isolation frequencies and colonization rates ranging from 1.84~2.88 and 95.65%~100%, respectively. Molecular biology characteristics showed that the endophytic fungi belonged to 38 species, among which penicillium was the dominant endophytic fungi genera of the four bryophyte species. However, the dominant species of each type in bryophytes were different, demonstrating host specificity. The biological activity results showed that the static fermentation products exhibited antibacterial activity, with a comprehensive activity rate of 21.55%. Conclusion This study indicated that the endophytic fungi had generous species diversities, and their secondary metabolites showed great antibacterial activity and potential research value for antibiotic products.
Key words Jinggangshan area; Bryophyte species; Endophytic fungi; Diversities; Antibacterial activity
苔藓植物作为一类独特的小型高等植物,没有真正的根、茎、叶的分化,主要由孢子进行繁殖,多生长于阴湿环境之中。在植物界演化进程中,它代表着从水生逐渐过渡到陆生的典型物种[1]。苔藓植物对环境有较强的适应能力,分布生态环境较为广泛,全世界约有苔藓植物189科1284属22175种,中国已报道发现150科591属3021种,是世界上苔藓植物多样性程度最高的国家之一[2]。研究表明苔藓植物中广泛定殖有内生菌,作为苔藓适应陆生环境的一个重要过渡类型,内生菌在苔藓植物的环境适应中发挥了重要的作用,能够显著提升对各种生物和非生物胁迫的抗性[3-4]。
有关苔藓植物内生菌的研究多聚焦于极端环境,如沙漠和极地等[5-6],而对温带和亚热带雨林等非极端环境苔藓内生菌的研究报道却相对较少[7-8]。因此全面了解各种生态环境来源内生真菌的多样性组成及其次级代谢产物的生物活性,是苔藓内生真菌来源药物先导化合物开发研究的基础。
井冈山国家级自然保护区位于江西省中南部的井冈山市,是以中亚热带湿润常绿阔叶林生态系统及其生物多样性为主的自然保护区[9]。保护区内峡谷瀑布众多,并具有丰富的地表水径流和地下水资源。独特、优越的自然地理条件为苔藓植物的生长提供了丰富多变的环境。现知共有苔藓67科183属418种8亚种6变种,其苔藓植物种类繁多,生活型与群落类型丰富多样,是井冈山自然保护区丰富的自然资源和生物多样性的特色之一。因此,以该地区苔藓来源内生真菌为挖掘对象的抗菌活性天然产物研究具有巨大的潜力。
本研究对井冈山自然保护区内4种苔藓来源内生真菌多样性和次级代谢产物进行挖掘,研究结果不仅可以丰富不同生境苔藓来源内生真菌的多样性,还可为特殊生境来源内生菌次级代谢产物的结构多样性及生物活性研究提供可靠的菌种资源。
1 材料和方法
1.1 材料
1.1.1 试验样品
4种苔藓样品(直叶曲尾藓Dicranum orthophylloides、小火藓Schlotheimia pungens、中华细枝藓Lindbergia sinensis和中华细指苔Kurzia sinensis)于2021年7月采集于江西省井冈山国家级自然保护区。每种苔藓选择5个采样点,每个采样点随机采集苔藓的光合作用部分和根部样品,共得到100个样本。样品采集置于密封袋后4 °C冰箱保藏。
1.1.2 培养基
菌株分离培养基:马铃薯葡萄糖琼脂培养基(PDA,g/L):马铃薯200.0,葡萄糖20.0,琼脂18.0,氯霉素0.1,去离子水1.0 L;孟加拉红琼脂培养基(RBC,g/L):蛋白胨5.0,葡萄糖10.0,磷酸二氢钾1.0,MgSO4·7H2O 0.5,琼脂20.0,1/3000孟加拉红溶液 100.0 mL,氯霉素0.1,去离子水1.0 L。
菌株液体发酵培养基(2#,g/L):甘露醇20.0,麦芽糖20.0,葡萄糖10.0,谷氨酸钠10.0,KH2PO4 0.5,玉米浆1.0,酵母浸粉3.0,MgSO4·7H2O 0.3,去离子水1.0 L。
1.1.3 抗菌活性指示菌
枯草芽胞杆菌(Bacillus subtilis,BNCC109047)、草分枝杆菌(Mycobacterium phlei,BNCC359483)、耻垢分枝杆菌(Mycobacterium smegmatis,BNCC134980)、金黄色葡萄球菌(Staphylococcus aureus,BNCC186335)、大肠埃希菌(Escherichia coli,BNCC336902)均购于北纳创联生物科技有限公司。
1.1.4 实验仪器
高压蒸汽灭菌锅(XFH-100CA,浙江新丰医疗器械有限公司);超净工作台(SN-CJ-2FD,上海尚仪仪器设备有限公司);生化培养箱(SN-SPX-350B,上海尚仪仪器设备有限公司);旋转蒸发仪(RE-52AA,上海亚荣生化仪器厂);低温冷却液循环泵(DLSB-5/20,郑州长城科工贸有限公司);循环水真空泵(SHZ-DIII四氟型,上海力辰仪器科技有限公司)分析天平(FA224,上海力辰仪器科技有限公司)。
1.2 方法
1.2.1 内生真菌分离纯化
每种苔藓冲洗表面泥土后,依次经过75%酒精漂洗3 min、无菌水冲洗3次,2%次氯酸钠溶液漂洗2 min、无菌水冲洗3次。加水充分研碎并吸取上清液,分别置于PDA和RBC培养基上于24 ℃恒温孵育5~25 d,从中分离出具有不同形态的真菌菌落,将其重新接种至PDA培养基上再孵育培养5~7 d。根据在PDA平板上的菌落形态特征(依据单菌落形态表面特征、菌丝颜色、菌丝生长速率、产孢方式、孢子形态特征和产孢结构特点等),将其分为不同的形态类型,最终得到内生真菌纯菌株。
1.2.2 内生真菌种属鉴定
实验采用ITS通用引物[生工生物工程(上海)股份有限公司]:ITS1(5'-AGAA GTCGTAACAAGGTTTC-3')和ITS4(5'-TCCTCCGCT TATTGATATGC-3')扩增内部转录的间隔区[10-12],PCR扩增产物1%琼脂糖胶电泳检测合格后,由北京睿博生物科技有限公司完成后续菌株测序工作。通过对其BLAST数据分析后,将鉴定出的菌株序列与GenBank数据库(http://www.ncbi.nlm.nih.gov)中的其他真菌序列进行比较分析,并在ClustalW中进行比对[13]。利用Godinho的标准来分析验证GenBank数据库的BLAST结果:对于覆盖率和序列同一性大于98%,内生真菌种属被确定;对于覆盖率和序列同一性为95%~97%确定到种,而覆盖率和序列同一性小于95%,则暂定为新菌[14]。
1.2.3 内生真菌发酵培养与抗菌活性测试
将内生真菌继代培养后接种至2#液体发酵培养基中,参考文献[15]中的菌株发酵条件和提取方法获得粗提物。采用纸片扩散法进行抗菌活性筛选,以2 mg/mL氯霉素为阳性对照药。制备含提取物纸片的方法参照文献[15],将药敏纸片放置在指示菌琼脂表面上,于37 ℃培养箱中培养24 h。通过测量抑菌圈直径来评价其抗菌活性强弱。抗菌活性评价标准:抑菌圈直径小于11.0 mm代表活性较弱;抑菌圈直径11.0~15.0 mm代表中等活性;抑菌圈直径15.0~
20.0 mm代表活性较强;抑菌圈直径大于20.0 mm代表活性显著。
1.2.4 次级代谢产物分离纯化
菌株JW-15-2在2#培养基条件下实验室静置发酵30 d,菌体甲醇浸泡,超声破碎;发酵液乙酸乙酯萃取,减压蒸馏,合并获得粗浸膏6.8 g。粗浸膏采用甲醇为流动相的葡萄糖凝胶LH-20进行分离,所得6个组分进行抗菌活性测定。其中组分3表现出较好的抗菌活性且化合物较为单一,进一步利用正相硅胶柱(流动相为二氯甲烷:甲醇=10:1)其进行纯化,并采用ODS-C18半制备柱(YMC-Pack ODS-A, 10 mm×
250 mm, 5 μm, 4 mL/min),采用流动相:甲醇/水=55/45进行制备,获得化合物1(tR=18.0 min)。
1.2.5 数据统计分析
内生真菌的分离频率(isolation rate, IR)和定殖率(colonization rate, CR)可以衡量苔藓组织中内生真菌的丰富程度和组织块受侵染的频率,相对分离频率(relative frequency,RF)则可以衡量苔藓组织中内生真菌的优势度[16],其分别按以下公式(1~3)计算得出。
2 结果与讨论
2.1 内生真菌种属分析与鉴定
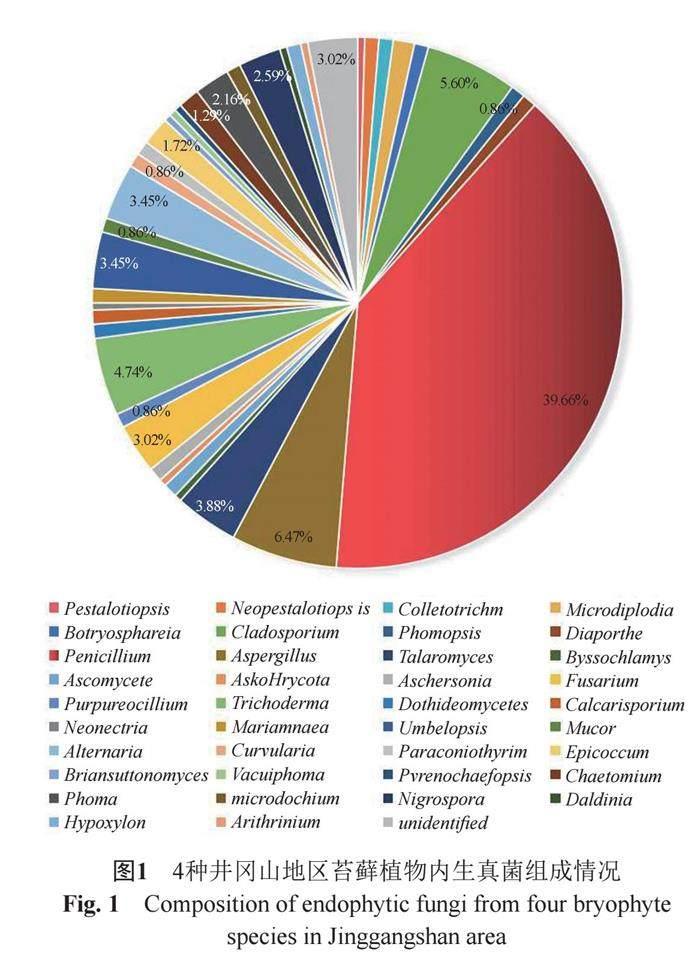
通过组织研磨分离法从井冈山地区来源苔藓的各个样品中获得内生真菌232株,对其归类分析发现涵盖子囊菌类和接合菌类两大真菌类群,统计分析发现青霉属和曲霉属真菌为占比最高,分别为39.66%和6.47%(图1)。
基因序列对比结果显示部分菌株与数据库最接近的种属具有较高的相似度,初步推断其中225株内生真菌分别隶属于13个目26个科38个属(表1),其中7株内生真菌因与GenBank数据库中的序列覆盖率和序列同一性小于95%,因而暂时不能确定其种属归类。
2.2 内生真菌的分离频率和定殖率
从井冈山地区来源的直叶曲尾藓、小火藓、中华细枝藓和中华细指苔的100个样本中分别得到内生真菌72、46、60和54株,分离结果显示其内生真菌分离频率在1.84~2.88之间,平均分离频率为2.32(图2)。其中直叶曲尾藓内生真菌的分离频率最高为2.88,小火藓内生真菌的分离频率最低为1.84。内生真菌的定殖率在不同苔藓种类间存在一定的差异性,其分布在95.65%~100%之间(图3)。实验结果显示,不同种类苔藓内生真菌的分离率和定殖率趋势一致,但存在各自的种群差异性,其中直叶曲尾藓的分离率和定殖率都最高,小火藓的分离率和定殖率最低。
2.3 内生真菌的相对分离频率
苔藓样品中优势菌属为青霉属,其相对频率分别为39.66%。各种苔藓植物中不仅内生真菌的种类不同,其优势内生真菌种群也存在差异。其中直叶曲尾藓样品中内生真菌种类最多,有31种;小火藓样品中内生真菌种类最好,仅有22种。中华细枝藓和中华细指苔样品中内生真菌分别有26种和28种。统计发现青霉属(Penicillium)、曲霉属(Aspergillus)、枝孢霉属(Cladosporium)、木霉属(Trichoderma)是该地区苔藓来源内生真菌的优势属,其相对分离频率分别为39.66%、6.47%、5.60%和4.74%(图1)。由此可见,不同苔藓的内生真菌群落组成各不相同,且内生真菌群落的多样性因苔藓种类差别而异。
2.4 内生真菌的抗菌活性评价
将所有菌株采用真菌2号培养基静置发酵30 d后,获得232个代谢粗提物。在对其进行5种鉴定菌的抗菌活性筛选后,发现50株内生真菌的次级代谢产物表现出较好的抗菌活性,综合活性率为21.55%。其中部分菌株表现出广谱的抗菌活性,尤其对金黄色葡萄球菌显示出显著的抑制活性(表2),预示潜在的活性代谢产物研究价值。
2.5 内生真菌代谢主产物分析
结合抗菌活性筛选与代谢产物分析结果,发现活性菌株JW-15-2(Penicillium sp.)具有较好的研究潜力,逐对其的次级代谢产物进行抗菌活性追踪分离纯化研究,从中获得了1个代谢主产物(化合物1),其NMR数据与文献报道的已知化合物一致[17],确定化合物1为苯二氮卓类生物碱circumdatin B(图4)。
化合物1 淡黄色粉末;ESI-MS: m/z 388.3 [M+Na]+(C20H19N3O4Na);UV(MeOH)λmax(log ε)230(3.15),270(3.23),320(3.68)nm;1H NMR(400 MHz, DMSO-d6)δ: 7.83,7.65,7.59,6.41,5.74,5.71,4.54,3.63,2.03,1.97,1.76,1.23; 13C NMR(100 MHz, DMSO-d6)δ: 163.7,162.4,158.7,157.7,157.1,145.6,132.9,132.3,130.9,129.6,129.4,129.1,115.8,110.4, 95.6,58.4,55.5,46.7,26.6和23.7。
3 讨论
3.1 内生真菌的物种多样性
井冈山国家级自然保护区气候属于亚热带湿润山地气候,地表水和地下水资源非常丰富,水质良好,森林土壤类型丰富,孕育着丰富的生物资源。苔藓植物对水分、矿质营养等特殊的体表吸收方式,利用孢子进行远距离传播的能力和多样化的营养繁殖方式,使其能广泛地分布于保护区的绝大部分生境中,形成大片极具地域特色的苔藓群落[9]。
有研究表明,许多苔藓植物具有特殊的芳香气味,且不易被微生物、昆虫等侵蚀破坏,且其中的化学成分也表现出广泛的生物学活性,比如植物生长调节、抗氧化、抗炎、抗真菌和细胞毒活性等,这些现象表明苔藓中存在着活性物质来参与化学防
御[18]。由于苔藓植物所形成的特殊内部微环境,生活在其中的微生物迫于多种因素的压力,同时经过与宿主植物的长期协同进化,可能存在独特的生物合成代谢途径,能够产生拥有新颖结构骨架的天然产物。内、外生存环境的特殊性,极有可能造就井冈山自然保护区来源苔藓内生真菌异于普通生境下真菌的特殊基因簇及合成特殊化合物的能力,是抗生素类活性天然产物潜在的资源库。
本研究从井冈山地区4种苔藓中分离获得232株苔藓内生真菌,内生真菌的分离频率分布在 1.84~2.88之间,与研究报道的热带和温带生态环境中的提灯藓、地钱、鞭苔及合叶苔的内生真菌分离频率具有一定的相似度,但远高于极端生态环境苔藓植物内生真菌的分离频率,如发现于极端干热环境的白发藓和角齿藓内生真菌分离频率仅为0.15和0.21[6,19-20]。文献调研结果表明,苔藓植物来源内生真菌的丰富程度不仅与宿主植物种类密切相关,其所处的生态环境也是造成丰度差异的一个潜在因素,说明相对适宜的气候温度和营养环境能够显著提升苔藓来源内生微生物的数量和种群类型。与此同时,本研究中4种苔藓植物内生真菌的定殖率在95.65%~100%之间,也远高于极端低温环境来源苔藓植物内生真菌8.7%~12.3%的定殖率[21]。由此表明,井冈山地区湿润多雨的亚热带季风气候环境,造就了其苔藓来源内生真菌丰富的物种多样性。
3.2 内生真菌良好的生物活性和代谢潜力
近几十年来,植物内生真菌作为特殊生境来源的微生物受到越来越多的关注,已成为生物活性物质重要的资源库[22]。研究发现,植物内生真菌已经进化出适应植物微环境的遗传和代谢机制,这意味着该特殊生境的真菌具有产生结构类型独特的代谢产物的潜力[23]。本研究利用纸片扩散法对井冈山地区苔藓来源内生真菌次级代谢产物的抗菌生物活性进行筛选研究,发现了50株具有抗菌活性的菌株,综合活性率为21.55%。生物活性结果显示,该来源的内生真菌具有较好的研究潜力,是抗生素研发潜在的资源库。
通过对活性菌株JW-15-2次级代谢产物研究获得了苯二氮卓类生物碱类化合物1。苯二氮卓类药物作为一类临床使用广泛的镇静类处方药物,许多该类型的化合物已被全合成获得,而大多数天然存在的苯二氮卓类药物则主要来自于丝状真菌,如青霉属和曲霉属真菌[24]。化合物1抗菌活性筛选发现其具有较弱的抑菌活性,但该类化合物具有复杂的生物合成途径,后续利用基因调控策略(如OSMAC、表观遗传修饰等)激活活性菌株沉默的生物合成基因簇,可能能够获得结构更为多样的活性抗生素类天然产物。
综上研究表明,井冈山地区来源苔藓内生真菌具有丰富的物种多样性,表现出良好的抗菌活性,其潜力菌株为后续抗生素类药物先导化合物的开发研究奠定了实验基础。
参 考 文 献
Zhu R L, Ma X Y, Cao C, et al. Advances in research on bryophyte diversity in China[J]. Biodivers Sci, 2022, 30: 86-97.
马静, 张绍梅, 赵明德. 中国湿地苔藓植物研究进展[J]. 青海科技, 2021, 28: 51-58.
Tosi S, Casado B, Gerdo R, et al. Fungi isolated from Antarctic mosses[J]. Polar Biol, 2002, 25: 262-268.
Zhang T, Zhang Y Q, Liu H Y, et al. Diversity and cold adaptation of culturable endophytic fungi from bryophytes in the Fildes Region, King George Island, maritime Antarctica[J]. Fems Microbiol Lett, 2013, 341: 52-61.
Upson R, Read D J, Newsham K K. Widespread association between the ericoid mycorrhizal fungus Rhizoscyphus ericae and a leafy liverwort in the maritime and sub-Antarctic[J]. New Phytol, 2007, 176: 460-471.
U'ren J M, Lutzoni F, Miadlikowska J, et al. Community analysis reveals close affinities between endophytic and endolichenic fungi in mosses and lichens[J]. Microb Ecol, 2010, 60: 340-353.
Davis E C, Shaw A J. Biogeographic and phylogenetic patterns in diversity of liverwort-associated endophytes[J]. Am J Bot, 2008, 95: 914-924.
Davis E C, Franklin J B, Shaw A J, et al. Endophytic Xylaria (Xylariaceae) among liverworts and angiosperms: Phylogenetics, distribution, and symbiosis[J]. Am J Bot, 2003, 90: 1661-1667.
廖文波, 王英永, 李贞, 等. 中国井冈山地区生物多样性综合科学考察[M]. 北京: 科学出版社, 2014.
Zhang Y H, Wei D S, Xing L J, et al. A modified method for isolating DNA from fungus[J]. Microbiol China, 2008, 35: 466-474.
White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J, et al. eds. PCR protocols: a guide to methods and application. San Diego: Academic Press, 1990: 315-322.
Janso J E, Bernan V S, Greenstein M, et al. Penicillium dravuni, a new marine-derived species from an alga in Fiji[J]. Mycologia, 2005, 97: 444-453.
Thompson J D, Higgins D G, Gibson T J. CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Res, 1994, 22: 4673-4680.
Godinho V M, Furbino L E, Santiago I F, et al. Diversity and bioprospecting of fungal communities associated with endemic and cold-adapted macroalgae in Antarctica[J]. ISME J, 2013, 7: 1434-1451.
Liu W J, Li L Q, Tang J H, et al. Study on the diversity and antibacterial activity of endophytic fungi from Glycyrrhiza uralensis[J]. Nat Prod Res Dev, 2021, 33: 256-267.
Chen J, Xu Z, Zhang X, et al. Diversity and isolation parameters of endophytes from Glycyrrhiza uralensis of different habitats[J]. Acta Pharm Sin, 2019, 54: 373-379.
Ookura R, Kito K, Ooi T, et al. Structure revision of circumdatins A and B, benzodiazepine alkaloids produced by marine fungus Aspergillus ostianus, by x-ray crystallography[J]. J Org Chem, 2008, 73: 4245-4247.
张教真, 娄红祥. 苔藓植物化学生物学研究进展[J]. 世界科学技术-中医药现代化, 2019, 21: 1202-1208.
Davis E C, Shaw A J. Biogeographic and phylogenetic patterns in diversity of liverwort-associated endophytes[J]. Am J Bot, 2008, 95(8): 914-924.
周雯娜, 吴远双, 初龙, 等. 云南大围山四种苔藓植物内生真菌多样性[J]. 微生物学报, 2015, 55(6): 764-771.
Zhang T, Zhang Y Q, Liu H Y, et al. Diversity and cold adaptation of culturable endophytic fungi from bryophytes in the Fildes Region, King George Island, maritime Antarctica[J]. Fems Microbiol Lett, 2013, 341(1): 52-61.
Chen S H, Cai R L, Liu Z M, et al. Secondary metabolites from mangrove-associated fungi: source, chemistry and bioactivities[J]. Nat Prod Rep, 2022, 39: 560-595.
Daley S, Cordell G A. Biologically significant and recently isolated alkaloids from endophytic fungi[J]. J Nat Prod, 2021, 84: 871-897.
Rahb?k L, Breinholt J, Jens C, et al. Circumdatin A, B, and C: Three new benzodiazepine alkaloids isolated from a culture of the fungus Aspergillus ochraceus[J]. J Org Chem, 1999, 64: 1689-1692.

