抗寄生虫药氟雷拉纳对金黄色葡萄球菌的抗菌活性研究
唐海涛 王社盈

摘要:目的 研究抗寄生虫药物氟雷拉纳对金黄色葡萄球菌的抗菌活性。方法 金黄色葡萄球菌临床菌株SA1901和SA1902于2023年5月份收集自脓胸患者的胸水培养标本;通过微量肉汤稀释实验和时间-杀菌曲线检测金黄色葡萄球菌对氟雷拉纳的敏感性;通过连续诱导耐药实验检测氟雷拉纳的耐药诱导能力;通过构建持留菌、生物被膜抗菌实验以及激光共聚焦显微镜检测氟雷拉纳对金黄色葡萄球菌持留菌和生物被膜的抗菌活性;最后,棋盘稀释实验用于检测氟雷拉纳与氨基糖苷类抗菌药物的联用效果。结果 氟雷拉纳对金黄色葡萄球菌的最低抑菌浓度(minimal inhibitory concentration, MIC)和最低杀菌浓度分别为4~8 μg/mL和8~16 μg/mL;通过时间-杀菌曲线发现亚抑菌浓度的氟雷拉纳即可有效抑制细菌的增殖;氟雷拉纳连续处理金黄色葡萄球菌15 d也未见耐药突变的形成;8×MIC的氟雷拉纳作用ATCC 25923持留菌4 h可使其活菌计数从(8.97± 0.35)Log10 CFU/mL降低到(7.47± 0.09)Log10 CFU/mL(t=7.17, P=0.002),使USA300持留菌从(9.35±0.31)Log10 CFU/mL降低到(6.79±0.20)Log10 CFU/mL(t=12.04, P<0.001);1×MIC的氟雷拉纳可显著抑制USA300生物被膜的形成,使其生物被膜的形成量从(2.41±0.12)降低到(0.20±0.06)(t=44.03, P<0.0001);1×MIC的氟雷拉纳还能显著清除已形成的生物被膜,使其生物被膜的总量从(3.02±0.02)减少到(2.04±0.39)(t=5.58, P=0.0008);通过棋盘稀释试验和活菌计数发现氟雷拉纳与阿米卡星联用具有协同抗菌活性,其协同抑菌指数为0.375。结论 氟雷拉纳对金黄色葡萄球菌具有显著的抗菌作用,且与阿米卡星联用具有协同抗菌活性。
关键词:金黄色葡萄球菌;氟雷拉纳;持留菌;生物被膜;抗菌药物
中图分类号:R632文献标志码:A
Antimicrobial effects of the anti-parasite drug flurlalner against
Staphylococcus aureus
Tang Haitao1 and Wang Sheying2
(1 Department of Thoracic Surgery, The Affiliated Changsha Hospital of Xiangya School of Medicine, Central South University, Changsha 410005; 2 Department of Clinical Laboratory, The Affiliated Changsha Hospital of Xiangya School of Medicine,
Central South University, Changsha 410005)
Abstract Objective This study aimed to investigate the antimicrobial effects of the anti-parasite drug fluralaner against Staphylococcus aureus. Methods S. aureus clinical isolates of SA1901 and SA1902 were collected from the thoracic fluid of pyothorax patients in May 2023. The antimicrobial susceptibility of fluralaner against S. aureus was determined by the micro-broth dilution assay and time-killing curves. The consecutive resistance-inducing assay was used to detect the resistance-inducing ability of fluralaner. The persister cell killing assay, the anti-biofilm assay and the laser confocal microscope were used to explore the anti-persister and anti-biofilm activities of fluralaner. Last, the combinational antimicrobial effects between fluralaner and aminoglycosides were determined by the checkerboard dilution assay. Results The minimal inhibitory concentration (MIC) and minimal bactericidal concentration of fluralaner against S. aureus were 4~8 μg/mL and 8~16 μg/mL, respectively. The sub-MIC of fluralaner was found to effectively inhibit bacterial growth by the time-killing assay. No resistant mutation was observed even after fluralaner treatment for 15 consecutive days. After 4 h treatment, 8×MIC of fluralaner could significantly reduce the viable persister cells of ATCC 25923 and USA300 from (8.97± 0.35) Log10 CFU/mL to (7.47± 0.09) Log10 CFU/mL (t=7.17, P=0.002), and from (9.35±0.31) Log10 CFU/mL to (6.79±0.20) Log10 CFU/mL (t=12.04, P<0.001), respectively. Fluralaner could significantly inhibit the biofilm formation of USA300 from (2.41±0.12) to (0.20±0.06) (t=44.03, P<0.0001) at the concentration of 1×MIC; and 1×MIC of fluralaner could also significantly eradicate the pre-formed biofilm form (3.02±0.02) to (2.04±0.39) (t=5.58, P=0.0008); By checkerboard dilution assay and viable bacteria counting, amikacin was found to be synergistic with fluralaner against S. aureus with a synergistic antiacterial index of 0.375. Conclusion Fluralaner showed significant antimicrobial effects against S. aureus and could be synergistic with amikacin against S. aureus.
Key words Staphylococcus aureus; Fluralaner; Persister cells; Biofilm; Antibiotic drug
金黄色葡萄球菌简称金葡菌,是一种常见的革兰阳性条件致病菌,常引起社区或医院获得性感染。金葡菌可以引起多种类型的感染,例如:脓胸、肺炎、皮肤软组织感染、植入物相关感染和败血症等[1]。金葡菌还能黏附于人体组织表面或医疗器械表面,分泌胞外基质,相互聚集而形成具有立体结构的生物被膜。由于生物被膜的物理屏障作用和生物被膜内部细菌的休眠状态等原因,使生物被膜状态下金葡菌的耐药性比相应浮游状态细菌高达10~1000倍不等[2]。因此,研究生物被膜的抗菌药物具有重要的临床意义。
近年来,“老药新用”已成为药物研发的有效且快捷途径。已上市药物的合成工艺和毒理学数据可以加快药物的研发过程。例如:Liu等[3]发现二甲双胍对金葡菌和大肠埃希菌等具有显著的抗菌活性;Kim等[4]发现抗肿瘤药物CD437对金葡菌具有有效的体内和体外抗菌活性等。氟雷拉纳是1种抗寄生虫药物[5],然而,尚未见研究报道其对金葡菌的抗菌作用。本研究通过药敏实验、杀菌动力学实验和生物被膜清除实验等方法,研究了氟雷拉纳对金葡菌的抗菌活性,并进一步评估了其作为抗菌药物的细胞毒性。
1 材料与方法
1.1 主要试剂和仪器
氟雷拉纳、环丙沙星(ciprofloxacin,CIP)、万古霉素(vancomycin, VAN)、庆大霉素(gentamycin,GEN)、卡那霉素(kanamycin,KANA)、妥布霉素(tobramycin,TOB)、奈替米星(netilmicin,NET)、大观霉素(spectinomycin,SH)、阿米卡星(amikacin,AMK)、CCK-8试剂盒和Triton×-100均购自美国MedChem Express公司);胎牛血清(以色列BI公司);DMEM(兰州市民海生物工程有限公司);RPMI-1640(上海索莱宝生物有限公司);人红细胞(上海血液生物医药有限责任公司);二甲基亚砜(dimethyl sulfoxide,DMSO)(爱必信(上海)生物科技公司);结晶紫染液(日本同仁化学;人红细胞(上海血液生物医药有限责任公司);SYTO9/PI荧光试剂盒(美国赛默飞公司);阳离子校正的Mueller-Hinton(MH)肉汤和胰蛋白大豆肉汤(Tryptic Soy Broth,TSB)肉汤(北京索莱宝科技有限公司);羊血琼脂平板(郑州安图生物科技有限公司);96孔和6孔细胞培养板(美国Corning公司);全自动酶标仪(美国Bio-Tek仪器公司);恒温摇床和恒温培养箱(美国Thermo公司);激光共聚焦显微镜Zeiss LSM 800(德国Zeiss公司)。
1.2 方法
1.2.1 菌株及培养条件
人HepG2细胞和LO2细胞株、甲氧西林敏感金葡菌(methicillin sensitive Staphylococcus aureus,MSSA)标准菌株ATCC25923和ATCC 29213以及MRSA标准菌株ATCC 43300和USA300均购自美国模式细胞/菌种收集中心(American Type Culture Collection,ATCC)。金葡菌临床菌株MRSA SA1901和MSSA SA1902于2023年5月份收集自脓胸患者的胸水培养标本,经羊血平板分纯和质谱鉴定。并通过是否对氨苄西林耐药鉴定其是否为MRSA。所有菌种均接种于甘油磁珠中,于-80 ℃保存。并于羊血琼脂平板上传代两次后用于实验。
1.2.2 微量肉汤稀释实验
将金葡菌于37 ℃恒温培养箱中传代培养后,挑取新鲜单个纯菌落于无菌生理盐水中,调至1.5×
108 CFU/mL的菌悬液,用MH肉汤1:1000稀释后备用。将氟雷拉纳用MH肉汤倍比稀释后(0.5~32 μg/mL),于96孔板中每孔加入50 μL,再分别加入50 μL备用菌悬液。将96孔板放置湿盒中,于37 ℃恒温培养16~18 h后观察结果。最低抑菌浓度(minimal inhibitory concentration, MIC)即为肉眼可见抑制细菌增殖的最低抗菌药物浓度。随后,从1×MIC至最高测试浓度,每孔分别吸取10 μL悬液至羊血琼脂平板上,37 ℃过夜孵育后,读取最低杀菌浓度(minimal bactericidal concentration,MBC)值,即为杀灭99.9%活菌的最低抗菌药物浓度[6]。
1.2.3 时间-杀菌曲线
挑取单个菌落于生理盐水中,调为1.5×108 CFU/mL,再用新鲜TSB肉汤于50 mL离心管中稀释至1×106 CFU/mL。将氟雷拉纳用TSB肉汤进行倍比稀释,再等体积加入含菌的TSB肉汤中,使氟雷拉纳的终浓度为1/4~4×MIC。DMSO设置为阴性对照组。将离心管放置于37 ℃恒温摇床中,180 r/min摇菌培养至0、2、4、6和12 h,分别吸取100 μL菌悬液进行平板稀释菌落计数[7]。
1.2.4 连续诱导耐药实验
通过微量肉汤稀释实验检测氟雷拉纳的MIC值后,选取1/2×MIC孔中的菌悬液用新鲜MH肉汤1:1000稀释继续进行微量肉汤稀释实验,37 ℃孵育24 h后,记录MIC值。同时,选取1/2×MIC孔中的菌悬液用新鲜MH肉汤稀释后进行微量肉汤稀释实验。直至连续检测15 d,记录每日MIC值,绘制时间-MIC变化曲线。本实验将CIP设置为阳性对照组[4]。
1.2.5 持留菌杀菌实验
挑取单个新鲜金葡菌菌落于适量TSB肉汤中,37 ℃ 180 r/min摇菌培养24 h确保细菌到达平台期[8]。5000× g离心15 min收集平台期持留菌,并用无菌生理盐水漂洗3次以去除多余的培养基。用1×PBS(pH=7.4)重悬菌沉淀,并调至108~109 CFU/mL。加入氟雷拉纳存储液使体系的终浓度分别为1~8×MIC。同时,将10× MIC的VAN设置为对照组。将菌悬液放置37 ℃恒温摇床中,180 r/min摇菌培养,分别于0、1、2、3和4 h时间点吸取100 μL菌悬液进行平板稀释菌落计数。
1.2.6 生物被膜抗菌实验
生物被膜抑制实验[9]:用TSB将金葡菌摇菌培养至对数生长期,用生理盐水调为1.5×108 CFU/mL的菌悬液,并用TSB肉汤稀释至约1×106 CFU/mL备用。用TSB肉汤将氟雷拉纳倍比稀释,加入100 μL至96孔板中,每孔再分别加入备用的菌悬液。DMSO设置为阴性对照组。将96孔板放置于湿盒中,37 ℃静置孵育24 h后,弃上清,用无菌生理盐水漂洗2次后,各孔分别加入0.25%(W/V)结晶紫染液,静置孵育15 min后,弃上清,继续用无菌生理盐水漂洗3次以去除未与生物被膜结合的结晶紫。每孔分别加入
100 μL无水乙醇溶解与生物被膜结合的结晶紫,室温放置30 min后,于酶标仪检测570 nm处的吸光度(A570),即为生物被膜的相对量;生物被膜清除实验[9]:用TSB将金葡菌摇菌培养至对数生长期,并稀释至约1×106 CFU/mL,于96孔板中每孔加入200 μL菌悬液。37 ℃静置孵育24 h后形成生物被膜,弃上清,将孔中的生物被膜用无菌生理盐水漂洗2次。弃上清,每孔再分别加入200 μL用TSB肉汤倍比稀释的氟雷拉纳。37 ℃静置孵育24 h后,弃上清液,漂洗3次进行结晶紫染色,其余步骤同上。
1.2.7 激光共聚焦显微镜观察生物被膜
生物被膜抑制实验[10]:将对数生长期的金葡菌用新鲜TSB肉汤稀释至约1×106 CFU/mL,并于6孔细胞培养板中每孔加入1 mL。各孔中再分别加入1 mL TSB倍比稀释的氟雷拉纳,DMSO设置为阴性对照组。充分混匀后,每孔放入1块无菌盖玻片。37 ℃静置孵育24 h后,用生理盐水漂洗盖玻片,并在盖玻片上分别滴加10 μmol/L的SYTO/PI染液。避光孵育15 min后,继续漂洗盖玻片,并于激光共聚焦显微镜下观察生物被膜的形态结构,SYTO和PI的激发光和发射光波长分别设置为488 nm/550 nm和540 nm/ 620nm;生物被膜清除实验[10]:加入2 mL TSB稀释的对数生长期菌悬液至6孔板中,每孔中再分别加入无菌盖玻片,37 ℃静置孵育24 h构建生物被膜。用生理盐水漂洗后,每孔加入2 mL氟雷拉纳,DMSO设置为阴性对照组,37 ℃继续孵育24 h后,漂洗去除未与盖玻片结合的细菌,并进行SYTO9/PI染色,其余步骤同上。
1.2.8 棋盘稀释实验
挑取单个菌落于TSB中,37 ℃ 180 r/min摇菌2~3 h
至对数生长期。用无菌生理盐水调至1.5×108 CFU/mL,再用MH肉汤稀释至约1×106 CFU/mL备用。用MH肉汤将氟雷拉纳倍比稀释后,于96孔板中每横排设置为一个浓度,分别加入50 μL/孔。再用备用的含菌MH肉汤倍比稀释氨基糖苷类抗菌药物,加入50 μL至96孔板中,使每竖排为同一浓度。将96孔板放置湿盒中,37 ℃静置孵育16~18 h后,读取MIC值并于酶标仪检测630 nm处的光密度(A630),即为细菌的生长浊度,根据A630绘制棋盘稀释细菌浊度图。计算协同抑菌指数(fractional inhibitory concentration index,FICI)=MICA联用/MICA单用+MICB联用/MICB单用。其中,A和B分别为两种联用的抗菌药物。FICI≤0.5为协同作用,0.5
1.2.9 统计学分析
采用GraphPad 8.0统计学软件进行分析,计量资料用(均数±标准差,x±s)表示,组间比较采用Student's t检验,多组比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 氟雷拉纳对金葡菌具有一定的抗菌活性
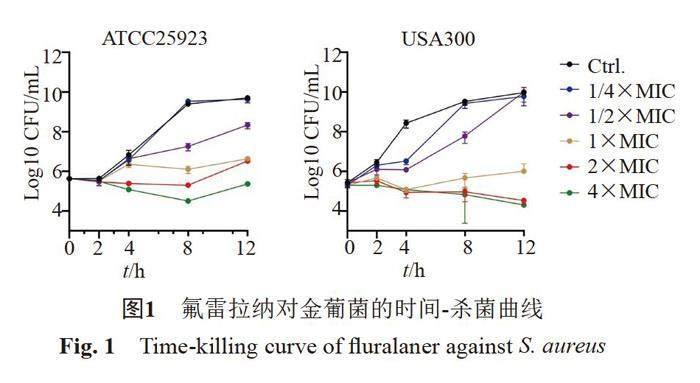
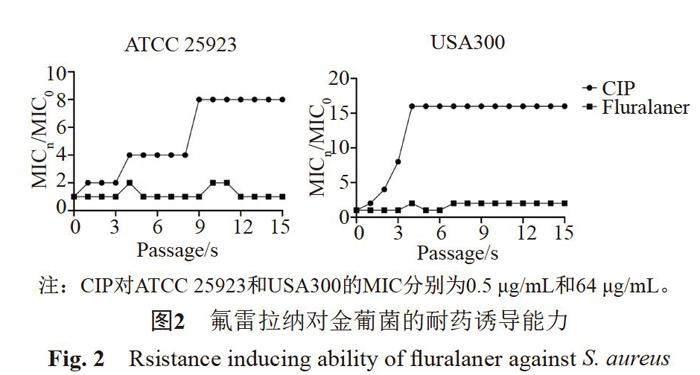
氟雷拉纳对金葡菌标准菌株和临床分离菌株的MIC和MBC分别为4~8 μg/mL和8~16 μg/mL。氟雷拉纳无论是对MSSA还是MRSA均具有相同的抗菌活性(表1)。通过时间-杀菌曲线可知,亚抑菌浓度的氟雷拉纳(1/2×MIC)即可有效抑制细菌的增殖,且随着浓度增高,其抗菌活性越强。(2~4)×MIC的氟雷拉纳处理8 h内可有效降低MSSA标准菌株ATCC25923的活菌数量。而(2~4)×MIC可显著降低MRSA标准菌株USA300的活菌数量长达12 h(图1)。此外,即使亚抑菌浓度氟雷拉纳连续处理金葡菌ATCC25923和USA300长达15 d也未见耐药突变株的形成。而经过CIP诱导后的金葡菌ATCC25923和USA300的MIC分别升高了8倍和16倍(图2)。但氟雷拉纳对CIP诱导的耐药菌株的MIC仍然为8 μg/mL,说明氟雷拉纳与CIP之间不存在交叉耐药。
2.2 氟雷拉纳具有显著的抗持留菌活性以及生物被膜抑制和清除活性
由图3可知,即使高达10×MIC的VAN对金葡菌ATCC 25923和USA300均无抗菌活性。而1~8×MIC的氟雷拉纳可显著降低ATCC 25923的持留菌活菌数量,且随着时间的延长,活菌数量显著降低。例如,与对照组相比较,8×MIC的氟雷拉纳作用ATCC25923持留菌4 h可使其活菌计数从(8.97±0.35)Log10 CFU/mL降低到(7.47±0.09)Log10 CFU/mL(t=7.17, P=0.002)。此外,(2~8)×MIC的氟雷拉纳也能显著降低USA 300的持留菌活菌量,其杀菌活性也表现出明显的时间依赖性。例如,8×MIC的氟雷拉纳作用USA300持留菌4 h可使其活菌计数从(9.35±0.31)Log10 CFU/mL降低到(6.79±0.20)Log10 CFU/mL(t=12.04, P<0.001)。
氟雷拉纳还具有显著的生物被膜抗菌活性。1×MIC的氟雷拉纳可显著抑制MRSA USA300生物被膜的形成,使其生物被膜的形成量从(2.41±0.12)降低到(0.20±0.06)(t=44.03, P<0.0001)(图4A)。同时,1×MIC的氟雷拉纳还能显著清除已形成的生物被膜,使其生物被膜的总量从(3.02±0.02)减少到(2.04±0.39)(t=5.58, P=0.0008)。且随着氟雷拉纳的浓度增加,其生物被膜的清除活性明显增强,具有显著的剂量依赖性(图4B)。进一步通过激光共聚焦显微镜观察可知,氟雷拉纳能有效抑制生物被膜的形成,降低生物被膜的总量,使荧光总量减低,且使红色荧光(死菌)比例增加。同时,氟雷拉纳还能有效破坏已形成的生物被膜的结构,使荧光总量减少,且红色荧光比例增加(图4C)。
2.3 氟雷拉纳与AMK具有协同抗菌活性
通过棋盘稀释实验,将氟雷拉纳与氨基糖苷类抗菌药物的联用效果进行了筛选。由表2可知,氟雷拉纳与AMK联用具有协同抗菌活性,其FICI值最低,为0.375。图5A为氟雷拉纳联用AMK的代表性棋盘稀释实验图片。通过活菌计数(图5B),亚抑菌浓度的AMK和氟雷拉纳对金葡菌USA300的增殖无或仅有较弱的抑制作用,而当两药联用时可明显抑制USA300的增殖,进一步验证了其协同作用。
3 讨论
金葡菌逐渐上升的耐药性已成为全球难题,研发针对耐药金葡菌的新型抗菌药物已成为当下研究热点。本研究通过“老药新用”,发现抗寄生虫药物氟雷拉纳对金葡菌具有显著的抗菌活性。且氟雷拉纳合成路线成熟,成药潜力大。目前,尚未见氟雷拉纳对金葡菌抗菌作用的相关研究报道。
氟雷拉纳是1种杀菌剂,其对金葡菌的MBC约为2倍MIC。氟雷拉纳对持留菌还具有一定的杀菌作用。持留菌是1种处于休眠状态的细菌,对多种抗生素均耐药。近年来,研究者发现靶向细菌细胞膜的抗菌药物能不依赖于细菌的增殖而有效裂解持留菌[4]。因此,氟雷拉纳的作用机制可能也涉及细菌细胞膜的裂解。此外,AMK是1种作用于细菌细胞内部的氨基糖苷类抗生素,AMK与氟雷拉纳的协同抗菌作用机制可能也是通过氟雷拉纳对细胞膜的破坏作用从而增加了细胞膜的通透性,促进AMK进入细菌内部而发挥抗菌作用。与本研究类似,Kim等[8]发现抗寄生虫药物硫双二氯酚不仅能破坏细菌的细胞膜,还能与氨基糖苷类抗生素庆大霉素协同杀菌。She等[12]发现小分子药物L007-0069可通过破坏细菌细胞膜而发挥持留菌杀菌作用,还可与庆大霉素联用发挥协同抗菌作用。
生物被膜状态下的细菌耐药性高。植入物相关生物被膜的治疗往往需要通过手术且需要延长抗菌治疗时间,给临床诊疗带来极大的困难[13]。近年来,有关针对生物被膜的相关抗菌药物已成为研究热点。研究者发现将抗菌药物联用特异性作用于生物被膜组成成分或调控靶点的抗菌药物可以有效抑制生物被膜的形成或一定程度上清除已形成的生物被膜。例如,savirin和apicidin可以作用于金葡菌的Agr群体密度感应系统而抑制生物被膜的形成;重组酶DNase I和DispersinB能通过降解生物被膜基质而起到生物被膜清除作用;lysostaphin和抗菌肽能一定程度上杀灭生物被膜内部的细菌等[14]。但这些抗菌药物因稳定性差、药动学不佳或合成工艺复杂等原因,目前还停留于实验室研究阶段。本研究中的氟雷拉纳属于小分子药物,具有生物被膜抑制和清除作用以及抗持留菌的活性,且有结构稳定、合成工艺成熟和毒性低等优点,具有较大的成药潜力。
AMK一般临床上用于治疗革兰阴性菌引起的感染,但与某些抗菌药物联用可以降低其毒性,扩大抗菌谱从而提高其临床适用性。此外,包括生物被膜在内的难治性金葡菌往往对常用抗菌药物耐药,且对单一药物具有较高的耐药性,而当AMK联用其他抗菌药物时,对生物被膜具有良好的杀菌效果。例如:Cui等[15]发现AMK联用鹅去氧胆酸可通过改变细菌质子动力势和促进活性氧的产生而促进AMK对金葡菌的抗菌活性。Broussou等[16]和Boles等[17]发现万古霉素联用AMK不仅能有效降低AMK诱导金葡菌的耐药突变发生率,还能协同抑制植入物表面金葡菌生物被膜的形成。与单一抗菌药物的使用相比,抗菌药物联用具有诸多其独特的优点。例如,抗菌药物联用可以在不增加用药剂量的前提下提高药物的疗效;联用可以减少耐药突变的发生率;联用还可以降低药物的毒性等[18]。本研究发现氟雷拉纳与AMK联用对MRSA具有显著的协同抗菌作用。亚抑菌浓度的氟雷拉纳即可显著提高AMK的抗菌活性,有效降低了用药剂量,解决了AMK的毒性难题,从而进一步提高了AMK的利用价值,延缓了细菌耐药性的产生。
氟雷拉纳主要用于治疗动物寄生虫感染,其作用靶点为一种寄生虫特有的γ-氨基丁酸门控氯离子通道。由于哺乳动物和节肢动物的γ-氨基丁酸门控氯离子通道结构与寄生虫不同,因此,不存在共同作用靶点,从而氟雷拉纳对人体细胞的毒性低且具有良好的体内耐受性[19]。氟雷拉纳具有良好的体内代谢参数,在实验狗中,口服25 mg/kg的氟雷拉纳可使血药浓度最高达到3.95 μg/mL。其作用时间长,半衰期可持续12 d,曲线下面积为46.12μg·d/mL,提示氟雷拉纳能被良好的吸收利用[20]。虽然,本研究中的最高血药浓度仅为3.95 μg/mL(低于本研究中金葡菌的MIC值8 μg/mL),但其给药剂量仅为25 mg/kg,鉴于其耐受性良好,有望通过加大剂量提高药物在体内浓度。一项针对于实验狗的临床试验发现,即使高达56 mg/kg的氟雷拉纳持续用药8周也未见明显的体内毒性[21]。此外,氟雷拉纳也被研究用于治疗媒介传播疾病,Miglianico等[22]发现氟雷拉纳对按蚊、伊蚊、库蚊和白鳍豚沙蝇具有显著的杀灭作用,其半数抑制浓度低至33~575 nmol/L。通过临床前药物代谢动力学数据分析,研究者预测410 mg的人体使用剂量能维持50~90 d的作用效果,从而能有效防止塞卡病毒和疟原虫的感染。近年来,通过“老药新用”,抗寄生虫药物被广泛研究用于新型冠状病毒[23]和抗菌治疗[24],且都表现出良好的应用前景、降低了人力和财力的消耗,加快了药物的研究进程。因此,将氟雷拉纳改造为抗菌药物具有较大的研发潜力。
本研究通过药敏试验、生物被膜和持留菌杀菌实验以及棋盘稀释实验等方法,发现抗螨虫药物氟雷拉纳对金葡菌及其耐药菌株具有显著的抗菌活性,且与AMP联用还具有显著的协同抗菌活性。有望为金葡菌感染提供新武器。
参 考 文 献
Cheung G Y C, Bae J S, Otto M. Pathogenicity and virulence of Staphylococcus aureus[J]. Virulence, 2021, 12(1): 547-569.
Mottola C, Matias C S, Mendes J J, et al. Susceptibility patterns of Staphylococcus aureus biofilms in diabetic foot infections[J]. BMC Microbiol, 2016, 16(1): 119.
Liu Y, Jia Y, Yang K, et al. Metformin restores tetracyclines susceptibility against multidrug resistant bacteria[J]. Adv Sci (Weinh), 2020, 7(12): 1902227.
Kim W, Zhu W, Hendricks G L, et al. A new class of synthetic retinoid antibiotics effective against bacterial persisters[J]. Nature, 2018, 556(7699): 103-107.
Liu Z, Khan M M, Fajar A, et al. Toxicity of fluralaner against vegetable pests and its sublethal impact on a biocontrol predatory ladybeetle[J]. Ecotoxicol Environ Saf, 2021, 225: 112743.
Liu Y, She P, Xu L, et al. Antimicrobial, antibiofilm, and anti-persister activities of penfluridol against Staphylococcus aureus[J]. Front Microbiol, 2021, 12: 727692.
Blaskovich M A T, Hansford K A, Gong Y, et al. Protein-inspired antibiotics active against vancomycin- and daptomycin-resistant bacteria[J]. Nat Commun, 2018, 9(1): 22.
Kim W, Zou G, Hari T P A, et al. A selective membrane-targeting repurposed antibiotic with activity against persistent methicillin-resistant Staphylococcus aureus[J]. Proc Natl Acad Sci U S A, 2019, 116(33): 16529-16534.
Qu L, She P, Wang Y, et al. Effects of norspermidine on Pseudomonas aeruginosa biofilm formation and eradication[J]. Microbiologyopen, 2016, 5(3): 402-412.
Yasir M, Dutta D, Kumar N, et al. Interaction of the surface bound antimicrobial peptides melimine and Mel4 with Staphylococcus aureus[J]. Biofouling, 2020, 36(9): 1019-1030.
Mataraci E, Dosler S. In vitro activities of antibiotics and antimicrobial cationic peptides alone and in combination against methicillin-resistant Staphylococcus aureus biofilms[J]. Antimicrob Agents Chemother, 2012, 56(12): 6366-6371.
She P, Liu Y, Xu L, et al. L007-0069 kills Staphylococcus aureus in high resistant phenotypes[J]. Cell Mol Life Sci, 2022, 79(11): 552.
Suresh M K, Biswas R, Biswas L. An update on recent developments in the prevention and treatment of Staphylococcus aureus biofilms[J]. Int J Med Microbiol, 2019, 309(1): 1-12.
Schilcher K, Horswill A R. Staphylococcal biofilm development: Structure, regulation, and treatment strategies[J]. Microbiol Mol Biol Rev, 2020, 84(3): e00026-19.
Cui K, Yang W, Liu Z, et al. Chenodeoxycholic acid-amikacin combination enhances eradication of Staphylococcus aureus[J]. Microbiol Spectr, 2023, 11(1): e0243022.
Broussou D C, Lacroix M Z, Toutain P L, et al. Differential activity of the combination of vancomycin and amikacin on planktonic vs. biofilm-growing Staphylococcus aureus bacteria in a hollow fiber infection model[J]. Front Microbiol, 2018, 9: 572.
Boles L R, Awais R, Beenken K E, et al. Local delivery of amikacin and vancomycin from chitosan sponges prevent polymicrobial implant-associated biofilm[J]. Mil Med, 2018, 183(suppl_1): 459-465.
Coates A R M, Hu Y, Holt J, et al. Antibiotic combination therapy against resistant bacterial infections: Synergy, rejuvenation and resistance reduction[J]. Expert Rev Anti Infect Ther, 2020, 18(1): 5-15.
刘冠麟, 王建, 程雪娇, 等. 氟雷拉纳在动物寄生虫疾病控制中的应用进展[J]. 中国兽药杂志, 2022, 56(9): 58-65.
Takano K, De Hayr L, Carver S, et al. Pharmacokinetic and pharmacodynamic considerations for treating sarcoptic mange with cross-relevance to Australian wildlife[J]. Int J Parasitol Drugs Drug Resist, 2023, 21: 97-113.
Prohaczik A, Menge M, Huyghe B, et al. Safety of fluralaner oral solution, a novel systemic antiparasitic treatment for chickens, in laying hens after oral administration via drinking water[J]. Parasit Vectors, 2017, 10(1): 363.
Miglianico M, Eldering M, Slater H, et al. Repurposing isoxazoline veterinary drugs for control of vector-borne human diseases[J]. Proc Natl Acad Sci U S A, 2018, 115(29): E6920-E6926.
Singh S, Weiss A, Goodman J, et al. Niclosamide-a promising treatment for COVID-19[J]. Br J Pharmacol, 2022, 179(13): 3250-3267.
Lele A C, Mishra D A, Kamil T K, et al. Repositioning of DHFR inhibitors[J]. Curr Top Med Chem, 2016, 16(19): 2125-2143.

