氟苯尼考/二甲基-β-环糊精包合物的制备及评价
程晓敬 陈怡健 李智斌 梁劲康 胡巧红


摘要:目的 以2,6-二甲基-β-环糊精(DM-β-CD)为包合材料制备氟苯尼考(florfenicol,FF)包合物FF/DM-β-CD,以改善FF的溶解度和溶出速度,提高其生物利用度。 方法 在应用分子对接结合相溶解度法筛选合适的环糊精(CD)后,采用加热搅拌法制备FF/DM-β-CD,并使用DSC、PXRD、FT-IR对包合物进行物相鉴别,对其溶解性、溶液稳定性和体外溶出进行考察,同时进行了FF/DM-β-CD在鸡体内的药动学研究。结果 FF与 HP-β-CD、DM-β-CD和SBE-β-CD对接后的模型较稳定,DM-β-CD改善FF溶解度的效果最好。选择DM-β-CD作为包合材料,加热搅拌法制备了FF/DM-β-CD,DSC、PXRD和FT-IR结果证实FF/DM-β-CD的形成。FF/DM-β-CD可显著增加FF的溶解度,在标准硬水、自来水、去离子水和纯化水中的溶解度均大于FF的55.0倍。FF/DM-β-CD溶液在25 ℃放置1 d后,自来水中无析出,标准硬水、纯化水和去离子水中有微量析出;随着时间增加,析出逐渐增多,7 d后,以自来水中析出最少;FF含量无明显变化。FF/DM-β-CD在不同水质水中的溶出无明显差异,25 ℃、5 min时均已完全溶出,为FF原料药的17.09倍。与FF相比,FF/DM-β-CD能明显提高FF在鸡体内的生物利用度(Fr=165.24%)。结论 以DM-β-CD为包合材料制备FF/DM-β-CD,可显著提高FF的溶解度、溶出度和生物利用度。
关键词:氟苯尼考;DM-β-CD;包合物;溶解度;体外溶出;体内药动学
中图分类号:R978文献标志码:A
Preparation and evaluation of florfenicol/dimethyl-β-cyclodextrin
inclusion compound
Cheng Xiaojing1, Chen Yijian1, Li Zhibin2, Liang Jingkang3, and Hu Qiaohong1,4
( 1 School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006; 2 Guangzhou Health Science College, Guangzhou 510450; 3 Guangdong Wens Dahuanong Biotechnologianl Co. Ltd., Yunfu 527400; 4 Guangdong Provincial Key Laboratory of
Advanced Drug Delivery Systems and Guangdong Provincial Engineering Center of Topical Precise Drug Delivery
System, Guangdong Pharmaceutical University, Guangzhou 510006)
Abstract Objective To improve the solubility, dissolution rate and bioavailability of florfenicol (FF), a FF/dimethyl-β-cyclodextrin (DM-β-CD) inclusion complex (FF/DM-β-CD) was prepared and evaluated. Methods The binding free energies of FF with 6 cyclodextrins (CDs) were calculated by molecular docking, and then the phase solubility of FF in 4 cyclodextrin solutions was determined to screen for a proper CD. FF/DM-β-CD was prepared by stirring under the heating method and characterized by differential scanning calorimetry (DSC), powder X-ray diffractometry (PXRD), and Fourier transform infrared spectrometry (FT-IR). The solubility, solution stability, in vitro dissolution and in vivo pharmacokinetics of FF/DM-β-CD were investigated. Results The results of molecular docking and phase solubility determination showed that the docking model of FF with hydroxypropyl-β-cyclodextrin (HP-β-CD), DM-β-CD and sulfobutyl-β-cyclodextrin (SBE-β-CD) was stable, and DM-β-CD exhibited the best enhancing effect on the solubility of FF. Using DM-β-CD as inclusion material, FF/DM-β-CD was prepared successfully by stirring under the heating method. DSC, PXRD and FT-IR results confirmed the formation of FF/DM-β-CD. FF/DM-β-CD could significantly increase the solubility of FF in standard hard water, tap water, deionized water, and purified water, which were at least 55.0 times higher than that of FF. When stored at 25 ℃, the FF/DM-β-CD solution was still clear in tap water after 1 day, while a small amount of precipitate occurred in standard hard water, pure water and deionized water. The amount of precipitate gradually increased with time and was the least in tap water after 7 days. There were no significant differences between the in vitro dissolution of FF/DM-β-CD in standard hard water, tap water, deionized water and purified water. At 5 min, the cumulative dissolution percentage of FF/DM-β-CD reached 100% at 25 ℃, which was 17.09 times that of FF raw material. Compared with FF, the bioavailability of FF/DM-β-CD in chickens increased with Fr=165.24%. Conclusion FF/DM-β-CD prepared with DM-β-CD as inclusion material could significantly improve the solubility, dissolution and bioavailability of FF.
Key words Florfenicol; Dimethyl-β-cyclodextrin; Inclusion complex; Solubility; In vitro dissolution; In vivo pharmacokinetics
氟苯尼考(florfenicol,FF)是一种动物专用的酰胺醇类广谱抗生素[1],对绝大多数的革兰阴性菌和革兰阳性菌均有很强的杀菌作用,如大肠埃希菌、金黄色葡萄球菌、多杀性巴氏杆菌、伤寒杆菌、链球菌等[2],广泛用于临床。然而,FF的水溶性较差,极大地限制了其临床应用。FF属于BCS II类药物[3],溶出是其吸收的限速步骤,因此,在FF新制剂的开发中,应重点考虑如何提高其溶解度和溶出度。
目前,改善FF溶解度的方法主要有固体分散体、纳米晶、超微粉、微晶、微乳和包合物等[4-5]。固体分散体在储存过程中不稳定,可能会由于尺寸增大、重结晶等出现老化问题[6];纳米晶通常会由于粒径减小导致体系不稳定,出现Ostawald熟化现象[7];超微粉具有较大的表面积,易出现氧化和吸湿等现象[8];微晶在制备过程中可能会由于溶液中局部过饱和度不一致使产品粒度不均一,造成团聚[9]。微乳中表面活性剂占比较大,对胃肠道的刺激等副作用增加[10]。包合物可通过主、客分子间的疏水作用、静电引力、范德华力和氢键的相互作用包载FF,增加FF的溶解度和稳定性,且制备工艺简单,给药方便[11]。
包合材料是决定包合物增溶效果的重要因素之一,目前包合材料的筛选通常仍采用传统的实验方法,不仅耗时且费用较高。随着计算机技术的飞速发展,计算药剂学在药物制剂研发中展现出巨大的潜力。其中,分子对接是一种通过受体特征以及受体和药物分子间的相互作用方式,研究分子间(如配体和受体)相互作用,并预测其结合模式和亲合力的一种理论模拟方法,近年来已成为计算机辅助药物研究领域的一项重要技术。将该技术应用于包合物,通过预测小分子配体与大分子受体的结合模式和包合物的微观结构[12],以及最低结合能,筛选出合适的包合材料,可提高实验的准确性和可靠性。
目前研究最多的FF包合物的包合材料为β-环糊精(β-cyclodextrin, β-CD)[13-15],此外,还有羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin, HP-β-CD)、γ-环糊精(γ-cyclodextrin, γ-CD)、羟丙基-γ-环糊精(hydroxypropyl-γ-cyclodextrin, HP-γ-CD)等[16]。尽管这些包合材料可在一定程度上增加FF溶解度,但其效果均不甚理想。因此,本文选择6种CDs,通过分子对接预测,结合相溶解度测定,筛选出增溶效果最好的2,6-二甲基-β-环糊精(2,6-dimethyl-β-cyclodextrin, DM-β-CD)作为包合材料,制备FF/DM-β-CD,旨在提高FF的溶解度、溶出度和生物利用度,更好地满足用药要求。
1 材料与动物
1.1 仪器
FA2004B 电子天平(上海精科天美科学仪器有限公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器责任有限公司);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);SHA-B恒温振荡器(上海力辰邦西仪器科技有限公司);ZRS-8GD智能溶出仪(天津天大天发科技有限公司);Spectrum100傅里叶红外光谱仪、DSC-4000差示扫描量热仪(美国PerkinElmer仪器有限公司);X射线粉末衍射仪(日本理学Rigaku ULTIMA IV);DGJ-56T10NDP冷冻干燥机(北京赛欧华创科技有限公司);1200高效液相色谱仪(美国Agilent公司);3-30K高速冷冻离心机(德国Sigma公司)
1.2 药品与试剂
FF原料药(批号:200634)购自湖北龙翔药业科技股份有限公司;FF对照品(批号:wkq22060603;含量≥98%)购自四川省维克奇生物科技有限公司;氯霉素(CAP)对照品(含量为99.8%,批号:201704)购自中国兽医药品监察所;DM-β-CD、α-环糊精(α-cyclodextrin, α-CD)、γ-环糊精(γ-CD)、羟丙基-β-环糊精(HP-β-CD)、磺丁基-β-环糊精(SBE-β-cyclodextrin, SBE-β-CD)购自山东滨州智源生物科技有限公司;β-CD购自安徽山河药用辅料有限公司;色谱用甲醇、乙腈为色谱纯;其他试剂均为分析纯。
1.3 实验动物
(12±1)月龄健康三黄鸡12只,体重为(2.0±
0.3) kg,常规饲养,自由饮水和采食,饲料为不含抗菌药物的全价日粮。给药前12 h开始至给药后4 h禁食,自由饮水。
2 方法
2.1 环糊精的筛选
(1) FF与CDs的分子对接 从PubChem数据库下载FF、α-CD、β-CD和γ-CD的3D模型(CID编号为114811、444913、444041和5287407),用MarvinSketch软件打开去水后的β-CD模型,用相应取代基将葡萄糖单元中对应位置进行取代,得到β-CD衍生物模型并进行几何优化;采用AutoDockTools 1.5.7软件处理受体(α-CD、β-CD、γ-CD、HP-β-CD、2,6-DM-β-CD、SBE-β-CD)与配体(FF),并保存为pdbqt格式[17]。在分子对接过程中,将合适尺寸的反应约束盒子中心置于受体几何中心。能量差值设定为10,对接的细致程度设定为20,最多生成30000个模型,其他参数取默认值;对接方法采用半柔性对接。
(2) 相溶解度的测定 根据分子对接结果,选取最佳结合能较小的若干CDs,测定FF在不同CDs中的相溶解度。将过量 FF 加入到10 mL不同浓度的CDs溶液中,在30 ℃、200 r/min下恒温震荡72 h,4000 r/min离心5 min,取上清液过滤,滤液适当稀释后用HPLC进行分析[18]。以FF的摩尔浓度对CD的摩尔浓度进行线性拟合,求出回归方程,按下式计算包合常数K以及吉布斯自由能△G。
式中,S0表示FF在水中的溶解度,Slope表示相溶解度曲线的斜率,T表示温度。
2.2 FF/DM-β-CD的制备
取处方量FF,用适量无水乙醇溶解。另取处方量DM-β-CD,置于50 mL烧杯中,加纯化水10 mL,在50 ℃、650 r/min下,搅拌溶解,缓缓滴加上述 FF醇溶液,待反应液呈均相后,密闭继续搅拌5 h,停止加热,旋蒸除乙醇,过滤,滤液冷冻干燥即得包合物。
2.3 FF/DM-β-CD的物相鉴别
(1) DSC分析 取FF、DM-β-CD、FF与DM-β-CD简单物理混合物(FF-PM)、FF/DM-β-CD适量,进行DSC测定。测定条件:N2流速20 mL/min,温度范围30~250 ℃,升温速率10 ℃/min。
(2) PXRD分析 取FF、DM-β-CD、FF-PM、FF/DM-β-CD适量,进行PXRD分析。测定条件:Cu靶Ka射线,电压40 kV,电流40 mA,发散狭缝1/32°,防散射狭缝1/16°,防散射狭缝7.5 mm,2θ角度范围5°~90°,步长0.02°,每步停留时间40 s,扫描速度10°/min。
(3) FT-IR分析 取FF、DM-β-CD、FF-PM、FF/DM-β-CD适量,进行FT-IR分析。采用KBr压片。扫描范围4000~400 cm?1,分辨率4 cm?1。
2.4 FF/DM-β-CD的溶解性考察
(1) FF的溶解度 分别将过量FF加入10 mL标准硬水、纯化水、自来水和去离子水中,在25 ℃、150 r/min条件下振荡72 h后取出,于5000 r/min离心5 min,上清液用0.45 μm的微孔滤膜过滤,取滤液适当稀释后,用HPLC进行分析[18],计算FF溶解度。
(2) FF/DM-β-CD的溶解性 分别精密称取包合物1.2 g(相当于FF 142.32 mg),置于2 mL容量瓶,加标准硬水、自来水、纯化水和去离子水溶解并定容,适当稀释后用HPLC测定FF浓度[18]。
2.5 FF/DM-β-CD溶液稳定性考察
精密称取包合物1.25 g,分别用标准硬水、自来水、纯化水和去离子水溶解并定容至5 mL,在25 ℃下放置,于0、1、2、3、4、5、6和7 d观察其外观性状,并取样适量稀释后,用HPLC测定FF浓度[18]。
2.6 FF/DM-β-CD的体外溶出考察
按《中国兽药典》(2020年版Ⅰ卷)第160条规定的方法(桨法)测定,温度分别为25 ℃和37 ℃,溶出介质为标准硬水、自来水、纯化水和去离子水,溶出介质体积为900 mL,转速为50 r/min。取FF、FF-PM或FF/DM-β-CD(均相当于200 mg的FF)进行测定,在预定的时间点取样5 mL,同时补加等温等体积的新鲜溶出介质。样品过0.45 μm微孔滤膜,滤液用HPLC进行分析[18],计算FF的累积溶出率,并绘制溶出曲线。
2.7 FF/DM-β-CD的体内药动学
12只三黄鸡随机分为A、B两组,A组灌服FF混悬液,B组灌服FF/DM-β-CD溶液,剂量为20 mg/kg;在给药前及给药后0.083、0.16、0.333、0.5、0.75、1、1.5、2、4、6、8、10、12和24 h,从翅静脉采血2 mL,置于肝素钠抗凝的离心管中,5000 r/min离心10 min,收集血浆,置-20 ℃冰箱保存。血浆样品用HPLC进行分析[1]。
3 结果
3.1 环糊精的筛选
(1) FF与CDs的分子对接 对FF与不同CDs可能的结合模式进行筛选,每种CD从30000次构象搜索中选出能量最低的结合方式,此能量为最佳结合能(ΔG),FF与α-CD、β-CD、γ-CD、HP-β-CD、DM-β-CD和SBE-β-CD之间的ΔG分别为-4.3、-4.9、 -4.5、-5.7、-5.1和-5.1,说明反应均可自发进行,ΔG的绝对值为HP-β-CD>DM-β-CD=SBE-β-CD>β-CD>γ-CD>α-CD,说明FF与HP-β-CD、DM-β-CD和SBE-β-CD形成的构象相对较稳定。
(2) 相溶解度 根据对接结果,选择HP-β-CD、DM-β-CD、SBE-β-CD和常用的β-CD,测定FF在4种CDs中的相溶解度,结果见图1。FF的溶解度随着CDs浓度的增大而增大。FF在HP-β-CD中的相溶解度曲线呈AL型,随HP-β-CD浓度增加,FF溶解度呈线性增加;FF在β-CD、SBE-β-CD中的相溶解度曲线呈AN型,随β-CD (或SBE-β-CD)浓度增加,FF溶解度增加的速率变慢;FF在DM-β-CD中的相溶解度曲线呈AP型,随DM-β-CD浓度增加,FF溶解度增加的速率变快。
根据公式计算求得包合物的K值以及相应的ΔG,结果见表1。K值大小顺序为DM-β-CD>β-CD>SBE-β-CD>HP-β-CD,说明FF与DM-β-CD形成包合物的过程最稳定;ΔG均小于0,表明包合过程自发进行,且ΔG的绝对值为DM-β-CD>β-CD>SBE-β-CD>HP-β-CD,表明DM-β-CD反应自发进行的程度最高。因此,选择DM-β-CD为包合材料制备FF/DM-β-CD。
3.2 FF/DM-β-CD的制备
因FF水溶性较差,制备包合物时将FF先溶于无水乙醇中,再滴加到DM-β-CD水溶液中,整个过程中,体系均为澄清溶液,无药物析出,旋蒸去除乙醇后,仍为澄清溶液,冷冻干燥后得到白色粉末状的包合物。
3.3 FF/DM-β-CD的物相鉴别
(1) DSC分析 DSC结果见图2,FF在159 ℃处有熔融吸热峰,而DM-β-CD无明显的吸热峰。FF-PM中的FF熔点峰在146 ℃左右,较FF有所降低,且强度减弱。这可能是由于升温过程中,当温度较高时FF与DM-β-CD间发生了相互作用,有部分已经形成包合物,使熔点降低;且物理混合物样品中含有的FF量较FF原料药样品少,使峰强度减弱。而FF/DM-β-CD中,FF的吸热峰消失,表明FF已经嵌入DM-β-CD空穴中,没有药物结晶,证明包合物确已形成。
(2) PXRD分析 PXRD结果见图3,FF在8.22°、16.22°、21.16°、23.64°、24.44°、26.88°、31.92°、41.42°和43.52°处有较强的衍射峰,表明FF具有特定晶型结构。DM-β-CD没有明显的衍射峰。FF-PM出现与FF同样的衍射峰,但峰强度较FF原料药小,可能是由于物理混合物样品中含有FF的量较FF原料药样品少,使衍射峰强度减弱。FF/DM-β-CD中FF的特征吸收峰完全消失,表明形成了包合物。
(3) FT-IR分析 FT-IR结果见图4,FF在3448 cm-1处有-OH伸缩振动吸收峰,在1681 cm-1处有-C=O伸缩振动吸收峰,在1535 cm-1处有-NH的弯曲振动和-CN的伸缩振动吸收峰,在1270 cm-1处有-CN的弯曲振动和-NH的伸缩振动吸收峰。DM-β-CD在3401 cm-1有-OH伸缩振动吸收峰,1644 cm-1处有C-O-C伸缩振动吸收峰。FF-PM红外图谱中,由于DM-β-CD的存在使FF的-OH伸缩振动吸收峰偏移至3437 cm-1,其他峰位置不变,表明FF与DM-β-CD未发生相互作用。FF/DM-β-CD在3402 cm-1有-OH伸缩振动吸收峰,与DM-β-CD一致,而FF的特征峰消失或发生偏移,说明FF与DM-β-CD之间发生了氢键的作用,形成了包合物,与文献[19]基本一致。
3.4 FF/DM-β-CD的溶解性
溶解性考察结果见表2。25 ℃时,FF在标准硬水、自来水、纯化水和去离子水中的溶解度没有明显差异;FF/DM-β-CD在4种水质水中的溶解度分别是FF的55.74、57.68、55.0和55.57倍以上,对FF的增溶效果远大于文献报道[14-15]。
3.5 FF/DM-β-CD溶液稳定性
FF/DM-β-CD溶液稳定性结果见表3。25 ℃下放置7 d,24 h后,在自来水中无析出,在去离子水、纯化水和标准硬水中有微量析出,随着放置时间延长,析出增加,尤以去离子水中析出明显,其后依次为纯化水、标准硬水、自来水,表明在自来水中的物理稳定性最佳;此外,放置过程中FF含量也没有明显下降,表明FF/DM-β-CD溶液的化学稳定性较好。
3.6 FF/DM-β-CD的体外溶出
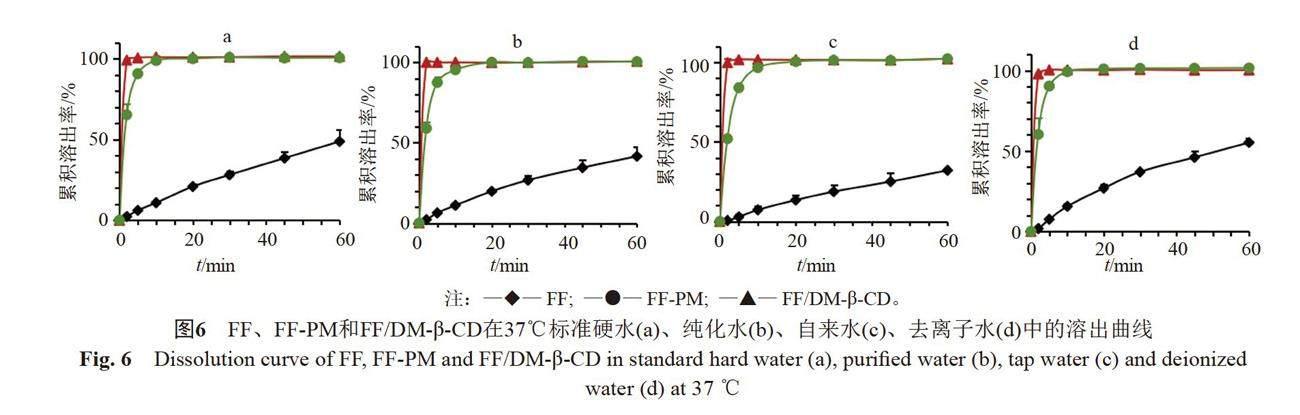
体外溶出结果见图5~6。在不同水质水中,FF、FF-PM和FF/DM-β-CD在37 ℃的溶出速率均比25 ℃快,升高温度有助于药物的溶出。FF/DM-β-CD在不同水质水中的溶出无明显差异。在25 ℃、2 min时,FF/DM-β-CD在标准硬水、纯化水、自来水和去离子水中的累积溶出率分别为98.60%、99.36%、97.70%和98.67%;FF-PM的累积溶出率分别为54.98%、46.12%、37.28%和59.84%,明显低于FF/DM-β-CD;而FF的累积溶出率分别为1.63%、1.43%、0.61%和1.38%,远低于FF/DM-β-CD和FF-PM。这是因为与FF原料药(粒径约为15.60 μm)相比,FF/DM-β-CD不仅显著增加了FF的溶解度,而且使FF以分子状态分散,比表面积显著增加,根据Noyes-Whitney方程,溶解度越大,药物粒径越小,比表面积越大,溶出速率越快。包合物在5 min均可完全溶出,是FF的17.09倍以上,表明FF/DM-β-CD可显著加快FF的溶出。
3.7 FF/DM-β-CD的体内药动学
FF和FF/DM-β-CD的平均血药浓度-时间曲线见图7,药动学参数见表4。FF/DM-β-CD的Cmax和AUC(0-t)均显著大于FF(P<0.01),AUC(0-∞) 明显大于FF(P<0.05),Tmax、MRT(0-t)、MRT(0-∞)、t1/2z、CLz/F、Vz/F、Zeta与FF无显著性差异(P>0.05)。表明制成FF/DM-β-CD可明显提高FF的生物利用度(Fr=165.24%)。
4 讨论
药物与CD的相溶解度图可分为A型和B型,其中A型表示生成可溶性包合物,可进一步分为AL、AN和AP型,FF与DM-β-CD的相溶解度曲线呈AP型,随DM-β-CD浓度增加,对FF的增溶效果越好。FF与SBE-β-CD和β-CD的相溶解度曲线呈AN型,可能是由于FF与SBE-β-CD和β-CD之间的作用力不及FF与DM-β-CD之间的作用力或者是高浓度的CD分子间存在着聚合作用[20]。K值是衡量包合物稳定性的重要参数,K值越大,对药物稳定作用越强[21]。ΔG是判断反应是否可以自发进行以及自发进行难易程度的重要指标,通常ΔG为负值反应自发进行,且值越小,反应自发进行的程度越高。本实验中,分子模拟预测的结果与相溶解度结果略有差异,可能是由于分子对接采用的是半柔性对接,CDs为刚性结构,对接过程中受到限制,而实际过程中FF和CDs之间可能发生更为复杂的相互作用。因此,本文在分子对接基础上通过相溶解度测定后,选用增溶效果最好的DM-β-CD作为包合材料。
FF/DM-β-CD制备中,应用单因素试验考察了药载比、水浴温度、搅拌时间、搅拌速度对包封率和载药量的影响,结果发现,药载比影响较大,药载比1:2时包封率最高,温度、搅拌时间和搅拌速度的影响均无明显差异,因此确定包合物制备处方工艺为药载比1:2、水浴温度50 ℃、搅拌时间5 h、搅拌速度650 r/min。
鉴于FF在临床上常采用饮水给药,本文考察了FF/DM-β-CD在不同水质水中的溶解性。实验过程中曾尝试用平衡溶解度测定法测定FF/DM-β-CD溶解度,发现1.2 g FF/DM-β-CD均可以溶于2 mL不同水质水中,且溶液黏度合适;当用量增加到2 g时,溶液黏度过大,无法顺利取样测定,因此,仅考察了溶解性。结果表明,FF/DM-β-CD能明显增加FF的溶解度。临床上,饮水给药时,首先配成浓溶液,稀释后作为饮水给予动物,在此过程中,必须确保药物始终完全溶解且不发生降解,因此本文考察了FF/DM-β-CD溶液的稳定性。结果表明,25 ℃放置1 d,FF/DM-β-CD在自来水中物理稳定性最好;连续放置7 d,去离子水、纯化水中析出相对较多,可能是因为在缺少离子的条件下,FF更易从包合物中脱离,而标准硬水、自来水中析出较少,其中自来水中析出最少,原因可能是DM-β-CD与水中金属离子发生络合作用,使体系更稳定,FF不易从包合物中脱离;FF浓度未发生明显下降,说明溶液的化学稳定性较好,为FF/DM-β-CD的临床应用奠定了基础。
溶出度测定不仅可以反映药物的溶出特性,还可作为包合物鉴别的辅助方法。FF因水溶性较差,导致其溶出缓慢[22]。FF/DM-β-CD的溶出速率明显高于FF,也证明成功制得FF/DM-β-CD。FF-PM的溶出速率较FF有明显提高,这是因为一方面DM-β-CD的存在增加了FF的分散程度和可润湿性,另一方面,在搅拌条件下,可能有部分FF与DM-β-CD发生相互作用形成包合物。
Cmax和AUC(0-∞)是评价药物吸收程度的重要药动学参数,也是评价药品质量的重要指标之一。FF/DM-β-CD组的Cmax和AUC(0-∞)显著高于FF组,表明包合物可明显增加FF溶解度和溶出速率,从而增加药物吸收。Tmax可反映药物吸收速度,FF/DM-β-CD的Tmax与FF无显著差异,这可能是因为包合物和DM-β-CD仅影响FF的溶解度和溶出速率,不能影响药物的透膜转运,从而不能加快药物的吸收。
5 结论
本文通过分子对接结合相溶解度法筛选出DM-β-CD作为包合材料后,应用加热搅拌法制备FF/DM-β-CD,并通过DSC、PXRD和FT-IR证明成功制备了FF/DM-β-CD。DM-β-CD为包合材料制备的包合物,可提高FF的溶解度、溶出速率和生物利用度,为后续FF新制剂的开发提供必要的实验依据。
参 考 文 献
张雨晴, 刘连超, 高建亭, 等. 氟苯尼考固体分散体的制备、优化及体内外释药评价[J]. 中国兽医杂志, 2023, 59(8): 41-47.
李亮. 畜牧生产中常用的抗生素种类及科学使用[J]. 畜禽业, 2022, 33(9): 24-26.
Li B, Hu Y, Guo Y, et al. Coamorphous system of florfenicol-oxymatrine for improving the solubility and dissolution rate of florfenicol: preparation, characterization and molecular dynamics simulation[J]. J Pharm Sci, 2021, 110(6): 2544-2554.
刘连超, 李雪娇, 李金辉, 等. 氟苯尼考固体形态增溶技术研究进展[J]. 动物医学进展, 2021, 42(4): 104-108.
张炳顺, 方秋华, 魏海涛, 等. 氟苯尼考增溶技术的研究进展[J]. 北方牧业, 2023(17): 19.
胡洋, 杨奕, 林霞, 等. 固体分散体制备工艺对其物理稳定性的影响[J]. 沈阳药科大学学报, 2022, 39(1): 98-104.
Tuomela A, Hirvonen J, Peltonen L. Stabilizing agents for drug nanocrystals: Effection bioavailability[J]. Pharmaceutics, 2016, 8(2): 16.
Gao W, Chen F, Wang X, et al. Recent advances in processing food powders by using superfine grinding techniques: A review[J]. Compr Rev Food Sci Food Saf, 2020, 19(4): 2222-2255.
李玉秀, 张子怡, 李丙东, 等. 药物增溶技术研究进展[J]. 山东化工, 2021, 50(10): 70-71.
Callender S P, Mathews J A, Kobernyk K, et al. Microemulsion utility in pharmaceuticals: Implications for multi-drug delivery[J]. Int J Pharm, 2017, 526(1-2): 425-442.
黄健榕, 杨凤, 仲雨叶, 等. 环糊精包合物的研究进展[J]. 广东化工, 2015, 42(19): 87-88.
Liu J, Zhang S, Zhao X, et al. Molecular simulation and experimental study on the inclusion of rutin with β-cyclodextrin and its derivative[J]. J Mol Struct, 2022, 1254: 132359.
马可, 张勇军, 邓桦, 等. 氟苯尼考-β-环糊精包合物的制备与结构表征[J]. 中国抗生素杂志, 2018, 43(2): 223-227.
罗娟, 陈彪, 郑珊, 等. 氟苯尼考β-环糊精包合物的制备[J]. 中兽医医药杂志, 2015, 34(1): 58-62.
马素英, 尚校军, 闫福林. 氟苯尼考β-环糊精包合物的制备与表征研究[J]. 湖北农业科学, 2011, 50(4): 802-806.
Ma S, Shi Y, Wang J, et al. Preparation and characterization of florfenicol inclusion complexes with three cyclodextrins[J]. World J Pharm Res, 2014, 3(9): 38-48.
姚培培, 樊金玲, 李德锋, 等. 光甘草定/环糊精固体包合物的制备和性质[J]. 食品科学, 2022, 43(16): 9-18.
万进, 牛志强, 徐瑞华, 等. 两种氟苯尼考制剂产品比较药动学研究[J]. 中国动物保健, 2017, 19(5): 82-85.
杨宝亭, 王庚南, 黄康东, 等. 氟苯尼考-羟丙基-β-环糊精包合物的研制[J]. 中国畜牧兽医, 2017, 44(6): 1854-1860.
艾凤伟, 张加伟, 钱楠, 等. 芦丁-二甲基-β-环糊精包合物的制备、物理化学表征及体外溶出研究[J]. 药学研究, 2015, 34(11): 650-653.
Ding X, Zheng M, Lu J, et al. Preparation and evaluation of binary and ternary inclusion complexes of fenofibrate/hydroxypropyl-β-cyclodextrin[J]. J Incl Phenom Macrocycl Chem, 2018, 91: 17-24.
Bharathi Balakrishnan S, Veerakanellore G B, Stalin T. In-vitro dissolution rate and molecular docking studies of cabergoline drug with β-cyclodextrin[J]. J Mol Struct, 2018, 1160: 1-8.

