萝卜硫素对放射性心肌损伤的防护作用
王鹤儒 郑庆霜 夏彬凤 崔明月 尹霞
摘要 目的: 探索萝卜硫素(SFN)对放射性心肌损伤的潜在防护作用及机制。 方法: 将8周龄雄性ICR小鼠随机分为 对照组、电离辐射组(IR组)、IR+SFN组,每组5只。IR组及IR+SFN组均于心脏定位后使用深部X射线治疗机对小鼠进行心脏照射(225 kV/13.33 mA 高能X线,射线予以3 mm铝及1.85 mm铜过滤,直径为1 cm的圆形的辐射场,剂量率为1 Gy/min,总剂量为2 000 cGy/20 Gy),未照射部位使用1 cm厚的铅板遮挡。IR+SFN组小鼠接受照射24 h后予以皮下注射SFN(0.5 mg/kg),每周5 d。4周后采用超声心动图测定心脏结构指标[左心室内径(LVID)]及功能指标[左室射血分数(LVEF)、左室短轴缩短率(LVFS)]、心肌纤维化指标[天狼星红染色、结缔组织生长因子(CTGF)]、心肌脂质过氧化指标[丙二醛(MDA)]、心肌细胞凋亡指标[裂解半胱氨酸天冬氨酸蛋白酶3(Cleaved Caspase.3)]。苏木精.伊红(HE)染色观察心肌结构,测定心肌组织中核因子E2相关因子2(Nrf2)表达。 结果: 给药结束后,与对照组比较,IR组与IR+SFN组小鼠LVID增大,LVEF、LVFS下降,心肌组织CTGF、Cleaved Caspase.3表达及MDA含量升高( P <0.05), 心肌组织存在明显的病理损伤,其中IR组上述指标变化更显著。与IR组比较,IR+SFN组LVID缩小,LVEF、LVFS提高,心肌组织中CTGF、Cleaved Caspase.3表达及MDA含量均下降( P <0.05),病理损伤减轻。与对照组比较,IR组及 IR+SFN组Nrf2表达升高( P < 0.05),其中IR+SFN组更显著。 结论: 辐射可引起小鼠心肌损伤、心脏结构改变及心功能减低,SFN可抑制辐射造成的心肌细胞凋亡、氧化应激,从而减轻心肌组织损伤,改善心功能,对心肌有一定的保护作用,该作用可能与Nrf2表达有关。
关键词 放射性心肌损伤;萝卜硫素;心脏功能;心脏结构;心功能;小鼠;实验研究
doi: 10.12102/j.issn.1672.1349.2024.10.011
放射在较多肿瘤的治疗中具有明确的作用,在此过程中部分病人心脏不可避免地受到了照射 [1] 。由电离辐射(ion.irradiation,IR)导致的心脏损伤称为放射 性心脏损伤,临床表现为心包疾病、心脏血管病变、传导系统疾病、心肌疾病、心脏瓣膜疾病等,这些心血管相关疾病统称为放疗导致的心脏疾病(radiation.induced heart disease,RIHD) [2] 。多项研究表明,放疗可使各类心脏疾病及心血管事件的发生风险升高,心脏接受的辐射剂量被认为是不良心血管事件和全因死亡风险的影响因素。RIHD有临床表现前可有10年以上的潜伏期,相关症状表现时心脏已出现不可逆损伤 [3.4] 。放疗技术的改进及方案的优化是RIHD的一级预防,不能使心脏受照射剂量完全降为零,因此,必须接受放疗的病人早期预防及后期治疗极为重要 [5.7] 。目前,尚无成熟的药物预防或治疗放射性心肌损伤,因此,亟需探讨放射性心肌损伤的发生、发展机制, 研发新型药物以预防和减轻放疗给心脏带来的损伤。
心肌暴露于辐射后,水辐解可产生大量活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)。机体内源性抗氧化能力不足以清除过量的ROS和RNS时导致氧化应激,进而引起心肌损伤。因此,氧化应激被认为是RIHD的主要发病机制之一,抑制氧化应激可能是减轻放射性心脏损伤的有效方法 [8] 。萝卜硫素(sulforaphane,SFN)是一种抗氧化剂,其抑制氧化应激不仅依赖于某一抗氧化酶,而是通过激活抗氧化应激转录因子——核因子E2相关因子2(nuclear factor erythroid 2.related factor 2,Nrf2)启动内源性抗氧化系统抵抗氧化损伤,有效预防或抑制各种因素导致的氧化应激相关心脏损伤,现已广泛用于氧化应激相关心血管疾病的基础研究 [9.10] 。尚无证据表明SFN是否能减轻放射性损伤。本研究旨在探讨SFN是否通过激活Nrf2减轻放射性心肌损伤。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
8周龄雄性ICR小鼠,体质量约28 g,购自北京维通利华实验动物技术有限公司,饲养于吉林大学公共卫生学院实验动物饲养中心。
1.1.2 实验试剂及器材
SFN(源叶生物,中国),Nrf2抗体(CST,美国),结缔组织生长因子(connective tissue growth factor,CTGF) 抗体(Abcam,美国),裂解半胱氨酸天冬氨酸蛋白酶3(Cleaved Caspase.3)抗体(CST,美国),丙二醛(malonaldehyde,MDA)试剂盒(万类生物,中国),内参抗体β.actin(wanleibio,中国),天狼 星红染液(Solarbio,中国),X射线治疗机(A84XOV XSZ.220/20, 康嘉仪器设备有限公司,中国),超声心动仪(SONOS 5500,Philips,中国)。
1.2 实验方法
1.2.1 放射性心脏损伤模型及SFN治疗模型的构建
将ICR小鼠随机分为对照组、IR组、IR+SFN组,每组5只。IR组及IR+SFN组均于心脏定位后使用深部X射线治疗机对小鼠进行心脏照射(225 kV/13.33 mA高能X线,射线予以3 mm铝及1.85 mm铜过滤,直径为1 cm的圆形辐射场,剂量率为1 Gy/min,总剂量为2 000 cGy/20 Gy),未照射部位使用1 cm厚的铅板遮挡;IR+SFN组小鼠于次日皮下注射SFN(0.5 mg/kg),每周5 d,持续给药4周。对照组使用相同方法处理,照射剂量为0 Gy。上述动物模型构建已获得吉林大学伦理委员会批准,遵循国家有关实验动物保护与使用准则。
1.2.2 心脏功能评价
第4周时,将小鼠麻醉后剔除胸部毛发,采用Philips SONOS 5500高效超声系统监测心脏功能。仰卧位固定小鼠,利用30 MHz高频探头,经胸骨旁长轴切面记录M型超声心动图像,测量心脏结构指标[左心室内径(LVID)]及功能指标[左室射血分数(LVEF)、左室短轴缩短率(LVFS)]。
1.2.3 苏木精.伊红(HE)染色
处死小鼠后,将部分心脏固定于10%甲醛中;经梯度乙醇脱水、二甲苯透明及石蜡包埋后制作为3 μm厚的石蜡切片,切片经纯乙醇脱水,再经二甲苯使切片透明;最后使用树胶及盖玻片固封、晾干。在光学显微镜下观察并拍照。
1.2.4 天狼星红染色
将上述石蜡切片滴加天狼星红饱和苦味酸水溶液进行染色。水洗、脱水后浸于二甲苯中使其透明;用中性树胶将切片固封、凉干。使用光学显微镜进行观察及拍照;采用Image J图像分析软件计算胶原面积占整个心肌面积的百分比。
1.2.5 蛋白免疫印记法
裂解样本得到蛋白质抽提物,定量蛋白后将蛋白通过十二烷基硫酸钠丙烯酰胺凝胶电泳(SDS.PAGE)分离后转EP到聚偏乙烯膜(PVDF)上,用10%的脱脂奶粉溶液封闭1 h后,分别使用抗Nrf2、Cleaved Caspase.3及CTGF和内参β.actin抗体4 ℃孵育过夜,置于二抗于室温孵育1 h。使用化学发光成像系统采集图像,图像处理分析软件(Image J)对各组小鼠心肌Nrf2和β.actin蛋白进行定量分析。
1.2.6 MDA含量检测
将1.2.5步骤中得到的浓度相同的蛋白稀释液试剂按照说明书加入干净的试管中混匀,使用保鲜膜扎紧试管口,用针头刺一小孔,95 ℃沸水浴40 min。冷却后离心,取上清液测试吸光度(532 nm处,1 cm光径,测试前用蒸馏水调零),确定MDA的表达(具体步骤按说明书进行)。
1.3 统计学处理
采用SPSS 19.0统计软件进行数据分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,采用方差分析;蛋白条带的灰度值采用Image J软件进行分析。以 P <0.05为差异有统计学意义。
2 结 果
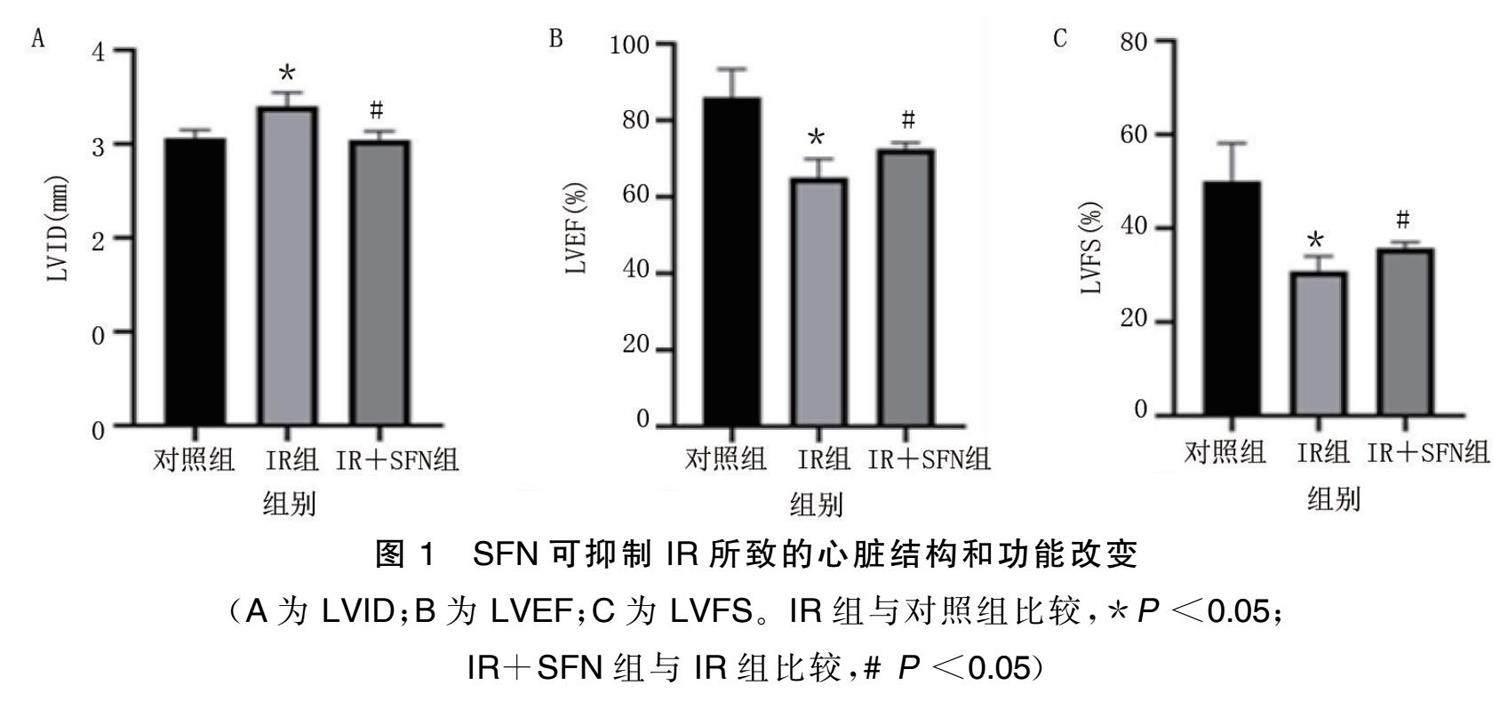
2.1 SFN可抑制IR所致的心脏结构和功能改变
给药第4周,与对照组比较,IR组收缩期及舒张期LVID增加,LVEF、LVFS降低( P <0.05);与IR组比较,IR+SFN组小鼠LVID减小,LVEF、LVFS增加( P <0.05)。详见图1。
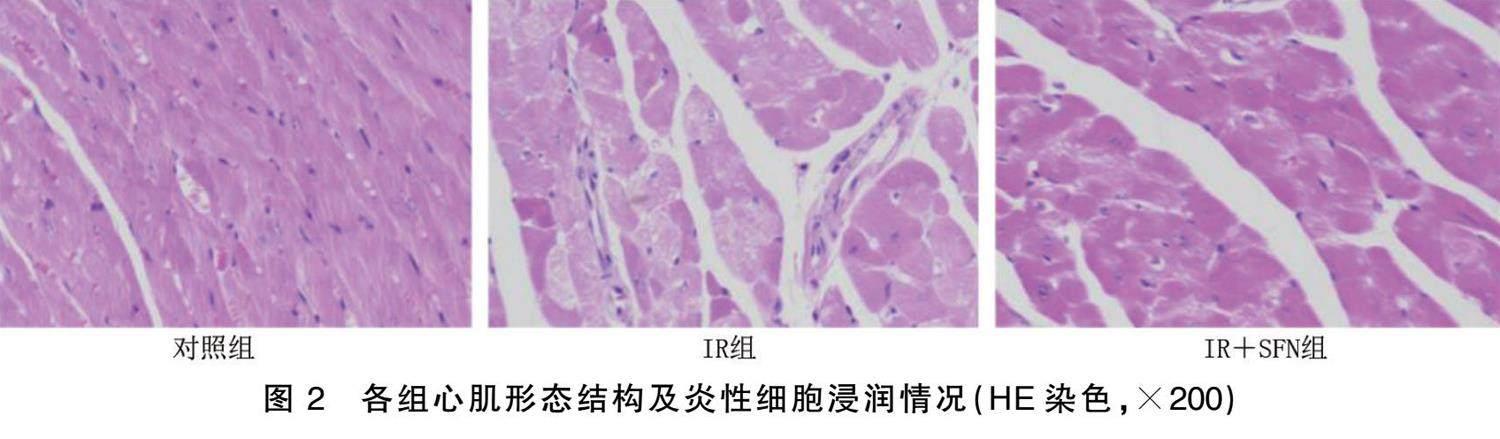
2.2 SFN可抑制IR导致的心肌结构紊乱
对照组心肌细胞结构完整、横纹清晰,细胞间质未见血管扩张及炎性细胞浸润;IR组可见心肌细胞结构紊乱,细胞外纤维成分增多,炎性细胞浸润;IR+SFN组心肌细胞结构基本规整,炎性细胞浸润程度有所减轻。详见图2。
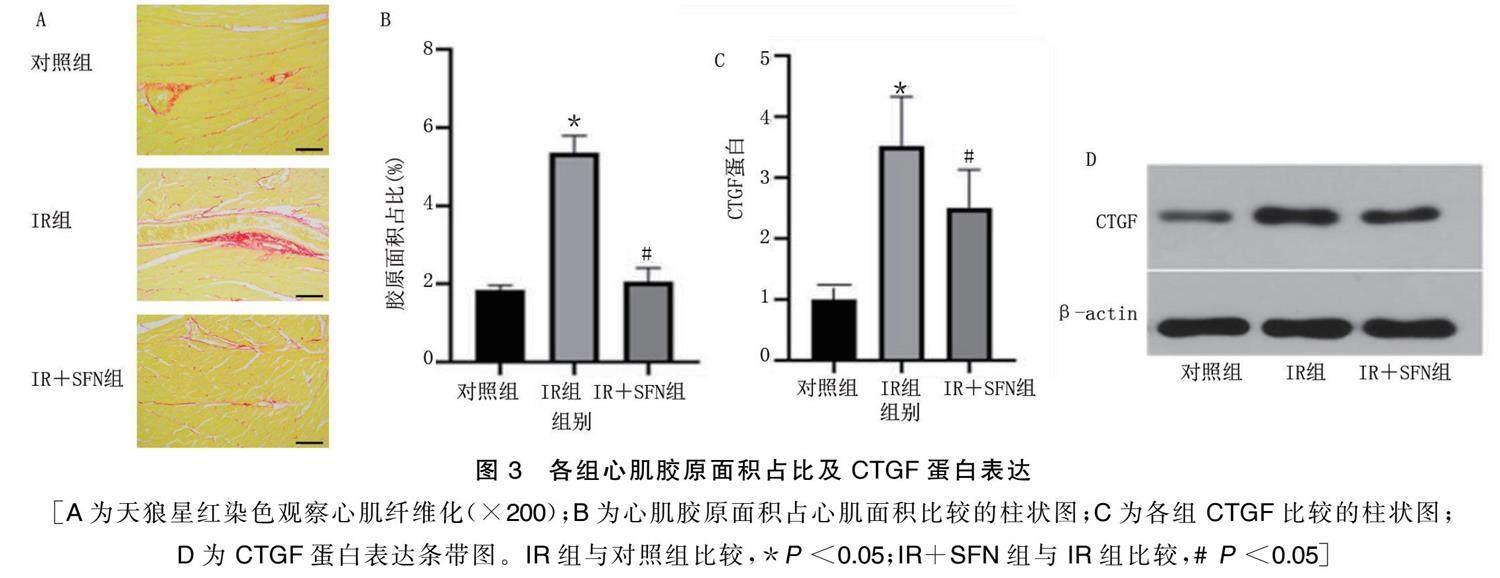
2.3 SFN可抑制IR导致的心肌纤维化
天狼星红染色显示:与对照组比较,IR组小鼠心肌组织血管周围及心肌间质可见胶原纤维沉积;与IR组小鼠比较,IR+SFN组心肌胶原组织沉积减轻。详见图3A、3B。与对照组比较,IR组心肌组织心肌纤维化特异性指标CTGF表达增高;与IR组比较,IR+SFN组CTGF表达下调( P <0.05)。详见图3C、3D。
2.4 SFN可抑制心肌细胞凋亡
与对照组比较,IR组Cleaved Caspase.3表达上调( P <0.05);与IR组比较,IR+SFN组心肌组织Cleaved Caspase.3表达下降( P <0.05)。详见图4。表明SFN干预可抑制IR引起的心肌细胞凋亡。
2.5 SFN可抑制IR导致的心肌脂质过氧化
与对照组比较,IR组心 肌组织MDA含量增加( P < 0.05);与IR组比较,IR+SFN组心肌组织MDA含量降低( P <0.05)。详见图5。表明SFN可抑制IR引起的心肌脂质过氧化。
2.6 SFN使心肌组织内Nrf2表达升高
与对照组比较,IR组Nrf2表达增加( P <0.05);与IR 组比较,IR+SFN组Nrf2进一步提高( P <0.05)。 详见图6。
3 讨 论
抗氧化剂是抵抗ROS损害的第一道防线,分为内源性抗氧化剂和外源性抗氧化剂,可抑制氧化应激反应,使细胞免受氧化损伤。外源性抗氧化剂由体外补充,内源性抗氧化剂多为酶抗氧化剂,由机体自行产生,因此,酶抗氧化剂的表达可被较多转录因子调控 [11] 。目前,针对RIHD防护剂的研究多集中于外源性抗氧化剂,虽然多数研究结果表明外源性抗氧化剂可减轻RIHD,因作用短暂及潜在的副作用使其未广泛应用于临床 [12.14] 。因此,调动内源性抗氧化系统以维持机体的抗氧化能力,减轻放射性心脏损伤可能是一种有效的治疗方法。
SFN是一种异硫氰酸酯类化合物,多从十字花科蔬菜中提取,是一种强效的Nrf2激活剂。Nrf2被SFN激活的经典方式是其Keap1 BTB区第151位半胱氨酸残基被SFN氧化修饰,使其与Nrf2解偶联,故稳定游离态的Nrf2在心肌细胞中上调 [9] 。多项研究表明,SFN可预防或抑制多种因素引起的氧化应激相关心脏损伤,广泛用于氧化应激相关心血管疾病的基础研究 [15.16] 。因此,SFN可能是一种强大有效的RIHD防护剂,对心脏的保护性作用亦可能与Nrf2的激活密切相关。
基于上述假设,本研究予以小鼠接受IR及SFN干预,并从分子、细胞、器官进行了相关分析。MDA含量是评估心肌脂质过氧化的重要指标,与IR组比较,IR+SFN组小鼠心肌细胞MDA表达降低,表明SFN的干预可抑制心肌脂质过氧化,降低氧化应激水平。其次,IR导致的氧化应激条件下心肌中过量ROS引起内质网应激及线粒体功能障碍,这是IR诱导心肌细胞凋亡的主要机制 [17.19] 。
Caspase家族的关键核心酶Caspase.3是心肌细胞凋亡的重要标志。本研究结果显示,IR+SNF组较IR组小鼠心肌组织内Cleaved Caspase.3表达明显下调,提示SFN可抑制IR引起的心肌细胞凋亡。ROS可上调CTGF表达,增加胶原的合成,促进心肌纤维化 [12] 。本研究结果显示,IR+SFN组心肌CTGF表达较IR组下调,天狼星红染色结果亦表明SFN干预后小鼠心肌胶原纤维沉积程度减轻,说明SFN可抑制IR引起的心肌纤维化。本研究应用超声心动图检查证实了SFN的干预可减轻心脏结构改变,心功能降低。可见,SFN对IR引起的心肌损伤有明确的保护作用,并减轻由此引起的心功能下降。本研究同时测定了各组小鼠心肌组织Nrf2表达,IR组较对照组Nrf2表达上调;接受SFN干预的小鼠心肌组织Nrf2表达较IR组进一步上调。认为小鼠接受IR暴露后Nrf2表达上调可能是由于心肌组织为抵抗氧化应激代偿性升高;在上述基础上,SFN干预将激活Nrf2,增强了心肌抗氧化能力,从而抑制IR引起的氧化应激,减轻心肌损伤。
综上所述,SFN对放射性心肌损伤有明确的保护性作用。该作用可能与上调心肌组织Nrf2的表达有关。SFN在体内心脏模型中展现出来的保护作用使 其成为RIHD持续、有效、无毒的保护策略提供了 依据。
参考文献:
[1] SLEZAK J, KURA B,BABAL P, et al .Potential markers and metabolic processes involved in the mechanism of radiation.induced heart injury[J].Canadian Journal of Physiology and Pharmacology,2017,95(10):1190.1203.
[2] DONNELLAN E, PHELAN D,MCCARTHY C P, et al .Radiation.induced heart disease:a practical guide to diagnosis and management[J].Cleveland Clinic Journal of Medicine,2016,83(12):914.922.
[3] WU S P, TAM M,VEGA R M, et al .Effect of breast irradiation on cardiac disease in women enrolled in BCIRG.001 at 10.year follow.up[J].International Journal of Radiation Oncology,Biology,Physics,2017,99(3):541.548.
[4] DESS R T, SUN Y L,MATUSZAK M M, et al .Cardiac events after radiation therapy:combined analysis of prospective multicenter trials for locally advanced non.small.cell lung cancer[J].Journal of Clinical Oncology,2017,35(13):1395.1402.
[5] WANG K, EBLAN M J,DEAL A M, et al .Cardiac toxicity after radiotherapy for stage Ⅲ non.small.cell lung cancer:pooled analysis of dose.escalation trials delivering 70 to 90 Gy[J].Journal of Clinical Oncology,2017,35(13):1387.1394.
[6] GIORDANO S H, KUO Y F,FREEMAN J L, et al .Risk of cardiac death after adjuvant radiotherapy for breast cancer[J].Journal of the National Cancer Institute,2005,97(6):419.424.
[7] ATKINS K M, RAWAL B,CHAUNZWA T L, et al .Cardiac radiation dose,cardiac disease,and mortality in patients with lung cancer[J].Journal of the American College of Cardiology,2019,73(23):2976.2987.
[8] ZHANG P, YANG P,HONG L, et al .Oxidative stress in radiation.induced cardiotoxicity[J].Oxidative Medicine and Cellular Longevity,2020,2020:3579143.
[9] ESFANDYARI S ,ALEYASIN A,NOROOZI Z, et al .The protective effect of sulforaphane against oxidative stress through activation of NRF2/ARE pathway in human granulosa cells[J].Cell Journal,2021,23(6):692.700.
[10] ZHOU S S, WANG J Q,YIN X, et al .Nrf2 expression and function,but not MT expression,is indispensable for sulforaphane.mediated protection against intermittent hypoxia.induced cardiomyopathy in mice[J].Redox Biology,2018,19:11.21.
[11] VOROTNIKOVA E, ROSENTHAL R A,TRIES M, et al .Novel synthetic SOD/catalase mimetics can mitigate capillary endothelial cell apoptosis caused by ionizing radiation[J].Radiation Research,2010,173(6):748.759.
[12] SLEZAK J, KURA B,RAVINGEROVT, et al .Mechanisms of cardiac radiation injury and potential preventive approaches[J].Canadian Journal of Physiology and Pharmacology,2015,93(9):737.753.
[13] SRIDHARAN V, TRIPATHI P,AYKIN.BURNS N, et al .A tocotrienol.enriched formulation protects against radiation.induced changes in cardiac mitochondria without modifying late cardiac function or structure[J].Radiation Research,2015,183(3):357.366.
[14] FAN Z G ,HAN Y,YE Y P, et al .L.carnitine preserves cardiac function by activating p38 MAPK/Nrf2 signalling in hearts exposed to irradiation[J].European Journal of Pharmacology,2017,804:7.12.
[15] GU J L, YAN X Q,DAI X Z, et al .Metallothionein preserves Akt2 activity and cardiac function via inhibiting TRB3 in diabetic hearts[J].Diabetes,2018,67(3):507.517.
[16] BAI Y, WANG X L,ZHAO S, et al .Sulforaphane protects against cardiovascular disease via Nrf2 activation[J].Oxidative Medicine and Cellular Longevity,2015,2015:407580.
[17] YAMAMORI T, YASUI H,YAMAZUMI M, et al .Ionizing radiation induces mitochondrial reactive oxygen species production accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint[J].Free Radical Biology & Medicine,2012,53(2):260.270.
[18] LEACH J K, VAN TUYLE G,LIN P S, et al .Ionizing radiation.induced,mitochondria.dependent generation of reactive oxygen/nitrogen[J].Cancer Research,2001,61(10):3894.3901.
[19] SALATA C, FERREIRA.MACHADO S C,DE ANDRADE C B V, et al . Apoptosis induction of cardiomyocytes and subsequent fibrosis after irradiation and neoadjuvant chemotherapy[J].International Journal of Radiation Biology,2014,90(4):284.290.
(收稿日期:2023.02.07)
(本文编辑 薛妮)

