米老排优树组培技术体系优化研究





收稿日期Received:2023-03-06""" 修回日期Accepted:2023-04-25
基金项目:广东省林业科技创新项目(2023KJCX002)。
第一作者:孙旭高(sunxugao1998@163.com)。
*通信作者:邓小梅(dxmei2006@scau.edu.cn),教授。
引文格式:
孙旭高,陶家璐,谢微,等. 米老排优树组培技术体系优化研究. 南京林业大学学报(自然科学版),2024,48(2):69-78.
SUN X G, TAO J L, XIE W, et al. Optimization of the tissue culture technology system of Mytilaria laosensis" trees. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(2):69-78.
DOI:10.12302/j.issn.1000-2006.202303008.
摘要:【目的】建立米老排(Mytilaria laosensis)优良单株组培再生体系,为今后其无性化推广提供技术支撑。【方法】以米老排优树基部半木质化萌芽为外植体,采用丛芽发生途径,通过初代腋芽诱导、继代增殖培养、生根培养等过程,研究筛选最适的外植体采集时间、继代及生根培养的基本培养基以及植物生长调节剂的种类及浓度配比等。【结果】10月采集的外植体诱导效果最好,存活率为32.38%;米老排腋芽诱导最适配方为MS+6-BA 0.5 mg/L+NAA 0.02 mg/L,诱导率为100%,萌发时间为4.07 d;最适增殖培养基为MX(改良WPM)+6-BA 1.0 mg/L+NAA 0.05 mg/L,增殖系数达4.94,芽生长旺盛;最适生根培养基为MX + NAA 0.3 mg/L,生根率100%,平均根数13.18,根生长健壮,移栽成活率可达92.3%。【结论】米老排外植体诱导成活率与取材地点、时间相关,广东地区10月的米老排外植体材料最佳;在使用MS基本培养基增殖系数低的情况下,改用MX(改良WPM)培养基能够显著提高米老排增殖继代倍数;本研究还对米老排诱导培养基、增殖培养基、生根培养基进行了优化,有助于建立米老排优树组培体系,有效提高组培质量和效率。
关键词:米老排;基本培养基;丛生芽;组织培养
中图分类号:S722.3+7""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)02-0069-10
Optimization of the tissue culture technology system of Mytilaria laosensis trees
SUN Xugao, TAO Jialu, XIE Wei, SHI Jie, ZHANG Baojin, DENG Xiaomei*
(College of Forestry and Landscape Architectural, Guangdong Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm, South China Agricultural University, Guangzhou 510642, China)
Abstract: 【Objective】Mytilaria laosensis" is an evergreen, broad-leaved tree with a wide range of suitable habitats and good economic and ecological protection. The seedling is mostly used for cultivation. Grafting and cutting techniques are still experimental, and few reports on tissue culture techniques exist. Therefore, it is of great significance to establish an efficient tissue culture technology system for M. laosensis and to provide technical support for promoting its clone in the future. 【Method】With the semi-lignified bud at the base of the superior tree as explants, through the processes of primary axillary bud induction, secondary proliferation culture, rooting culture, the optimal explant collection time, the basic breeding and rooting culture medium, and the type and concentration ratio of plant growth regulator were studied. 【Result】There were significant differences in the effect of different sampling times on the induction of M. laosensis. The best induction of explants was collected in October 2022, with a survival rate of 32.38%. Treatment with different hormone concentrations significantly affected the time required for bud germination and the growth status of explants. The optimal formula for axillary bud induction was MS+6-BA 0.5 mg/L+NAA 0.02 mg/L, the induction rate was 100%, and the germination time was 4.07 d. The selection of different basic mediums significantly affected the proliferation of M. laosensis. MX medium had the highest average shoot length (4.47 cm) and the largest proliferation coefficient (4.41), respectively, which were significantly higher than those of other basic media (1/2 MS, MS, DKW, WPM), and the proliferation buds grew strongly, increased quickly and had a good effect. Different hormone types and treatment concentrations significantly affected the proliferation and rooting effects of M. laosensis. The optimal breeding medium was MX (modified WPM) + 6-BA 1.0 mg/L+NAA 0.05 mg/L, and the proliferation coefficient reached 4.94. The buds grow vigorously. The optimal rooting medium was MX+NAA 0.3 mg/L, the rooting rate was 100%, the average root number was 13.18, root growth was robust, and the transplanting survival rate reached 92.3%. 【Conclusion】The induction survival rate of M. laosensis explants was related to the location and time of material collection. October was the best time to collect explant material in Guangdong. In the case of a low proliferation coefficient of the MS basic medium, switching to an MX (modified WPM) medium could significantly increase the proliferation succession factor. Then, the induction medium, breeding medium, and rooting medium were optimized, which helped establish the tissue culture system of the superior tree of M. laosensis and improved the quality and efficiency of the tissue culture.
Keywords:Mytilaria laosensis; basal medium; multiple shoots; tissue culture
米老排(Mytilaria laosensis),又名壳菜果、山桐油,为金缕梅科(Hamamelidaceae)壳菜果属(Mytilaria)的常绿阔叶乔木,其适生范围广,喜温湿气候,有一定耐寒能力,是我国南方珍贵的乡土阔叶树种。其更新萌蘖能力强,具涵养水源、改良土壤等功能,是良好的生态防护树种,同时还具较强的防火性能,可作为防火林带种植;米老排干形通直,材质美观,强度高,是制作家具、板材的重要原料;且米老排枝叶繁茂,叶大肥厚,不仅易形成较厚的林地腐殖质层,提高土壤肥力,还富有营养,可满足动物生长发育所需,是一种颇具潜力的木本饲料。由于米老排的优良特性及广泛用途,其在我国云南、广东、广西、福建、江西等地的速生丰产林和生态公益林等应用中得到推广。
目前米老排人工造林大多采用种子实生苗进行,而米老排种子内源激素含量少,自然状态下萌发率低,催芽时间长,成本极大,严重影响造林效率,且使用来自不同种源的种子容易产生遗传变异,导致米老排林分分化大,林相参差不齐,影响造林质量及效益;虽然采用无性繁殖能克服种子繁殖的缺点,但目前米老排的嫁接和扦插技术尚未取得突破,且关于米老排的组织培养技术报道甚少,其中组培所用母本材料为3~5年生幼林中的单株,不是经过长期选择的成年优树,同时组培过程中还存在诱导污染率高,增殖率低,增殖周期长,增殖苗质量差,增殖苗生根率较低等不足,导致组培速度慢、成本高,难以实现规模化。
因此本研究选择米老排成年优良单株为母本,以基部萌枝为外植体,通过基本培养基设计、激素种类、浓度及其配比的优化,旨在建立其高效的离体植株再生技术,达到增殖芽健壮生长,增殖率、生根率、移栽成活率均高等目的。通过规模化育苗进行无性系推广,为我国米老排人工林栽培所需优质种苗的繁殖提供技术支撑,对提升米老排人工林经济效益有重大意义。
1" 材料与方法
1.1" 供试材料
试验材料为广东韶关乐昌龙山林场12年生米老排人工林优良单株。外植体选取优树基部生长健壮、无病害的半木质化枝条的萌芽,将其诱导后获得的米老排组培苗作为试验材料。
1.2" 实验方法
1.2.1" 启动培养
1)外植体采集与表面消毒。分别于2022年的1、4、7、10月,选择天气晴朗的9:30—10:30,采集米老排新萌发的半木质化嫩枝,剪去部分叶片,并用吸水棉将枝条基部包裹保湿带回实验室。剪去外植体上所有叶片,用体积分数5%洗洁精溶液浸泡5 min,并用软毛刷清洗叶腋,后用流水冲洗3 h。在超净工作台中,根据枝条老嫩程度的差异选择不同时长进行灭菌,分为顶芽、第2、3节、中间段、基部4部分;先用体积分数75%酒精灭菌1~3 min,无菌水清洗1次;后用质量分数0.1% HgCl2溶液(加入吐温1~2滴)灭菌3~10 min,灭菌过程放入摇床振荡,最后用无菌水清洗5次。灭菌后迅速接种于诱导培养基中。
2)诱导培养基的筛选。经过表面消毒灭菌后,将外植体剪成若干带1个腋芽或顶芽的茎段,接种于不同诱导培养基以进行诱导。本试验以MS为基本培养基,添加不同质量浓度的6-BA、NAA,共5个处理(表1)。
每瓶接种1个茎段,每个诱导处理及对照组接种30瓶,重复3次。试验期间观察外植体的腋芽萌发、生长及污染情况,接种后30 d统计诱导率、褐化率及污染率。
1.2.2" 增殖培养基的筛选
1)基本培养基的筛选。将组培苗切去下端愈伤组织和上端嫩芽部分,再切成1.0~1.5 cm的单芽茎段,转接于1/2MS、MS、DKW(B5)、WPM、MX(表2)的基本培养基(均添加6-BA 0.5 mg/L+NAA 0.1 mg/L)进行增殖培养。试验共5个处理,每个处理接种20个茎段,重复3次。培养30 d后统计增殖系数并观察记录增殖苗生长情况。
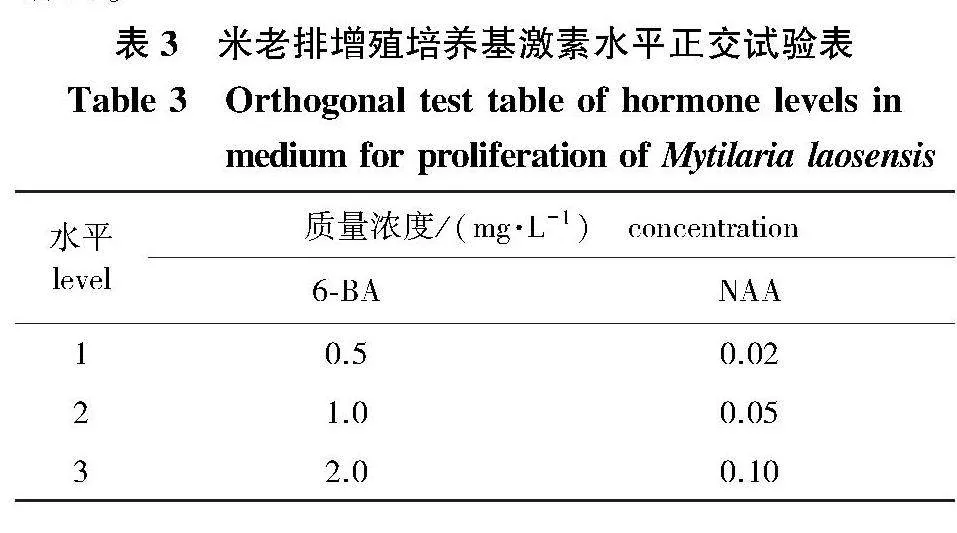
2)植物生长调节剂水平及配比的筛选。以MX为基本培养基,设置6-BA(0.5、1.0、2.0 mg/L)、NAA(0.02、0.05、0.1 mg/L)2因素3水平共9个不同浓度配比处理的正交实验(表3)。每个处理6瓶,每瓶接种5个茎段,重复3次。培养30 d后统计增殖系数(培养30 d后的总芽数与接种时的芽数之比值),并观察记录增殖苗的生长情况。
1.2.3" 生根培养基的筛选
选取苗高2 cm、生长健壮的继代苗,以MX作为基本培养基, 添加不同质量浓度(0.1、0.2、0.3、0.4、0.5 mg/L)的NAA进行生根培养。每个浓度接种15瓶, 每瓶接种6株,重复3次。培养20 d统计生根率(生根苗数占接种苗数的百分比)和生根系数(生根总数与接种苗数之比值)。
1.2.4" 培养条件
以上培养基均添加卡拉胶9.0 g/L,蔗糖30 g/L(生根培养基添加蔗糖15 g/L),pH均调至5.8~6.0,于高压蒸汽灭菌锅121 ℃温度下灭菌1 100 s;组培试验在华南农业大学林学与风景园林学院组培实验室进行,培养温度(25±2) ℃,光照度1 500~2 000 lx,光照时间12 h/d。
1.2.5" 炼苗与移栽
生根培养20 d,移至温室炼苗5~7 d后将生根苗取出,用流水洗净根部培养基, 移入已消毒处理的泥炭土和珍珠岩(体积比为3∶1)的混合基质中, 覆膜并加盖遮阳网,保持相对湿度80%~90%,温度25 ℃左右,30 d后统计移栽成活率。
1.3" 数据分析
统计外植体污染率、存活率、腋芽诱导率、生长状况、增殖系数、生根率、诱导根长度、根条数等数据。使用Excel 2016、SPSS 26.0对数据进行统计分析。
2" 结果与分析
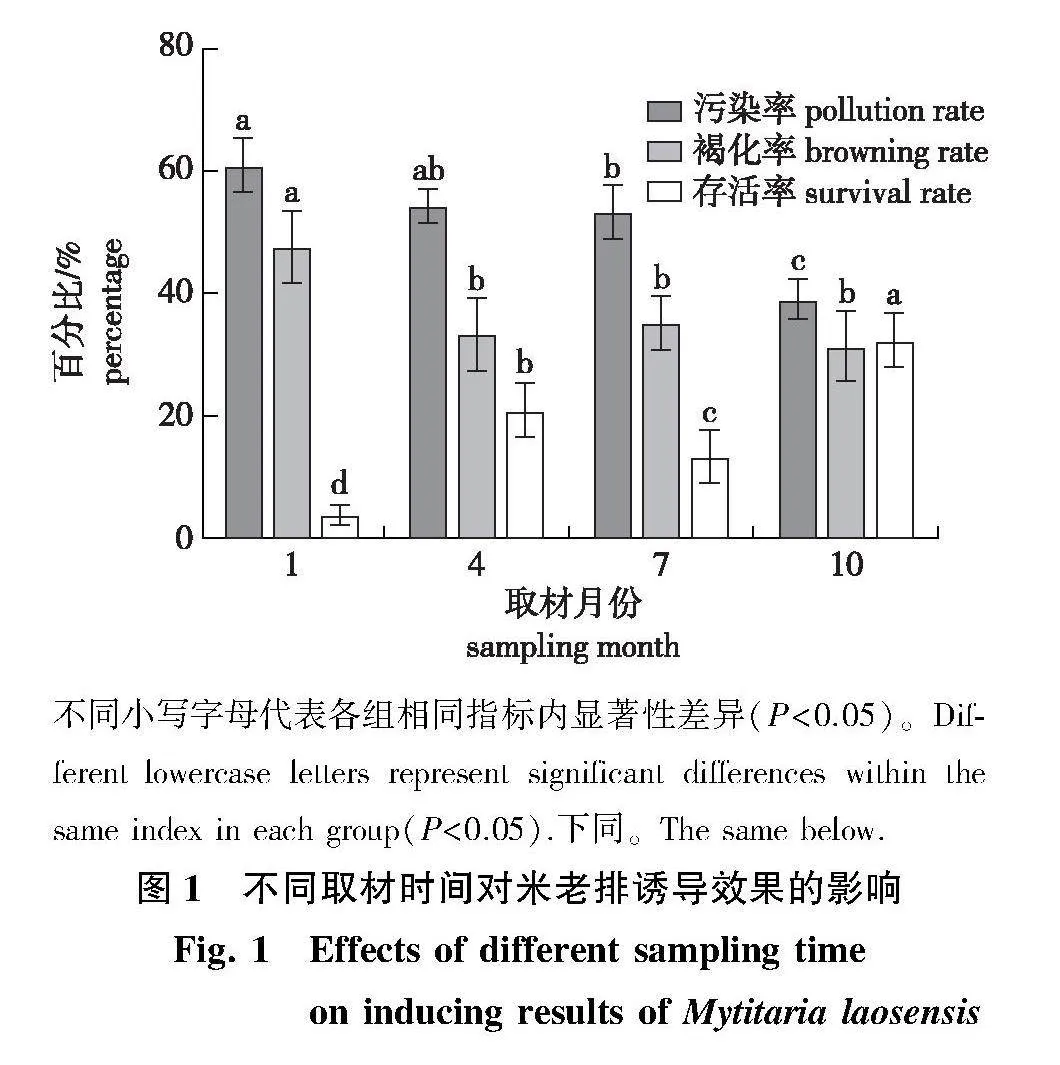
2.1" 不同取材时间对米老排诱导效果的影响
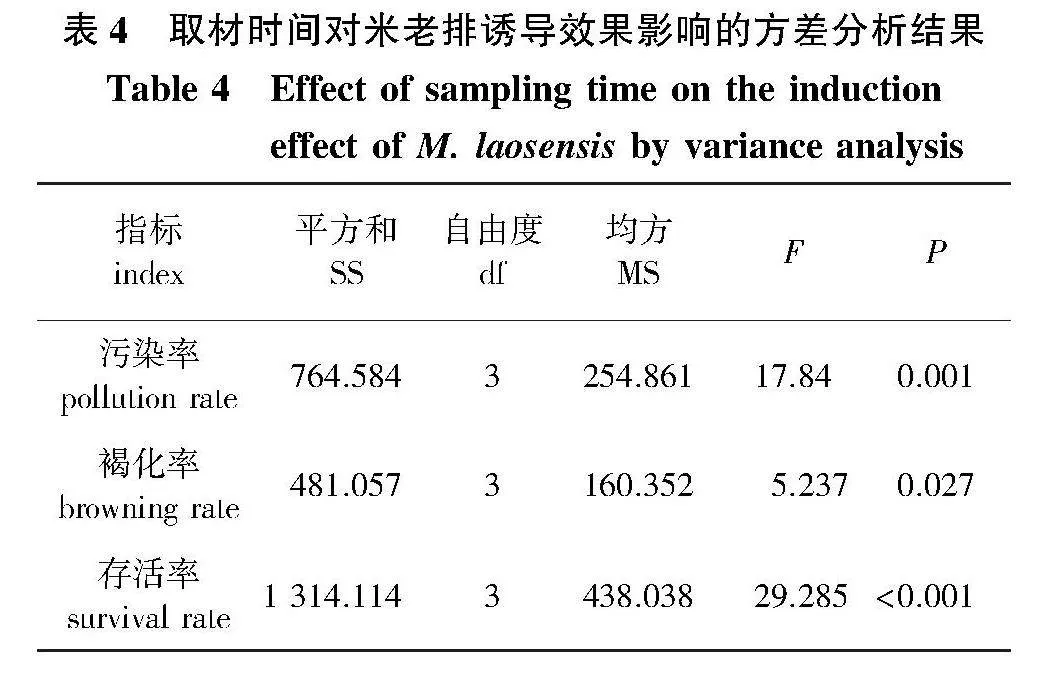
取材时间对米老排外植体诱导效果影响结果的方差分析显示,不同取材时间对外植体诱导的污染率、褐化率和存活率存在显著性差异(Plt;0.05)(表4)。
不同小写字母代表各组相同指标内显著性差异(Plt;0.05)。Different lowercase letters represent significant differences within the same index in each group(Plt;0.05).下同。The same below.
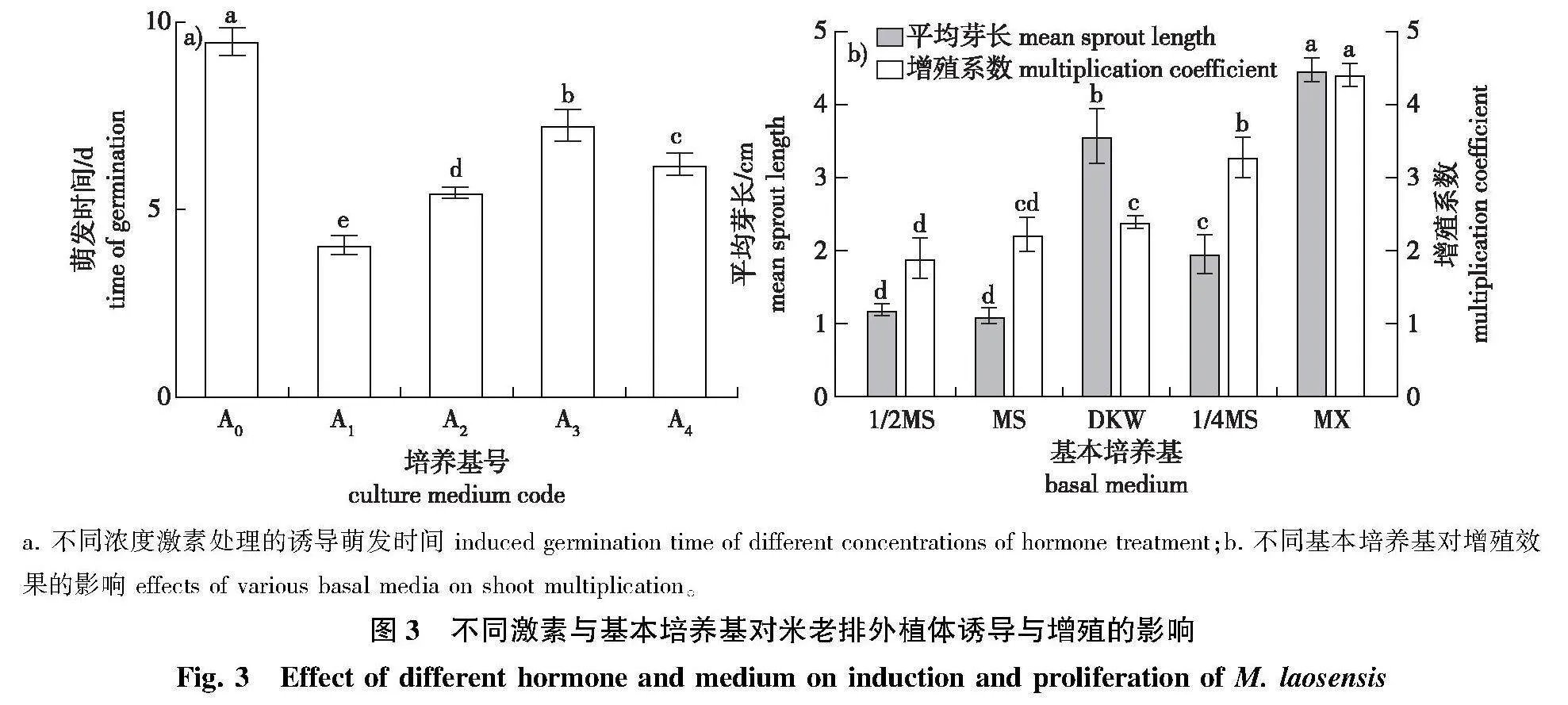
各月取材诱导的结果(图1)显示:1月取材诱导的污染率、褐化率分别为60.95%、47.62%,显著高于其他月份取材(Plt;0.05);污染率随着取材时间的推移而降低,10月取材的污染率为39.05%,显著低于其他月份取材(Plt;0.05)。4、7、10月取材诱导褐化率相近,分别为33.33%、35.24%、31.43%;各月份取材的存活率存在显著差异(Plt;0.05),从大到小依次为10月gt;4月gt;7月gt;1月(图2a);综上各指标,10月取材诱导效果最佳(图2b),4月次之。
2.2" 腋芽诱导
诱导结果显示所有激素组合处理均能诱导米老排外植体萌发新芽,且诱导率均达100%,但不同激素浓度处理对外植体芽萌动所需的时间(图3a)和生长状况存在显著影响(Plt;0.05)。
其中,在不添加任何激素的A0培养基中诱导,芽萌发所需时间最长(Plt;0.05),为9.50 d,苗长势不良(表5);使用6-BA 0.5 mg/L + NAA 0.02 mg/L的培养基(A1),萌发时间最短(Plt;0.05),为4.07 d,显著小于其他处理结果,且生长情况最好;而A2—A4诱导萌发时间分别为5.47、7.20、6.23 d,显著增加(Plt;0.05),同时基部开始出现愈伤组织(表5)。综合萌发时间和生长情况的诱导培养基次序为A1lt;A2lt;A4lt;A3lt;A0。
2.3" 基本培养基对米老排增殖效果的影响
将诱导出的米老排腋芽连续在诱导培养基上继代,腋芽分化成丛生芽,丛生芽不断分化出新的腋芽(图2c),但随着继代次数的增加,新芽变小,增殖系数虽高,但芽细小,生长缓慢,节间短,有效芽数少(图2d)。在连续诱导培养3~4代后,部分增殖芽甚至出现死亡的情况。故推测MS基本培养基不适合米老排的增殖培养。
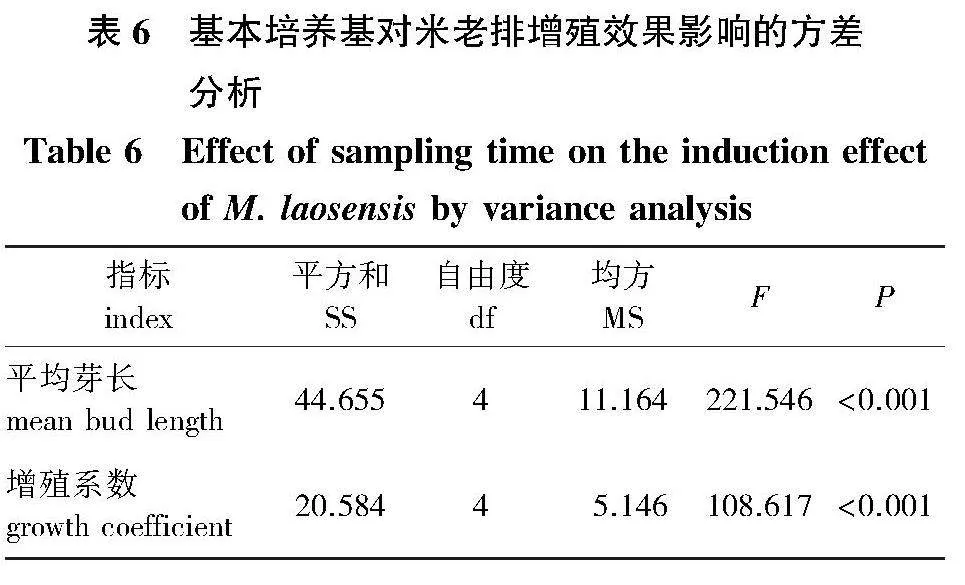
分别以1/2 MS、MS、DKW、WPM(1/4MS)、MX(改良WPM)为基本培养基进行米老排增殖试验。基本培养基对米老排增殖效果影响结果的方差分析(表6)表明,不同基本培养基类型对米老排增殖的平均芽长和增殖系数均有极显著影响(Plt;0.001)。
试验结果所示,以1/2 MS为基本培养基进行增殖,腋芽平均芽长和增殖系数分别为1.20 cm和1.90,与MS相近,增殖效果差(图3b);DKW增殖的平均芽长3.57 cm,显著高于MS(Plt;0.05),但增殖系数仅2.40,长势一般,增殖效果优化不佳(表7);1/4 MS的增殖系数为3.28,显著优于前3组处理(Plt;0.05),但平均芽长为1.96 cm,显著低于DKW(Plt;0.05),且叶片颜色黄绿,增殖优化效果同样不全面;而以MX增殖培养的增殖芽平均芽长最高,增殖系数最大,分别为4.47 cm和4.41,均显著高于其他基本培养基,且增殖芽生长旺盛,增殖速度快,效果好。对比各基本培养基增殖的平均芽长、增殖系数和生长情况来看,MX最适宜作为米老排增殖的基本培养基,增殖效果最佳。
2.4" 6-BA和NAA对米老排丛生芽增殖的影响
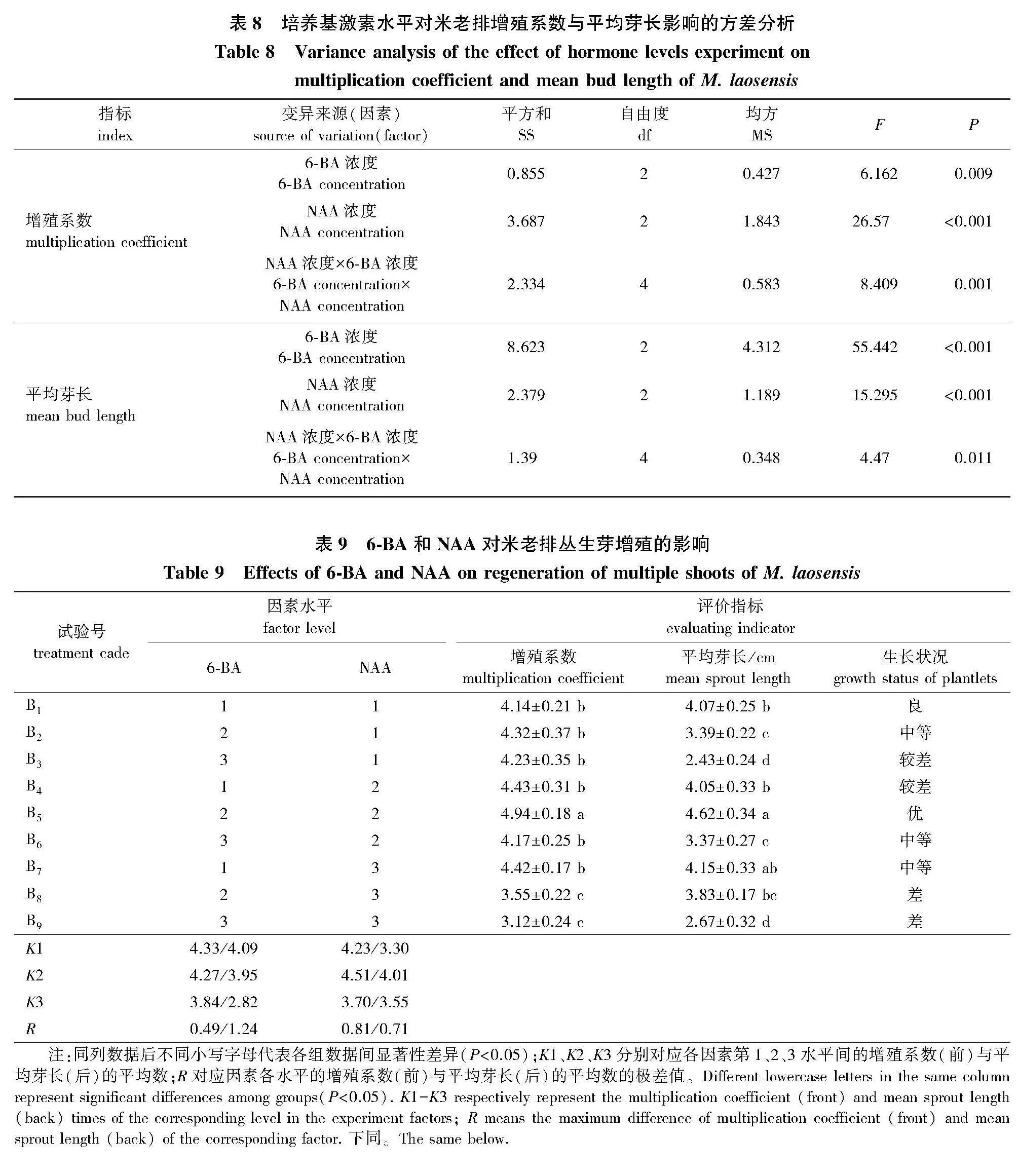
不同激素种类及使用浓度对米老排增殖效果影响试验结果的方差分析结果(表8)可知,不同6-BA、NAA浓度以及双激素的交互作用对米老排丛生芽的增殖系数和平均芽长均有显著影响。均为影响米老排丛生芽增殖的主要因素(Plt;0.05)。
试验方差分析中极差(R)分析结果见表9。
表9显示,6-BA、NAA对米老排增殖的影响程度不同,NAA对米老排增殖系数的影响程度大于6-BA,而对平均芽长的影响小于6-BA。各处理增殖指标显著性差异和多重比较结果表明:当添加6-BA 0.5 mg/L+NAA 0.02 mg/L(B1)时,米老排丛芽生长较好(图2e),但增殖系数和平均芽长分别为4.14和4.07 cm,仍有优化空间;B5的米老排增殖系数和平均芽长分别为4.94和4.62 cm,均显著高于其他处理(Plt;0.05),生长情况最佳(图2f);当添加6-BA 2.0 mg/L(B3、B6、B9)时,丛生芽增殖系数下降,有效芽数目减少,芽苗质量下降,植株出现玻璃化现象(图2g),特别是同时添加NAA 0.1 mg/L的B9处理,其增殖系数、平均芽长分别为3.12和2.67 cm,均显著低于其他处理(Plt;0.05),长势最差。
2.5" 生根培养基及移栽
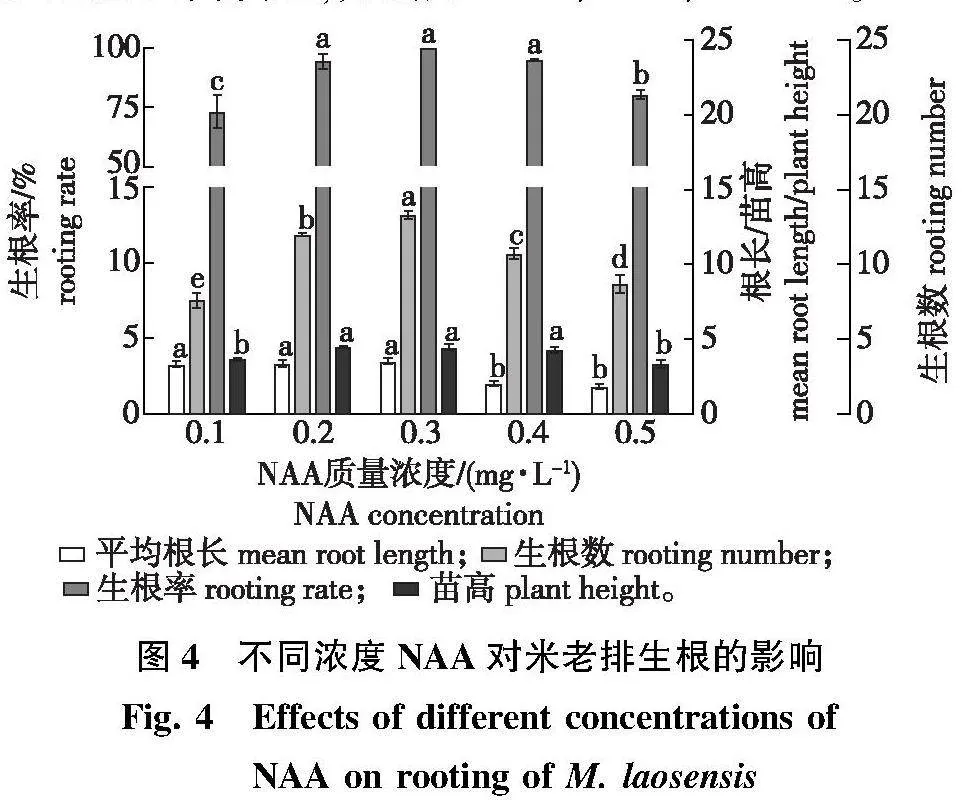
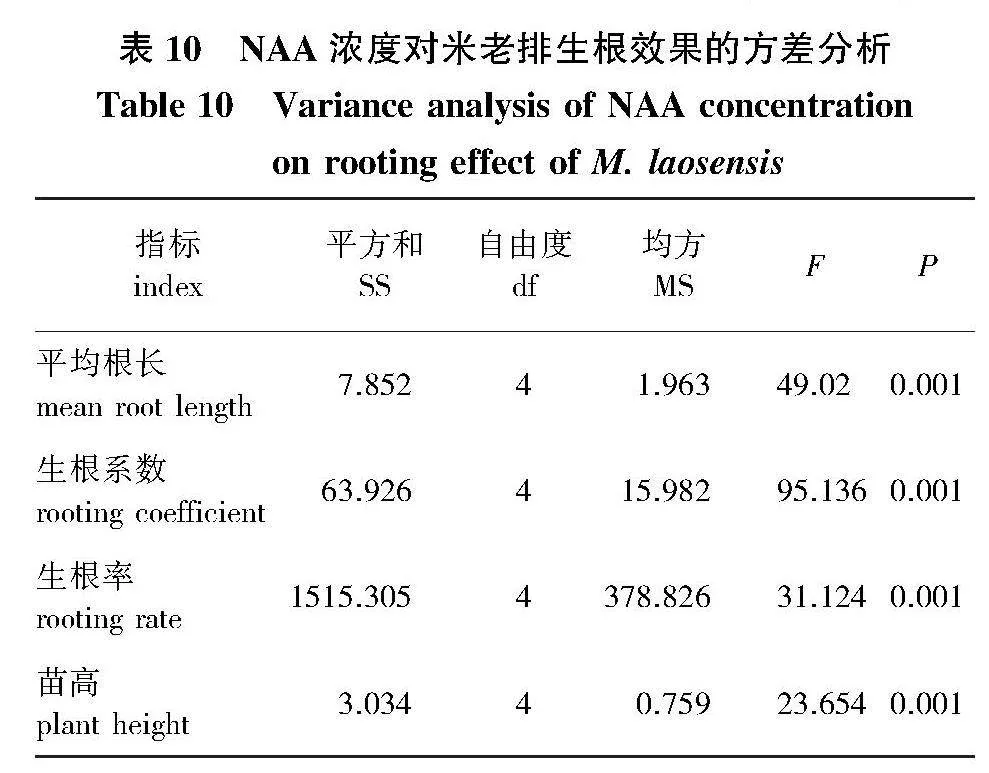
将生长健壮、芽高在1.5~2.0 cm的继代单芽切下,接入以MX作为基本培养基,并添加不同浓度梯度的NAA生根培养基中,平均培养5~6 d后开始生根。生根试验的方差分析结果(表10)表明,不同浓度NAA对米老排的平均根长、生根系数、生根率、生根苗高均具有显著影响(Plt;0.05)。
相同指标进行对比(图4)显示:平均根长在NAA质量浓度为0.4、0.5 mg/L时下降,分别为2.04、1.82 cm,显著低于0.1~0.3 mg/L的平均根长(分别为3.29、3.38、3.50 cm)(Plt;0.05);平均根数随NAA浓度的增加出现先升高后降低的现象,并在浓度为0.3 mg/L时最高13.18,显著高于其他浓度水平(Plt;0.05),同时植株根系发达,叶色翠绿,芽伸长生长快(图2h、2i),而NAA质量浓度达0.5 mg/L时,生根苗基部出现大块愈伤组织;NAA质量浓度在0.1、0.5 mg/L的生根率分别为73.29%、80.39%,均显著低于其他浓度水平(Plt;0.05),且当质量浓度为0.3 mg/L时,生根率达100%;生根苗高在NAA质量浓度0.1、0.5 mg/L时显著低于其他浓度水平(Plt;0.05),0.2、0.3、0.4 mg/L NAA处理的苗高接近,分别为4.43、4.44、4.29 cm。
生根培养20 d后将生根瓶苗移到温室中炼苗5~7 d,然后将组培瓶盖从半开到全开炼苗1 d,将组培苗取出,洗净根部残留的培养基,移栽到泥炭土和珍珠岩(体积比为3∶1)的混合基质上,前20 d采用盖膜保湿,后揭开薄膜按常规幼苗管理。移栽成活率为92.3%,植株生长旺盛(图2j)。
3" 讨" 论
不同植物在各个季节的生长情况,不同季节外植体生理代谢情况以及外植体材料表面携带病菌情况都是影响外植体诱导成功率的关键因素,所以在适宜的季节采集合适的外植体,可以有效减少污染、褐化的发生,如:异叶南洋杉(Araucaria heterophylla)最佳取材时节为春末夏初,此时利于不定芽的形成,而秋冬季不定芽数量少,长势弱,易褐化;徐南翔从桉树离体培养试验中得出3—5月取的外植体比下半年取的外植体污染少,且褐化率低的结论;胡计红等研究锦绣杜鹃(Rhododendron×pulchrum )古树组培快繁时,发现5月中旬取材,诱导成功率最高。本研究对象米老排的生长季节性变化较大,冬春季生长量较低,夏秋季生长旺盛,月平均生长出现2次高峰,分别在5月和9月,而广东6—8月盛夏属高温多雨季节,林木生长处于相对低谷期。取材诱导实验表明取材当月气候及米老排生长情况与诱导情况息息相关,随取材时间的推移先升高后降低再升高,结果显示广东地区冬季1月取材诱导情况最差,该阶段米老排的幼芽正处于休眠时期,生长势弱,对诱导反应迟钝,诱导期长,同时外植体老,内含物及带菌多等因素共同导致诱导死亡率、污染率居高;4月天气回暖,米老排新茎、芽长势逐渐恢复,枝条幼嫩,内含物少,诱导效果好转;而7月进入夏季,华南地区高温多雨,气候环境适合细菌霉菌生长,且米老排受高温影响生长放缓,外植体内酚类物质积累,多酚氧化酶活性增强,导致外植体易褐化且存活率低,此时不宜采样诱导;10月广东地区温度适宜,伴有台风,水热条件良好,同时米老排生长迎来2次高峰,其外植体幼嫩,带病菌少,幼芽生长旺盛,此时取材诱导效果最好,更有利于米老排外植体的无菌系建立。同样,李清香等在树型金银花(Lonicera japonica )外植体诱导试验和番木瓜(Carica papaya)组培研究中均发现秋季外植体诱导的萌芽率最高,更适合组培诱导。
同一品种不同基因型,甚至同一植株不同部位对生长所需的营养成分存在不同要求,所以外植体诱导完成后,接种到合适的基本培养基是外植体能否顺利增殖的关键。基本培养基不仅影响植株的有效芽率和平均芽长,在植物组培研究中已有数十种组分各异的基本培养基配方得到应用,根据不同材料的需要,常使用MS、1/2 MS、N6、DKW(B5)、WPM(1/4MS)等作为基本培养基,MS培养基源于对White培养基的改良,是目前使用最广泛的基本培养基,适合大部分植物生长,最初用于烟草(Nicotiana tabacum)愈伤组织培养;而DKW和WPM培养基适合一般木本植物生长。本试验选用MS对米老排进行继代培养时,新芽细小,生长慢,节间短,有效芽数少,且3~4代后,部分增殖芽出现死亡现象。裘珍飞等在以MS作为米老排基本培养基进行增殖培养时也存在株高生长缓慢的现象。因此,选择合适的基本培养基对植物组织培养至关重要。在本研究中,对各类基本培养基筛选试验对比,MX(改良WPM)培养基,各项指标均显著优其他基本培养基,生长状况最佳。
组培增殖过程中,细胞分裂素与生长素的比值决定了芽和根的分化,其中细胞分裂素在芽的增殖和生长中起决定性作用。6-BA是组织培养中常用的细胞分裂素类物质,主要是促进细胞分裂和分化,诱导胚状体和不定芽的形成和增殖。现报道的米老排芽增殖试验中发现添加1.0 mg/L的6-BA效果最好。而适量浓度生长素NAA的加入,能够促进不定芽和侧芽的萌发并促进茎的伸长。饶丹丹等在紫叶紫薇(Lagerstroemia indica)继代增殖试验中,添加NAA 0.25 mg/L得到的幼芽增殖系数最高,增殖芽健壮。本研究增殖试验中,添加6-BA 1.0 mg/L+NAA 0.05 mg/L进行增殖时,丛芽增殖系数、平均芽长最高,分别为4.94、4.62 cm,均高于其他激素浓度组合的数据,增殖优化效果最好,且植株生长旺盛,叶色翠绿,有效芽多,生长状况最佳。试验发现,细胞分裂素与生长素的比值较大,且激素浓度过高时,增殖植株出现玻璃化现象。玻璃化是植物组织培养中普遍发生的一种生理失调或生理病变,将导致叶片半透明鲜绿水渍状,伴随卷曲或肿胀,变得脆弱易碎,难以恢复正常,进而影响分化和生根,严重影响组培快繁体系的稳定性。高英等在天津野生山樱花(Cerasus serrulate)茎段增殖时使用6-BA出现了不同程度的组培苗玻璃化现象,最高可达87%。可见适宜质量浓度的细胞分裂素6-BA和生长素NAA配合使用,对米老排丛生芽的增殖才更有效,而过高浓度的激素会适得其反,该结论在西瓜(Citrullus lanatus)、桑树(Morus alba)、尾巨桉(Eucalyptus urophylla × E. grandis)、杨树(Populus sp.)等植物中均有此规律。因此,找到米老排增殖培养基中细胞分裂素与生长素的最佳配比,既能保证最好的增殖效果,又能在米老排规模化生产中节约资源,降低成本。
不定根的形成是组培过程中一个非常关键的环节,直接影响到组培苗移栽成活率的高低,关系到组培的成败。生长素NAA等是植物不定根诱导过程中是最常用的激素,使形成层薄壁细胞恢复分裂机能、刺激愈伤组织细胞的分裂与分化、诱导根原基的发生,从而促进根的形成。NAA浓度与组培苗幼根的生长发育密切相关,本研究生根试验发现生根率随着生长素浓度的升高而增加,但高浓度的生长素对生根也有抑制作用,当添加NAA 0.3 mg/L时,平均根数最多为13.18,生根率100%,幼苗根系发达粗壮;而NAA浓度过高会降低生根率,并且诱导愈伤组织的形成,与Park等研究结论相同。为了避免生根过程中愈伤组织的产生,可在生根培养基中添加活性炭,吸附部分生长素,以降低高浓度NAA的抑制效果。此外,本试验所得生根效果是自米老排组培快繁报道以来最佳的,并在单激素生根培养基配方中取得重大突破,可进一步简化米老排工厂化育苗生根培养基的配制步骤。
通过研究米老排外植体取材时间的选择、诱导培养基的优化、增殖培养基的筛选、生根培养基的改良和移栽生根苗,最终实现了米老排离体再生和组培快繁。其中一系列的试验确定米老排外植体的最佳取材时间为10月;最适诱导培养基配方为MS+6-BA 0.5 mg/L+NAA 0.02 mg/L;最适增殖培养基为 MX (改良WPM)+ 6-BA 1.0mg/L + NAA 0.05 mg/L;最适宜生根的培养基配方为MX (改良WPM)+NAA 0.3 mg/L。本研究为米老排工厂化育苗提供了理论基础,一定程度上缩短了组培生产周期,且繁殖系数高,组培苗后代品质好,成活率高,并为其他物种利用器官组织直接诱导不定芽进行大规模扩繁提供了一定的研究基础和技术参考。参考文献(reference):
[1]陈勇,唐昌亮,贾朋,等.米老排培育技术及其应用研究进展.温带林业研究,2020,3(1):21-26.CHEN Y,TANG C L,JIA P,et al.Research advances on Mytilaria laosensis breeding techniques and its application.J Temp For Res,2020,3(1):21-26.DOI: 10.3969/j.issn.2096-4900.2020.01.004.
[2]罗水钧.米老排生物防火林带营造林初报.安徽农学通报,2018,24(10):91-93. LUO S J.Preliminary report on afforestation of biological fire-proof forest belt in Mytilaria laosensis.Anhui Agric Sci Bull,2018,24(10):91-93.DOI: 10.16377/j.cnki.issn1007-7731.2018.10.039.
[3]许晓银.不同坡位对米老排生物防火林带生长的影响.现代农业科技,2022(17):123-125. XU X Y.Effects of different slope positions on the growth of bio-fire shelterbelt in Mytilaria laosensis .Mod Agric Sci Technol,2022(17):123-125. DOI:10.3969/j.issn.1007-5739.2022.17.031.
[4]覃仁泷.米老排栽培技术及应用前景.现代农业科技,2021(18):150-151,153. QIN R L.Cultivation techniques and application prospect of rice old row.Mod Agric Sci Technol,2021(18):150-151,153. DOI:10.3969/j.issn.1007-5739.2021.18.062.
[5]卢立华,贾宏炎,何日明,等.南亚热带6种人工林凋落物的初步研究.林业科学研究,2008,21(3):346-352. LU L H,JIA H Y,HE R M,et al.A preliminary study on litter falls of six kinds of plantations in the tropical South Asia.For Res,2008,21(3):346-352.DOI: 10.3321/j.issn:1001-1498.2008.03.012.
[6]景跃波,杨德军,马赛宇,等.热带速生树种米老排的育苗与造林.林业实用技术,2008(1):21-23. JING Y B,YANG D J,MA S Y,et al.Seedling raising and afforestation of tropical fast-growing tree species Mytilaria laosensis .Pract For Technol,2008(1):21-23.DOI: 10.13456/j.cnki.lykt.2008.01.019.
[7]陈朝黎,余纽,李荣生,等.米老排叶片营养成分与利用前景分析.热带亚热带植物学报,2021,29(4):367-373. CHEN Z L,YU N,LI R S,et al.Nutritional ingredients in leaves of Mytilaria laosensis and its utilization prospects.J Trop Subtrop Bot,2021,29(4):367-373.DOI: 10.11926/jtsb.4324.
[8]于彬,闫彩霞,杨锦昌,等.米老排幼苗对不同供氮方式的光合生理响应.热带作物学报,2019,40(8):1529-1536. YU B,YAN C X,YANG J C,et al.Photosynthetic and physiological characteristic of Mytilaria laosensis seedlings under different nitrogen application.Chin J Trop Crops,2019,40(8):1529-1536.DOI: 10.3969/j.issn.1000-2561.2019.08.011.
[9]黄银珊.乡土树种米老排、任豆种子萌发特性与贮藏生理研究.南宁:广西大学,2012. HUANG Y S.Storage physiology of native species Mytilaria laosensis and Zenia insignis seeds.Nanning:Guangxi University,2012.
林能庆.米老排嫁接技术研究.防护林科技,2015(12):14-16.LIN N Q.Grafting technology of Mytilaria laosensis.Prot For Sci Technol,2015(12):14-16.DOI: 10.13601/j.issn.1005-5215.2015.12.005.
白磊.米老排扦插繁殖技术.北京:中国林业科学研究院,2015.BAI L.Cutting propagation techniques of Mytilaria laosensis.Beijing:Chinese Academy of Forestry,2015.
裘珍飞,曾炳山,李湘阳,等.米老排的组织培养和快速繁殖.植物生理学报,2013,49(10):1077-1081.QIU Z F,ZENG B S,LI X Y,et al.Tissue culture and rapid propagation of Mytilaria laosensis lecomte.Plant Physiol J,2013,49(10):1077-1081.DOI: 10.13592/j.cnki.ppj.2013.10.010.
刘振湘.米老排组培快繁优化及愈伤诱导研究.北京:中国林业科学研究院,2020.LIU Z X.The optimization of tissue culture and the induction of callus of Mytilaria laosensis.Beijing:Chinese Academy of Forestry,2020.DOI: 10.27625/d.cnki.gzlky.2020.000255.
马玲玲,王鹏,王淑安,等.取材时间和激素对‘豫楸1号’腋芽诱导的影响.北方园艺,2014(13):84-87.MA L L,WANG P,WANG S A,et al.Effect of sampling time and hormones on axillary buds induction of ‘Yuqiu No.1’.North Hortic,2014(13):84-87.
陈罡.林木组培快繁技术中常见问题及对策.防护林科技,2017(4):100-102.CHEN G.Common problems and countermeasures in tissue culture and rapid propagation of forest trees.Prot For Sci Technol,2017(4):100-102.DOI: 10.13601/j.issn.1005-5215.2017.04.038.
黄松殿,俞建妹,龙敏,等.异叶南洋杉外植体预处理及消毒灭菌的研究.农业与技术,2020,40(21):77-79.HUANG S D,YU J M,LONG M,et al.Study on pretreatment,disinfection and sterilization of explants of Aralia heterophylla.Agric Technol,2020,40(21):77-79.DOI: 10.19754/j.nyyjs.20201115025.
徐南翔.桉树组织培养育苗技术的研究.吉林农业,2010(11):47.XU N X.Study on tissue culture and seedling raising technology of eucalyptus.Jilin Agric,2010(11):47.
胡计红,陈桂信,杨惠婷,等.屏南龙源‘四季杜鹃’古树组培快繁技术研究.热带作物学报,2020,41(4):755-763.HU J H,CHEN G X,YANG H T,et al.Technology for rapid propagation in vitro of ancient four-season Rhododendron tree in Longyuan of Pingnan.Chin J Trop Crops,2020,41(4):755-763.DOI: 10.3969/j.issn.1000-2561.2020.04.017.
郭文福,蔡道雄,贾宏炎,等.米老排人工林生长规律的研究.林业科学研究,2006,19(5):585-589.GUO W F,CAI D X,JIA H Y,et al.Growth laws of Mytilaria laosensis plantation.For Res,2006,19(5):585-589.DOI: 10.3321/j.issn:1001-1498.2006.05.008.
涂俊凡,秦仲麒,李先明,等.兔眼蓝莓组织培养与快繁技术研究.安徽农业科学,2012,40(28):13725-13728.TU J F,QIN Z Q,LI X M,et al.Tissue culture and micropropagation of Vaccinium ashei.J Anhui Agric Sci,2012,40(28):13725-13728.DOI: 10.13989/j.cnki.0517-6611.2012.28.142.
宋绍敦,张祝平,蔡旭粦.米老排造林试验报告.广东林业科技,1986,2(3):12-15.SONG S D,ZHANG Z P,CAI X L.Experimental report on afforestation of rice old row.Guangdong For Sci Technol,1986,2(3):12-15.
李清香,吴红英.树型金银花外植体诱导技术.林业科技通讯,2020(7):10-14.LI Q X,WU H Y.Induction technique of tree Lonicera japonica Thunb.explant.For Sci Technol,2020(7):10-14.DOI: 10.13456/j.cnki.lykt.2019.05.17.0001.
李清香.水果型番木瓜组培快繁体系的建立及应用研究.南宁:广西大学,2016.LI Q X.The establishment of the technology sysem of in vitro rapid propagation and utilization technology of fruit-type Papaya.Nanning:Guangxi University,2016.
邓桂秀,於虹,宋鹏飞,等.不同基本培养基对南方高丛蓝浆果丛生枝增殖及生长的影响.植物资源与环境学报,2011,20(1):60-64.DENG G X,YU H,SONG P F,et al.Effect of different basic media on proliferation and growth of clumpy shoot of southern highbush blueberry (Vaccinium corymbosum hybrids).J Plant Resour Environ,2011,20(1):60-64.DOI: 10.3969/j.issn.1674-7895.2011.01.009.
POOTHONG S,REED B M.Modeling the effects of mineral nutrition for improving growth and development of micropropagated red raspberries.Sci Hortic,2014,165:132-141.DOI: 10.1016/j.scienta.2013.10.040.
杨峰,刘巧莲,代真真,等.不同基本培养基和外植体对剑麻愈伤组织诱导及分化的影响.热带作物学报,2012,33(3):475-478.YANG F,LIU Q L,DAI Z Z,et al.Effects of different explants and basic medium on callus induction and differentiation of Agave sisalana.Chin J Trop Crops,2012,33(3):475-478. DOI:10.3969/j.issn.1000-2561.2012.03.015.
马均,马明东.曼地亚红豆杉的组织培养快繁技术.林业科学,2007,43(7):30-34.MA J,MA M D.Tissue culture technique of Taxus media ‘Hecksii’.Sci Silvae Sin,2007,43(7):30-34.DOI: 10.3321/j.issn:1001-7488.2007.07.006.
王军娥,巩振辉,李新凤.牡丹愈伤组织诱导与分化技术的优化研究.西北农业学报,2008,17(5):282-286.WANG J E,GONG Z H,LI X F.Optimization on techniques of callus induction and differentiation of Paeonia suffruticosa.Acta Agric Boreali Occidentalis Sin,2008,17(5):282-286.DOI: 10.3969/j.issn.1004-1389.2008.05.061.
蔡祖国,李桂荣,姜立娜,等.MS培养基配方研究.现代农业科技,2022(8):125-127.CAI Z G,LI G R,JIANG L N,et al.Research on formulation of MS medium.Mod Agric Sci Technol,2022(8):125-127. DOI:10.3969/j.issn.1007-5739.2022.08.041.
胡倩,赵天宇,张新叶,等.三个楸树优良无性系的组培快繁技术研究.湖北民族大学学报(自然科学版),2021,39(4):361-366,383.HU Q,ZHAO T Y,ZHANG X Y,et al.Tissue culture of three superior clones of Catalpa bungei.J Hubei Nat Sci Ed,2021,39(4):361-366,383.DOI: 10.13501/j.cnki.42-1908/n.2021.12.001.
钟宇,张健,罗承德,等.西洋杜鹃组织培养技术体系研究(Ⅰ):基本培养基和外植体的选择.四川农业大学学报,2001,19(1):37-39.ZHONG Y,ZHANG J,LUO C D,et al.A study on the technique system of tissue culture in Rhododendron hybrind(Ⅰ): Selection of medium and explant.J Sichuan Agricul Tural Univ,2001,19(1):37-39.DOI: 10.3969/j.issn.1000-2650.2001.01.010.
AREMU A O,BAIRU M W,DOLEAL K,et al.Topolins:a panacea to plant tissue culture challenges?.Plant Cell Tiss Organ Cult,2012,108(1):1-16.DOI: 10.1007/s11240-011-0007-7.
姚金澳,王旭承,唐徐玮,等.杂交兰组织培养与快速繁殖技术的分析.分子植物育种,2021,19(3):929-936.YAO J A,WANG X C,TANG X W,et al.Analysis of tissue culture and rapid propagation technology of Cymbidium hybrid.Mol Plant Breed,2021,19(3):929-936.DOI: 10.13271/j.mpb.019.000929.
黄歆怡,覃茜,谢振兴,等.蝴蝶兰属植物及其现状研究.农业研究与应用,2018,31(1):42-47.HUANG X Y,QIN Q,XIE Z X,et al.Research status of Phalaenopsis plants.Agric Res Appl,2018,31(1):42-47.
饶丹丹,王湘莹,蔡能,等.紫叶紫薇良种组培快繁研究.中南林业科技大学学报,2020,40(12):75-82.RAO D D,WANG X Y,CAI N,et al.Study on tissue culture and rapid propagation of Lagerstroemia indica.J Cent South Univ For Technol,2020,40(12):75-82.DOI: 10.14067/j.cnki.1673-923x.2020.12.010.
胡彦,赵艳.植物组织培养技术的应用以及在培养过程中存在的问题.陕西师范大学学报(自然科学版),2004,32(S1):130-134.HU Y,ZHAO Y.Application of tissue culture and the problem during tissue culture.J Shaanxi Norm Univ (Nat Sci Ed),2004,32(S1):130-134.
高英,刘昊,杨利云,等.天津野生山樱花组织培养与再生体系的建立.山东农业科学,2022,54(6):20-26.GAO Y,LIU H,YANG L Y,et al.Establishment of tissue culture and regeneration system of Tianjin wild Cerasus serrulate.Shandong Agric Sci,2022,54(6):20-26.DOI: 10.14083/j.issn.1001-4942.2022.06.003.
张锋.6-BA对西瓜组培幼苗生长发育的影响.现代农业科技,2010(17):106,109.ZHANG F.Effect of 6-BA on growth and development of watermelon tissue culture seedlings.Mod Agric Sci Technol,2010(17):106,109.
陆鑫,孟彩婷,韩淑华,等.不同培养基对桑树茎段外植体摄取6-BA和增殖生长的影响.蚕业科学,2021,47(4):301-309.LU X,MENG C T,HAN S H,et al.Effects of different culture media on 6-BA absorption and proliferation of mulberry explants.Acta Sericologica Sin,2021,47(4):301-309.DOI: 10.13441/j.cnki.cykx.2021.04.001.
林桦,邓海燕,曾奇,等.尾巨桉M8无性系增殖培养技术研究.林业与环境科学,2020,36(4):73-79.LIN H,DENG H Y,ZENG Q,et al.Study on the multiplication and culture technology of Eucalyptus urophylla × E.grandis M8 clones.For Environ Sci,2020,36(4):73-79.
卢小三,范素杰,张帅,等.杨树诱导芽分化中6-BA和NAA配比优化研究.湖北林业科技,2010,39(3):17-21.LU X S,FAN S J,ZHANG S,et al.Optimize the concentration of 6-BA and NAA in the introduction of adventitious buds.Hubei For Sci Technol,2010,39(3):17-21.DOI: 10.3969/j.issn.1004-3020.2010.03.005.
徐新然,陈向东,张薇薇,等.生长素调节药用植物生长发育的研究进展.中国现代中药,2016,18(12):1675-1678.XU X R,CHEN X D,ZHANG W W,et al.Advance on effects of auxin on growth and development of medicinal plants.Mod Chin Med,2016,18(12):1675-1678.DOI: 10.13313/j.issn.1673-4890.2016.12.032.
龚永福,陈芳,张兆萍,等.植物组培苗生根研究综述.安徽农业科学,2022,50(17):5-8.GONG Y F,CHEN F,ZHANG Z P,et al.Review on rooting of plant tissue culture seedling.J Anhui Agric Sci,2022,50(17):5-8.DOI: 10.3969/j.issn.0517-6611.2022.17.002.
PARK S H,ELHITI M,WANG H Y,et al.Adventitious root formation of in vitro peach shoots is regulated by auxin and ethylene.Sci Hortic,2017,226:250-260.DOI: 10.1016/j.scienta.2017.08.053.
张太奎,郭腾,刘峥,等.国外引进品种‘Hort16A’猕猴桃离体再生体系建立.西南林业大学学报,2017,37(1):54-60.ZHANG T K,GUO T,LIU Z,et al.In vitro regeneration system of ‘Hort16A’ kiwifruit introduced from abroad.J Southwest For Univ,2017,37(1):54-60.
(责任编辑" 吴祝华)

