白藜芦醇对自发性高血压大鼠脑基底动脉重构的影响
王磊 刘华江 周成 余巍 张真


摘要目的:探究白藜芦醇对高血压诱导的大鼠脑血管重构的逆转作用,并探讨其作用机制。方法:6周龄雄性自发性高血压大鼠(SHR)适应性喂养,WKY正常饲养大鼠作为对照组,正常喂养SHR大鼠分为模型组、阳性药物组、白藜芦醇高剂量组、白藜芦醇低剂量组,每组8只。2周后测量各组大鼠尾动脉收缩压,苏木精伊红(HE)染色检查大鼠基底动脉病理改变,提取基底动脉原代平滑肌细胞,胆囊收缩素八肽(CCK8)、Transwell及划痕实验评估各组细胞增殖迁移与侵袭能力变化,酶联免疫吸附试验(ELISA)检测各组大鼠静脉血中氧化应激因子变化,蛋白免疫印迹法(WesternBlot)检测细胞增殖相关磷脂酰肌醇3激酶(PI3K)蛋白激酶B(AKT)通路蛋白和上皮间质转化及增殖相关Snail蛋白表达水平。结果:与对照组相比,模型组大鼠基底动脉血管横断面积更小,基底动脉血管壁厚度增加,细胞迁移能力、增殖能力与侵袭能力增加,血液中丙二醛(MDA)含量升高,超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)及过氧化氢酶(CAT)活性降低,磷酸化PI3K(pPI3K)、磷酸化AKT(pAKT)以及Snail蛋白表达水平增加,差异均有统计学意义(P<0.05或P<0.01);与模型组相比,阳性药物组、白藜芦醇低剂量组与白藜芦醇高剂量组基底动脉血管横断面积增加,基底动脉血管壁厚度下降,细胞增殖能力、迁移能力与侵袭能力下降,血液中MDA含量降低,SOD、GSH、CAT升高,pPI3K、pAKT以及Snail蛋白表达减少,差异均有统计学意义(P<0.05或P<0.01)。结论:白藜芦醇可以通过抑制PI3KAKT信号通路的激活来改善SHR大鼠高血压病理条件诱导的脑基底动脉血管重构及细胞功能异常。
关键词自发性高血压;白藜芦醇;血管重构;氧化应激;实验研究
doi:10.12102/j.issn.16721349.2024.06.012
全球疾病负担研究(GBD)显示脑卒中是全球第二大死亡原因及第三大致残原因[1]。高血压是脑卒中的重要高危因素[23],近30年,世界范围内高血压发病人数增加超过1倍,而我国高血压病人数量约占全球的四分之一[4]。尽管在高血压药物治疗领域取得了明显进展,但包括脑卒中在内的脑血管恶性事件的发病率与复发率仍较高[5]。血管重构(vascularremodeling,VR)是高血压诱发脑血管疾病的主要病理机制之一[6]。脑血管重构会导致静息脑血流量减少与脑血管阻力升高[7]。目前的研究显示,血管壁内的各种细胞类型都参与了脑血管重构的进程[8]。血管平滑肌细胞的增殖和迁移在高血压的动脉重构中发挥关键作用[9]。血管平滑肌细胞的异常增殖和迁移会引起血管壁厚度增加,管腔直径变小,从而造成脑组织缺血[10]。因此,控制高血压诱发的脑血管结构变化和功能障碍对于防治高血压诱发的脑卒中具有重要意义。
白藜芦醇(resveratrol)是一种天然多酚化合物,因其具有抗氧化、抗炎和抗凋亡特性[11],几十年来一直备受关注。有研究证实白藜芦醇可降低高血压病人的收缩压,且对高血压病人心肌组织具有保护作用[12]。也有研究显示,白藜芦醇可通过抑制与血管平滑肌细胞过度增殖有关的信号通路来减轻血管紧张素Ⅱ诱导的细胞肥大[13]。但白藜芦醇在高血压诱发的脑血管重构过程中的具体功能尚不清楚。因此,本研究拟采用自发性高血压(SHR)大鼠模型来评估白藜芦醇对高血压病脑血管重构的影响,并分析其潜在作用机制,旨在为临床防治高血压脑血管病提供新的药物选择。
1材料与方法
1.1实验动物
本研究使用6周龄的雄性无特定病原体(SPF)级商业化SHR和WKY雄性大鼠,由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)20160006,动物质量合格证号:100011911044391。以相同的基础饮食喂养,WKY大鼠体质量(76.41±4.73)g,SHR大鼠体质量(78.26±4.76)g。大鼠饲养环境:温度(25±2)℃,相对湿度55%~65%,调整昼夜节律,光照与黑暗每12h循环1次,自由饮水,无菌饲料喂养。实验结束时,过量的戊巴比妥钠(200mg/kg)深度麻醉,对大鼠进行颈椎脱臼安乐死。本研究获得我院实验动物护理和使用伦理委员会的批准(伦理批号:XY.No20220115c0461231)。
1.2药物与试剂
白藜芦醇(上海阿拉丁生物科技有限公司,货号:R408711),苏木精伊红(HE)染色液(北京Leagene,货号:DH0006),胆囊收缩素八肽(CCK8)试剂盒(日本同仁化学研究所,货号:CK04),总磷脂酰肌醇3激酶(PI3K)、磷酸化PI3K(pPI3K)、总蛋白激酶B(AKT)、磷酸化AKT(pAKT)、ECadherin、NCadherin、Vimentin及甘油醛3磷酸脱氢酶(GAPDH)抗体均购自CellSignalingTechnology公司(货号分别为1856、2678、4159、5879、14472、13116、5741、22698),丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)及过氧化氢酶(CAT)活性检测试剂盒均购自武汉索莱宝科技生物公司(货号分别为BC0020、BC0170、SCW1、BC0205)。
1.3主要仪器
SynergyHT型多功能酶标仪(美国Biotek公司),bx53荧光显微镜(日本Olympus公司),IMH400S胞孵育箱(美国ThermoFisher公司),DM800倒置显微镜(日本NIKON公司),1645050电泳仪及1704150电转移仪(美国BioRad公司),ABI7900实时荧光定量聚合酶链式反应(PCR)仪(美国ThermoFisher公司)。
1.4造模与分组
本实验分为WKY大鼠正常对照组(对照组)、SHR模型组(SHR组)、SHR大鼠卡托普利治疗阳性对照组(阳性药物组)、SHR大鼠白藜芦醇低剂量治疗组(白藜芦醇低剂量组)与SHR大鼠白藜芦醇高剂量治疗组(白藜芦醇高剂量组),每组8只。
1.5实验给药
对照组和SHR组大鼠正常喂养,阳性药物组予以卡托普利管饲2周,剂量为30mg/(kg·d),白藜芦醇低剂量组与白藜芦醇高剂量组采用白藜芦醇管饲法治疗2周,参照文献[12]分别给予剂量5mg/(kg·d)与10mg/(kg·d)。实验开始前5d于08:00~13:00固定时间进行测压训练:将大鼠放入37℃恒温箱预热15min,无创血压仪连续测量大鼠尾动脉收缩期脉压3次以上,取平均值。实验过程中定期监测血压与体质量。
1.6观察指标
1.6.1HE染色
各组大鼠腹腔注射致死剂量的戊巴比妥钠(200mg/kg)后行颈椎脱臼安乐死,并在3倍镜下取含有基底动脉的完整脑干,分离成功后浸入4%多聚甲醛中浸泡48h固定;使用梯度乙醇对标本进行脱水并使用石蜡包埋、切片;然后石蜡切片用二甲苯脱蜡,并依次用浓度递减的乙醇(99.9%、97.0%、75.0%、50.0%)和蒸馏水冲洗;然后使用HE染色法对石蜡切片进行染色;最后,在高倍光学显微镜下观察各组大鼠的基底动脉病理学变化并拍照。
1.6.2原代细胞培养
处死大鼠后小心分离基底动脉,去除结缔组织和内皮后,于冰上用含双抗的磷酸缓冲盐溶液(PBS)清洗,将基底动脉切成约0.5mm长的小块,放入含有20%胎牛血清(FBS)的DMEM中;然后,将组织片段在5%CO2、37℃孵育箱中培养5d后换液,后续每隔48h换液;待从组织片迁移出的平滑肌细胞长满后,用含10%FBS的DMEM传代并鉴定,然后取第3代~第5代细胞进行试验。
1.6.3CCK8实验
将一定密度的血管平滑肌细胞接种于96孔板中,每孔加入100μL含10%FBS的培养基,细胞孵育箱孵育12h,加入提前配制好的药物孵育48h,然后每孔细胞中加入10μL的CCK8溶液,培养箱中孵育2h后,采用酶标仪检测450nm吸光度OD值,计算细胞的相对增殖与相对存活率,计算公式:(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.6.4细胞划痕实验
将平滑肌细胞按照一定密度均匀地接种到六孔板上,过夜待细胞贴壁后,使用100μL移液器吸头在六孔板上笔直均匀地划线形成伤口样间隙,PBS清洗掉细胞碎片后加入不含血清的新鲜培养基培养;24h后用倒置显微镜拍摄划痕间隙并计算细胞迁移距离。
1.6.5Transwell实验
取各组平滑肌细胞以每孔5×104个种植于Transwell24孔板,每孔设置3个复孔,上室和下室均为含10%FBS的正常培养基,48h后预冷,甲醇固定,0.1%结晶紫染色并拍照。
1.6.6血清氧化应激反应指标水平检测
给药2周后,大鼠禁食水12h,用3%戊巴比妥钠以4mL/100g腹腔注射麻醉,下腔静脉采血,注入离心管,4℃,3000r/min离心20min,取上清液。按照试剂盒说明书酶联免疫吸附试验(ELISA)法检测MDA、SOD、CAT及GSH水平。
1.6.7蛋白免疫印迹法(WesternBlot)
使用含有1%蛋白酶和磷酸酶抑制剂的RIPA缓冲液裂解细胞;二喹啉甲酸(BCA)试剂盒对样品蛋白质浓度进行定量;等量与等体积的蛋白通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)凝胶分离,然后转移到聚偏二氟乙烯(PVDF)膜上。5%脱脂奶粉封闭1h后一抗4℃孵育过夜(一抗稀释浓度为1∶1000),PBS洗膜,然后二抗室温孵育1h,加入增强化学发光试剂(enhancedchemiluminescence,ECL)曝光显色。采用WesternBlot检测血管平滑肌细胞中PI3KAKT信号通路活化水平和细胞增殖蛋白Snail表达水平。
1.7统计学处理
采用SPSS20.0软件进行统计分析,符合正态分布的定量资料以均数±标准差(x±s)表示,采用独立样本t检验或方差分析。以P<0.05为差异有统计学意义。每次实验重复3次及以上,采用GraphPad8.0软件作图。
2结果
2.1各组大鼠体质量、尾动脉收缩压比较
经过2周的白藜芦醇喂养后,各组大鼠体质量比较差异无统计学意义(P>0.05),表明白藜芦醇不会对大鼠体质量产生明显影响(见图1)。鼠尾动脉收缩压监测结果显示,与对照组相比,模型组尾动脉收缩压明显升高(P<0.05),表明本实验采用的SHR模型有效;与模型组相比,阳性药物组、白藜芦醇低剂量组与白藜芦醇高剂量组大鼠尾动脉收缩压明显下降(P<0.05);白藜芦醇高剂量组尾动脉收缩压低于白藜芦醇低剂量组(P<0.05),表明白藜芦醇具有改善大鼠尾动脉收缩压的作用。详见图2。
2.2各组大鼠脑血管重构情况比较
血管横断面积(CSA)改变是血管重构的重要病理生理学特征之一。HE染色观察各组基底动脉的CSA,模型组CSA较对照组下降(P<0.05);与模型组比较,阳性药物组、白藜芦醇低剂量组及白藜芦醇高剂量组CSA有所恢复(P<0.05),且白藜芦醇高剂量组CSA恢复更明显(P<0.05)。HE染色观察各组血管厚度变化,模型组血管厚度较对照组增加(P<0.05);与模型组比较,阳性药物组与白藜芦醇低剂量组及白藜芦醇高剂量组血管厚度不同程度下降(P<0.05),且白藜芦醇高剂量组下降更明显(P<0.01)。表明白藜芦醇可逆转高血压引起的脑血管结构改变。详见图3~图5。
2.3各组血管平滑肌细胞增殖、侵袭及迁移能力变化
采用细胞划痕实验、Transwell实验与CCK8实验评估白藜芦醇对血管平滑肌细胞侵袭、迁移、增殖能力的影响。划痕实验结果显示,模型组细胞迁移能力增强,阳性药物组、白藜芦醇低剂量组与白藜芦醇高剂量组迁移能力减弱。详见图6。Transwell实验结果显示,模型组细胞侵袭能力增强,阳性药物组、白藜芦醇低剂量与白藜芦醇高剂量组迁移能力减弱。详见图7。CCK8结果显示,模型组细胞存活率较对照组明显增加(P<0.05),阳性药物组、白藜芦醇低剂量组与白藜芦醇高剂量组细胞存活率较模型组降低(P<0.05),且白藜芦醇高剂量组细胞存活率低于白藜芦醇低剂量组(P<0.05)。详见图8。表明白藜芦醇可以抑制血管平滑肌细胞迁移、侵袭与增殖能力。
2.4各组氧化应激反应指标比较
与对照组比较,模型组MDA水平明显增加(P<0.05),SOD、GSH及CAT活性明显降低(P<0.05);与模型组相比,阳性药物组、白藜芦醇低剂量组及高剂量组MDA水平均有所下降(P<0.05),SOD、GSH及CAT活性明显提高(P<0.05);且白藜芦醇高剂量组MDA、SOD、GSH及CAT改变较白藜芦醇低剂量组更为明显(P<0.05)。提示白藜芦醇可以通过提升SOD、CAT、GSH水平及降低MDA含量,提高体内抗过氧化作用来保护内皮细胞。详见表1。
2.5白藜芦醇可抑制PI3KAKT信号通路激活PI3K通路蛋白与Snail蛋白表达
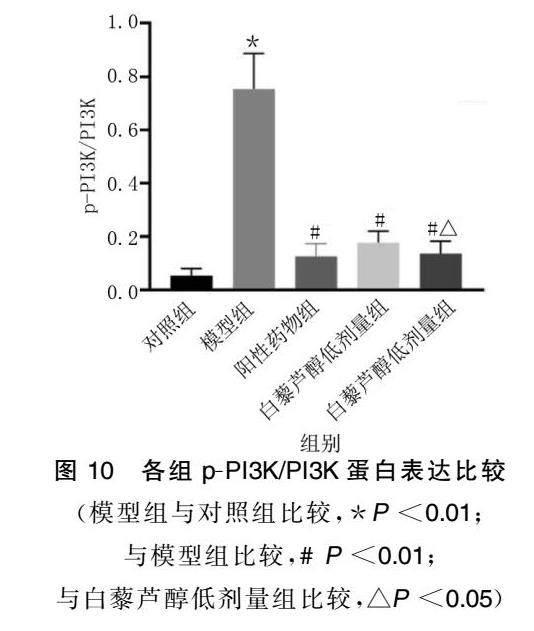
与对照组相比,模型组细胞PI3KAKT信号活化相关蛋白pPI3K、pAKT蛋白及Snail蛋白水平增加(P<0.01);阳性药物组、白藜芦醇低剂量组、白藜芦醇高剂量组则各蛋白表达水平低于模型组(P<0.01)。表明白藜芦醇通过抑制PI3KAKT信号通路的激活与抑制增殖相关蛋白Snail的表达来逆转高血压诱导的血管重构。详见图9~图12。
3讨论
高血压诱发的脑血管重构是脑卒中的主要风险之一[14]。小动脉如基底动脉阻力对于调节血压至关重要,血压升高造成的高血管灌注会损害脑毛细血管,脑血管系统通过提高血管阻力,如诱导更小的血管腔径适应血压升高来防止脑损伤[15]。但这些脑血管结构的改变会导致慢性脑灌注不足、脑梗死和其他更为严重的损伤[16]。因此,防治高血压脑血管重构对于防治高血压引发的脑卒中具有重要意义。
白藜芦醇是存在于红葡萄、浆果和花生中的天然多酚物质,之前的研究更多地关注于其在心血管疾病中的作用,但其对高血压诱发的脑血管重构的作用尚未明确。本研究初步探讨白藜芦醇对高血压诱发的脑血管重构的保护作用。本研究结果显示,SHR尾动脉收缩压上升,血管CSA减小,基底动脉血管平滑肌厚度增加,白藜芦醇可以明显逆转这些变化;分离并培养血管平滑肌细胞发现,白藜芦醇可以有效降低细胞增殖、迁移与侵袭能力,此外白藜芦醇可以有效抑制大鼠体内的氧化应激反应。
高血压血管重构是一种伴随整个疾病发生发展进程的慢性病理反应,其主要表现为血管壁厚度、血管壁横截面积以及血管壁/血管腔内径比值的增加[17]。血管平滑肌细胞是主动脉血管中膜的重要组成,其结构与功能的完整有助于调节血管张力并保证主动脉的正常生理功能。在正常生理状态下,血管平滑肌细胞呈长梭形,并不能进行增殖和迁移,而在高血压病理条件下,自分泌途径被激活,多种细胞及生长因子可促使血管平滑肌细胞由收缩型逐渐向合成型转换[18]。因合成型的血管平滑肌细胞增殖、迁移速率较高而收缩能力差,继而引起主动脉组织弹性减弱,最终导致主动脉血管重构及诱发各种并发症。血管平滑肌细胞的增殖、迁移受多种血管重构相关信号通路影响,如丝裂原活化蛋白激酶(MAPK)信号途径以及AKT途径等[19]。AKT通路是多层信号级联通路,包括Snail在内其下游效应蛋白众多,该通路可将细胞外多重信号网络,如生长因子、细胞因子等传递至胞浆内,并对AKT通路双磷酸化位点进行逐级激活,从而调控血管平滑肌细胞的增殖、迁移过程。本研究结果显示,白藜芦醇可抑制与增殖相关的PI3KAKT信号通路的激活,并进一步抑制上皮间质转化及增殖相关Snail蛋白的表达,这可能是白藜芦醇逆转高血压诱导的基底动脉结构改变、血管平滑肌增厚及抑制血管平滑肌细胞增殖、侵袭、迁移能力的重要机制之一。
此外,高血压诱导的脑血管重构与过氧化损伤有关。真核生物机体针对氧化应激稳态的调控存在两类酶系统,一类是抗氧化酶类系统,如SOD、CAT等,另一类是促进活性氧生成的酶系统,如还原型辅酶Ⅱ(NADPH)氧化酶及黄嘌呤氧化酶(XOD)等[20]。正常情况下,组织细胞的某些代谢环节能产生氧自由基,氧自由基可以引发脂质过氧化作用,机体存在的具有活性的抗氧化酶如SOD、CAT、GSH等可及时有效地清除氧自由基,维持体内自由基的动态平衡,以避免损伤机体的组织细胞。MDA水平是反映机体氧化应激损伤的重要指标之一,MDA含量的提升可引起多种组织器官的损伤,有研究显示高血压病人MDA水平升高[21]。本研究结果显示,模型组大鼠血液中MDA含量较对照组升高,而经过白藜芦醇干预后,血液中MDA含量降低,同时SOD、GSH、CAT活性升高,提示白藜芦醇可以通过恢复大鼠氧化应激系统功能来逆转高血压诱导的基底动脉血管重构。
总之,本研究证实了白藜芦醇对SHR大鼠高血压诱导脑基底动脉血管重构及血管平滑肌细胞异常功能具有改善作用,可为白藜芦醇应用于临床高血压脑血管病防治提供理论基础。
参考文献:
[1]MURRAYCJL,ARAVKINAY,ZHENGP,etal.Globalburdenof87riskfactorsin204countriesandterritories,19902019:asystematicanalysisfortheGlobalBurdenofDiseaseStudy2019[J].TheLancet,2020,396(10258):12231249.
[2]陈昱,思金华,时晓迟.老年高血压并发症临床治疗研究进展[J].中国老年学杂志,2019,39(2):508511.
[3]WEBBAJS,WERRINGDJ.Newinsightsintocerebrovascularpathophysiologyandhypertension[J].Stroke,2022,53(4):10541064.
[4]ZHOUB,CARRILLOLARCORM,DANAEIG,etal.Worldwidetrendsinhypertensionprevalenceandprogressintreatmentandcontrolfrom1990to2019:apooledanalysisof1201populationrepresentativestudieswith104millionparticipants[J].TheLancet,2021,398(10304):957980.
[5]周琳,吴琼,郭秀君,等.灸法干预缺血性脑卒中患者肢体功能障碍的选穴规律研究[J].中医药导报,2021,27(4):131135.
[6]LIUWJ,HUANGXQ,LIUXB,etal.Uncontrolledhypertensionassociateswithsubclinicalcerebrovascularhealthglobally:amultimodalimagingstudy[J].EuropeanRadiology,2021,31(4):22332241.
[7]蔡逸青,陈瑜,张腾.高血压血管重构机制及中医药防治研究进展[J].上海中医药杂志,2019,53(7):8892.
[8]WANGBT,CAIW,ZHANGZ,etal.Circulatingmicroparticlesinpatientsafterischemicstroke:asystematicreviewandmetaanalysis[J].ReviewsintheNeurosciences,2018.DOI:10.1515/revneuro20170105.
[9]邱志兵,陈鑫,万松.血管外膜和平滑肌细胞增殖活性及胶原分布对血管重塑影响[J].南京医科大学学报(自然科学版),2008,28(6):752757.
[10]CHENYQ,LIS,GUOYX,etal.Astaxanthinattenuateshypertensivevascularremodelingbyprotectingvascularsmoothmusclecellsfromoxidativestressinducedmitochondrialdysfunction[J].OxidativeMedicineandCellularLongevity,2020,2020:4629189.
[11]GRUJICMILANOVICJ,JACEVICV,MILORADOVICZ,etal.Resveratrolprotectscardiactissueinexperimentalmalignanthypertensionduetoantioxidant,antiinflammatory,andantiapoptoticproperties[J].InternationalJournalofMolecularSciences,2021,22(9):5006.
[12]SINGHAP,SINGHR,VERMASS,etal.Healthbenefitsofresveratrol:evidencefromclinicalstudies[J].MedicinalResearchReviews,2019,39(5):18511891.
[13]ALMAJDOOBS,HOSSAINE,ANANDSRIVASTAVAMB.Resveratrolattenuateshyperproliferationofvascularsmoothmusclecellsfromspontaneouslyhypertensiverats:roleofROSandROSmediatedcellsignaling[J].VascularPharmacology,2018,101:4856.
[14]CIPOLLAMJ,LIEBESKINDDS,CHANSL.Theimportanceofcomorbiditiesinischemicstroke:impactofhypertensiononthecerebralcirculation[J].JournalofCerebralBloodFlow&Metabolism,2018,38(12):21292149.
[15]侯静,蔺艳,刘勇,等.苯磺酸左旋氨氯地平对慢性肾脏病合并原发性高血压大鼠的肾脏保护研究[J].世界临床药物,2022,43(5):542548.
[16]蔡拓,周艳芳,邓宇斌.缺氧诱导因子1在缺血性脑损伤中的作用[J].国际脑血管病杂志,2010,18(4):300305.
[17]ZANCHETTIA.Bloodpressuremeasurement,bloodvesselsandtreatmentofhypertension[J].JournalofHypertension,2018,36(3):449450.
[18]INTAPADS.Reprogrammingessentialhypertension:theroleofresveratrol[J].Hypertension,2016,67(5):829830.
[19]ZHANGL,ZHANGYY,WUY,etal.RoleofthebalanceofAKTandMAPKpathwaysintheexerciseregulatedphenotypeswitchinginspontaneouslyhypertensiverats[J].InternationalJournalofMolecularSciences,2019,20(22):5690.
[20]FIKECD,SLAUGHTERJC,KAPLOWITZMR,etal.ReactiveoxygenspeciesfromNADPHoxidasecontributetoalteredpulmonaryvascularresponsesinpigletswithchronichypoxiainducedpulmonaryhypertension[J].AmericanJournalofPhysiologyLungCellularandMolecularPhysiology,2008,295(5):L881L888.
[21]TOGLIATTOG,LOMBARDOG,BRIZZIMF.Thefuturechallengeofreactiveoxygenspecies(ROS)inhypertension:frombenchtobedside[J].InternationalJournalofMolecularSciences,2017,18(9):1988.
(收稿日期:20220920)
(本文编辑郭怀印)
作者单位枣阳市第一人民医院(湖北枣阳441200)
通讯作者张真,Email:1159388296@qq.com
引用信息王磊,刘华江,周成,等.白藜芦醇对自发性高血压大鼠脑基底动脉重构的影响[J].中西医结合心脑血管病杂志,2024,22(6):10331039.

