琼凹大叶蝉精子发生及精子超微结构
陈实锐 陈哲晶 郑欣然 李佳灵 张贝贝
摘要
昆蟲精子超微结构在不同类群间变异较大,在昆虫分类、种群进化研究及系统发育分析中具有重要意义。研究叶蝉科昆虫精子发生及精子超微结构,可为叶蝉科及头喙亚目系统发育分析提供更多特征依据。本研究采用光学和电子显微镜技术,观察了琼凹大叶蝉Bothrogonia qiongana Yang et Li的精子发生和精子超微结构。精子形成时期,精子细胞内高尔基复合体形成精子顶体;线粒体融合衍变为线粒体衍生物;中心粒产生轴丝。单层微管结构围绕精子各组成部分,在精子成熟后消失,对精子细胞伸长起关键作用。成熟精子细长、线状,头部顶端由绳状物质连接形成梳状精子束。顶体圆锥状,具有顶体腔,末端延伸出2条突起插入细胞核顶端。细胞核近柱状,末端平截,侧缘凹陷,通过片层状中心粒侧体与鞭毛线粒体衍生物连接。尾部鞭毛由1条9+9+2型轴丝,2条对称线粒体衍生物,2条较短副体,2条细小附结构及鞭毛中心物质组成。琼凹大叶蝉副体横切椭圆形、长度较短仅出现在鞭毛起始区,与角顶叶蝉亚科昆虫差异较大。结合已报道头喙亚目类昆虫,我们推断副体结构可为叶蝉科及头喙亚目系统发育分析提供有用的特征。
关键词
头喙亚目; 大叶蝉亚科; 生殖细胞; 精子形成; 超微结构; 副体
中图分类号:
Q 964
文献标识码: A
DOI: 10.16688/j.zwbh.2023271
Spermatogenesis and sperm ultrastructure of Bothrogonia qiongana Yang et Li (Hemiptera: Cicadellidae)
CHEN Shirui1, CHEN Zhejing1, ZHENG Xinran1, LI Jialing2, ZHANG Beibei1*
(1. College of Forestry, Hainan University, Danzhou 571737, China; 2. Wuzhishan Branch of the Management
Office of Hainan Tropical Rainforest National Park, Wuzhishan 572200, China)
Abstract
Sperm ultrastructure displays a great variability among insect groups and holds great significance in the classification, evolution, and phylogenetic analysis of insects. The study of spermatogenesis and sperm ultrastructure in Cicadellidae can provide additional valuable characters for phylogenetic analysis of both Cicadellidae and Auchenorrhyncha. Spermatogenesis and sperm ultrastructure of the leafhopper Bothrogonia qiongana Yang et Li were investigated using light and electron microscopy. During spermiogenesis, the acrosome originated from the Golgi apparatus, while the mitochondrial derivatives formed through the aggregation and fusion of numerous mitochondria in the spermatid cytoplasm. The flagellar axoneme was generated by the centriole. Spermatid components were surrounded by a single layer of microtubules, which played a critical role in the spermatid elongation during spermiogenesis, which then disappeared in mature spermatozoa. The spermatozoa exhibited an elongated, filiform structure. The sperm heads were arranged in a row with a ropelike structure, forming a pectinate sperm bundle. The conical acrosome possessed a subacrosomal space and formed two acrosomal processes inserting into both sides of the anterior part of nucleus. The nucleus was cylindrical, with a flattened base, and its marginal depression connected to the two mitochondrial derivatives of the flagellum through a lamellate centriolar adjunct. The flagellum was composed of a 9+9+2 axoneme, two symmetrical mitochondrial derivatives, two short accessory bodies, two small subellipsoidal structures, and a centerflagellar material. Two ovoid and short accessory bodies observed only in the flagellums initial region of Bothrogonia qiongana, were quite different from those of species in Deltocephalinae. Combined with the reported data from other auchenorrhynchans, these accessory bodies likely provide valuable characters for phylogenetic analysis of Cicadellidae and Auchenorrhyncha.
Key words
Auchenorrhyncha; Cicadellinae; germ cell; spermiogenesis; ultrastructure; accessory body
叶蝉科Cicadellidae是昆虫纲Insecta半翅目Hemiptera头喙亚目Auchenorrhyncha中最大的類群,目前已知记载约1 500属20 000余种[1],广泛分布于世界各地,是生态系统中昆虫物种最丰富的类群之一。该类昆虫具有典型的刺吸式口器和较强的生殖力,其通过吸食植物汁液影响植物生长,一些种类还可以传播植物病毒,是重要的农林业害虫。然而,叶蝉科的系统发育关系至今仍存在较大争议[214]。近年来,基于形态学和分子数据的系统发育研究认为叶蝉科是并系群,科内窄颊叶蝉亚科Ulopinae和圆痕叶蝉亚科Megophthalminae互为姊妹群,与角蝉分支(犁胸蝉科Melizoderidae、美角蝉科Melizoderidae和角蝉科Membracidae)聚成一支[5,8,14],而叶蝉科其他亚科支系间亲缘关系仍处于争论中。因此,若要完善叶蝉科的系统发育分析,还需寻找更多的特征依据。
精子是有性生殖动物中高度特化且形态最多样化的一类特殊细胞[15],对种族的繁衍、延续至关重要。昆虫精子因快速、趋异的进化特性,形态结构复杂多样,尤其是精子的超微结构在不同类群间表现出显著差异,可为昆虫分类、进化及系统发育分析提供有效的特征依据[1622]。然而,关于叶蝉科昆虫的精子超微结构研究迄今仅涉及少数种类,其中精子超微结构被完整研究的种类只有6种,包括玉米黄翅叶蝉Dalbulus maidis (Delong & Wolcott)、条沙叶蝉Psammotettix striatus (Linnaeus)、横线顶带叶蝉Exitianus nanus (Distant)、短二室叶蝉Balclutha brevis Lindberg、大青叶蝉Cicadella viridis (Linnaeus)和白边大叶蝉Kolla paulula (Walker)[2328]。因此,亟须开展更多叶蝉科昆虫的精子研究。
琼凹大叶蝉Bothrogonia qiongana Yang et Li, 1980,隶属于叶蝉科大叶蝉亚科Cicadellinae凹大叶蝉属Bothrogonia,已知分布于中国华中、华南等地山间阴湿林区,尤其在海南地区广泛分布,为害林木及近林区农作物,是一类重要潜在农林业害虫[29]。本研究采用光学和电子显微镜技术,对琼凹大叶蝉雄性生殖器官、精子发生及精子超微结构进行观察研究,旨在为叶蝉科及头喙亚目系统发育分析提供更多有用的特征依据。
1 材料与方法
1.1 供试标本
琼凹大叶蝉雄成虫于2020年,2021年的6月-8月在海南省五指山市海南热带雨林国家公园五指山片区(18°54′N, 109°40′E)扫网捕获。网捕采集的成虫装入预先盛放有新鲜枝条的养虫笼内,带回实验室备用。
1.2 光学显微镜样品制备与观察
用乙酸乙酯将新鲜雄性活体成虫麻醉,放入盛有磷酸缓冲液(0.1 mol/L PBS, pH 7.2)的凹面皿中,在Olympus SZX7体视显微镜下迅速解剖,获得完整的雄性生殖系统,并置于装有HQimagie C630成像系统的Nikon SMZ800N光学体视显微镜下观察、拍照。
精子形态观察:将快速解剖分离出来的贮精囊转移至预先滴有磷酸缓冲液的洁净载玻片上,破壁使囊内精子游离出来,加盖盖玻片后置于连有Nikon DSFi3成像系统的Nikon NI/E显微镜下观察、拍照。
精子细胞核形态观察:将贮精囊置于预先滴有蒸馏水的洁净载玻片上,破壁后使精子游离出来,室温条件下晾干后用4,6二脒基2苯基吲哚(DAPI, Beyotime)对精子进行染色,蒸馏水冲洗干净后在显微镜下观察、拍照。
在同一显微镜下,随机拍摄50个精子和精子细胞核,采用NISElements (D 5.20.00)软件测量长度,并结合Excel 2010软件及SPSS进行精子长度统计、分析。
1.3 透射电子显微镜样品制备与观察
样品预处理:用乙酸乙酯将新鲜雄性活体成虫麻醉,在低温环境下将其置于盛有2%多聚甲醛-2.5%戊二醛固定液的表面皿中,在体视显微镜下快速解剖。将精巢小管和贮精囊剪切为1 mm3的样块,投入盛有添加3%蔗糖溶液的多聚甲醛戊二醛固定液的离心管中,4℃条件下避光固定12 h以上。
透射电子显微镜样品制备与观察:预处理后的样品室温条件下用磷酸缓冲液漂洗,4℃条件下置于1%锇酸中固定2 h,经磷酸缓冲液漂洗后用乙醇溶液(30%、50%、75%、80%、90%、100%)逐级脱水。脱水后的样品依次经过不同浓度的乙醇LR White树脂混合物(乙醇和LR White树脂体积比为3∶1,1∶1和1∶3)及纯LR White树脂渗透后包埋,并置于烘箱内于60℃条件下聚合48 h。聚合好的样品胶粒使用Leica EM UC7超薄切片机进行定位及切片,切片厚度约70 nm,经醋酸双氧铀和柠檬酸铅双重染色后,在Hitachi HT7700透射电子显微镜80 kV下观察并拍照。
1.4 组织学观察
聚合好的样品胶粒经修整后,用装有玻璃刀的切片机切成厚度约800 nm的半薄切片。将样品切片置于预先滴有蒸馏水的洁净载玻片水滴上,烤干后经0.5%甲苯胺蓝染色,蒸馏水冲洗,再次烤干,最后在显微镜下观察、拍照。
2 结果与分析
2.1 琼凹大叶蝉雄性生殖器官
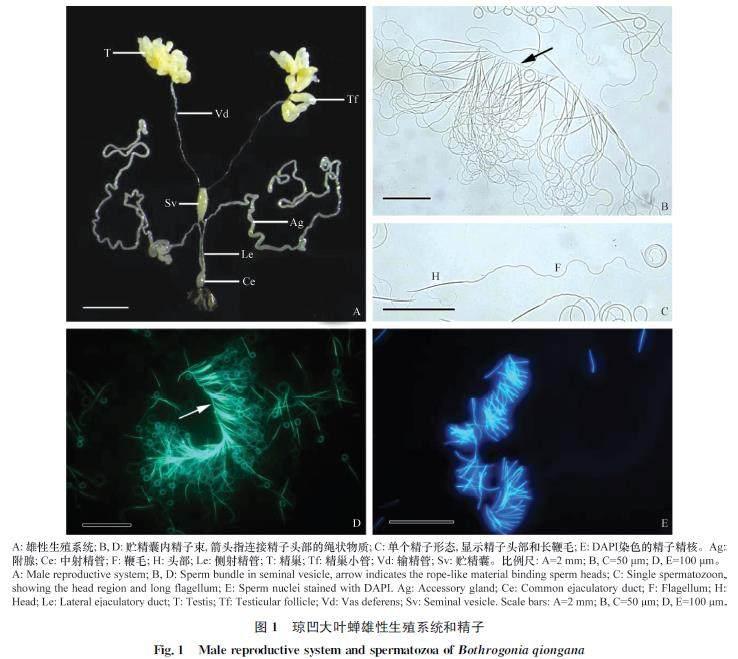
琼凹大叶蝉雄性生殖系统由精巢、输精管、贮精囊、附腺、射精管及外生殖器组成(图1A)。其中1对精巢左右对称,各由12个长度约为1.27 mm的淡黄色指状精巢小管组成,基部连接输精管。2条输精管细长,前端略粗,后端较细,末端膨大形成长卵形、长宽比约为5∶1的淡黄色贮精囊,并与1对发达的附腺连接侧射精管。2条侧射精管末端汇合形成膨大、近球状的中射精管,最后与外生殖器连接(图1A)。
2.2 琼凹大叶蝉精子发生
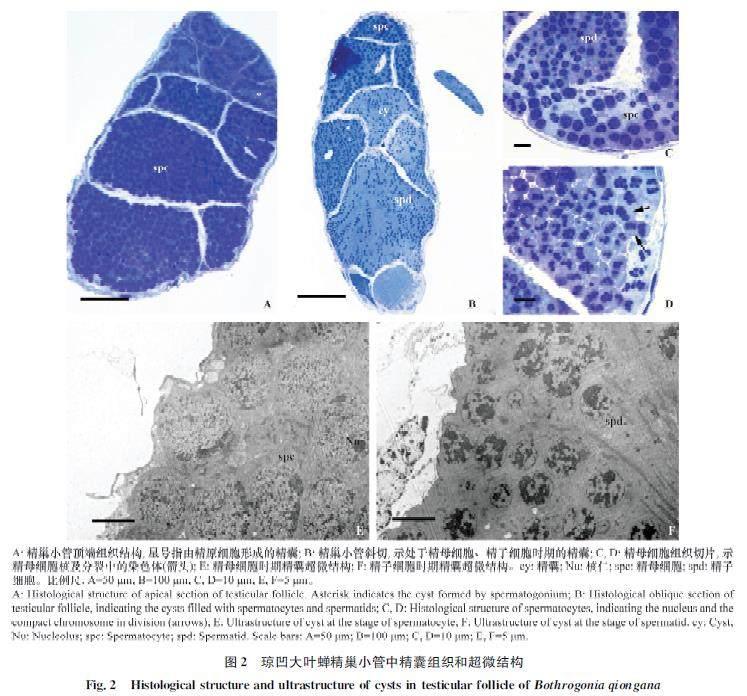
琼凹大叶蝉精子发生在精巢小管中以精囊为单位同步进行细胞分裂、形变(图2A~D)。精巢小管顶端精原细胞被非生殖性细胞包围形成精囊(图2A,星号),精原细胞在精囊中进行多次有丝分裂产生精母细胞(图2A, 2E)。精母细胞经历2次分裂产生精子细胞(图2C, 2D, 2F),而精子细胞经过形变最终形成线状成熟精子(图1C, 2F)。精子发生早期,随着精原细胞的产生、分裂及增殖,精巢小管内精囊逐渐增多,体积增大(图2A~B),向基部移动。精原细胞经过多次连续有丝分裂后产生精母细胞,而处于精母细胞时期的精囊内细胞体积较大,具有直径约8.3 mm的细胞核,且在核周细胞质内有大量为细胞分裂提供能量的线粒体(图2C, 2E, 3A)。精子发生中期,精囊内精母细胞经历2次分裂产生精子细胞(图2B~D)。精子细胞相比于精母细胞,细胞核明显较小,直径约4.3 mm(图2C, 2F)。
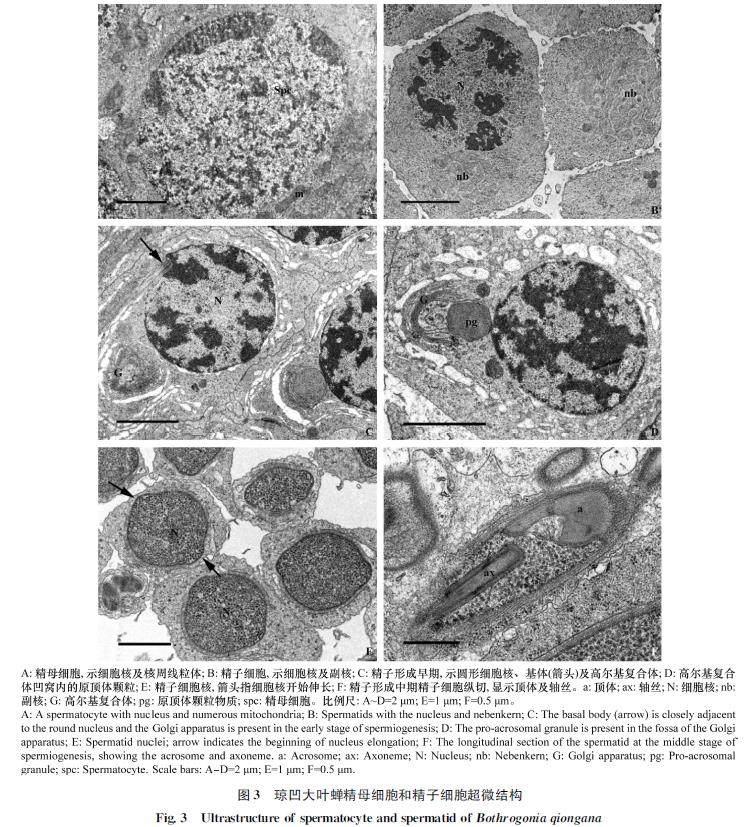
精子发生后期是精子细胞形变转化为线状精子的过程,又称为精子形成时期。精子形成初期,精子细胞具有染色质较均匀的圆球状细胞核,而进入精子形成早期细胞核内染色质开始小区域凝集,细胞质内线粒体聚集融合形成连锁状副核结构(图3B)。随着时间的延续,细胞质内出现明显的高尔基复合体及原顶体结构,同时细胞核基部出现由中心粒形变形成的基体结构(图3C)。原顶体颗粒出现在高尔基复合体凹窝内,体积逐渐增大,并随高尔基复合体开始移向细胞核顶端位置(图3C, 3D)。细胞核基部基体产生轴丝结构。随着轴丝的出现,细胞质中副核开始移向轴丝两侧。精子形成中期,精子细胞细胞核由球状开始向两端伸长,核内的染色质继续凝集(图3E)。而细胞质内的原顶体颗粒与高尔基复合体一起移动至细胞核顶端,形成内部具腔的顶体结构(图3F)。精子细胞核基部副核形成2条大小相等的线粒体衍生物,平行于轴丝结构(图4C)。顶体、细胞核及线粒体衍生物等结构随精子形成过程逐渐伸长(图4A, 4D),外围具有一圈明显的单层微管结构(图4B, 4C)。精子形成后期,细胞核基部中心粒周围物质逐渐在细胞核与线粒体衍生物之间形成中心粒侧体结构(图4D)。精子细胞内组成精子的各部分结构继续伸长,同时细胞核内染色质进一步凝集。精子形成末期,精子细胞的细胞核伸长呈圆柱状,核内染色质变得致密(图4E, 4F),核外微管层逐步消失,而精子细胞质膜内仍具有部分细胞质残余物质(图4F,星号)。随着时间的推移,精子各组成部分完成伸长过程,其中精子头部顶体呈帽状结构插入细胞核顶端,颈区中心粒侧体沿鞭毛延伸成副体,鞭毛轴丝和两条线粒体衍生物随鞭毛延伸至末端。精子形变成熟后,与形成末期精子细胞区别的典型特征为精子质膜内细胞质残余物质消失不见,呈现透明状(图6B,星号)。
2.3 琼凹大叶蝉精子超微结构
贮精囊内成熟精子长线状,约(196.41±1.67) μm(样本量50,平均值±标准误),主要由较短的头部和细长的鞭毛组成(图1C),其中精子头部细胞核长约(39.01±0.22) μm(图1E),头、尾长度比约为1∶4。琼凹大叶蝉精子整体形态无多态性现象,贮精囊内成熟精子头部顶端排列整齐由绳状物质连成一排,形成梳状精子束(图1B, 1D)。
精子头部主要由致密的长细胞核和位于细胞核顶端的顶体组成(图5A, 5B)。顶体圆锥状,长度较短,约3 μm,基部直径约0.4 μm,由纤维管状结构组成(图5A, 5B)。顶体顶端通常插入胞外基质中,后端多呈帽状插入精核顶端,顶体内形成顶体腔(图5A, B)。顶体腔直径渐增,前端通常不与顶体同轴心,后端多不规则。顶体末端两侧多延伸成突起插入细胞核顶端,横切图上清晰可见(图5A)。细胞核细长,圆柱状(图1C, 1E, 5C),由致密染色质组成。精核直径自顶端处至基部渐增,0.4~0.6 μm,其横切由前端椭圆形至特殊的不规则五边形(图5A, 6A, 6B)。
头部细胞核与尾部鞭毛的连接区为精子颈区,主要由中心粒和中心粒侧体组成。琼凹大叶蝉精子细胞核末端平截、一侧凹陷,由中心粒连接尾部轴丝,而凹陷区域出现中心粒侧体连接鞭毛线粒体衍生物(图5D, 5E)。从精子颈区的横、纵切图中可见,中心粒侧体为致密片层状结构,在精核凹陷区紧邻细胞核,长度从凹陷区前端延伸至鞭毛轴丝区,连接精核和线粒体衍生物(图5D, 5E, 6C, 6D, 7A)。
琼凹大叶蝉精子尾部鞭毛较长,主要由1条轴丝,2条线粒体衍生物,2条副体,2条细小附结构及鞭毛中心物质组成(图1C, 6E)。鞭毛中线粒体衍生物为1对长度和直径大小对称的结构,长度延伸至鞭毛末端,占据整个鞭毛的大部分区域。从纵切图中可见,线粒体衍生物由一列垂直于纵轴、规则排列的嵴状结构组成,其中嵴状结构间隔13 nm,直径38 nm(圖5E)。随鞭毛长度向后延伸,线粒体衍生物横切呈现出不同形状,前端卵圆状,中间兔耳状,后端芒果状(图6C~F);且从横切图中可明显看到线粒体衍生物具有电子稀疏区和电子致密区,其中底部电子致密区有晶状体结构(图7D)。此外,从横、纵切图中明显可见线粒体衍生物基部区域中央具有电子稀疏的间隙区(图6D, 6E,箭头),且间隙区直径随线粒体衍生物长度延伸变大,之后消失不见(图5E, 6D, 6E, 6F, 7B)。
鞭毛轴丝较长,始于中心粒延伸达整个鞭毛,具有典型的9+9+2型微管模式,即中央2个中心微管,内层9个双微管,外围9个副微管(图6E, 6F)。其中轴丝副微管间有粗纤维,双微管有动力蛋白臂及伸向中心微管的辐射链。沿鞭毛长度的延伸,鞭毛中副体和线粒体衍生物相继消失,末端规则排列的轴丝结构逐渐变得杂乱无序(图6A)直至消失。鞭毛中两条副体平行于轴丝,位于轴丝和线粒体衍生物之间(图6E)。副体结构细小,直径约100 nm,横切呈现规则的椭圆形或近圆形,同时副体内侧出现细小附结构(图6E, 7D)。副体长度较短,协同内侧细小附结构随鞭毛长度延伸而消失,仅出现在鞭毛起始区域,明显短于轴丝和线粒体衍生物(图6E, 6F)。此外,研究发现精子鞭毛基部,轴丝与线粒体衍生物中间还出现了鞭毛中心物质(图7A~C)。
3 结论与讨论
琼凹大叶蝉具有叶蝉科已报道种类的精子形成及形态结构的共同特征:1)精子细胞内高尔基复合体形成精子顶体,线粒体融合形变为线粒体衍生物,中心粒产生轴丝结构;2)单层微管结构在精子形成过程中围绕精子各组成部分,在精子成熟时消失;3)成熟精子细长、线状,无多态性,头部聚集形成精子束;4)圆锥状顶体长度短,内部具有顶体腔,末端两侧多延伸2条突起插入细胞核顶端;5)圆柱状细胞核染色质致密,末端平截、侧边多凹陷;6)颈区中心粒连接轴丝与平截细胞核,片层状中心粒侧体于细胞核凹陷区连接细胞核与线粒体衍生物;7)尾部鞭毛细长,多由1条9+9+2型轴丝,2条副体,2条线粒体衍生物组成;8)2条副体结构相对较小,随鞭毛长度延伸最先消失;9)线粒体衍生物大小相等,由嵴状结构组成,内部多具有晶状体结构[2328,30]。但琼凹大叶蝉也有其独特的特征,即横切呈五边形的细胞核、电子稀疏间隙区直径增大的线粒体衍生物。
线粒体衍生物作为昆虫精子鞭毛中重要的结构组成部分之一,由昆虫精子细胞内线粒体衍化形成,为精子运动提供能量。本研究中琼凹大叶蝉线粒体衍生物基部区域具有直径明显增大的电子稀疏间隙区。在已报道叶蝉科种类中仅白边大叶蝉具有该结构[27],但不同的是白边大叶蝉间隙区直径均一、无明显变化趋势。半翅目昆虫除头喙亚目广蜡蝉类(间隙区小、不明显,横切多呈圆形),其他类群同大多数昆虫一样线粒体衍生物中无类似的间隙区结构[19,3132]。基于线粒体衍生物间隙区,我们认为大叶蝉亚科中凹大叶蝉属与边大叶蝉属Kolla的亲缘关系近,而非大叶蝉属,这与孟泽洪等[33]根据线粒体Cyt b基因得出的凹大叶蝉属与边大叶蝉属亲缘关系较近的研究结果相符合,但由于大叶蝉亚科昆虫精子结构涉及种类较少,仍有待于进一步研究。此外,琼凹大叶蝉精子鞭毛中出现了2条位于线粒体衍生物、轴丝和副体之间的细小附结构,以及位于鞭毛基部轴丝、线粒体衍生物之间的鞭毛中心物质,这与玉米黄翅叶蝉和短二室叶蝉的一致,也说明以上两种结构并非角顶叶蝉亚科独有的特征[26,28]。关于2条特殊的细小附结构,研究者曾认为该结构可能是由轴丝周围膜池残余物形成[26]。尽管也有类似的细小附结构出现于异翅亚目、长翅目、直翅目昆虫精子鞭毛中[22,3437],但它们是否为同一类结构以及它们的来源、功能目前都尚不清楚,仍需开展更多深入的研究。
琼凹大叶蝉精子发生过程中精子细胞外围绕的单层微管结构,仅出现在精子形成期各组成部分伸长过程中,在精子成熟时消失不见,与已报道种类一致[27,30]。研究发现微管结构对精子细胞的形变和伸长起重要作用,且该结构与中心粒周围物质密切相关[38]。精子发生过程中中心粒周围物质参与了微管生成(主要为γ微管蛋白),而其剩余部分则会在精子形成后期沉积形成中心粒侧体。大多数昆虫的中心粒侧体会沿着鞭毛向后伸长形成2条副体结构,虽然二者之间的直接联系已被证实[17,38],但它们的具体功能还尚不清楚。本研究中琼凹大叶蝉片层状中心粒侧体连接细胞核与线粒体衍生物,延伸至鞭毛轴丝区后形成2条长度较短、横切呈椭圆形的副体结构。现有研究结果表明,叶蝉科昆虫精子副体在不同亚科类群间差异较大,在角顶叶蝉亚科副体长度较长几乎延伸至鞭毛端部,横切呈不规则三角形[2526,28];而在大叶蝉亚科副体长度较短仅出现在鞭毛起始区域,横切呈椭圆形[24,27]。此外,副体结构在头喙亚目不同类群间也具有较大差异,其中蝉总科和沫蝉总科昆虫缺少副体结构[3943],蜡蝉总科昆虫副体结构异常发达[3132,44],角蝉总科昆虫副体结构相对较为发达[2428,45]。由于在不同类群间表现出较大变异,我们推测副体结构很有可能为叶蝉科分类及半翅目头喙亚目高级阶元的系统发育分析提供有用的特征。
精子发生过程中精原细胞经过一系列分裂、形变最终成为成熟精子。节肢动物尤其是六足类雄性个体精子成熟后通常发生一定程度的精子接合形成精子束,以提高交配期间精子传输率,从而更有效地延续种族。关于精子接合方式,昆虫有初级接合(源于自身精子发生过程,由单个精原细胞产生的全部精子头部嵌入精囊细胞或包裹于帽状物质内形成精子束)和次级接合(精子发生完成后游离精子通过特定物质接合在一起形成精子束)2种方式,其中次级接合被认为比初级接合更为进化[46]。已报道头喙亚目类昆虫贮精囊中均有精子束存在,且精子头部多插入胞外基质。本研究中琼凹大叶蝉精子在贮精囊内由绳状物质连接头部顶端形成梳状精子束,与已报道叶蝉的彗星状、沫蝉的球状精子束差异较大,与蝉科昆虫的绳状精子束相类似[2526,28,3940,43]。结合精子发生特点及精子束形态,我们推断琼凹大叶蝉精子接合方式為次级接合,与Barcellos等[28]认为的沫蝉总科和角蝉总科精子初级接合方式观点不同,与Higginson等[46]的观点相一致。尽管研究证实凹大叶蝉精子束绳状连接物质为透明蛋白质类物质[47],但其来源、作用机理仍不清楚。明确头喙亚目各类群间精子接合方式、接合物质来源及其作用机理或许可为研究头喙亚目种群进化提供相应的研究思路,但由于头喙亚目昆虫精子结构研究涉及类群种类较少,亟须开展更多的研究。
參考文献
[1] BARTLETT C R, DEITZ L L, DMITRIEV D A, et al. The diversity of the true hoppers (Hemiptera: Auchenorrhyncha) [M]∥FOOTTIT R G, ADLER P H. Insect biodiversity: science and society, Ⅱ. New Jersey: John Wiley & Sons Ltd, 2018: 501590.
[2] DIETRICH C H, DDITZ L L. Superfamily Membracoidea (Homoptera: Auchenorrhyncha). Ⅱ. Cladistic analysis and conclusions [J]. Systematic Entomology, 1993, 18: 297311.
[3] HAMILTON K G A. The grounddwelling leafhoppers Myerslopiidae, new family, and Sagmatiini, new tribe (Homoptera: Membracoidea) [J]. Invertebrate Taxonomy, 1999, 13: 207235.
[4] CRYAN J R, URBAN J M. Higherlevel phylogeny of the insect order Hemiptera: is auchenorrhyncha really paraphyletic? [J]. Systematic Entomology, 2012, 37: 721.
[5] DIETRICH C H, ALLEN J M, LEMMON A R, et al. Anchored hybrid enrichmentbased phylogenomics of leafhoppers and treehoppers (Hemiptera: Cicadomorpha: Membracoidea) [J]. Insect Systematics and Diversity, 2017, 1(1): 5772.
[6] SONG Nan, CAI Wanzhi, LI Hu. Deeplevel phylogeny of Cicadomorpha inferred from mitochondrial genomes sequenced by NGS [J/OL]. Scientific Reports, 2017, 7: 10429. DOI: 10.1038/s41598017111320.
[7] JOHNSON K P, DIETRICH C H, FRIEDRICH F, et al. Phylogenomics and the evolution of hemipteroid insects [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(50): 1277512780.
[8] SKINNER R K, DIETRICH C H, WALDEN K K O, et al. Phylogenomics of Auchenorrhyncha (Insecta: Hemiptera) using transcriptomes: examining controversial relationships via degeneracy coding and interrogation of gene conflict [J]. Systematic Entomology, 2020, 45: 85113.
[9] XUE Qingquan, DIETRICH C H, ZHANG Yalin. Phylogeny and classification of the leafhopper subfamily Eurymelinae (Hemiptera: Cicadellidae) inferred from molecules and morphology [J]. Systematic Entomology, 2020, 45: 687702.
[10]CAO Yanghui, DIETRICH C H. Phylogenomics of flavobacterial insect nutritional endosymbionts with implications for Auchenorrhyncha phylogeny [J]. Cladistics, 2021, 38(1): 3858.
[11]DU Yimin, LIANG Zonglei, DIETRICH C H, et al. Comparative analysis of mitochondrial genomes of Nirvanini and Evacanthini (Hemiptera: Cicadellidae) reveals an explicit evolutionary relationship [J]. Genomics, 2021, 113: 13781385.
[12]WANG Xianyi, WANG Jiajia, DAI Renhuai. Structural features of the mitogenome of the leafhopper genus Cladolidia (Hemiptera: Cicadellidae: Coelidiinae) and phylogenetic implications in Cicadellidae [J]. Ecology and Evolution, 2021, 11(18): 1255412566.
[13]YU Tinghao, ZHANG Yalin. Two complete mitochondrial genomes of Mileewinae (Hemiptera: Cicadellidae) and a phylogenetic analysis [J/OL]. Insects, 2021, 12(8): 668. DOI: 10.3390/insects12080668.
[14]HU Yanhua, DIETRICH C H, SKINNER R K, et al. Phylogeny of Membracoidea (Hemiptera: Auchenorrhyncha) based on transcriptome data [J]. Systematic Entomology, 2023, 48(1): 97110.
[15]BIRKHEAD T R, HOSKEN D J, PITBICK S. Sperm morphological diversity [M]∥BIRKHEAD T R, HOSKEN D J, PITBICK S. Sperm biology: an evolutionary perspective. London: Elsevier, 2009: 68149.
[16]奚耕思, 鄭哲民. 蝗总科精子超微形态比较及其在系统分类上的意义[J]. 昆虫分类学报, 1997, 19(1): 19.
[17]JAMIESON B G M, DALLAI R, AFZELIUS B A. Insects: Their spermatozoa and phylogeny [M]. Plymouth: Science Publishers, 1999: 447480.
[18]DALLAI R. The contribution of the sperm structure to the reconstruction of the hexapod phylogeny [J]. Proceedings of Arthropodan Embryological Society of Japan, 2009, 43: 2338.
[19]DALLAI R. Overview on spermatogenesis and sperm structure of Hexapoda [J]. Arthropod Structure & Development, 2014, 43: 257290.
[20]DALLAI R, GOTTARDO M, BEUTEL R G. Structure and evolution of insect sperm: new interpretations in the age of phylogenomics [J]. Annual Review of Entomology, 2016, 61: 123.
[21]GOTTARDO M, DALLAI R, MERCATI D, et al. The evolution of insect sperm—an unusual character system in a megadiverse group [J]. Journal of Zoological Systematics and Evolutionary Research, 2016, 54: 237256.
[22]張贝贝. 长翅目昆虫精子发生和精子超微结构研究[D]. 杨凌: 西北农林科技大学, 2016.
[23]FOLLIOT R, MAILLET P L. Ultrastructure de la spermiogenèse et du spermatozode de divers insects Homoptères [M]∥BACCETTI B. Comparative spermatology. New York: Academic Press, 1970: 289300.
[24]ZHANG Beibei, DAI Wu. Ultrastructure of the spermatozoa of Cicadella viridis (Linnaeus) and its bearing on the phylogeny of Auchenorrhyncha [J]. Micron, 2012, 43(9): 978984.
[25]SU Mei, DIETRICH C H, ZHANG Yalin, et al. Ultrastructure of the spermatozoa of Psammotettix striatus (Linnaeus) and Exitianus nanus (Distant) (Hemiptera: Auchenorrhyncha: Cicadellidae: Deltocephalinae) [J]. Arthropod Structure & Development, 2014, 43: 559570.
[26]VITALE D G M, DURSO V, VISCUSO R. Morphostructural investigation on spermatozoa and sperm bundles of the leafhopper Balclutha brevis Lindberg 1954 (Hemiptera: Deltocephalinae) [J]. Zoomorphology, 2016, 135: 441451.
[27]ZHANG Beibei, ZHANG Chunni, DIETRICH C H, et al. Anatomy and ultrastructure of male reproductive system in two leafhoppers Cicadella viridis (Linnaeus) and Kolla paulula (Walker) (Hemiptera: Auchenorrhyncha: Cicadellidae) [J]. Annals of the Entomological Society of Amercia, 2016, 109(3): 463472.
[28]BARCELLOS M S, DIAS G, LINONETO J. Redescription of the sperm morphology of Dalbulus maidis (Hemiptera: Cicadellidae: Deltocephalinae) [J]. Tissue & Cell, 2018, 51: 5661.
[29]倪俊强, 楊茂发, 孟泽洪. 凹大叶蝉属分类研究进展[J]. 贵州农业科学, 2010, 38(11): 143146.
[30]KITAJIMA E W, CRUZLANDIM C. An electron microscopic study of the process of differentiation during spermiogenesis in the corn leafhopper Dalbulus maidis Del. & W. (Homoptera: Cicadellidae) [J]. Biological Reviews, 1972, 8: 519.
[31]江珍, 秦道正. 透明疏广蜡蝉精子超微结构[J]. 昆虫学报, 2018, 61(2): 246254.
[32]JIANG Zhen, LIU Jianing, QIN Daozheng. Sperm ultrastructure of Pochazia shantungensis (Chou & Lu) and Ricania speculum (Walker) (Hemiptera, Ricaniidae) with phylogenetic implications [J]. Zookeys, 2019, 880: 4359.
[33]孟泽洪, 杨茂发, 周玉锋, 等. 基于Cyt b 基因序列的大叶蝉亚科部分种类分子系统学分析[J]. 贵州农业科学, 2013, 41(7): 15.
[34]杜喜翠, 石福明. 中华蝈螽与中华螽斯精子超微结构研究 (直翅目螽斯总科) [J]. 动物分类学报, 2005, 30(3): 461466.
[35]张贝贝, 谢莎, 花保祯. 刘氏蝎蛉的精子发生和精子超微结构[J]. 昆虫学报, 2017, 60(4): 389400.
[36]BACCETTI B. Spermatozoa and phylogeny in orthopteroid insects [M]∥BACCETTI B. Evolutionary biology of orthopteroid insects. Chichester: Halsted Press, 1987: 12112.
[37]MERCATI D, GIUSTI F, DALLAI R. A novel membrane specialization in the sperm tail of bug insects (Heteroptera) [J]. Journal of Morphology, 2009, 270: 825833.
[38]DALLAI R, PAOLI F, MERCATIA D, et al. The centriole adjunct of insects: Need to update the definition [J]. Tissue & Cell, 2016, 48: 104113.
[39]CHAWANJI A S, HODGSON A N, VILLET M H. Sperm morphology in four species of African platylieurine cicadas (Hemiptera: Cicadomorpha: Cicadidae) [J]. Tissue & Cell, 2005, 37: 257267.
[40]CHAWANJI A S, HODGSON A N, VILLET M H. Sperm morphology in five species of cicadettine cicadas (Hemiptera: Cicadomorpha: Cicadidae) [J]. Tissue & Cell, 2006, 38: 373388.
[41]崔贝贝, 魏琮. 四种蝉科昆虫的精子形态 (半翅目: 蝉科) [J]. 昆虫学报, 2018, 61(8): 9911002.
[42]CUI Beibei, WEI Cong. Ultrastructure of spermatozoa in three cicada species from China (Hemiptera, Cicadomorpha, Cicadidae) [J]. Zookeys, 2018, 776: 6180.
[43]HODGSON AN, RIDGEWAY J A, VILLET M H. Sperm ultrastructure and spermatodesm morphology of the spittle bug Locris transversa (Thunberg 1822) (Hemiptera: Cercopidae) [J]. Invertebrate Reproduction & Development, 2016, 60(2): 8794.
[44]戴华国, 宋小玲, 吴小毅. 稻褐飞虱精子的超微结构[J]. 南京农业大学学报, 1996, 19(2): 109111.
[45]ARAU'JO V A, BO S N, MOREIRA J, et al. Ultrastructural characterization of the spermatozoa of Aethalion reticulatum Linnaeus 1767 (Hemiptera: Auchenorrhyncha: Aethalionidae) [J]. Micron, 2010, 41(4): 306311.
[46]HIGGINSON D M, PITNICK S. Evolution of intraejaculate sperm interactions: do sperm cooperate? [J]. Biological Reviews, 2011, 86: 249270.
[47]HAYASHI F, KAMIMURA Y. The potential for incorporation of male derived proteins into developing eggs in the leafhopper Bothrogonia ferruginea [J]. Journal of Insect Physiology, 2002, 48: 153159.
(責任编辑:杨明丽)

