噻虫胺种子处理对西瓜生长发育的影响及其残留分析
姚众 季宇超 张丽萍 刘珍 范巧兰 常芳娟 张贵云
摘要
為明确新烟碱类杀虫剂噻虫胺种子处理对西瓜生长发育和品质的影响,以及在西瓜中的残留状况,本研究以10%噻虫胺种子处理悬浮剂为供试药剂,采用拌种试验,开展噻虫胺对西瓜生长发育的影响及残留分析研究。结果表明,噻虫胺有效成分用量100~250 g/100 kg范围内,对西瓜出苗安全;噻虫胺拌种处理对西瓜苗期的株高、茎粗、叶绿素含量和叶面积有一定的促进作用,随着西瓜的生长促进作用减弱,西瓜出苗后30 d,各处理间差异不显著;噻虫胺各处理西瓜产量均高于空白对照,对西瓜有一定的增产作用;噻虫胺拌种可不同程度地提高西瓜果实中可溶性糖、可溶性固形物含量,提升西瓜的品质;随着西瓜生长发育,叶片内噻虫胺含量逐渐降低,出苗后45 d,叶片内未检测到噻虫胺残留;西瓜收获时果实中未检测到噻虫胺残留,西瓜根部土壤中噻虫胺的残留量在0.041 2~0.097 5 mg/kg之间。综上所述,噻虫胺100~250 g/100 kg用量范围内处理西瓜种子,对西瓜苗期生长有一定促进作用,并可提高产量,改善西瓜的品质,叶片内噻虫胺含量随植株生长逐渐降低,果实中无残留,本研究为噻虫胺种子处理在西瓜生产实践中合理、安全、高效的应用提供技术支撑。
关键词
噻虫胺; 种子处理; 生长发育; 品质; 残留
中图分类号:
S 482.37
文献标识码: A
DOI: 10.16688/j.zwbh.2023231
Effects of clothianidin seed treatment on watermelon growth and development, and its residue analysis
YAO Zhong, JI Yuchao, ZHANG Liping*, LIU Zhen, FAN Qiaolan, CHANG Fangjuan, ZHANG Guiyun
(Institute of Cotton Research, Shanxi Agricultural University, Yuncheng 044000, China)
Abstract
To elucidate the effects of seed treatment with neonicotinoid insecticide clothianidin on the growth, development, and quality of watermelon, physiological assessments of watermelon and residue analyses of clothianidin were performed using clothianidin 10% FS as the test agent. The results showed that clothianidin ranged from 100 to 250 g/100 kg was safe for emergence of watermelon seedling. Clothianidin treatment had a positive effect on plant height, stem diameter, chlorophyll content, and leaf area during the seedling stage. This positive effect weakened with the growth of plant. After seed emergence for 30 days, no significant differences were observed among treatments. Moreover, the treatment resulted in increased yields compared to the control group, and enhanced the content of soluble sugar and soluble solids in watermelon, consequently improving the quality of watermelon. As watermelon plants matured, the content of clothianidin in leaves gradually decreased, with no detectable clothianidin residue remaining 45 days after emergence. In addition, no clothianidin residue was detected in harvested fruits. The residual level of clothianidin in watermelon root soil ranged from 0.041 2 to 0.097 5 mg/kg. In conclusion, clothianidin seed treatment at dosages of 100-250 g/100 kg promotes the growth of watermelon at seedling stage, increases yield, and improves watermelon quality. The content of clothianidin in leaves gradual decline and no residue were determined in fruits. This study provides technical support for the reasonable, safe and efficient application of clothianidin seed treatment in watermelon production practices.
Key words
clothianidin; seed treatment; growth and development; quality; residue
西瓜Citrullus lanatus是葫芦科西瓜属植物,果实营养丰富,果肉甘甜,是世界上重要的园艺作物之一。我国是世界上西瓜种植面积最大、产量最高的国家,西瓜产业在农村经济发展中占据重要地位[1]。
噻虫胺和吡虫啉均为含硝基亚胺药效基团的烟碱类杀虫剂的代表性药剂,具有高效低毒、内吸性强,与常规农药无交互抗性等优点,被广泛应用于多种作物防治地下害虫及刺吸式口器害虫[25]。其具有良好的触杀、胃毒活性,应用方式多样,包括土壤处理、叶面喷施和浸种等[6]。其中种子处理是害虫综合治理中的一项重要措施,可以减少农药使用量,降低人工成本,对天敌无明显直接影响,持效期长,能最大限度地减少药剂向周围环境漂移和非靶标生物接触[79]。噻虫胺、吡虫啉等新烟碱类杀虫剂以种子处理方式防治作物上害虫的研究越来越多[1011]。
大量研究表明,种衣剂会因农药种类、含量和植物种类等因素对植物生长产生影响,从而对农产品品质造成影响,如导致其营养成分、风味、色泽、口感等产生改变。Ford等[12]的研究发现,在无虫条件下,新烟碱类农药可促进菠菜植株叶片生长,增强植株活力;Tang等[13]的研究发现,噻虫嗪种子处理有助于保护水稻幼苗,提高水稻产量;Ding等[14]的研究发现,噻虫胺和吡虫啉种子处理在一定浓度范围内能促进玉米幼苗生长;徐蕾等[5]的研究发现,采用600 g/L吡虫啉悬浮剂、70%噻虫嗪种子处理可分散粉剂和70%吡虫啉种子处理可分散粉剂对种子进行包衣可以促进大豆产量和品质的提升。李妍[15]的研究表明,70%噻虫嗪种子处理可分散粉剂拌种可以增加油菜株高和叶面积。目前,尚无新烟碱类杀虫剂拌种对西瓜生长发育及果实产量、品质影响的系统研究。
检测西瓜植株、果实和土壤中农药残留量是了解果品质量和农药环境安全性的重要方法。目前关于噻虫胺、吡虫啉残留检测方法有液相色谱法[16]、液相色谱串联质谱法[1719]等,其中超高效液相色谱串联质谱检测方法已在甘蓝[17]、黄瓜[18]、柑橘[19]等果蔬上应用,但检测分析噻虫胺、吡虫啉种子处理对西瓜叶片、果实及土壤的残留量未见报道。
课题组前期研究表明,用噻虫胺拌种,在有效成分用量为150~200 g/100 kg范围内对西瓜苗期蚜虫有较好的防治效果[20]。为明确噻虫胺对西瓜植株生长发育及果实品质的影响,探究其在西瓜果实、植株中的残留状况,本试验以10%噻虫胺种子处理悬浮剂为供试药剂,60%吡虫啉悬浮种衣剂为对照药剂,采用拌种试验,开展噻虫胺对西瓜生长发育的影响及残留分析研究,以期为噻虫胺种子处理在西瓜生产实践中合理、安全、高效的应用提供技术依据。
1 材料与方法
1.1 供试材料
供试品种:西瓜‘早佳8424,新疆哈密瓜种业有限责任公司生产,市售。
供试药剂:10%噻虫胺种子处理悬浮剂(FS),由山东绿士农药有限公司提供;60%吡虫啉悬浮种衣剂(FSC),拜耳作物科学(中国)有限公司生产,市售。
仪器及试剂:XEVO TQS Micro超高效液相色谱三重四极杆串联质谱仪(UPLCMS/MS),美国Waters公司;BS210S电子天平,德国Sartorius公司;Talboys 945066多管涡旋混合仪,美国Troemner公司;5804R离心机,德国Eppendorf公司。乙腈、甲醇、乙酸、甲酸及乙酸铵等试剂均为色谱级;提取盐包(4 g硫酸镁、1 g氯化钠、0.5 g柠檬酸氢二钠、1 g柠檬酸钠)及净化管(2 mL离心管,装填20 mg PSA、7.5 mg GCB、 142.5 mg无水硫酸镁),岛津技迩 (上海) 商贸有限公司;纯净水,广州屈臣氏食品饮料有限公司。
1.2 田間试验
1.2.1 试验地概况
试验设在山西农业大学棉花研究所试验田。土壤为褐土,pH 8.04,播种前每667 m2施用复合肥(养分含量N 22%、P2O5 18%、K2O 10%,湖北省黄麦岭磷化工有限责任公司)40 kg,有机肥(氮磷钾≥8%,孟州市施可富复合肥有限公司)120 kg。
1.2.2 试验处理
选取健康饱满、大小一致的西瓜种子,采用10%噻虫胺FS按有效成分用量100、150、200、250 g/100 kg进行拌种,以60%吡虫啉FSC 250 g/100 kg为药剂对照,清水为空白对照。拌种后自然晾干,以直播方式播种,每穴2粒种子,定苗后单穴单株,3蔓2瓜,统一采收。每处理4次重复,小区面积30 m2(10 m×3 m),株距40 cm,平均行距250 cm。各小区随机排列,田间常规操作一致。
1.2.3 西瓜生长发育指标测定
西瓜出苗后,统计各处理出苗情况,计算出苗率。出苗15、30、45 d后,采用五点取样法,每点取5株,每小区共选择25株西瓜植株,测量植株株高、主茎粗、叶绿素含量、叶面积。株高:苗期测量植株茎基部到生长点的高度,成株期用卷尺测主蔓长。主茎粗:用游标卡尺测量子叶节下1 cm处的茎粗。叶绿素测定:使用便携式SPAD502 Plus叶绿素仪,测定植株第3片真叶叶尖处的叶绿素含量。叶面积测定:用直尺测西瓜植株第3片真叶的叶长和叶宽,叶面积=叶长×叶宽×0.7。
1.2.4 西瓜产量及品质测定
西瓜成熟后,称量所有西瓜重量,统计每小区产量,计算667 m2产量。可溶性固形物、可溶性糖含量和维生素C含量测定方法参考《果蔬采后生理生化实验指导》[21];可滴定酸含量用PALEasy ACID5苹果数显酸度计测定。
1.3 农药残留测定
1.3.1 试验处理
农药残留试验在盆栽条件下进行,试验设10%噻虫胺FS有效用量100、200、300 g/100 kg,以60%吡虫啉FSC 250 g/100 kg为药剂对照,清水为空白对照,共5个处理。选取健康饱满的西瓜种子,按设置剂量拌种处理后自然晾干,播种到装有4 kg营养土的盆中,每盆6粒,出苗后保留4株,每处理重复4次,每重复10株西瓜苗,随机排列于室外60目防虫网(2.5 m×2 m×2.2 m)内。2~3 d浇适量水,每盆浇水量一致。30、40 d时将500 g磷酸二铵溶于16 L水中,每盆施200 mL。出苗后15 d采集嫩叶,30、45 d时分别在植株上、中、下随机选取叶片,样品经粉碎匀浆后四分法缩分留样10 g于50 mL离心管中,-20℃保存,待测;西瓜成熟后,采收果实及根部土壤,果实四分法粉碎匀浆,土壤过筛,分别留样10 g于50 mL离心管中,于-20℃保存,待测。
1.3.2 残留测定
1.3.2.1 样品前处理
在装有样品的50 mL离心管中,加入10 mL乙腈,2 500 r/min涡旋振荡提取10 min,加入4 g 硫酸镁、1 g氯化钠、0.5 g柠檬酸氢二钠、1 g柠檬酸钠,2 500 r/min涡旋振荡提取5 min,8 000 r/min离心5 min。吸取上清液1.5 mL加入装有142.5 mg 硫酸镁、20 mg PSA、7.5 mg GCB的2 mL离心管中,于涡旋振荡器2 500 r/min涡旋分散固相萃取5 min,5 000 r/min离心2 min,上清液过0.22 μm有机滤膜后,待测。
1.3.2.2 残留测定
用超高效液相色谱串联质谱(UPLCMS/MS)法,参照国家标准GB 23200.1212021[22]进行测定,每处理重复4次。残留测定委托山西农业大学山西功能农产品检验检测中心完成。
1.4 数据处理与分析
使用Excel 2019进行数据整理和统计,在SPSS 20.0软件中对数据进行单因素方差分析,多重比较采用Duncan氏新复极差法。
2 结果与分析
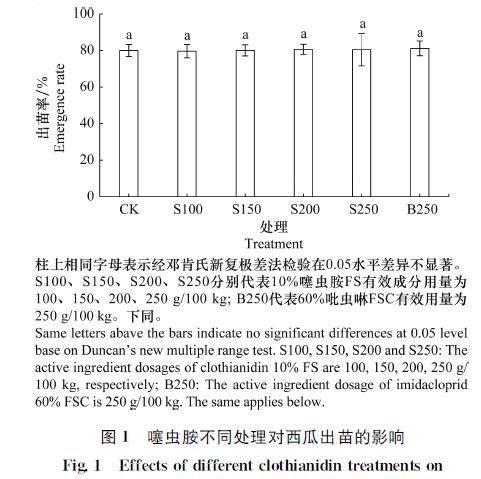
2.1 不同处理对西瓜出苗率的影响
10%噻虫胺FS各处理(100~250 g/100 kg)的出苗率为79.00%~81.00%(图1),均与药剂对照(81.18%)和空白对照(80.00%)的出苗率差异不显著。说明噻虫胺在供试剂量范围内对西瓜出苗安全。
2.2 噻虫胺不同处理对西瓜生长发育的影响
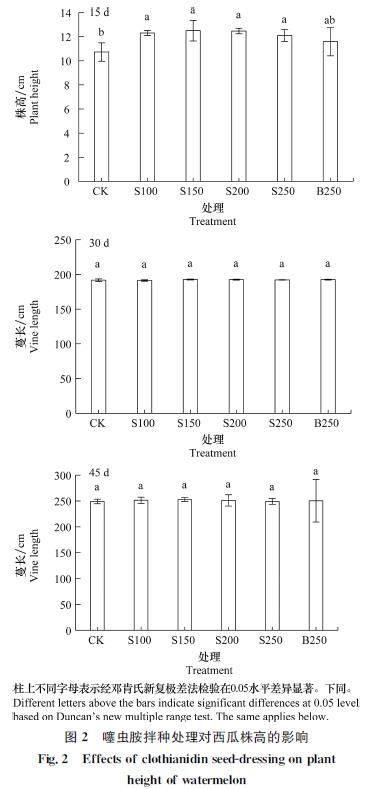
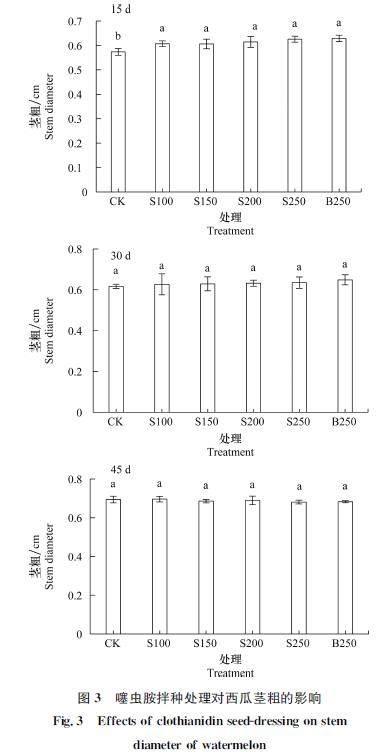
10%噻虫胺FS处理对西瓜株高的影响如图2所示。出苗后15 d,当噻虫胺用量150 g/100 kg时西瓜株高最高,为12.5 cm,较CK增加16.5%,之后随噻虫胺用量的增加而降低,噻虫胺各处理株高均显著高于CK;出苗后30 d和45 d,噻虫胺各处理蔓长与CK差异不显著。由图3可知,出苗后15 d,噻虫胺用量为250 g/100 kg时茎最粗,为0.63 cm,较CK增加9.1%,各处理茎粗显著高于CK;出苗后30 d和45 d,各处理与CK差异不显著。
由图4可知,出苗后15 d,西瓜叶面积随10%噻虫胺FS用量的增加呈现出先升高后降低的趋势,用量200 g/100 kg时叶面积最大,为103.70 cm2,较CK增加9.7%,与CK差异显著;出苗后30 d,噻虫胺各处理叶面积均高于CK,但与CK差异不显著。出苗后45 d噻虫胺各处理叶面积与CK无显著差异。
10%噻虫胺FS拌种处理对西瓜叶绿素(SPAD值)的影响如图5所示。出苗后15 d,叶绿素含量随噻虫胺用量的增加而增加,用量為250 g/100 kg时叶绿素含量最高,SPAD值为50.05,较CK增加16.2%,各处理与CK差异显著。出苗后30 d和45 d,噻虫胺各处理叶绿素含量与CK差异不显著。由上可知,10%噻虫胺FS对西瓜苗期的株高、茎粗、叶绿素含量和叶面积有一定的促进作用,随着西瓜的生长发育促进作用减弱。
2.3 噻虫胺不同处理对西瓜产量及品质的影响
2.3.1 噻虫胺拌种对西瓜产量的影响
由表1可知,10%噻虫胺FS拌种对西瓜有一定的增产作用。噻虫胺拌种各处理产量(2 251.46~2 487.41 kg/hm2)均高于CK(2 174.85 kg/hm2),尤以用量为200 g/100 kg时产量最高,较CK增产14%,增产效果显著。
2.3.2 噻虫胺拌种对西瓜品质的影响
由表1可以看出,可溶性糖含量随着10%噻虫胺FS用量的增加而增加,其中250 g/100 kg用量时可溶性糖含量最高,为13.85%,150~250 g/100 kg用量范围内与CK差异显著;可溶性固形物含量随噻虫胺用量的增加呈现出先增加后减少的趋势,200 g/100 kg用量处理时可溶性固形物含量最高,为8.48%,显著高于对照药剂吡虫啉,高于清水对照,但差异不显著;各处理间维生素C和可滴定酸含量无显著差异。因此,噻虫胺拌种处理可以增加西瓜的可溶性糖和可溶性固形物含量,提高西瓜的品质。
2.4 噻虫胺种子处理后在西瓜叶片内的残留状况
不同浓度的10%噻虫胺FS拌种后,噻虫胺在西瓜叶片中累积量与施药剂量呈正相关;西瓜叶片内药剂含量随着时间的推移而降低(图6)。出苗后45 d叶片内未检测到噻虫胺残留,与对照药剂60%吡虫啉FSC 250 g/100 kg处理相比,西瓜叶片内噻虫胺含量的降解速度高于吡虫啉。
2.5 噻虫胺种子处理的西瓜果实及根部土壤安全性评价
對采收期西瓜果实及根部土壤残留检测结果(表2)表明,在0.01 mg/kg的定量限(LOQ)下,各处理果实样品中均未检测出处理药剂残留。我国食品安全国家标准《食品中农药最大残留限量》(GB 27632021)[23]中未有相应的标准,日本[24]规定西瓜中噻虫胺的最大残留限量是0.2 mg/kg。说明供试药剂在试验剂量范围内拌种对西瓜果实安全、无毒、无残留污染。在供试剂量范围内,西瓜根部土壤中噻虫胺残留量随用药浓度的增加而增加,有效成分用量200 g/100 kg与300 g/100 kg时土壤中噻虫胺残留量差异不显著。
3 结论与讨论
本试验结果表明,10%噻虫胺FS在100~250 g/100 kg范围内拌种对西瓜出苗安全。噻虫胺各处理可以促进西瓜植株苗期的生长,在西瓜出苗后15 d,幼苗株高、茎粗、叶绿素含量和叶面积增加,出苗后30、45 d与CK无显著差异。在供试剂量范围内,噻虫胺可以提高西瓜产量,增加西瓜果实中可溶性糖、可溶性固形物含量,提高西瓜的品质。不同浓度的噻虫胺拌种后,噻虫胺在西瓜叶片中累积量与施药剂量呈正相关。随着西瓜生长发育,叶片内噻虫胺含量逐渐降低,出苗后45 d,叶片内未检测到噻虫胺残留,西瓜收获时果实中未检测到噻虫胺残留,噻虫胺在西瓜根部土壤的残留量在0.041 2~0.097 5 mg/kg之间。
已有研究表明,新烟碱类杀虫剂处理种子后,除具有杀虫生物活性外,还对作物生长有一定的促进作用。Senn等[25]的研究表明,新烟碱类杀虫剂代谢产物可促进油菜、茄子、水稻、马铃薯、大豆等作物生长,增强植株活力,增加作物产量;Thielert等[26]研发的专利表明,新烟碱类杀虫剂通过促进植株体内某些酶的活性,可以提高植物对胁迫的耐受性,表现为促进植株的生长发育等。本研究发现,噻虫胺不同用量处理西瓜种子,对幼苗的株高、叶面积、叶绿素含量及茎粗均有不同程度的促进作用,这可能与噻虫胺在植株内残留及分解、代谢有关。在西瓜出苗后15 d时,噻虫胺在植株内的浓度高,对植物生长发育促进作用最强;随着时间的推移,噻虫胺在植株体内逐渐消解,浓度降低,在西瓜出苗后30 d和45 d时,噻虫胺对植株株高、叶面积、叶绿素含量及茎粗促进作用减弱。噻虫胺在植物中的代谢产物2氯噻唑基5羧酸(CTA)可诱导拟南芥中与水杨酸(SA)相关的生理生化反应[27]。水杨酸是诱导系统获得性抗性(SAR)的广泛植物防御反应的局部和系统激活剂,可增强植物对生物/非生物的胁迫能力。本研究结果噻虫胺对西瓜生长发育的促进作用是否与CTA的作用效果有关有待进一步研究。造成这些结果的另一个原因可能是新烟碱类化合物可提高植物中某些酶的活性,如葡萄糖6磷酸脱氢酶(G6PDH)、愈创木酚过氧化物酶(GPX)以及种子中α淀粉酶等[2729],这些酶活性的提高对植株生长发育具有一定的促进作用。
Hao等[30]的研究表明,高浓度吡虫啉种子包衣会抑制油菜种子萌发和幼苗早期生长,随着油菜的发育影响减弱。许小龙等[31]的研究认为,70%吡虫啉种子处理可分散粉剂低用量包衣对水稻秧苗生长有一定促进作用,高用量对水稻秧苗前期株高和鲜质量有抑制作用。本研究结果表明,10%噻虫胺FS用量在100~250 g/100 kg范围内,西瓜出苗后15 d,西瓜株高和叶面积随噻虫胺用量的增加呈现先增加后降低的趋势,而西瓜植株内药剂含量随着噻虫胺用量的增加而增加,说明新烟碱类药剂在一定剂量范围内可以促进西瓜植株苗期生长发育,高用量对西瓜植株生长发育促进作用减弱,亦可能有抑制作用。新烟碱类杀虫剂对植物的影响不仅与药剂的剂量有关,还与农作物种类和品种、杀虫剂助剂配方、暴露时间和环境条件等因素有关[32],因此,新烟碱类杀虫剂种子处理对作物的影响需要针对不同浓度药剂、不同作物进行专业性评估。
可溶性糖和可溶性固形物是评价果实营养成分的重要指标之一,其含量的高低直接关系到西瓜的甜度,随着可溶性糖和可溶性固形物含量的增高,西瓜果实甜度加大[33]。本试验表明,经过拌种处理,噻虫胺各处理与空白对照相比,可溶性糖及可溶性固形物含量均有不同程度增加,可溶性糖含量在噻虫胺150~250 g/100 kg用量范围内与空白对照差异显著,与罗跃等[34]对刺梨品质的研究结果一致。维生素C是一种天然存在于水果中的水溶性维生素,是新鲜水果中重要的抗氧化活性物质之一[35]。本研究中维生素C含量随噻虫胺用量的增加而降低,但均较空白处理有不同程度的增加(P<0.05)。在果实生长过程中,维生素C的积累量与半乳糖内酯脱氢酶及抗氧化活性的变化有密切联系[3637]。新烟碱类化合物可提高植物抗氧化活性[28,38],本研究中维生素C含量的变化是否与此有关有待进一步研究。
此外,本试验发现,在果实成熟收获后,噻虫胺在西瓜中无残留检出,说明各处理药剂在试验剂量范围内拌种对西瓜果实安全。根部土壤中噻虫胺残留量在0.041 2~0.097 5 mg/kg之间,研究表明,土壤中农药的残留及降解速率与气候和环境因素、土壤类型、施药方式等多种因素有关[19,3940],因此,还需结合地域特点进行针对性的研究。
综上所述,噻虫胺拌种处理后,在植株体内累积到一定浓度会促进西瓜苗期生长发育,提高产量,改善西瓜的品质,在果实中无残留,该研究拓宽了噻虫胺的使用范围和方法,为噻虫胺种子处理在西瓜生产实践中合理、安全、高效地应用提供技术支撑。
参考文献
[1] 赵姜. 中国西瓜产业发展的经济学分析[D]. 北京: 中国农业科学院,2013.
[2] LABRIE G, GAGNON A , VANASSE A, et al. Impacts of neonicotinoid seed treatments on soildwelling pest populations and agronomic parameters in corn and soybean in Quebec (Canada) [J/OL]. PLoS ONE, 2020, 15(2): e0229136. DOI: 10.1371/journal.pone.0229136.
[3] BRYANT T B, TAYLOR S V. Efficacy of select insecticide seed treatments and infurrow applications for managing the brown stink bug, Euschistus servus (Say) (Hemiptera: Pentatomidae), in seedling maize [J/OL]. Crop Protection, 2021, 143: 105535. DOI: 10.1016/J.CROPRO.2021.105535.
[4] FERRACINI C, BLANDINO M, RIGAMONTI I E, et al. Chemicalbased strategies to control the western corn rootworm, Diabrotica virgifera virgifera LeConte [J/OL]. Crop Protection, 2021, 139: 105306. DOI: 10.1016/j.cropro.2020.105306.
[5] 徐蕾, 趙彤华, 钟涛, 等. 药剂包衣对苗期大豆蚜防治效果与安全性评价[J]. 应用昆虫学报, 2016, 53(4): 759771.
[6] JESCHKE P, NAUEN R, SCHINDLER M, et al. Overview of the status and global strategy for neonicotinoids [J]. Journal of Agricultural and Food Chemistry, 2011, 59(7): 897908.
[7] 高志山, 张学峰, 刘海涛, 等. 新烟碱类杀虫剂种子包衣防治麦蚜的可行性评价[J]. 植物保护学报, 2016, 43(5): 864872.
[8] 杨红福, 姚克兵, 束兆林, 等. 噻呋酰胺处理种子防治水稻纹枯病试验研究[J]. 江苏农业科学, 2020, 48(5): 107109.
[9] VAN LOON S, VICENTE V B, VAN GESTEL C A M. Longterm effects of imidacloprid, thiacloprid, and clothianidin on the growth and development of Eisenia andrei [J]. Environmental Toxicology and Chemistry, 2022, 41(7): 16861695.
[10]ZHANG Zhi, LI Yaping, LI Xiangrui, et al. Efficacy of imidacloprid seed treatments against four wheat aphids under laboratory and field conditions [J/OL]. Plants, 2023, 12(2): 238. DOI: 10.3390/plants12020238.
[11]ZHANG Peng, ZHANG Xuefeng, ZHAO Yunhe, et al. Effects of imidacloprid and clothianidin seed treatments on wheat aphids and their natural enemies on winter wheat [J]. Pest Management Science, 2016, 72(6): 11411149.
[12]FORD K A, CASIDA J E. Comparative metabolism and pharmacokinetics of seven neonicotinoid insecticides in spinach [J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 1016810175.
[13]TANG Tao, LIU Xueyuan, WANG Peng, et al. Thiamethoxam seed treatment for control of rice thrips (Chloethrips oryzae) and its effects on the growth and yield of rice (Oryza sativa) [J]. Crop Protection, 2017, 98: 136142.
[14]DING Jinfeng, LI Hong, ZHANG Zhengqun, et al. Thiamethoxam, clothianidin, and imidacloprid seed treatments effectively control thrips on corn under field conditions [J/OL]. Journal of Insect Science, 2018, 18(6): 19. DOI: 10.1093/jisesa/iey128.
[15]李妍. 4種杀虫剂对油菜黄宽条跳甲的毒力和对油菜生长的影响及生化机制[D].呼和浩特: 内蒙古农业大学.
[16]VALVERDE S, ARES A M, BERNAL J L, et al. Effect of the storage conditions (light and temperature) on the detection of thiamethoxam and clothianidin content in rapeseeds by LCDAD [J]. Food Analytical Methods, 2017, 11(1): 161169.
[17]高庆超, 胡家萌, 李亚辉, 等. 吡虫啉、苯醚甲环唑和百菌清在甘蓝中的消解及残留分布[J]. 农药学学报, 2021, 23(6): 12131218.
[18]李清华, 张奇珍, 余曼丽, 等. 噻虫胺在黄瓜叶片中累积量与对温室白粉虱防治效果的相关性及残留消解动态[J]. 农药学学报, 2021, 23(5): 938946.
[19]陈玲, 龚道新, 王寒, 等. 吡蚜酮与噻虫胺在柑橘和土壤中的残留分析[J]. 农药, 2019, 58(6): 448450.
[20]季宇超, 姚众, 张丽萍, 等. 噻虫胺拌种防治西瓜蚜虫的研究[J].中国植保导刊, 2022, 42(3): 7375.
[21]曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2017: 2427, 5458, 127128.
[22]中华人民共和国国家卫生健康委员会. 植物源性食品中331种农药及其代谢物残留量的测定液相色谱质谱联用法: GB 23200.1212021 [S]. 北京: 中国农业出版社, 2021.
[23]中华人民共和国国家卫生健康委员会. 食品中农药最大残留限量: GB 27632021 [S]. 北京: 中国农业出版社, 2021.
[24]残留農薬基準値検索システム[EB/OL]. [20200426].http:∥db.ffcr.or.jp/front/.
[25]SENN R, HOFER D, THIEME T, et al. Method for improving plant growth: US6, 753, 296 B1 [P].20020410.
[26]THIELERT W, METZLAFF M, BLOCK M D. Increase of stress tolerance by application of neonicotinoids on plants engineered to be stress tolerant: US0270254 A1 [P]. 20060526.
[27]FORD K A, CASIDA J E, CHANDRAN D, et al. Neonicotinoid insecticides induce salicylateassociated plant defense responses [J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(41): 1752717532.
[28]王艷, 陈雁君, 公茂礼, 等. 噻虫胺农药胁迫对小白菜过氧化物酶活性的影响[J].中国卫生检验杂志, 2008, 18(12): 25352536.
[29]段强, 赵国玲, 姜兴印, 等. 吡虫啉拌种对玉米种子活力及其幼苗生长的影响[J].玉米科学, 2012, 20(6): 6369.

